4种常见清热燥湿类中药对肠道菌群及粪便胆汁酸和短链脂肪酸代谢的影响
2023-06-10李心如盛先杰杨琰安振涛康安李慧葛飞
李心如,盛先杰,杨琰,安振涛,康安,李慧,葛飞
(1.南京中医药大学翰林学院附属海安市中医院,江苏 南通 226600;2.南京中医药大学药学院,江苏 南京 210023;3.南京中医药大学附属中西医结合医院,江苏省中医药研究院,江苏 南京 210028)
肠道菌群是一类寄居在胃肠道内的微生物的总称,专性厌氧菌是其中的优势菌群。绝大多数肠道菌群由5个门组成:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)[1-2]。其中,拟杆菌门和厚壁菌门的数量最多,占肠道菌群数量的90%以上。正常情况下,肠道菌群通过反馈机制来维持菌群间的动态平衡[3],并通过产生代谢物和一些信号分子与宿主进行相互作用[1]。常见的肠道菌群代谢物有短链脂肪酸(SCFAs)、胆汁酸(BAs)、胺类、吲哚及其衍生物等[4]。
短链脂肪酸又称挥发性脂肪酸,是由肠道微生物通过降解膳食纤维等机体无法代谢的食物而生成的2~6个碳原子的饱和脂肪族有机酸,主要包括丁酸、丙酸、乙酸、异丁酸、戊酸和己酸[5]。短链脂肪酸可激活G蛋白偶联受体(GPCRs)改善宿主肠道炎症[6],治疗结直肠癌[7]以及调节胰岛素分泌[8-9]。胆汁酸是由胆固醇合成的一种两亲分子,按来源可分为初级胆汁酸和次级胆汁酸2种[10]。其中,初级胆汁酸是在肝脏中由胆固醇直接合成而来,次级胆汁酸是在肠道中由肠道微生物代谢修饰而来[11]。最近研究表明,胆汁酸及短链脂肪酸与机体的免疫、肠道微环境等密切相关[12-13],如次级胆汁酸石胆酸和脱氧胆酸可通过激活法尼醇X受体(FXR)和G蛋白胆汁酸受体1(GPBAR1)发挥保护肠黏膜屏障和抗炎作用[14];丁酸等可通过三羧酸循环及激活编码紧密连接成分的基因和转录因子促进肠屏障的完整性[15],进而改善腹痛腹泻症状。这些内源性物质的变化与菌群密切相关。
清热燥湿类中药临床上多用于治疗湿热病证,即湿热引起的腹痛腹胀,大便稀烂热臭,舌苔黄腻等症。黄连、黄芩、黄柏和苦参是常见的清热燥湿类中药。之前的研究表明黄连、黄芩、黄柏和苦参具有多种药理活性,可以起到抗菌的作用[16-19]并能够调节胆汁酸的代谢。此外,黄连、黄柏、黄芩和苦参能通过改变肠道菌群、胆汁酸和短链脂肪酸等的代谢改善一些临床常见病症,如高脂血症[20-21]和2型糖尿病[22-23]。但长期给予临床等效剂量的药物对正常动物体内的肠道菌群、胆汁酸代谢和短链脂肪酸代谢的影响尚未见报道。本实验拟研究黄连、黄柏、黄芩和苦参在长期临床等效剂量下对正常小鼠肠道菌群、胆汁酸及短链脂肪酸的影响,为清热燥湿类中药的研究及其合理应用提供科学证据。
1 材料
1.1 动物
30只SPF级Balb/c小鼠,雄性,购自于斯贝福(北京)生物技术有限公司。饲养于温度为(22±2)℃,相对湿度为50%的环境内。饲养期间自由摄食、饮水,适应性喂养1周后用于实验。实验动物许可证号:SCXK(京)2019-0010。经南京中医药大学动物伦理中心批准,批准号:202006A034。
1.2 药物与试剂
黄柏(批号:20201001)、苦参(批号:20200501)、黄连(批号:20201101)、黄芩(批号:20201201)均购自安徽桐花堂中药饮片科技有限公司,符合《中国药典》2020版一部及四部执行标准。丙酸(PA,货号:P0500)、异丁酸(IBA,货号:I0103)、丁酸(BA,货号:B0754)、戊酸(VA,货号:V0003)、异戊酸(IVA,货号:M0182)、乙酸(AA,货号:A3377)均购自梯希爱(上海)化成工业发展有限公司;氘代己酸(CA-d3,货号:489727)购自Sigma-Aldrich公司;石胆酸(LCA,货号:B28100)、牛磺熊去氧胆酸(TUDCA,货号:B20921)、甘氨鹅脱氧胆酸(GCDCA,货号:B24724)、牛磺鹅脱氧胆酸(TCDCA,货号:B20919)、牛磺脱氧胆酸钠(TDCA,货号:B23672)、甘氨猪去氧胆酸(GHDCA,货号:B27133)、甘氨熊脱氧胆酸(GUDCA,货号:B32965)、牛磺猪去氧胆酸(THDCA,货号:B26449)、甘氨胆酸(GCA,货号:B27078)、牛磺胆酸(TCA,货号:B26949)、去氧胆酸(DCA,货号:B21032)、甘氨脱氧胆酸钠(GDCA,货号:B27134)、ω-鼠胆酸(ω-MAC,货号:S22144)、牛磺-α-鼠胆酸(T-α-MCA,货号:B7450)均购自于上海源叶生物科技有限公司;去氢胆酸(Dehydro-CA,货号:30830)、熊去氧胆酸(UDCA,货号:U5127)、猪去氧胆酸(HDCA,货号:H3878)、胆酸(CA,货号:C1129)、鹅去氧胆酸(CDCA,货号:C9377)、α-鼠胆酸(α-MCA,货号:700232P)、β-鼠胆酸(β-MCA,货号:SML2372)均购自Sigma-Aldrich公司;内标为氘代甘氨胆酸(GCA-d4,货号:SCSI-406054)购自上海赛可锐生物科技有限公司;氘代去氧胆酸(CDCA-d4,货号:G466261)购自上海阿拉丁生化科技股份有限公司。
甲醇(色谱纯)购自德国Merck公司,甲酸(色谱级)购买于阿拉丁公司,超纯水(实验室自制)。
1.3 仪器
ER-2000A旋转蒸发仪(上海亚荣生化仪器厂)、Sorvall Legend Micro21R微量离心机(美国Thermo Fisher Scientific公司)、SHIMADZU LC-30AD高效液相系统(日本岛津公司)、Triple QuadTM4500质谱系统(AB Sciex)、超纯水仪(美国Millipore公司)、电子分析天平(天津天马衡基仪器有限公司)。
2 方法
2.1 黄连、黄芩、黄柏和苦参水提物的制备
称取药材黄芩、黄连、黄柏和苦参各100 g。分别加入10倍、8倍体积水,煎煮2次,每次1 h。合并煎液、过滤,滤液60 ℃减压浓缩至浓度分别为生药量1 g·mL-1,灭菌密封保存,待用。
2.2 动物分组与处理
小鼠随机分成5组,分别为对照组(C,6只),苦参组(KS,6只),黄柏组(HB,6只),黄连组(HL,6只)和黄芩组(HQ,6只)。苦参组、黄柏组、黄连组和黄芩组分别灌胃给予2.34、3.12、1.3 g·kg-1和2.6 g·kg-1,给药体积10 mL·kg-1,每日给药1次,共14 d,给药剂量均为临床等效剂量。给药结束后收集小鼠粪便,-80 ℃储存备用。
2.3 胆汁酸的检测
精密称取LCA、UDCA、CDCA、HDCA、DCA、Dehydro-CA、CA、GUDCA、GCDCA、GDCA、GHDCA、GCA、TDCA、THDCA、TUDCA、TCDCA、TCA、α-MCA、β-MCA、ω-MAC、T-α-MCA对照品适量,用甲醇溶解,制备成浓度为约1.0 mg·mL-1的储备液,于4 ℃储存备用。用50%乙腈稀释配制一系列的混合标准曲线。所有样品进样前均于4 ℃下保存。内标采用CDCA-d4,GCA-d4。
称取粪便样品约50 mg于2 mL离心管中,于冷冻干燥机中冷冻干燥后再次称定粪便质量,加19倍体积的50%乙腈,涡旋震荡5 min并在4 ℃下以12 000g离心10 min。吸取上清40 μL加80 μL乙腈(内标浓度为375 μg·mL-1),涡旋震荡5 min并在4 ℃下以12 000g离心10 min,吸取上清进样。
色谱条件:色谱柱为Thermo Fisher Hypersil Gold(100 mm×2.1 mm,3 μm);柱温:40 ℃;流动相(A):0.1% 甲酸水溶液,流动相(B):乙腈∶甲醇∶甲酸=95∶5∶0.1;进样量3 μL;流速:0.4 mL·min-1;梯度洗脱:0~3 min,15%B;3~10 min,15%→28%B;10~19 min,28%→55%B;19~25 min,55%→90%B;25~27 min,90%B;27~27.5 min,90%→15%B。
质谱条件:采用电喷雾离子源(ESI),离子源温度(TEM)550 ℃,气帘气(CUR)30 psi,雾化气(GS1)55 psi,辅助加热气(GS2)55 psi,离子源喷雾电压(IS)-4 500 V。待测物及内标的监测离子对、优化去簇电压(DP)、碰撞电压(CE)以及碰撞室射出电压(CXP),如表1所示。
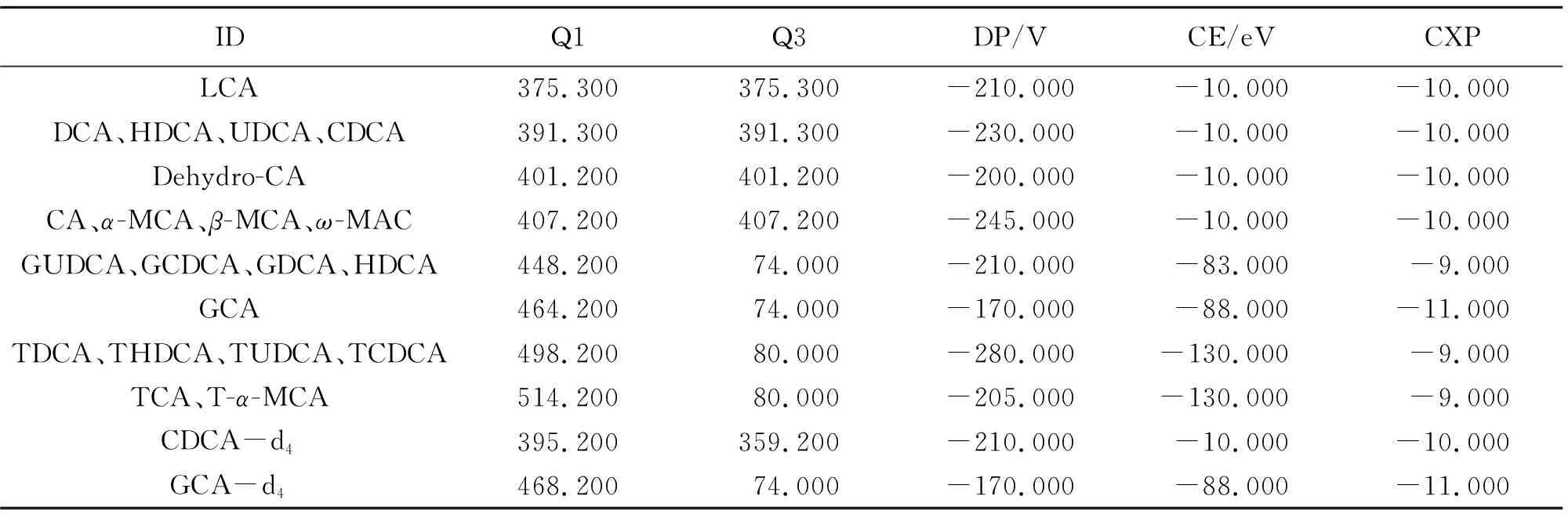
表1 胆汁酸及内标的LC-MS/MS参数Table 1 LC-MS/MS parameters for bile acids and internal standard
2.4 短链脂肪酸检测
精密称取乙酸、丙酸、丁酸、异丁酸、异戊酸和戊酸对照品适量,配制成适量系列浓度的对照品溶液。
称取粪便样品约50 mg,加入19倍体积50%乙腈,涡旋振荡至完全混匀后在12 000g,4 ℃条件下离心10 min。取40 μL上清与5 μL 1 μg·mL-1氘代己酸、20 μL 3-硝基苯肼和20 μL EDC-6%吡啶溶液混合,40 ℃反应30 min,12 000g,离心10 min取上清,根据不同SCFAs浓度水平,稀释不同倍数后进样。
色谱条件:色谱柱为Thermo Fisher Hypersil Gold(100 mm×2.1 mm,3 μm);柱温:40 ℃;流动相:水相(A)为0.1%甲酸-水溶液,有机相(B)为乙腈;进样量3 μL;流速:0.35 mL·min-1;梯度洗脱:0~1 min,10%B;1~11 min,10%→35%B;11~14 min,35%→90% B;14~15.5 min, 90%B;15.5~16.5 min,10%B;16.3~18 min,10%B。
质谱条件:采用电喷雾离子源(ESI),离子源温度(TEM)550 ℃,气帘气(CUR)30 psi,雾化气(GS1)55 psi,辅助加热气(GS2)55 psi,离子源喷雾电压(IS)-4 500 V。待测物的监测离子对信息如下:AA,194.1→137.1;PA,208.1→165.1;BA、IBA,222.1→137.1;VA、IVA,236.1→137.1。
2.5 肠道内容物样本采集及肠道菌群测序分析
各组小鼠脱臼处死后,取小鼠结肠内容物样品约0.2 g,提取粪便基因组,由上海美吉生物医药科技有限公司采用Illumina MiSeq平台(Illumina, San Diego, USA)对其16S rRNA的V3~V4高变区进行微生物多样性检测。将统计分析数据上传至美吉生信云分析平台进行后续分析。
2.6 数据处理

3 结果
3.1 黄连、黄芩、黄柏和苦参对小鼠肠道短链脂肪酸的影响
黄连、黄芩、黄柏和苦参组小鼠肠道短链脂肪酸含量如图1所示。黄连组乙酸、戊酸、异戊酸、异丁酸、丙酸水平均有下降趋势;黄芩组乙酸、丁酸、异戊酸和异丁酸水平均呈现上升趋势,丙酸水平呈现下降趋势;黄柏组乙酸、戊酸、丁酸、丙酸水平均呈现上升趋势,异戊酸水平呈现下降趋势;苦参组戊酸、丁酸、异戊酸、异丁酸水平均呈现上升趋势,乙酸、丙酸水平呈现下降趋势。但各组短链脂肪酸含量与正常组相比均无显著性差异。
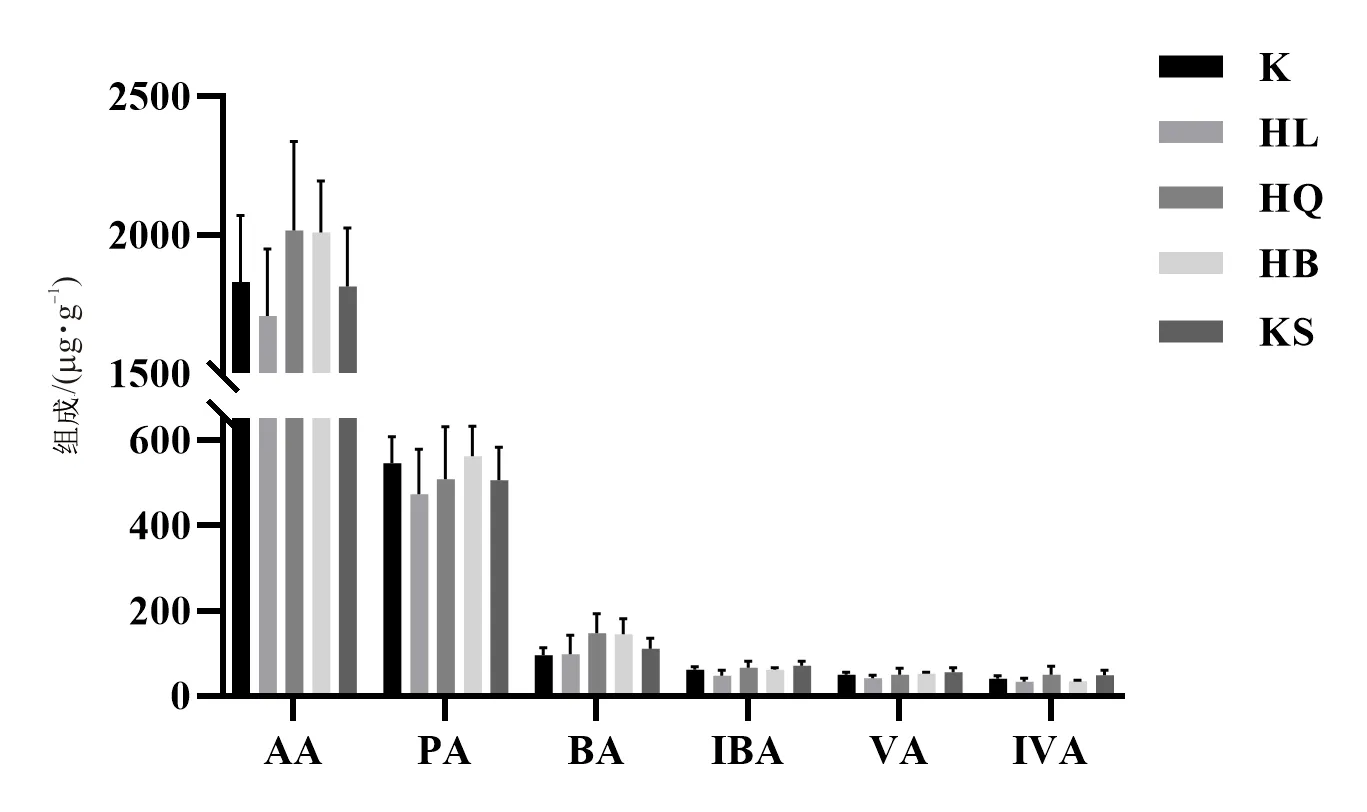
图1 黄连、黄芩、黄柏和苦参组小鼠短链脂肪酸含量图Fig.1 Content of short-chain fatty acids in mice of HL, HQ, HB and KS groups
3.2 黄连、黄芩、黄柏和苦参对小鼠粪便胆汁酸的影响
3.2.1 PCA分析和聚类分析 图2是将对照组、黄连组、黄芩组、黄柏组和苦参组小鼠粪便胆汁酸做PCA分析(图2A)和聚类分析(图2B)。PCA结果显示与对照组相比,各组胆汁酸变化无显著性差异。聚类热图分析结果显示,在我们所检测的23种胆汁酸中,黄柏组有14种胆汁酸出现下调,有9种胆汁酸出现上调;黄连组有13种胆汁酸出现下调,8种胆汁酸出现上调;黄芩组有15种胆汁酸出现下调,有8种胆汁酸出现上调;苦参组有10种胆汁酸出现下调,13种胆汁酸出现上调。
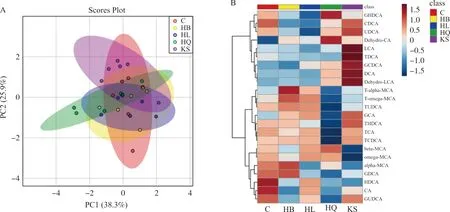
图2 黄连、黄芩、黄柏和苦参组小鼠胆汁酸PCA图(A)和热图(B)Fig.2 PCA (A) and Heatmap (B) of bile acids in mice of HL, HQ, HB and KS groups
3.2.2 差异胆汁酸分析 黄连、黄芩、黄柏和苦参组小鼠粪便中差异胆汁酸含量如图3所示。与正常组相比,黄连组小鼠粪便中鹅去氧胆酸(P<0.05)和熊去氧胆酸(P<0.05)含量显著降低;黄芩组小鼠粪便中去氢胆酸(P<0.05)含量显著上升,牛磺猪去氧胆酸(P<0.05)、牛磺熊去氧胆酸(P<0.01)、牛磺鹅脱氧胆酸(P<0.05)含量显著降低;黄柏组小鼠粪便中鹅去氧胆酸(P<0.05)的含量降低;苦参组小鼠粪便中β-鼠胆酸(P<0.05)、ω-鼠胆酸(P<0.05)的含量显著降低,而甘氨鹅脱氧胆酸(P<0.05)的含量上升。
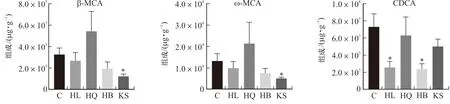
注:*P<0.05,**P<0.01。图3 黄连、黄芩、黄柏和苦参组小鼠粪便中差异胆汁酸含量图Fig.3 Bile acid content differences in feces of mice in HL,HQ,HB and KS groups
3.3 黄连、黄芩、黄柏和苦参对小鼠肠道菌群的影响
3.3.1 多样性分析 通过对对照组、黄连组、黄芩组、黄柏组和苦参组小鼠回肠微生物样品的16S rRNA基因序列分析,确定了黄连、黄芩、黄柏和苦参对肠道微生物区系整体结构的影响。α多样性分析结果表明(表2),与空白组比较,苦参组肠道菌群α多样性指数呈升高趋势;黄柏组、黄连组和黄芩组肠道菌群α多样性指数呈下降趋势,且黄连组具有显著性差异(P<0.01,P<0.000 1)。β多样性分析结果表明(PCA和PCoA分析),每个给药组的肠道微生物群落均存在明显的聚集(图4)。在长期给予正常小鼠药效剂量的中药后,小鼠的肠道菌群发生了显著变化。
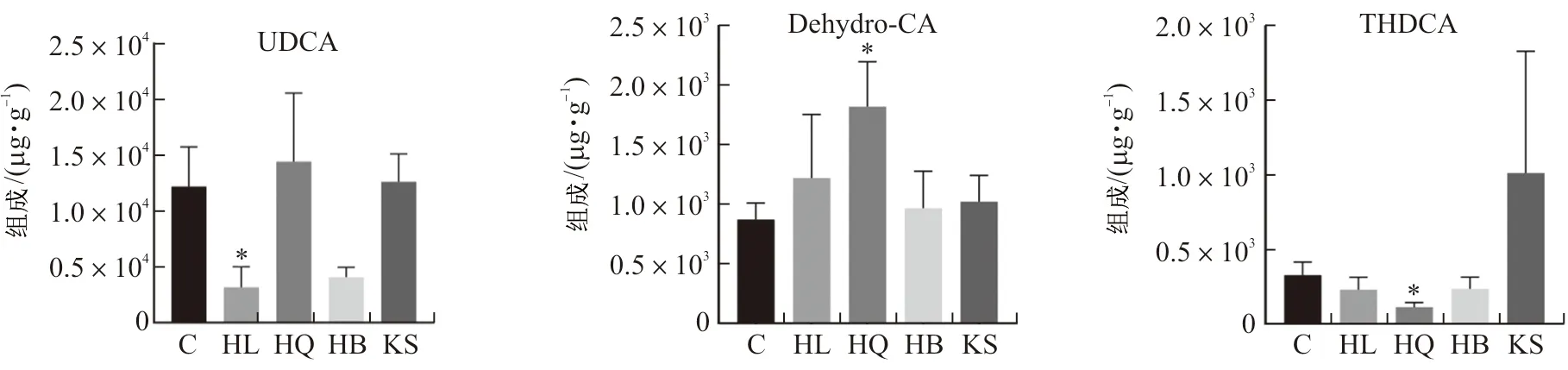
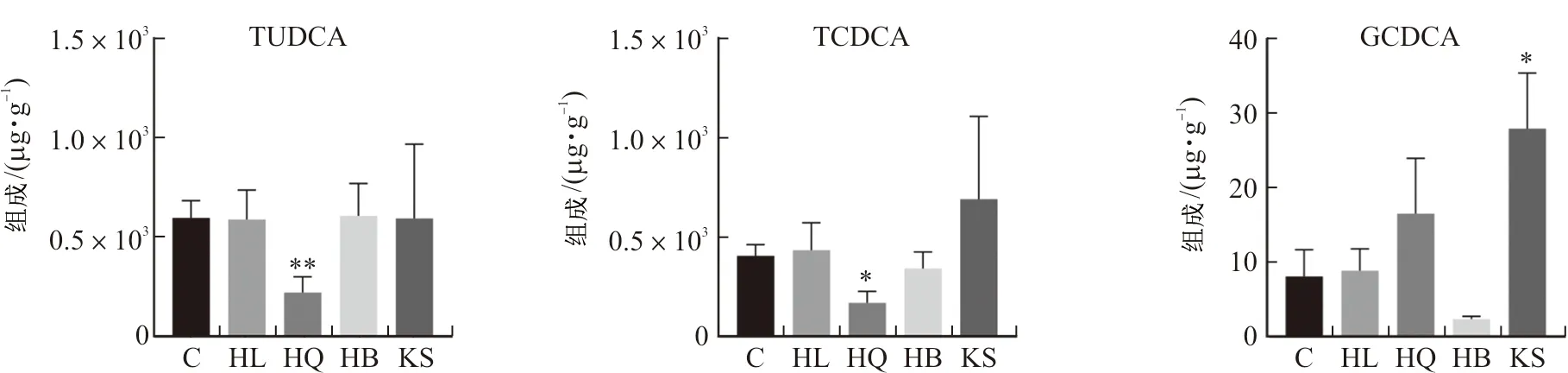
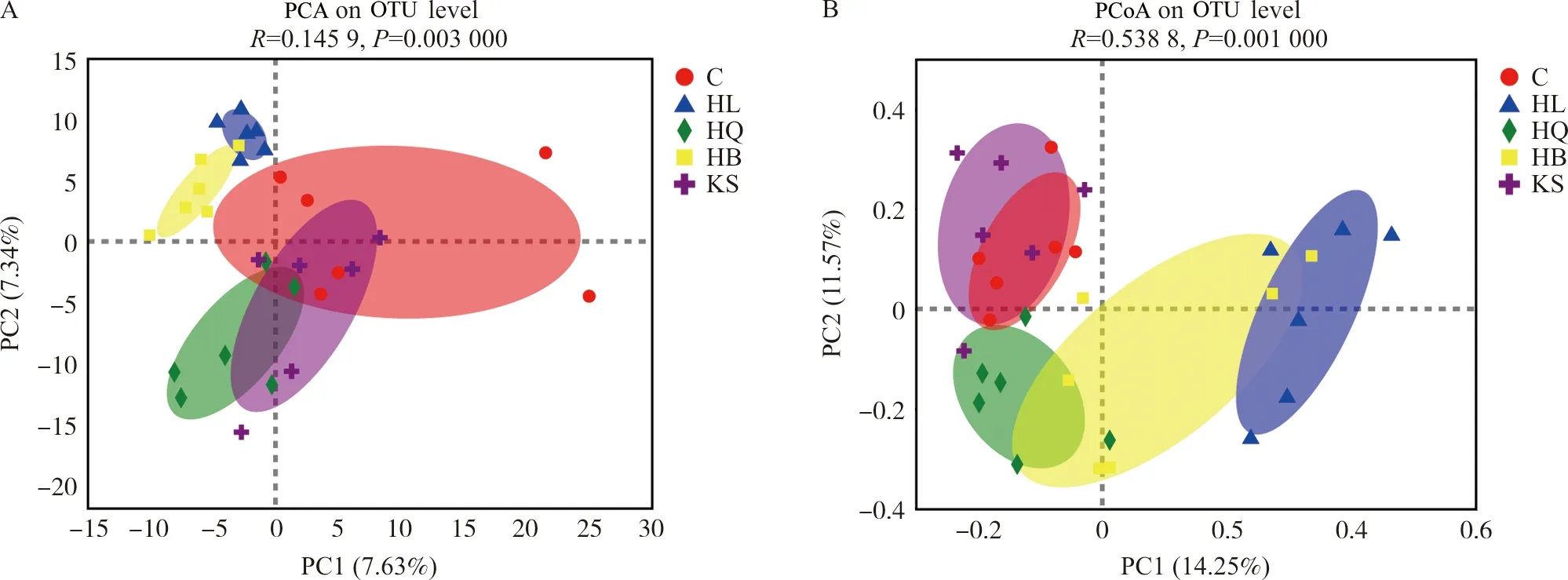
图4 黄连、黄芩、黄柏和苦参组小鼠肠道菌群PCA(A)和PCoA(B)图Fig.4 PCA (A) and PCoA (B) of intestinal flora of mice in HL,HQ,HB and KS groups

表2 黄连、黄芩、黄柏和苦参组小鼠肠道菌群α多样性指数比较Table 2 Comparison of intestinal flora α diversity indices of mice in HL,HQ,HB and KS
3.3.2 物种组成及差异分析 在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)是小鼠肠道的优势菌门,占全部微生物群的80%以上,其次是脱硫菌属(Desulfobacterota)和疣微菌门(Verrucomicrobiota)(图5A)。除苦参组外,黄连组、黄芩组和黄柏组小鼠厚壁菌门(Firmicutes)均呈现下降趋势,拟杆菌门(Bacteroidota)均呈现上升趋势,且黄连组变化更显著。在属水平上,不同中药组小鼠肠道微生物群落组成存在差异(图5B~F)。黄连组拟杆菌属(Bacteroides)(P<0.05)等丰度上调,梭菌目UCG-014(norank_f__norank_o__Clostridia_UCG-014)(P<0.05)、另枝菌属(Alistipes)(P<0.05)和臭味杆菌属(Oddoribacter)(P<0.05)等丰度下调,且均具有显著性差异;黄芩组理研菌科RC9菌群(Rikenellaceae_RC9_gut_group)(P<0.05)丰度上调;黄柏组梭菌目UCG-014(norank_f__norank_o__Clostridia_UCG-014)(P<0.05)、norank_f__norank_o__RF39(P<0.05)、norank_f__Eggerthellaceae(P<0.01)丰度下调,Anaerostipes(P<0.05)丰度上调且具有显著性差异;苦参组颤螺旋菌科(Oscillospiraceae)(P<0.05)丰度上调,norank_f__Eggerthellaceae(P<0.05)、norank_f__norank_o__Chloroplast(P<0.05)丰度下调且具有显著性差异。
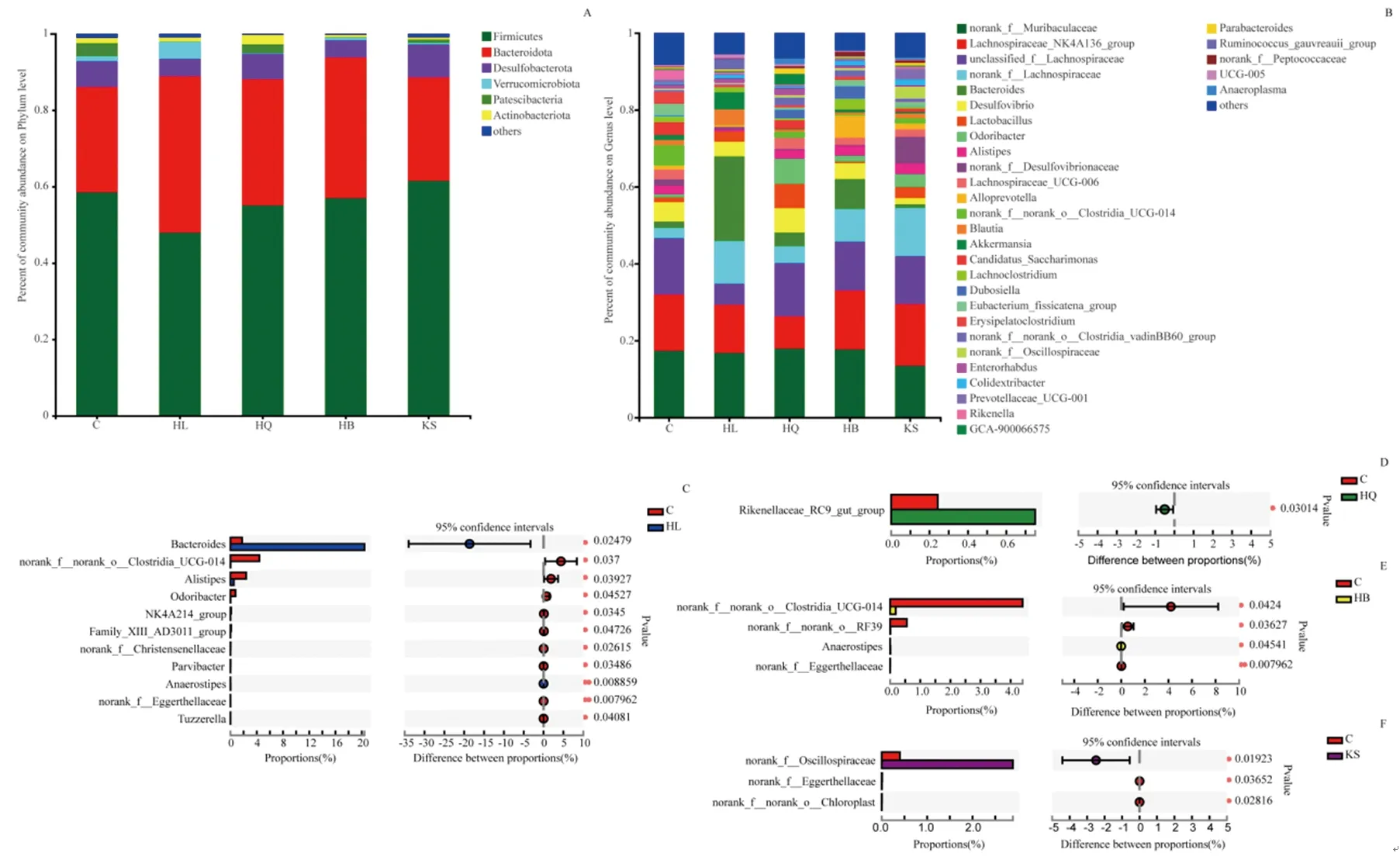
注:A.门水平物种组成图;B.属水平物种组成图;C~F.黄连、黄芩、黄柏和苦参组属水平物种差异图。*P<0.05,**P<0.01。图5 黄连、黄芩、黄柏和苦参组小鼠物种组成与差异分析图Fig.5 Species composition and difference analysis of mice in HL,HQ,HB and KS groups
3.3.3 相关性分析 将黄连、黄芩、黄柏和苦参组小鼠属水平肠道菌群与短链脂肪酸(图6A)和胆汁酸(图6B)做相关性分析。在短链脂肪酸水平上,乙酸水平与Lachnoclostridium(P<0.05)呈负相关且具有显著性差异;丁酸水平与Eubacterium_fissicatena_group(P<0.01)水平呈正相关,与Streptococcus(P<0.01)水平呈负相关且具有显著性差异;丙酸水平与norank_f__norank_o__Clostridia_vadinBB60_group(P<0.05)呈正相关,与norank_f__Eubacterium_coprostanoligenes_group(P<0.05)、Streptococcus(P<0.05)呈负相关;戊酸水平与Christensenellaceae_R-7_group(P<0.05)、norank_f__norank_o__RF39(P<0.05)呈正相关且均具有显著性差异;异丁酸水平与Candidatus_Saccharimonas(P<0.05)、Christensenellaceae_R-7_group(P<0.05)、norank_f__norank_o__RF39(P<0.05)呈正相关,与Bacteroides(P<0.05)、Streptococcus(P<0.05)呈负相关且均具有显著性差异;异戊酸与Christensenellaceae_R-7_group(P<0.01)、norank_f__norank_o__RF39(P<0.05)呈正相关,与Parabacteroids(P<0.05)呈负相关;在胆汁酸水平上,鹅去氧胆酸水平与Bacteroides(P<0.05)呈负相关,与norank_f__noranl_o_Clostridia_UCG-014(P<0.001)、Christensenellaceae_R-7_group(P<0.05)、norank_f__norank_o__RF39(P<0.001)呈正相关,且均具有显著性差异;熊去氧胆酸水平与Bacteroide(P<0.01)呈负相关,与norank_f__noranl_o_Clostridia_UCG-014(P<0.001)、norank_f__norank_o__RF39(P<0.001)呈正相关,且均具有统计学差异;去氢胆酸水平与Alloprevotella(P<0.05)、Prevotellaceae_UCG-001(P<0.05)呈负相关,与Bifidobacterium(P<0.05)呈正相关,且均具有统计学差异;牛磺猪去氧胆酸水平与Desulfovibrio(P<0.05)呈负相关,与Muribaculum(P<0.05)、Colidextribacter(P<0.05)、Anaeroplasma(P<0.05)呈正相关;牛磺熊去氧胆酸水平与Eubacterium_fissicatena_group(P<0.05)呈负相关,与Lachnoclostridium(P<0.05)、Streptococcusc(P<0.01)、norank_f__Ruminococcaceae(P<0.05)呈正相关,且均具有显著性差异;牛磺鹅去氧胆酸水平与Desulfovibrio(P<0.05)呈负相关、与Streptococcus(P<0.05)呈正相关,且均具有显著性差异;β-鼠胆酸水平和Alloprevotella(P<0.05)、Anaeroplasma(P<0.01)呈负相关,与GCA-900066575(P<0.05)呈正相关,且均具有显著性差异;ω-鼠胆酸水平和Alloprevotella(P<0.05)、Anaeroplasma(P<0.05)呈负相关,与GCA-900066575(P<0.01)呈正相关,且均具有显著性差异;甘氨鹅去氧胆酸水平与Erysipelatoclostridium(P<0.01)、Alloprevotella(P<0.01)、Lachnoclostridum(P<0.01)等呈负相关,与Christensenellaceae_R-7_group(P<0.01)、Ruminococcus(P<0.001)、norank_f__Oscillospiraceae(P<0.01)等呈正相关,且均具有显著性差异。
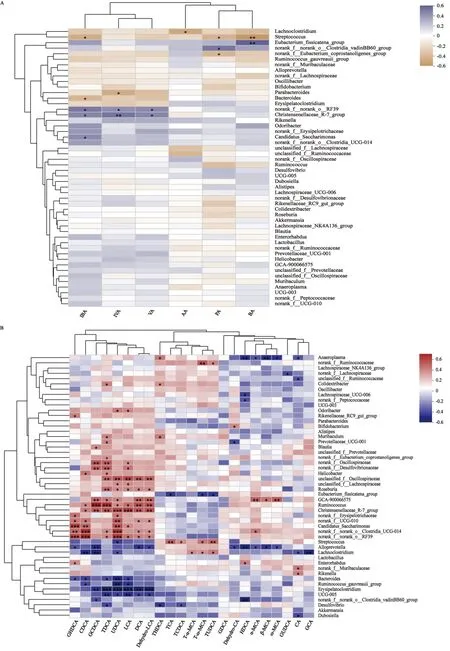
注:*P<0.05,**P<0.01,***P<0.001。图6 黄连、黄芩、黄柏和苦参组小鼠属水平肠道菌群与短链脂肪酸(A)和胆汁酸(B)相关性热图Fig.6 Heatmap of correlation between intestinal flora at genus level and short-chain fatty acids (A) or bile acids (B)
4 讨论
本实验选取Balb/c小鼠作为研究对象,在长期临床等效剂量下给予清热燥湿类中药黄连、黄柏、黄芩和苦参后对肠道菌群进行16S rRNA分析。各组小鼠给药后肠道微生物均存在明显的聚集,肠道菌群结构发生了显著变化。除苦参组外,黄连组、黄芩组和黄柏组小鼠厚壁菌门(Firmicutes)均呈现下降趋势,拟杆菌门(Bacteroidota)均呈现上升趋势,且黄连组变化更显著。但在属水平上,4种清热燥湿类中药对正常小鼠肠道菌群结构表现出不同的调节作用。黄连组有11种属水平肠道菌群出现显著性差异,其中有2种显著性上调,9种显著性下调;黄芩组有1种属水平肠道菌群出现显著性差异,并表现为显著性上调;黄柏组有4种属水平肠道菌群出现显著性差异,其中有1种显著性上调,3种显著性下调;苦参组有3种属水平肠道菌群出现显著性差异,其中1种显著性上调,2种显著性下调。
在各组上调菌属中,Bacteroides[14-15]、Rikenellaceae_RC9_gut_group[24]、Anaerostipes[25]、Oscillospiraceae[26-27]等均为有益菌且参与胆汁酸与短链脂肪酸的代谢。胆汁酸与短链脂肪酸为肠道菌群主要的代谢产物,除此之外常见的肠道菌群代谢产物还有吲哚类化合物。有研究表明清热燥湿类中药可调控脂多糖渗漏[28]及调节吲哚类化合物[29]的含量,但多发生在特定病例下,如糖尿病模型中,其是否能参与清热燥湿尚不明确。故本次实验以胆汁酸和短链脂肪酸为主要研究对象,探索了药物对正常小鼠肠道菌群、胆汁酸及短链脂肪酸的影响。结果显示黄连、黄柏、黄芩和苦参给药后对正常小鼠的短链脂肪酸水平的影响较小;黄连给药后有2种非结合型胆汁酸(鹅去氧胆酸、熊去氧胆酸)含量降低;黄芩给药后有1种非结合型胆汁酸(去氢胆酸)含量升高,3种结合型胆汁酸(牛磺猪去氧胆酸、牛磺熊去氧胆酸、牛磺鹅脱氧胆酸)含量降低;黄柏给药后有1种非结合型胆汁酸(鹅去氧胆酸)含量降低;苦参给药后有1种结合型胆汁酸(甘氨鹅脱氧胆酸)含量升高,2种非结合型胆汁酸(β-鼠胆酸、ω-鼠胆酸)含量降低。
有研究表明,肠道微生物可以产生多种代谢酶,与短链脂肪酸和胆汁酸的代谢息息相关。在胆汁酸代谢中,Lactobacillus、Bifidobacterium、Enterococcus、Clostridiumspp.和Bacteroidesspp.产生胆盐水解酶(BSHs)对初级胆汁酸进行酶解;ClostridiumclustersXIVa、IV、XI产生羟基类固醇脱氢酶(HSDHs)将胆汁酸3,7,或12环位氧化生成氧-胆汁酸[14]。在短链脂肪酸代谢中,丙酸由Bacteroidetes、Firmicutes介导的琥珀酸途径及Lachnospiraceae介导的丙二醇途径生成;丁酸则大部分由Faecalibacteriumprausnitzii,Eubacteriumrectale和Eubacteriumhallii通过丁酸辅酶A或小部分由Coprococcuscomes和Coprococcuseutactus通过丁酸激酶生成[15]。本研究结果显示,牛磺熊去氧胆酸水平与Lachnoclostridium、Streptococcusc丰度呈显著性正相关,这与Zhao等[30]的研究结果相一致;熊去氧胆酸与norank_f__noranl_o_Clostridia_UCG-014呈正相关,有文献指出熊去氧胆酸由Clostridium产生[31],这与我们的研究结果一致。此外,有报道称熊去氧胆酸还可以抑制直肠癌中的COX-2表达,并抑制NF-κB和AP-1的DNA结合发挥抗癌作用[32]。在本实验中,清热燥湿类中药降低了熊去氧胆酸的水平,这可能与小鼠所处的状态不同有关,且小鼠和人体的生理状态存在一定差异,后续还需要进一步的实验说明清热燥湿类中药在疾病状态下对肠道菌群和胆汁酸的影响。
综上所述,常见的清热燥湿类中药在长期给予临床等效剂量情况下可增加部分有益菌的水平,进而调节胆汁酸的代谢,但对小鼠肠道短链脂肪酸含量无明显影响。而清热燥湿类中药在疾病状态下对胆汁酸和短链脂肪酸的代谢调控尚需进一步的实验研究。以上结果补充了清热燥湿类中药对正常状态下动物肠道菌群介导的胆汁酸和短链脂肪酸变化的数据资料,为清热燥湿类中药在疾病的预防和治疗中的应用提供科学依据。
