UPLC-Q-TOF-MS/MS代谢组学分析针刺对抑郁症患者血浆代谢物变化的影响
2023-06-10曾锐康冬妮王省王红陈斌汪晶黄一平
曾锐,康冬妮,2,王省,王红,3,陈斌,汪晶,黄一平
(1.南京中医药大学附属中西医结合医院,江苏 南京 210028;2.宝鸡市中医医院药学部,陕西 宝鸡 721000;3.南京脑科医院医学心理科,江苏 南京 210029)
抑郁症又称抑郁障碍,是临床常见的精神疾病,主要表现为情绪低落、思维迟缓、意志减退、精力不足、悲观等,严重者可出现自残、自杀,是威胁人类健康和影响生活幸福指数的严重疾病之一[1-2],其具体发病机制尚不明确[3]。近年来,随着生活压力的增加,抑郁症的发病率越来越高。目前对于抑郁症治疗除了心理干预外,药物治疗也非常重要,抗抑郁药虽具有抗抑郁及抗焦虑作用,但部分患者存在较为严重的不良反应[4-5]。脊髓上神经通路在抑郁症治疗中作用特殊,外耳是体表唯一既有三叉神经又有迷走神经分布的部位,研究表明针刺治疗能够改善患者抑郁症状[6-8]。如缺血性中风后抑郁患者,在给予氟西汀西药抗抑郁治疗基础上,早期辅以加强扬刺百会穴治疗,能进一步提高临床疗效,减轻抑郁病情,促进神经功能恢复,改善患者生活质量,且安全可靠[9]。课题组前期研究发现,在对抑郁症患者口服选择性5-羟色胺(5-HT)再摄取抑制剂(Selective serotonin reuptake inhibitors,SSRIs)类药物的同时加予耳皮内刺治疗能有效提高抗抑郁药的抗抑郁作用[10]。
抑郁症是一种系统性综合病症,且抑郁症发病机制可能与单胺类递质系统、下丘脑-垂体-肾上腺轴等复杂的信号网络改变有关[11],可伴有氨基酸、糖和血脂代谢等多种代谢物异常[12]。代谢组学具有能够及时、灵敏、真实地反映生物体功能对病理生理或基因修饰等刺激产生的动态应答与整体调节的特点[8]。因此,本研究采用代谢组学UPLC-Q-TOF-MS/MS技术对抑郁症患者治疗前后的血浆样本进行分析,比较药物及针刺治疗作用于抑郁症可能的代谢途径,以期进一步阐明其作用机制。
1 临床资料
1.1 研究对象
选取2017年10月至2018年6月南京脑科医院的抑郁症患者25例,随机分为针刺药物组13例、药物组12例(脱落4例)。2组患者年龄、性别以及治疗前HAMD指数等方面比较无显著性差异(P>0.05),具有可比性(表1)。本研究经南京脑科医院伦理委员会批准(伦理批号:NJDEZYYZJ201602)。

表1 2组患者基线资料比较Table 1 Comparison of baseline data between
1.2 西医诊断标准
抑郁症诊断标准主要依据《中国精神疾病分类方案与诊断标准》第3版(CCDM-Ⅲ)的抑郁诊断标准,并且符合CCDM-Ⅲ关于抑郁单次或反复发作的诊断标准[13]。主要以心境低落为主,并至少包含下列中4项:①兴趣丧失、无愉快感;②精力减退或疲乏感;③精神运动性迟滞或激越;④自我评价过低,自责,或有内疚感;⑤联想困难或自觉思考能力下降;⑥反复出现想死的念头或有自杀、自伤行为;⑦睡眠障碍,如失眠、早醒,或睡眠过多;⑧食欲降低或体重明显减轻;⑨性欲减退。
1.3 纳入标准
①符合抑郁症诊断标准;②无其他神经精神类疾病史;③签署知情同意书;④未参加其他药物临床试验;⑤无药物依赖史或者物质滥用史;⑥常规医学检查(血常规、尿常规)无明显异常。
1.4 排除标准
①服用非SSRIs类药物患者;②有自杀计划或行为者;③有躁狂、轻度躁狂或混合发作史;④已接受其他治疗,可影响本研究的效应指标检测结果者。
2 方法
2.1 治疗方法
药物组患者均给予SSRIs类抗抑郁药常规治疗。根据临床用药经验,大多数抗抑郁药物初次给药剂量为10 mg·d-1,若7 d内患者接受度良好,剂量增加至20 mg·d-1。同时,根据患者病情与医生诊断,剂量会随着患者症状的加重增加。
针刺药物组在药物组治疗基础上进行耳内皮刺治疗。具体操作为:常规耳部皮肤消毒,使用0.18 mm×10 mm(镇江皇帝牌针灸针,货号:20161016)针灸针,在单侧外耳的耳甲区选取4个位置相对固定且平坦的进针点,分别是三角窝内:对耳轮上脚和对耳轮下脚分叉处(1处);耳甲艇内:对耳轮下脚下方(1处)和对耳轮上方(1处);耳甲腔内(1处)。采用平针(进针角度<15°)方法刺入皮肤内,将针体贯穿皮肤内而不是皮下,不触及耳软骨,避免产生疼痛感。针毕使用胶布贴敷以隐藏针体,留针4 h,每日治疗1次,每周连续治疗5次,2组疗程均为3周。
2.2 实验方法
2.2.1 仪器和试剂 Micromass Q-TOF microTM四级杆-飞行时间质谱(电喷雾离子源-Lockspray);低温高速离心机(德国 Eppendorf公司);Vortex Genie®2 Vortex型涡旋仪(深圳安必胜公司);超低温冰箱(-80 ℃,美国Thermo公司);Millipore纯水机(美国Millipore公司);KQ-4000B型超声清洗机(巩义市予华仪器公司);METTLER AB135-S型电子天平(上海梅特勒-托利多仪器有限公司);N-EVAP-112氮吹仪(美国Organomation公司)。肝素钠注射液(常州千红生化制药股份有限公司,货号:151710084A,);乙腈(色谱纯,美国Merck公司);甲酸(色谱纯,批号:J1610006,上海阿拉丁公司)。
2.2.2 全血标本采集及血浆提取 治疗前及末次治疗2 h后经肘正中静脉采集静脉血3 mL至肝素抗凝管中,立即颠倒混匀7~8次,静置1 h后将全血置于4 ℃离心机内以1 500 r·min-1离心15 min,离心结束后用移液器分别吸取150 μL上层清液(血浆)至200 μL EP管;分装结束后,将血浆样品迅速转移至-80 ℃冰箱保存待用。
2.2.3 血浆样品制备及预处理 于-80 ℃冰箱中取出上述冻存的血浆样品,将血浆样品于4 ℃解冻,解冻后精密吸取200 μL血浆,加入800 μL的预冷乙腈溶液,涡旋混合,4 ℃静置10 min,于4 ℃下13 000 r·min-1离心15 min,取上清液800 μL,4 ℃低温离心吹干,冻干物用200 μL乙腈-水(8∶2,v/v)超声复溶,涡旋,13 000 r·min-1离心15 min,取上清液进样检测。
2.2.4 质控样本的制备 等量吸取30 μL各个血浆样本,将其混合均匀后作为质控样本,用于检测仪器稳定性和重复性。
2.2.5 色谱条件 色谱柱为Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm);柱温30 ℃,流速0.8 mL·min-1,进样量3 μL;流动相A为0.1%甲酸水,流动相B为乙腈溶液。样品的洗脱条件:0~1 min,10%B;1~8 min,10%→95%B;8~9 min,95%B;9~10 min,95%→10%B;10~12 min,10%B。
2.2.6 质谱条件 采用TOF MS-IDA-MS/MS模式,电喷雾离子(ESI),正离子模式扫描,质量扫描范围50~1 500m/z。正离子检测方式:气帘气(CUR)40 psi,雾化气(GS1)55 psi,辅助气(GS2)55 psi,电喷雾电压(ISVF)4 500 eV,离子源温度(TEM)550 ℃,去簇电压(DP)±100 eV;TOF MS模式下设置碰撞电压±10 eV,IDA-MS/MS条件下设置碰撞电压±40 eV,碰撞电压差20 eV。
2.2.7 进样步骤 首先进样2针QC样品以平衡色谱柱和系统,接着进分析样品。每进7个样品,中间间隔1个QC样品进样,平衡因进样次序不同影响最终结果。所有样品按设置的进样程序依次进样。
2.3 统计学方法

3 结果
3.1 UPLC-Q-TOF-MS/MS分析
采用UPLC-Q-TOF-MS/MS对各组血浆样本进行检测,正离子模式下各组血浆样本总离子流图(TIC)见图1。从PCA、PLS-DA图(图2)中可以看出各组治疗前后,针刺药物组治疗后与药物组治疗患者的血浆样本代谢轮廓存在明显差异。针刺药物组和药物组进行PLS-DA分析,模型验证图即置换检验图可以用于判定PLS-DA模型是否过拟合,设定检验次数为200,得到模型验证结果如(图3)所示,左侧所有Q2值低于右侧原始点或Q2的回归线与纵轴相交数值<0,证明PLS-DA模型有效[15]。同时,利用PLS-DA对所有治疗前的患者代谢轮廓进行检验,2组患者虽有明显区分,但其左侧所有Q2没有低于右侧原始点,证明此PLS-DA模型为过度拟合,2组患者在治疗前无差异。

注:A.针刺药物组;B.药物组图1 正离子模式下各组血浆样本总离子流图(TIC)Fig.1 Total ion chromatogram of plasma samples from each group in positive ion mode

注:AB.针刺给药前;ab.针刺给药后;DE.给药前;de.给药后;①③⑤⑦.PCA图;②④⑥⑧.PLS-DA图图2 PCA图及PLS-DA图Fig.2 PCA and PLS-DA scores plot of each group
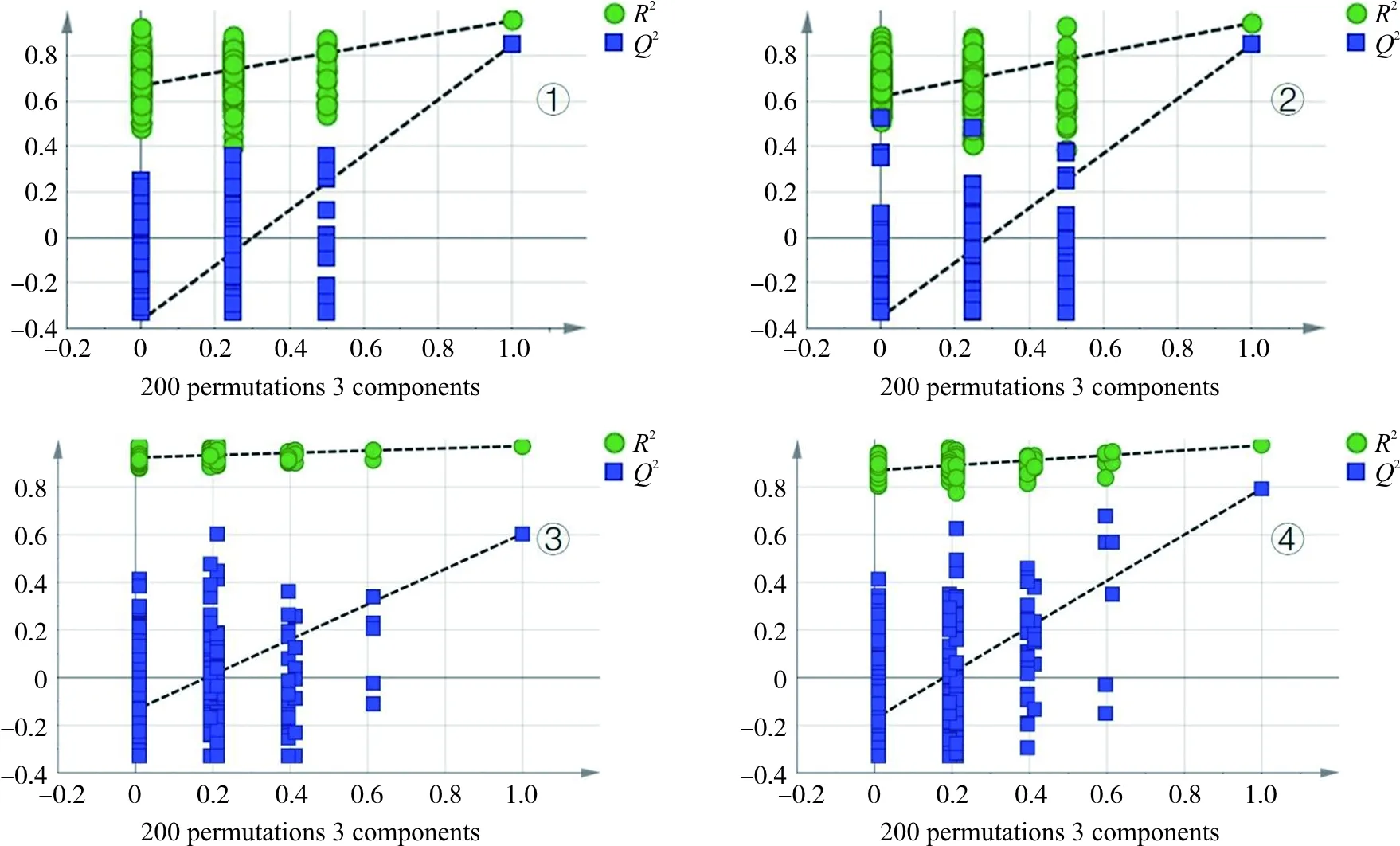
注:①.针刺药物组;②.药物组;③.治疗前对比;④.治疗后对比图3 PLS-DA置换检验图Fig.3 Permutation test of PLS-DA model
分别建立针刺药物前后的判别模型、单纯给药前后的判别模型,模型评价参数(R2Y,Q2)列于表2,R2Y,Q2越接近于1,表明模型越稳定可靠,通过本实验表明针刺药物组、药物组模型稳定可靠。
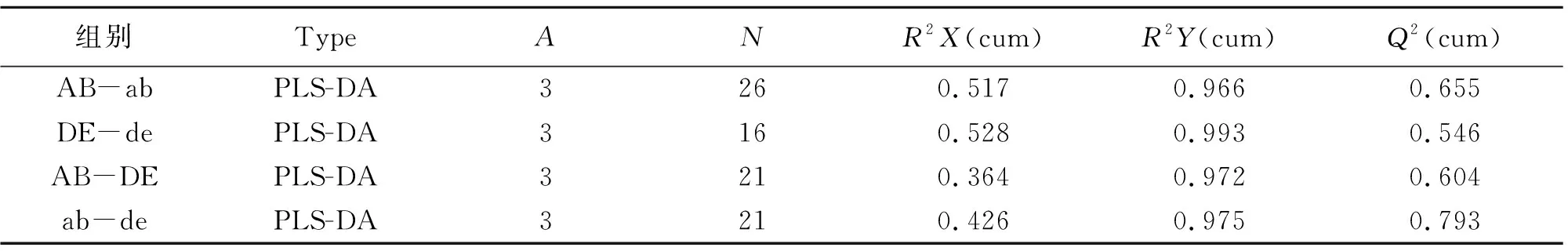
表2 各组间PLS-DA模型参数表Table 2 Evaluation parameter of PLS-DA in each group
3.2 潜在生物标志物的筛选
基于针刺药物组、药物组的PLS-DA图中的VIP值,按从大到小的顺序排序所有检测的质谱值,挑选VIP>1的代谢物,VIP越大说明对该疾病的贡献越大,定为差异成分;在针刺药物组、药物组中跟踪上述的差异成分,筛选出有显著性差异的成分(t检验),挑选P<0.05的这些差异代谢物最终被选定为结构鉴定的对象;采用AB Sciex的MarkerView软件进行峰识别,对照METLIN、HMDB、Chemspider等化合物在线数据库,综合筛选了针刺药物组、药物组的潜在生物标志物,针刺药物组有16个潜在生物标志物,药物组有9个潜在生物标志物,结果分别见表3~4。
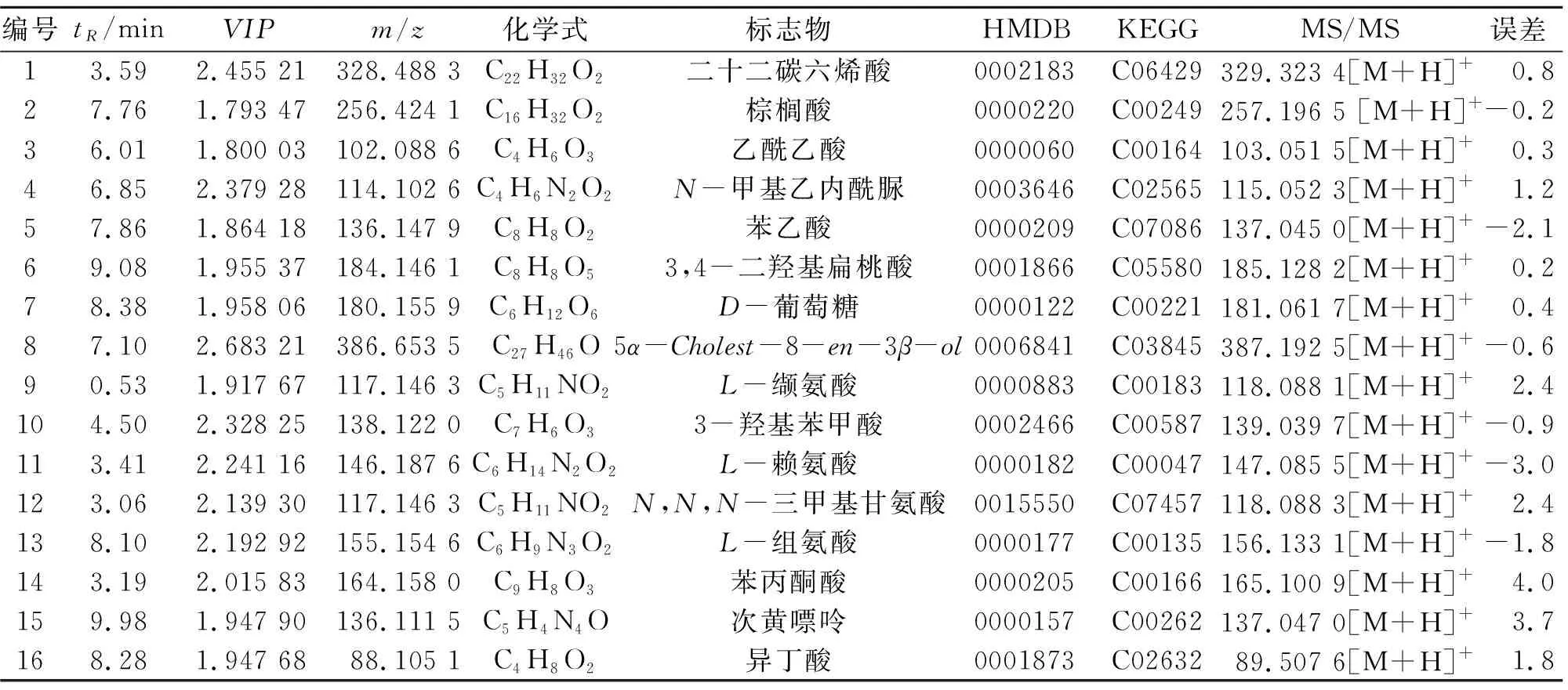
表3 针刺药物组抑郁症患者的潜在生物标志物Table 3 Potential biomarkers of depressed patient in acupuncture-drug group

表4 药物组抑郁症患者的潜在生物标志物Table 4 Potential biomarkers of depressed patient in drug group
3.3 差异代谢物生物功能分析
对差异性代谢物归一化后的数据进行聚类分析,所得针刺药物组热图结果见图4,药物组热图见图5。由图4可见,针刺药物组针刺给药后与针刺给药前相比,有3-羟基苯甲酸、二十二碳六烯酸、L-赖氨酸、L-缬氨酸等8个代谢物上调,有N-甲基乙内酰脲、L-组氨酸、棕榈酸、异丁酸等8个代谢物下调。由图5可见,药物组给药后与给药前相比,有乙酰磷酸酯、对黄嘌呤、氨己烯酸等5个代谢物上调,有顺式丙烯酸乙酰酯、4-羟基肉桂酸、甘油醛等4个代谢物下调。

图4 针刺药物组显著性差异代谢物层次聚类结果Fig.4 The hierarchical clustering results of significantly potential metabolites in acupuncture-drug group

图5 药物组显著性差异代谢物层次聚类结果Fig.5 The hierarchical clustering results of significantly potential metabolites in drug group
3.4 代谢通路分析
将针刺药物组16个差异代谢物、药物组9个差异代谢物输入到MetPA(http://www.metaboanalyst.ca/)数据库中进行通路分析,通过Impact>0.1筛选得到针刺药物组抑郁症患者有4条代谢通路发生显著变化,分别为酮体的合成与降解、赖氨酸降解、苯丙氨酸代谢、组氨酸代谢,见图6;药物组抑郁症患者有4条代谢通路发生显著变化,分别为亚油酸代谢、咖啡因代谢、牛磺酸和亚牛磺酸的代谢、精氨酸和脯氨酸代谢,见图7。
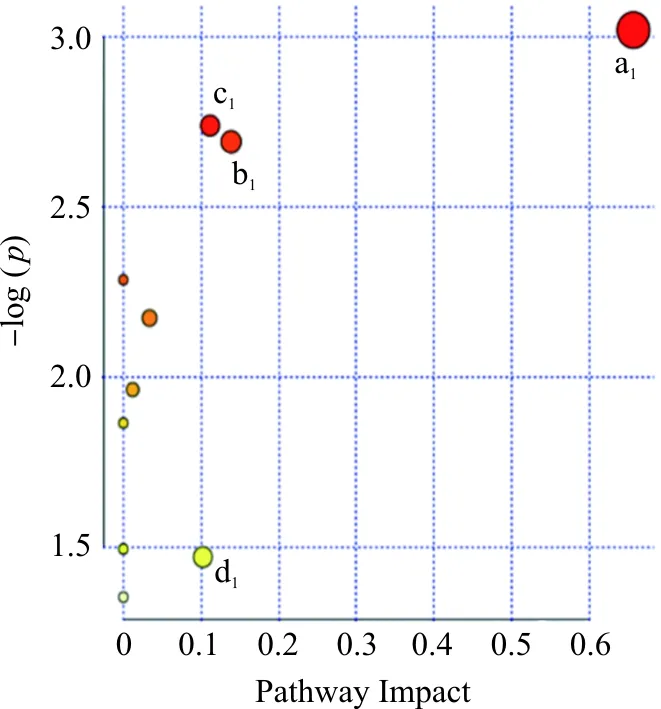
注:a1.酮体的合成与降解;b1.赖氨酸降解;c1.苯丙氨酸代谢;d1.组氨酸代谢图6 针刺药物组治疗前后血浆差异代谢通路Fig.6 Differential metabolic pathways in plasma before and after treatment in acupuncture-drug group

注:a.亚油酸代谢;b.咖啡因代谢;c.牛磺酸和牛磺酸的代谢;d.精氨酸和脯氨酸代谢图7 药物组治疗前后血浆差异代谢通路Fig.7 Plasma differential metabolic pathways before and after treatment in drug group
4 讨论
中医学认为抑郁症多由阳气亏虚、气机不畅导致五脏功能失调而产生。针灸具有疏经通络、调整脏腑、调和气血、调畅情致等作用,已广泛应用于临床抑郁症的治疗中。耳部可视为人体的缩影,穴位丰富,对耳内特定部位的皮刺刺激,能够调控神经内分泌系统改善脏腑功能,发挥安神、疏肝、调理脏腑作用,多用于神志相关病及痛证的治疗。现代研究表明,神经炎症可能是抑郁病的发病机制之一,外耳针刺的主要刺激对象为三叉神经旁核、孤束核、迷走神经核、蓝斑、延髓腹外侧的头端和尾端、下丘脑室旁核等,这些核团组成的网络与炎症调节密切相关,外耳针刺可降低机体的神经炎症[10],改善抑郁症状态。
维生素的生物合成与苯丙氨酸代谢息息相关[16],维生素具有消除氧自由基的作用,此外,维生素B6可使GABA以及5-HT合成增加,对抑郁症亦有治疗作用。L-赖氨酸是5-HT拮抗剂,并在钙吸收中起主要作用[17-18]。本次研究显示针刺药物可通过调节苯丙氨酸代谢及L-赖氨酸降解,促进维生素的合成,进而调节5-HT的合成。三羧酸循环(TCA)是有氧代谢供能系统,同时也是糖类、蛋白质、脂类的代谢枢纽,组氨酸是可以转化成TCA循环中间体的氨基酸之一[19-20]。差异性代谢物中的柠檬酸和异柠檬酸都是TCA循环中重要的中间产物。提示针刺药物组可一定程度改善抑郁症患者能量代谢异常。酮体[21]是脂肪酸在肝脏进行正常分解代谢所生成的特殊中间产物,包括有乙酰乙酸(约占30%),β-羟基丁酸(约占70%)和极少量的丙酮。酮体可作为替代燃料,为受损的线粒体提供更多的能量来源以维持脑组织正常功能,酮体可以氧化辅酶Q,减少线粒体内氧自由基的形成[20],改善抑郁症炎症状态。本研究显示,针刺药物主要调控酮体的合成与降解、赖氨酸降解、苯丙氨酸代谢以及组氨酸代谢,提示其可能通过调控机体代谢,改善抑郁症患者神经炎症及能量代谢异常。
本研究药物组差异代谢物与针刺药物组明显不同,其主要调控亚油酸代谢、咖啡因代谢、牛磺酸和亚牛磺酸、精氨酸和脯氨酸代谢。亚油酸在免疫调节、脂类代谢、心血管疾病等方面起着非常重要的作用。相关文献表明适宜的亚油酸水平对增强机体抗氧化功能具有重要影响[22]。咖啡因能够激活去甲肾上腺素能通路,已被证实能反复增强大脑多个区域去甲肾上腺素的转化。研究表明靶向去甲肾上腺素转运体,可对重度抑郁症发挥有效治疗作用[12]。对咖啡因的调控,可一定程度增强去甲肾上腺素的转化起到抗抑郁作用。牛磺酸作为体内含量最丰富的含硫氨基酸,以游离状态存在于生物体内,是人体正常所必需的活性物质,有研究发现牛磺酸[23]可对抗利血平诱导的急性抑郁患者多巴胺、去甲肾上腺素的含量下降,降低单胺氧化酶活性,升高脑源性神经营养因子水平,提示调控牛磺酸代谢治疗抑郁症的作用机制与神经单胺递质假说、神经内分泌假说和脑源性神经营养因子假说密切相关。
综上所述,SSRIs类药物加耳内皮刺与单独使用SSRIs类药物可能通过调控抑郁症患者代谢发挥抑郁症治疗作用,调控更多的代谢物可能是耳内皮刺增效的内在机制。但本研究未观察给予耳内皮刺后,是否可以减少SSRIs类药物量,且纳入病例较少,后续将进一步采用多中心大样本随机对照试验深入探讨耳内皮刺加药物发挥抗抑郁的作用机制。
