三仁颗粒制备及质量控制研究
2023-06-08冯禹壮肖春萍赵淑月翁丽丽
冯禹壮,徐 伟,肖春萍,赵淑月,翁丽丽
长春中医药大学药学院,吉林 长春 130117
三仁汤出自清代吴鞠通的《温病条辨》[1],原文记载:“头痛恶寒,身重疼痛,舌白不渴,脉弦细而濡,面色淡黄,胸闷不饥,午后身热,状若阴虚,病难速已,名曰湿温……三仁汤主之。”处方由杏仁、白蔻仁、生薏仁、半夏、厚朴、白通草、竹叶、飞滑石8 味药材组成,主治湿温初起及暑温夹湿之湿重于热证[2]。方中杏仁、白蔻仁、薏苡仁为君药,分消三焦湿热;竹叶、飞滑石为臣药,清热利湿;厚朴、半夏为佐药,芳化燥湿;白通草为使药,导热下行。现代临床研究表明,三仁汤配合其他药物对消化系统、免疫系统和运动系统等湿热证有良好疗效,如联合升降散治疗脾胃湿热型胃炎[3];舌草三仁汤能够改善青少年肠胃湿热型痤疮、并较低其复发率[4];三仁汤加陈皮、枳壳等药味,对湿热侵心的病毒性心肌损伤有良好疗效[5];联合美洛昔康可有效缓解湿热型骨关节炎[6]等。
目前,有关三仁汤的报道主要集中于其药理作用和临床应用,而前期制剂的生产工艺和质量标准研究较为缺乏。季旭明等[7]通过研究三仁汤对湿热证型病毒性肺炎小鼠的治疗作用发现,三仁汤能够改变机体炎性因子含量、增强机体免疫功能;胡锋等[8]研究发现,三仁汤可以通过下调大鼠膝关节软骨组织的NOD-、LRR-和pyrin 结构域的蛋白质3(NOD-,LRR-and pyrin domain-containing protein 3,NLRP3)和核因子-κB(nuclear factor-κB,NF-κB)p65 蛋白表达来减少大鼠血清中炎症因子的表达,从而缓解关节疼痛症状。苦杏仁、白蔻仁和薏苡仁为三仁汤的君药,苦杏仁的主要药效成分为苦杏仁苷,具有镇痛抗炎、抗胃溃疡、止咳平喘等药理作用[9];豆蔻作为芳香健胃药,其主要药效成分为桉油精,具有抗炎抗过敏、抗氧化、保护胃肠损伤等作用[10];薏苡仁具有抗炎镇痛、抗癌、调节免疫、抗溃疡等药效[11-12],其主要药效成分为甘油三油酸酯。三仁汤的君药均有镇痛抗炎作用,在治疗因湿热引起的各种炎症中起着关键作用。另外,厚朴中的厚朴酚及和厚朴酚也有抗炎镇痛功效[13-14],与三仁汤主治功能相吻合。因此,本研究将苦杏仁苷、厚朴酚及和厚朴酚作为三仁汤的关键质量属性,对三仁汤进行制备和处方质量控制。
相比于传统汤剂,颗粒剂能显著改善汤剂服用量大、携带运输不便等缺点,三仁汤剂型改良势在必行。迄今尚未发现有关三仁颗粒制备工艺及质量控制的有关报道,因此本实验采用HPLC 法建立了苦杏仁苷、厚朴酚及和厚朴酚等多指标成分含量测定方法;以出膏量,苦杏仁苷、厚朴酚及和厚朴酚含量,50%乙醇浸出物为综合考察指标,结合熵权法分配各指标权重,运用正交试验法优选三仁汤提取工艺;采用星点设计-响应面法(central composite design-response surface method,CCD-RSM)优化三仁颗粒的成型工艺,并结合薄层色谱及指纹图谱进行了三仁颗粒的质量控制研究,旨在为三仁颗粒的工艺生产和质量评价提供理论参考依据。
1 仪器与材料
1.1 仪器
AUW120D 型分析天平、岛津LC-2030 高效液相色谱仪,岛津企业管理中国有限公司;DHG-9070 A 型鼓风式干燥箱,上海精宏实验设备有限公司;FA1004B型电子天平,上海佑科仪器仪表有限公司;HH-S24 型恒温水浴锅,金坛市大地自动化仪器厂。
1.2 试剂与药物
对照品苦杏仁苷(批号110820-201808,质量分数88.2%)、厚朴酚(批号110729-202015,质量分数99.0%)、和厚朴酚(批号110730-201915,质量分数99.8%),中国食品药品检定研究院;甲醇,色谱纯,赛默飞世尔科技(中国)有限公司;其余试剂均为分析纯,水为娃哈哈纯净水。
进行三仁颗粒制备工艺优化、质量标准建立及指纹图谱基准样品制备的药材杏仁、白蔻仁、生薏仁、半夏、厚朴、白通草、竹叶、飞滑石均购自吉林北药药材加工有限公司、吉林省宏检大药房及吉林国安药业有限公司,经长春中医药大学药学院翁丽丽教授鉴定,分别为蔷薇科李属植物山杏Prunus armeniacaL. var.ansuMaxim.的干燥成熟种子、姜科豆蔻属植物白豆蔻AmomumkravanhPierre ex Gagnep.的干燥成熟果实、禾本科薏苡属植物薏米Coixlacryma-jobiL. var.ma-yuen(Roman.) Stapf 的干燥成熟种仁、木兰科厚朴属植物厚朴Magnolia officinalisRehd. et Wils.的干燥干皮、天南星科半夏属植物半夏Pinelliaternata(Thunb.) Breit.的干燥块茎炮制品、五加科通脱木属植物通脱木Tetrapanax papyrifer(Hook.) K. Koch 的干燥茎髓、禾本科淡竹叶属植物淡竹叶LophatherumgracileBrongn.的干燥茎叶、硅酸盐类矿物滑石族滑石Talcum,主含含水硅酸镁[Mg3(Si4O10)(OH)2]。
进行三仁颗粒制备工艺优化及质量标准建立所采用的药材及批号分别为苦杏仁(批号20210111-01)、白蔻仁(批号20210508)、薏苡仁(批号20210408)、厚朴(批号20200901-01)、姜半夏(批号20210412)、通草(批号20210508)、淡竹叶(批号20200902)、滑石(批号20210202),均购自吉林北药药材加工有限公司。10 批三仁颗粒样品(S1~S10)组方药材及批号信息如表1 所示。
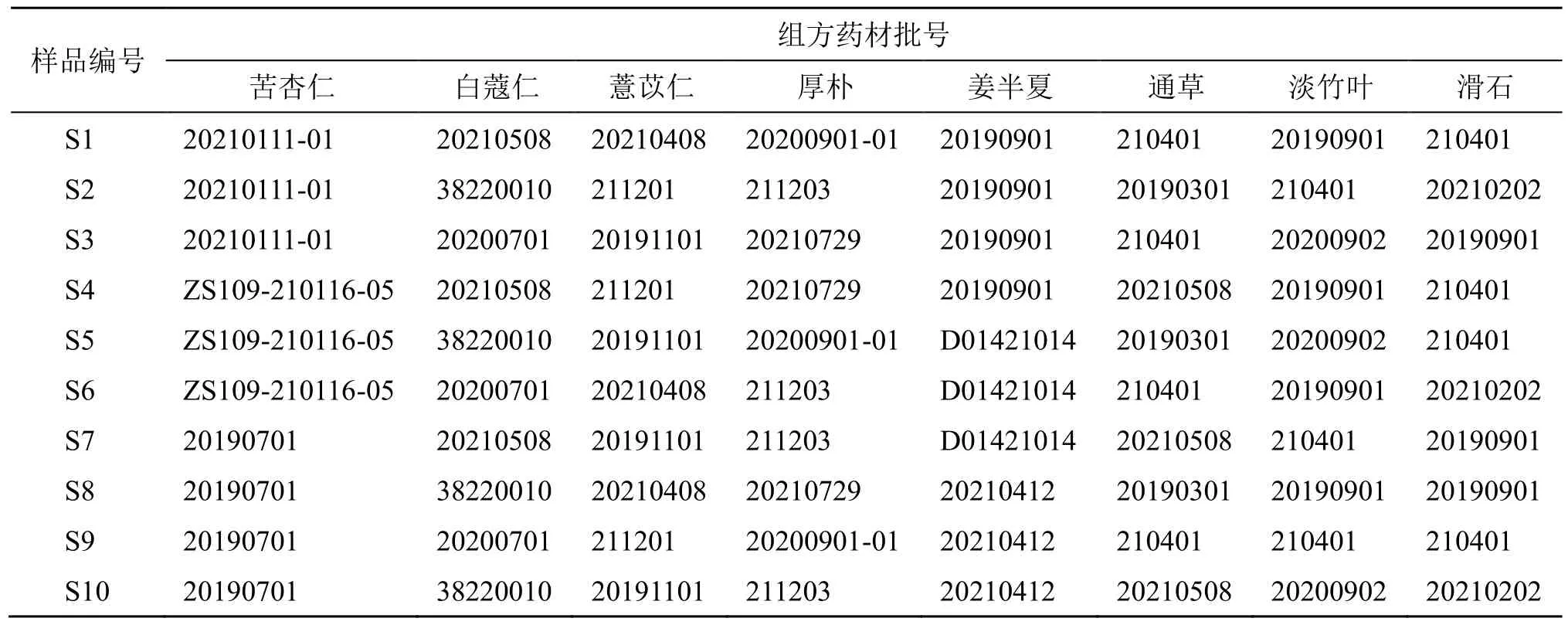
表1 10 批三仁颗粒基准样品 (S1~S10) 组方药材及批号信息Table 1 Prescription medicinal materials and batch number information in 10 batches of Sanren Granules reference samples(S1—S10)
2 方法与结果
2.1 三仁汤标准煎液的制备
《温病条辨》中描述三仁汤煎煮方法为“杏仁五钱、白蔻仁二钱、生薏仁六钱、半夏五钱、厚朴二钱、白通草二钱、竹叶二钱、飞滑石六钱,甘澜水八碗,煮取三碗。”参考《中国科学技术史·度量衡卷》[15]中附录的《中国历代度量衡值表》及颜文强考证的《中国历代度量衡换算简表》,清代“一两等于37.3 g,一钱等于3.73 g”。参考“十三五”规划教材《方剂学》[16],“一两等于37.3 g,一钱等于3.73 g”,参考《经典名方开发指引》[17]中清代1 碗约为150~300 mL。经文献考证及预实验考察,确定三仁汤基准样品制备方法为苦杏仁18.65 g,豆蔻7.46 g,薏苡仁22.38 g,姜半夏18.65 g,厚朴7.46 g,白通草7.46 g,淡竹叶7.46 g,飞滑石22.38 g,加水1200 mL,传统方法煎煮至药液剩余450 mL,收集滤液,干燥即得。
2.2 三仁汤提取工艺优化
2.2.1 色谱条件 色谱柱为Agilent Zorbax Eclipse XDB C18柱(250 mm×4.6 mm,5 μm);体积流量1 mL/min;柱温25 ℃;进样量10 μL;检测波长:0~72 min,220 nm;72~100 min,330 nm;100~120 min,294 nm;流动相为0.05%磷酸水溶液-甲醇,洗脱程序:0~20 min,5%~10%甲醇;20~70 min,10%甲醇;70~75 min,10%~30%甲醇;75~80 min,30%甲醇;80~90 min,30%~47%甲醇;90~100 min,47%~60%甲醇;100~105 min,60%~85%甲醇;105~110 min,85%甲醇。对照品、供试品、苦杏仁阴性、厚朴阴性对照溶液的HPLC 图见图1。
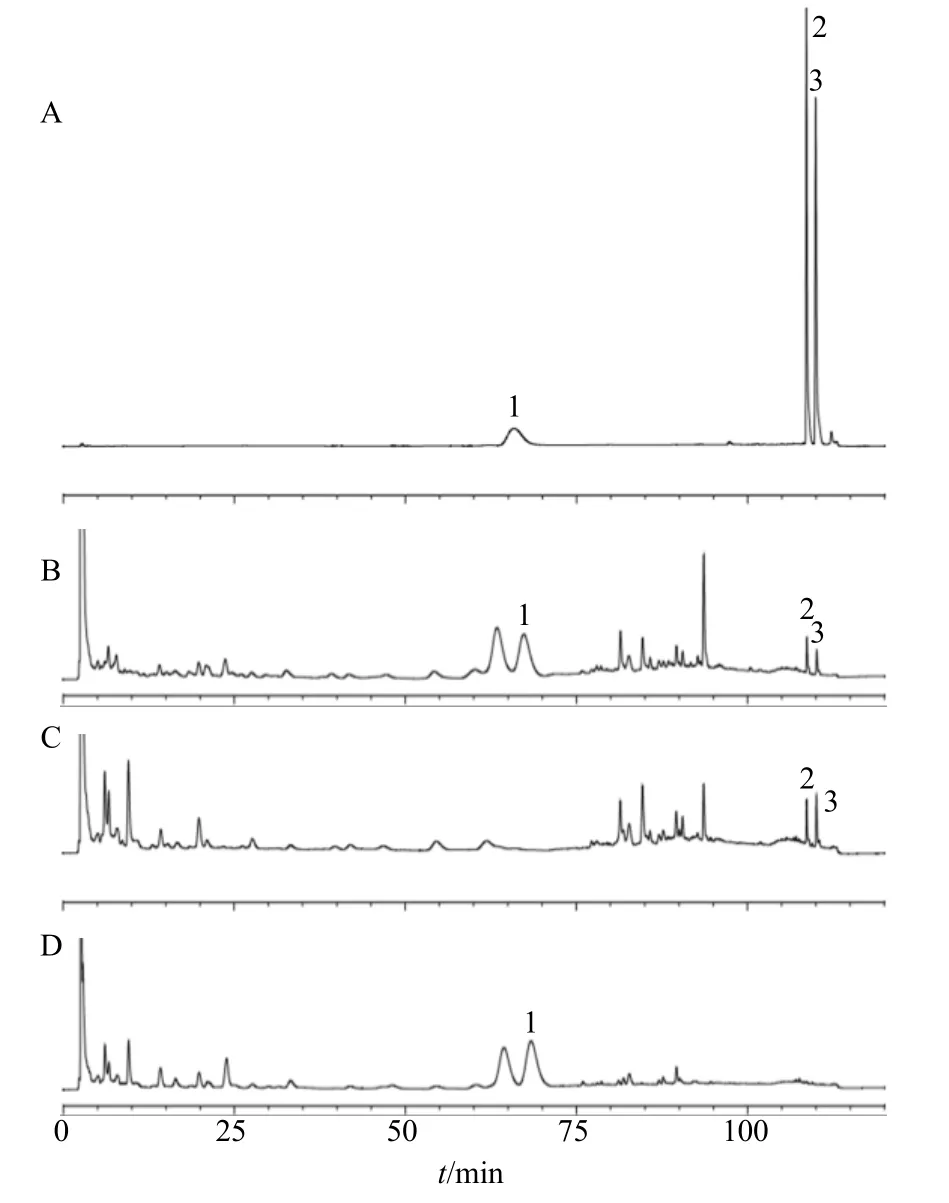
图1 混合对照品 (A)、三仁汤供试品 (B)、缺苦杏仁阴性样品 (C) 和缺厚朴阴性样品 (D) 的HPLC 图Fig. 1 HPLC of mixed reference substances (A), test sample(B), negative sample without Armeniacae Semen Amarum(C), and negative sample without Magnoliae Officinalis Cortex (D)
2.2.2 对照品溶液的制备 取苦杏仁苷、厚朴酚、和厚朴酚对照品适量,精密称定,加甲醇制成含苦杏仁苷753.5 μg/mL、厚朴酚82 μg/mL、和厚朴酚48.8 μg/mL 的混合对照品溶液,于4 ℃下保存备用。
2.2.3 供试品溶液的制备 按处方剂量称取药材,煎煮,滤过,滤液浓缩成干浸膏,粉碎过三号筛,作为供试品。取供试品1 g,精密称定,加甲醇25 mL,称定质量,回流提取45 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.2.4 阴性对照溶液的制备 分别称取缺苦杏仁、缺厚朴的三仁汤处方,同“2.2.3”项操作,分别制成缺苦杏仁阴性对照溶液、缺厚朴阴性对照溶液。
2.2.5 线性关系考察 精密吸取“2.2.2”项下混合对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL,加甲醇定容至10 mL,摇匀,精密吸取各质量浓度的对照品溶液10 μL,注入高效液相色谱仪,测定。得到回归方程分别为苦杏仁苷Y=11 318 301.85X-220 931.188 1,r=0.999 6,线性范围37.6~753.5 μg/mL;厚朴酚Y=15 083 504.12X+22 001.191 03,r=0.999 3,线性范围4.1~82.0 μg/mL;和厚朴酚Y=22 759 975.26X+32 124.668 38,r=0.999 7,线性范围2.44~48.80 μg/mL。
2.2.6 精密度试验 精密吸取“2.2.2”项下对照品混合溶液,按“2.2.1”项下方法连续测定6 次,测得苦杏仁苷峰面积RSD 为0.70%,厚朴酚峰面积RSD 为0.23%,和厚朴酚峰面积RSD 为0.19%,表明仪器精密度良好。
2.2.7 重复性试验 按“2.2.3”项下方法制备6 份供试品溶液,按“2.2.1”项下色谱条件进样测定,测得6 份供试品中苦杏仁苷质量分数的RSD 为1.36%,厚朴酚质量分数的RSD 为1.76%,和厚朴酚质量分数的RSD 为1.48%,表明该提取方法重复性良好。
2.2.8 稳定性考察 取“2.2.6”项下供试品溶液1份,按“2.2.1”项下方法,分别在制备后0、2、4、6、8、10、12、24 h 进行测定,测得供试品溶液中苦杏仁苷峰面积RSD 为1.29%,厚朴酚峰面积RSD为1.70%,和厚朴酚峰面积RSD 为1.02%,表明该供试品溶液在24 h 内稳定性良好。
2.2.9 加样回收率试验 取已测定指标成分含量的供试品0.5 g,精密称定,分别加入适量苦杏仁苷、厚朴酚、和厚朴酚对照品,加甲醇至25 mL,按照“2.2.3”项下方法制备6 份供试品溶液,测定苦杏仁苷、厚朴酚、和厚朴酚的加样回收率分别为100.88%、98.65%、99.06%,RSD 分别为1.68%、1.11%、0.99%,符合规定。
2.2.10 正交试验设计及结果
(1)正交试验设计:通过对三仁汤标准煎液的制备考察可知,三仁汤全方共111.9 g,加水量为1200 mL,约为药材重量的10 倍,且将1200 mL 煎煮至450 mL 所用时间大约为1.2 h,在此基础上设计正交试验因素水平。正交试验将全方质量扩大为223.8 g,以加水量(A)、煎煮时间(B)、煎煮次数(C)为影响因素,出膏量(Y1)、苦杏仁苷含量(Y2)、厚朴酚含量(Y3)、和厚朴酚含量(Y4)、50%乙醇浸出物(Y5)为评价指标,建立L9(34)正交试验表,进行三仁汤提取工艺的考察,正交实验设计与结果见表2。
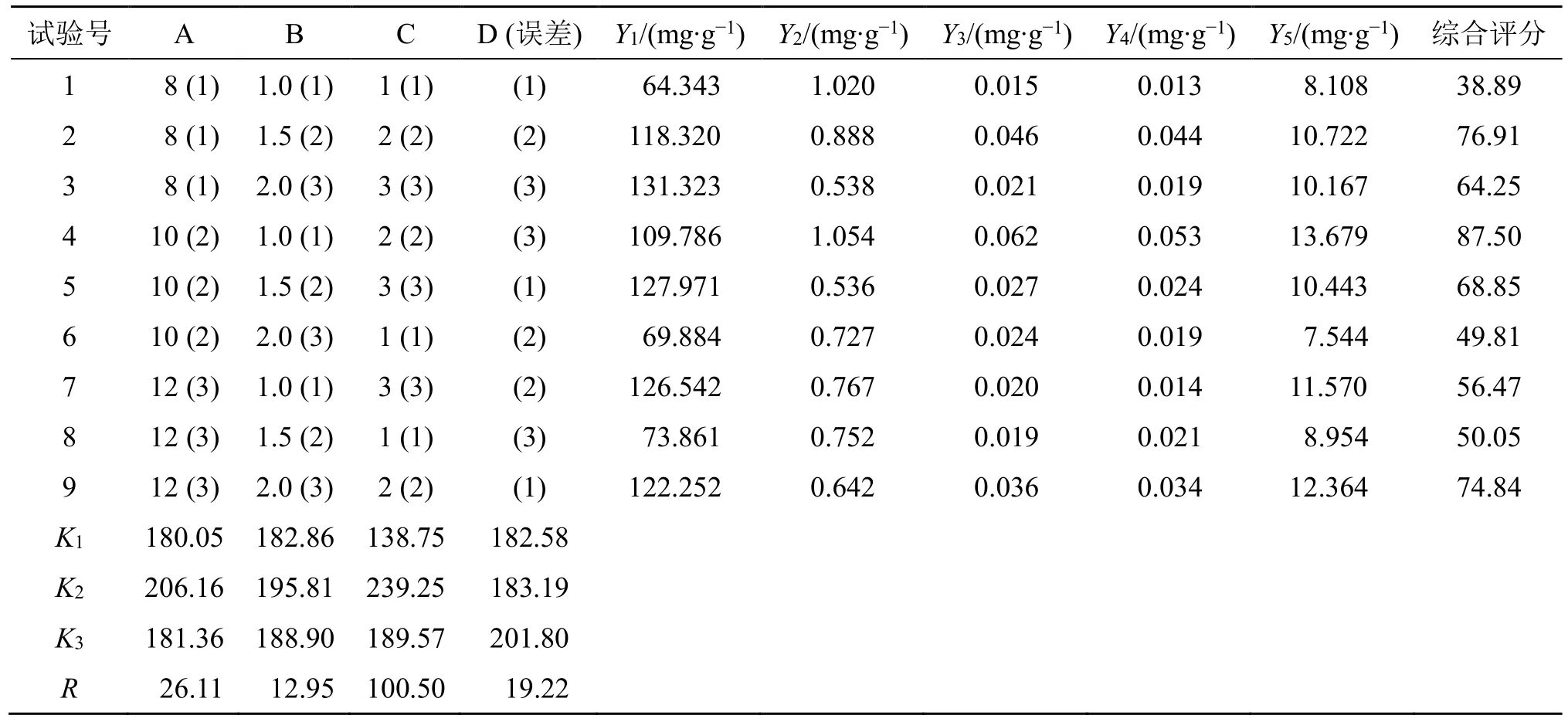
表2 正交试验设计及结果Table 2 Design and results of orthogonal test
(2)熵权法:采用熵权法计算各评价指标熵权系数,该指标对于试验结果作用越大,权重值也越大。计算可得综合评分计算公式为Y=Y1/Y1max×16.03+Y2/Y2max×20.07+Y3/Y3max×24.42+Y4/Y4max×24.51+Y5/Y5max×14.97。信息熵及权重计算结果见表3。

表3 信息熵及权重计算结果Table 3 Information entropy and weight calculation results
(3)提取工艺优化结果及分析:正交试验直观分析及方差分析分别见表2、4。直观分析结果显示,以综合评分为评价指标分析可知,A2>A3>A1,B2>B3>B1,C2>C3>C1,三仁汤提取的最优工艺为A2B2C2。方差分析结果表明,C 因素对试验结果有显著影响(P<0.05),A、B 因素对试验结果无显著影响。因此,进一步对A2B2C2与A1B1C2提取参数进行比较,结果发现2 种提取工艺下,出膏量、苦杏仁苷、厚朴酚、和厚朴酚含量、50%乙醇浸出物总量的RSD 分别为1.59%、2.62%、1.77%、2.18%、0.49%,兼顾节省能源和工时,最终将煎煮条件确定为A1B1C2,即加8 倍量水,煎煮2 次,每次1 h。
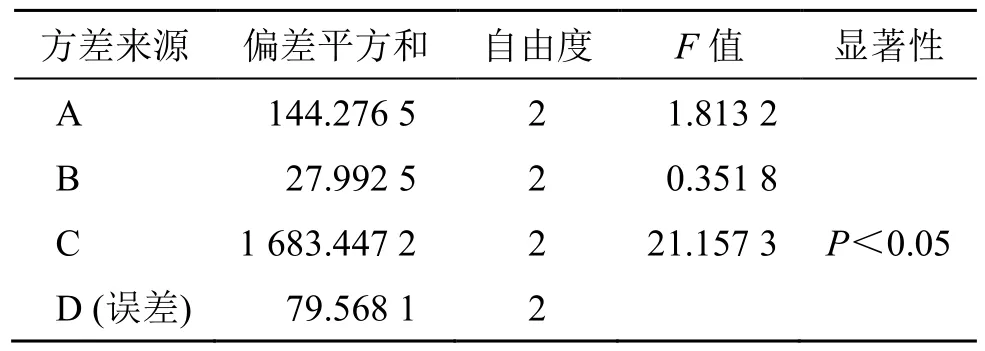
表4 综合评分的方差分析结果Table 4 Analysis of variance table
(4)验证试验:采用“2.2.10(3)”项下最佳工艺进行3 批验证。由表5 可知,3 组验证试验中出膏量、苦杏仁苷含量、厚朴酚含量、和厚朴酚含量、浸出物总量及综合评分RSD 分别为0.85%、2.89%、1.54%、1.31%、0.67%、1.07%,表明优选出的最佳工艺稳定可靠。
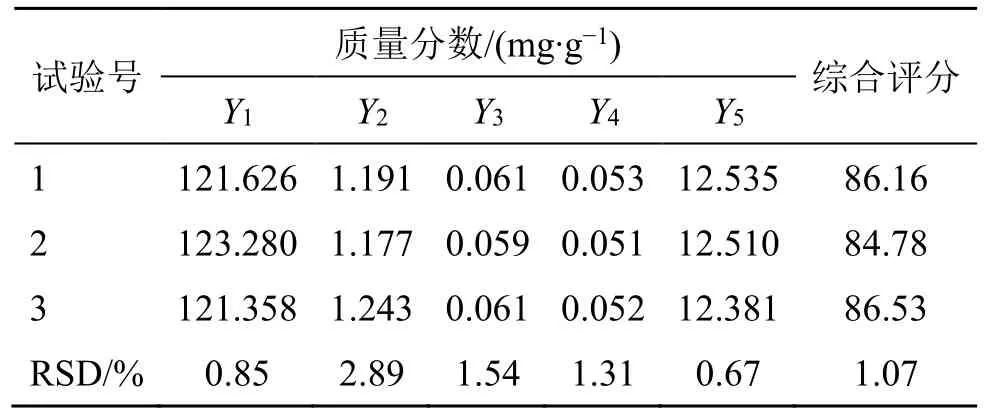
表5 验证试验结果Table 5 Verification test results
2.3 三仁颗粒成型工艺优化
2.3.1 三仁颗粒制备方法 照“2.1”项下剂量称取药材,按“2.2.10(3)”项下三仁汤最佳提取工艺进行煎煮,在70 ℃、0.08 MPa 条件下进行减压干燥,得到浸膏粉末,粉碎,过五号筛,加入辅料和润湿剂,采用挤压制粒法,过14 目筛,60~80 ℃下梯度升温干燥,整粒,即得。
2.3.2 测定指标 参考文献方法[18-22],测定颗粒成型率、休止角、堆密度、吸湿率。
2.3.3 辅料的筛选 以可溶性淀粉、糊精、糖粉和微晶纤维素为辅料,按药辅比1∶1.5,80%乙醇进行制粒,以颗粒成型率、休止角、堆密度、吸湿率为考察指标进行测定。结果,以糊精为辅料时,颗粒容易制备,且各项指标测定结果均优于其余辅料组,所以选用糊精为辅料进行后续试验。
2.3.4 CCD-RSM 优化三仁颗粒成型工艺处方
(1)试验设计与结果:以药辅比(X1)、乙醇体积分数(X2)和乙醇用量(X3)为影响因素,成型率(Y1)、休止角(Y2)、堆密度(Y3)和吸湿率(Y4)为评价指标,采用CCD-RSM 优化成型工艺,实验设计与结果见表6。
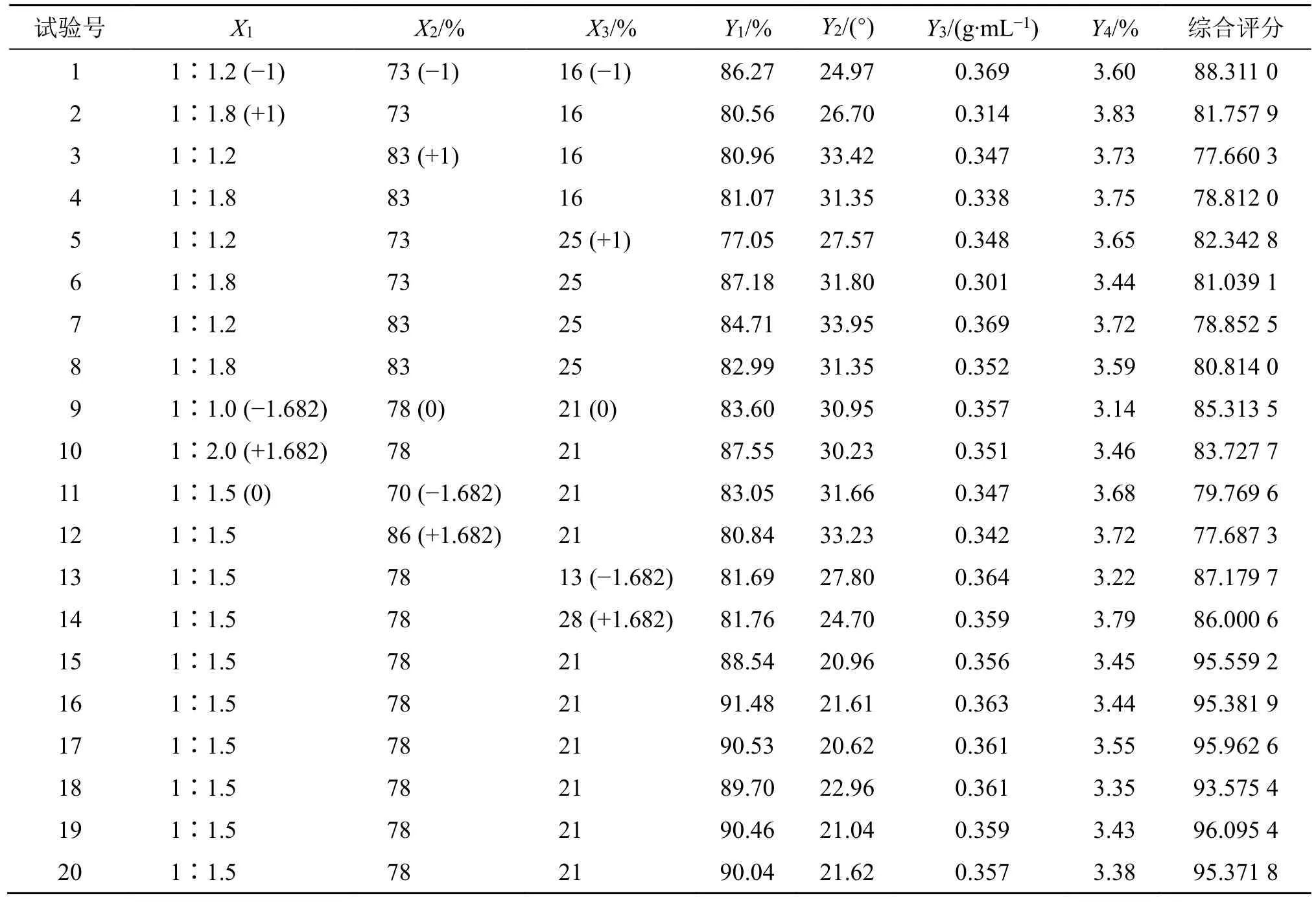
表6 试验设计与结果Table 6 Design and results of test
(2)熵权法计算综合评分:参考文献方法[23],采用熵权法计算各评价指标熵权系数,计算可得综合评分计算公式为Y=Y1/Y1max×20.12+Y2min/Y2×45.88+Y3/Y3max×11.11+Y4min/Y4×22.89。
(3)成型的工艺优化:采用Design-Expert 8.0.6 Trial 软件进行数据分析(表6),得到拟合方程为Y=95.37-0.54X1-1.52X2-0.40X3+1.37X1X2+0.76X1X3+1.24X2X3-4.10X12-6.15X22-3.37X32,r=0.988 6。由方差分析(表7)可知,该模型拟合具有极显著性(P<0.000 1),失拟误差项为0.079 0,表明该模型拟合度较好,且各因素影响程度依次为乙醇体积分数>药辅比>乙醇用量。
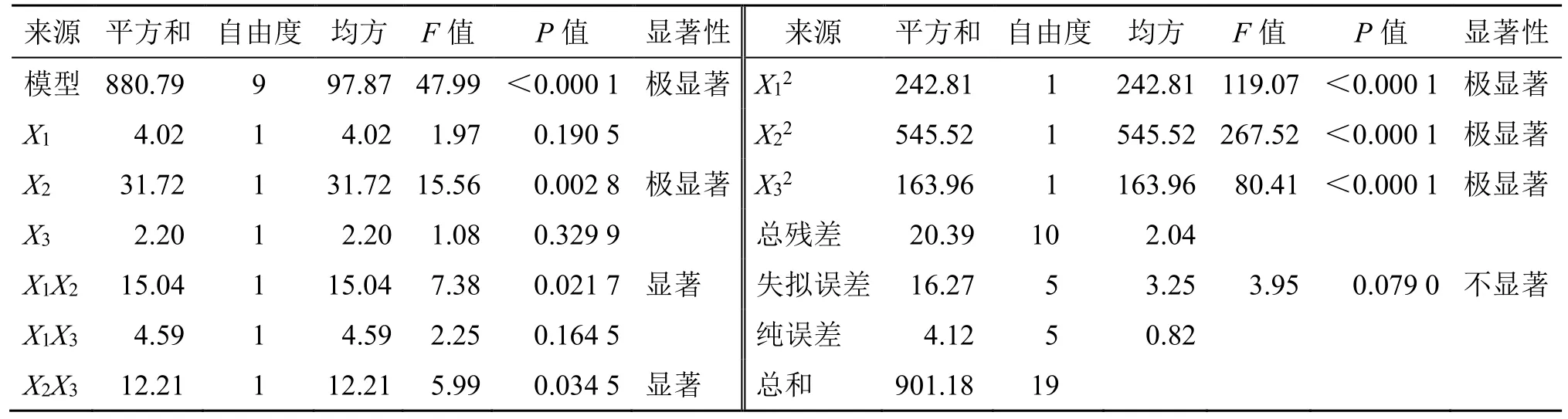
表7 方差分析Table 7 Analysis of variance
综上可知,三仁颗粒最佳成型工艺为药辅比1∶1.5,乙醇体积分数78%,乙醇用量为药粉和辅料总量的21%,综合评分预测值为95.368。
(4)验证试验:按上述最佳工艺参数进行验证试验。结果表明(表8),3 批三仁颗粒成型率、休止角、堆密度、吸湿率的RSD 分别为0.43%、1.22%、1.23%、1.05%,综合评分与预测值95.368 相近,证明该工艺相对稳定。
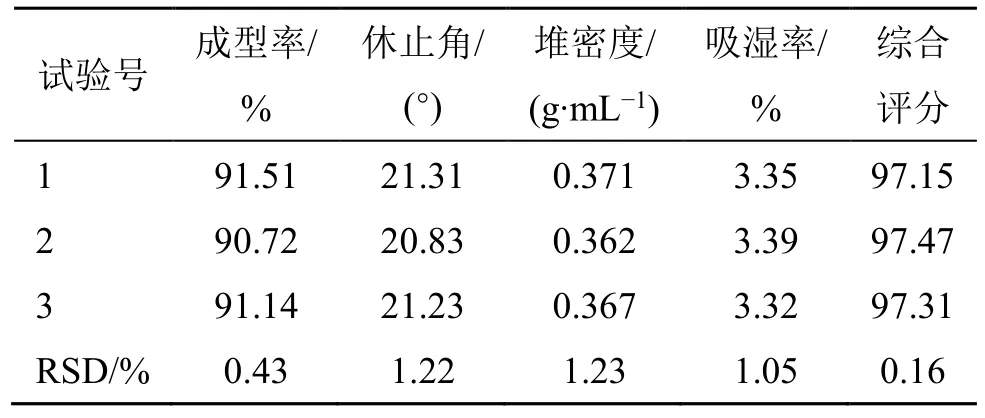
表8 验证试验及结果Table 8 Verification test and results
2.4 三仁颗粒的质量控制研究
2.4.1 薄层鉴别
(1)苦杏仁薄层鉴别:参照国家药典委员会[24]中燀苦杏仁配方颗粒的鉴别方法进行修改,具体操作:①取苦杏仁苷对照品,加甲醇制成每1 mL 含1 mg 的溶液,作为对照品溶液。②另取苦杏仁对照药材0.3 g,加入30 mL 沸水,保持微沸30 min,滤过,滤液蒸干,残渣加甲醇10 mL 使溶解,制成对照药材溶液。③取3 批颗粒各0.5 g,研细,加甲醇10 mL,超声处理15 min,滤过,滤液作为供试品溶液。同法制成缺苦杏仁阴性对照溶液。吸取苦杏仁苷对照品溶液、对照药材溶液各5 μL,供试品溶液、阴性对照溶液各5~10 μL,分别点于同一硅胶G 薄层板上,以三氯甲烷-醋酸乙酯-甲醇-水(3∶8∶6∶2)5~10 ℃放置12 h 的下层溶液为展开剂,展开,取出,晾干,以0.8%磷钼酸的15%硫酸乙醇溶液浸板,在105 ℃加热至斑点显色清晰。苦杏仁薄层色谱见图2,结果显示,供试品色谱中,在与对照品和对照药材色谱相应的位置上,显相同颜色的斑点,且阴性无干扰。方法学考察结果表明,苦杏仁薄层鉴别方法稳定。
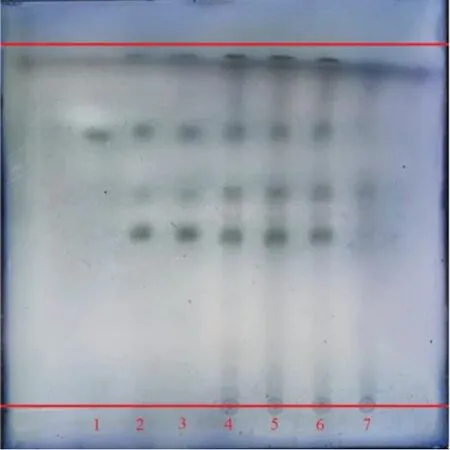
图2 苦杏仁薄层色谱图Fig. 2 TLC of Armeniacae Semen Amarum
(2)薏苡仁薄层鉴别:参考文献中薏苡仁薄层鉴别方法[25]并进行修改,具体操作:①取薏苡仁对照药材1 g,加水100 mL,微沸30 min,滤过,滤液蒸干,残渣加醋酸乙酯50 mL,转移至具塞锥形瓶中,超声提取30 min,滤过,滤液作为对照药材溶液。②取3 批颗粒各5 g,研细,加水30 mL,超声提取30 min,滤过,滤液置分液漏斗中,加醋酸乙酯萃取2 次,每次15 mL,合并醋酸乙酯液,蒸干,残渣加醋酸乙酯0.5 mL 溶解,作为供试品溶液。同法制成缺薏苡仁阴性对照溶液。吸取对照药材溶液4 μL,供试品溶液8 μL,点于同一硅胶G 薄层板上,以石油醚(60~90 ℃)-醋酸乙酯-冰醋酸(17∶1∶1)为展开剂,预饱和30 min,展开,取出,晾干,喷以4%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。薏苡仁薄层色谱见图3,结果显示,供试品色谱中,在与对照品和对照药材色谱相应的位置上,显相同颜色的斑点,且阴性无干扰。方法学考察结果表明,薏苡仁薄层鉴别方法稳定。
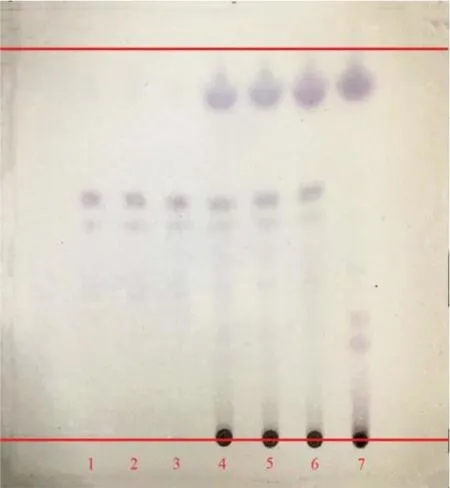
图3 薏苡仁薄层色谱图Fig. 3 TLC of Coicis Semon
(3)厚朴薄层鉴别:参照国家药典委员会[24]中厚朴配方颗粒的鉴别方法进行修改,具体操作:①取厚朴酚、和厚朴酚对照品,加甲醇分别制成每1 mL 含0.5 mg 的溶液,作为对照品溶液。②另取厚朴对照药材1 g,加甲醇10 mL,超声处理30 min,滤过,滤液作为对照药材溶液。③取3 批颗粒各5 g,研细,加甲醇25 mL,超声处理30 min,滤过,滤液蒸干,加甲醇2 mL 溶解,作为供试品溶液。同法制成缺厚朴阴性对照溶液。吸取对照品溶液5 μL,对照药材溶液2 μL,供试品溶液8 μL,分别点于同一硅胶G 薄层板上,以甲苯-甲醇(15∶2)为展开剂,展开,取出,晾干,喷以4%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。厚朴薄层色谱见图4,结果显示,供试品色谱中,在与对照品和对照药材色谱相应的位置上,显相同颜色的斑点,且阴性无干扰。方法学考察结果表明,厚朴薄层鉴别方法稳定。
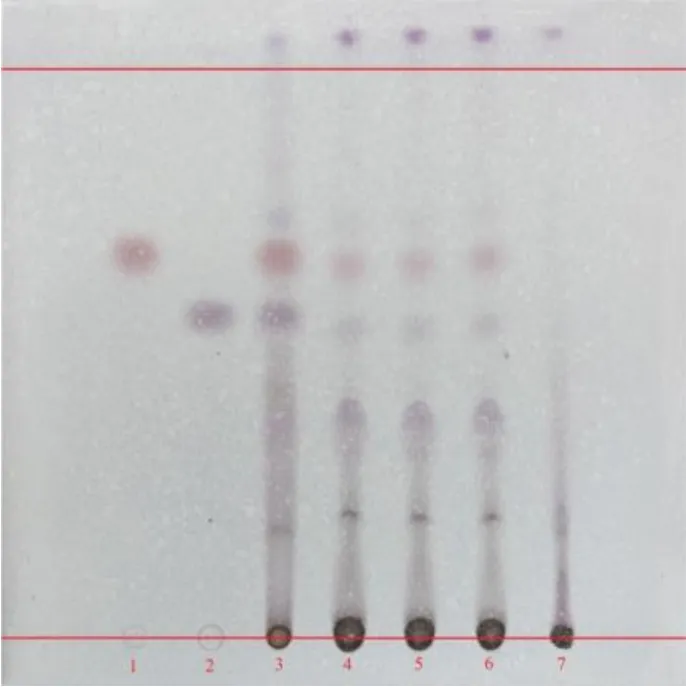
图4 厚朴薄层色谱图Fig. 4 TLC of M. officinalis
2.4.2 指标成分含量测定
(1)色谱条件:同“2.2.1”项下色谱条件。
(2)对照品溶液的制备:同“2.2.2”项下对照品溶液制备方法。
(3)供试品溶液的制备:取供试品2.5 g,精密称定,加甲醇25 mL,称定质量,回流提取45 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
(4)线性关系考察:同“2.2.4(1)”项。
(5)精密度考察:取“2.2.2”项下对照品溶液,连续进样6 次,测得苦杏仁苷、厚朴酚、和厚朴酚峰面积的RSD 分别为0.70%、0.23%、0.19%,表明仪器精密度良好。
(6)重复性考察:按“2.4.2(3)”项下方法制备6 份供试品溶液,测得6 份三仁颗粒中苦杏仁苷、厚朴酚、和厚朴酚质量分数的RSD 分别为1.51%、1.20%、1.34%,表明该提取方法重复性良好。
(7)稳定性考察:取“2.4.2(3)”项下供试品溶液1 份,分别在制备后0、2、4、6、8、10、12、24 h 测定,苦杏仁苷、厚朴酚、和厚朴酚峰面积的RSD 分别为1.01%、1.66%、1.29%,表明该供试品溶液在24 h 内稳定性良好。
(8)加样回收率考察:取已测定指标成分含量的供试品0.25 g,精密称定,精密加入对照品溶液,加甲醇至25 mL,按照“2.4.2(3)”项下方法制备6 份供试品溶液,测得苦杏仁苷、厚朴酚、和厚朴酚的平均加样回收率分别为99.24%、97.91%、99.35%,RSD 分别为0.46%、0.48%、0.63%,符合规定。
2.4.3 指纹图谱研究
(1)色谱条件:同“2.2.1”项下色谱条件。
(2)对照品溶液的制备:取苦杏仁苷、厚朴酚、和厚朴酚对照品适量,精密称定,分别加甲醇制成含苦杏仁苷39.8 μg/mL、厚朴酚40 μg/mL、和厚朴酚24 μg/mL 的对照品溶液,于4 ℃下保存备用。
(3)供试品溶液的制备:同“2.4.2(3)”项下供试品溶液制备方法。
(4)饮片单煎样品溶液的制备:按处方称取各单味药材,按最佳提取工艺进行煎煮,浓缩成干浸膏,取0.5 g,照“2.4.3(3)”项下制备方法制备各饮片单煎样品溶液。
(5)阴性样品溶液的制备:按处方称取各味药材的阴性处方,按最佳提取工艺进行煎煮,浓缩成干浸膏并制成颗粒,照“2.4.3(3)”项下方法制备各饮片阴性样品溶液。
(6)精密度考察:照“2.4.3(3)”项下方法进行供试品溶液的制备,按上述色谱条件重复测定6次,以9 号峰为参照峰,各共有峰的相对保留时间和相对峰面积的RSD 均小于2.65%,表明仪器精密度良好。
(7)重复性考察:照“2.4.3(3)”项下方法制备6 份供试品溶液,测定,以9 号峰为参照峰,各共有峰的相对保留时间和相对峰面积的RSD 均小于2.53%,表明该提取方法重复性良好。
(8)稳定性考察:照“2.4.3(3)”项下供试品溶液制备方法进行提取,分别在制备后0、2、4、6、8、10、12、24 h 测定,以9 号峰为参照峰,各共有峰的相对保留时间和相对峰面积的RSD 均小于2.29%,表明该供试品溶液在24 h 内稳定。
(9)指纹图谱的建立及相似度评价:选用编号为S1~S10 的组方,按照上述优选出的最佳提取及成型工艺操作,按上述方法进行提取并测定,采用《中药色谱指纹图谱相似度评价系统(2012 版)》对十批样品的图谱进行分析,建立了15 个共有峰的评价模式,得到10 批三仁颗粒指纹图谱共有峰的对照图谱(R),如图5 所示,相似度计算结果如表9 所示。由表9 可知,10 批三仁颗粒(S1~S10)样品间相似度均大于0.90,表明优选得到的三仁颗粒制备工艺稳定,指纹图谱整体相似度较高,可用于三仁颗粒的鉴别和质量控制。

图5 10 批三仁颗粒指纹图谱共有特征峰Fig. 5 Common characteristic peaks of ten batches of Sanren Granules fingerprint
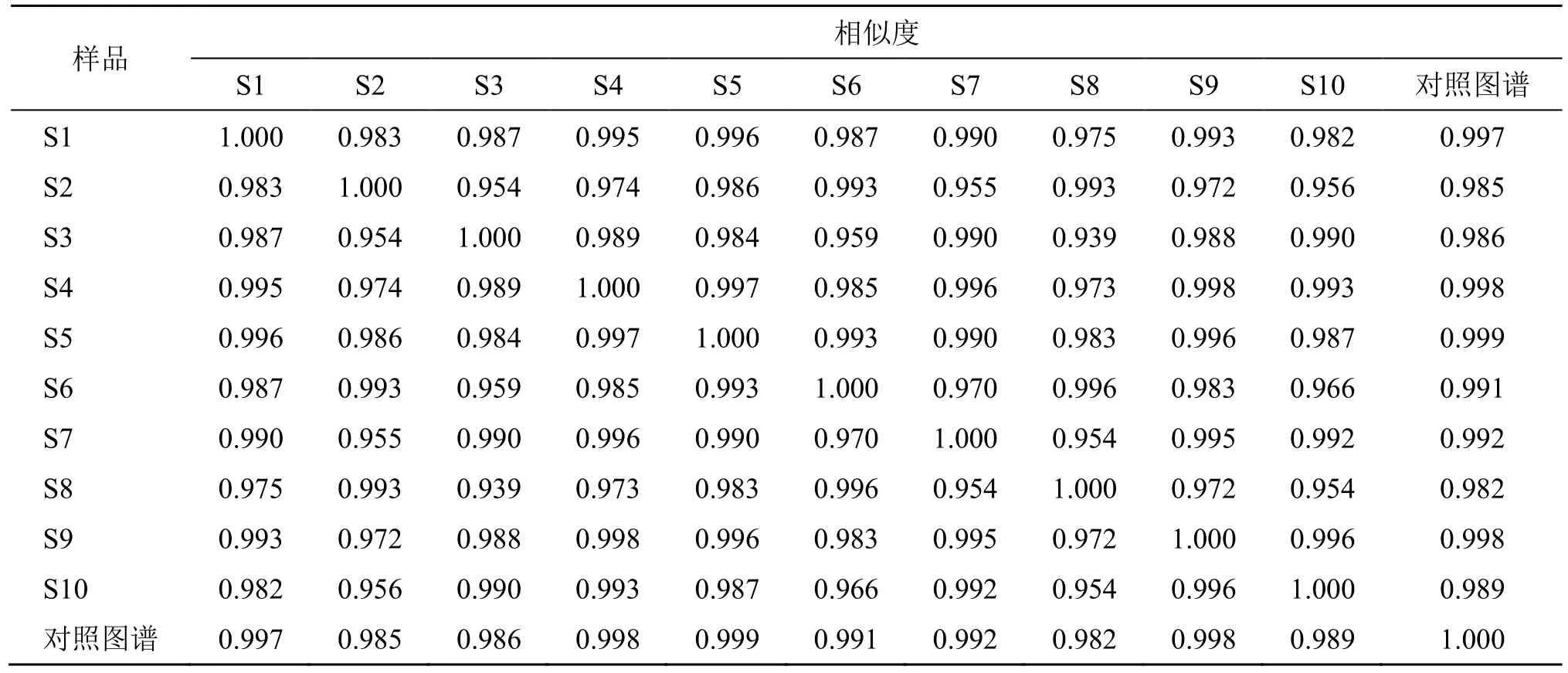
表9 10 批三仁颗粒指纹图谱相似度计算结果Table 9 Similarity calculation results of ten batches of Sanren Granules fingerprint
(10)色谱峰归属:将单味药材照“2.2.10(3)”项下方法进行煎煮,浓缩成干浸膏,分别各取0.5 g,照“2.4.3(3)”项下方法进行供试品溶液的制备,按“2.2.1”项下色谱条件测定,与供试品溶液进行对比,归属色谱峰。结果如图6 所示,1 号峰归属于苦杏仁、厚朴,2、7、13 号峰归属于豆蔻、厚朴、淡竹叶,3、4、8、9 号峰为苦杏仁专属峰,5 号峰归属于苦杏仁、豆蔻、厚朴、淡竹叶,6、11、12、14、15 号峰为厚朴专属峰,10 号峰归属于厚朴、淡竹叶。

图6 三仁颗粒指纹图谱中15 个共有峰及其归属Fig. 6 15 Common peaks and their attribution in fingerprints of Sanren Granules
2.5 三仁颗粒最佳工艺验证
按处方比例称取药材,加8 倍量水,煎煮2 次,每次1 h,浓缩,减压干燥至干浸膏,以糊精为辅料,按药辅比1∶1.5,乙醇体积分数78%,乙醇用量为药粉和辅料总量的21%进行制粒。采用“2.4.2”项下含量测定方法对6 批三仁颗粒中苦杏仁苷、厚朴酚、和厚朴酚进行含量测定,由表10 结果可知,由最佳工艺制备的三仁颗粒中苦杏仁苷、厚朴酚、和厚朴酚含量RSD 分别为0.90%、1.27%、1.42%,表明该制备工艺稳定可靠。
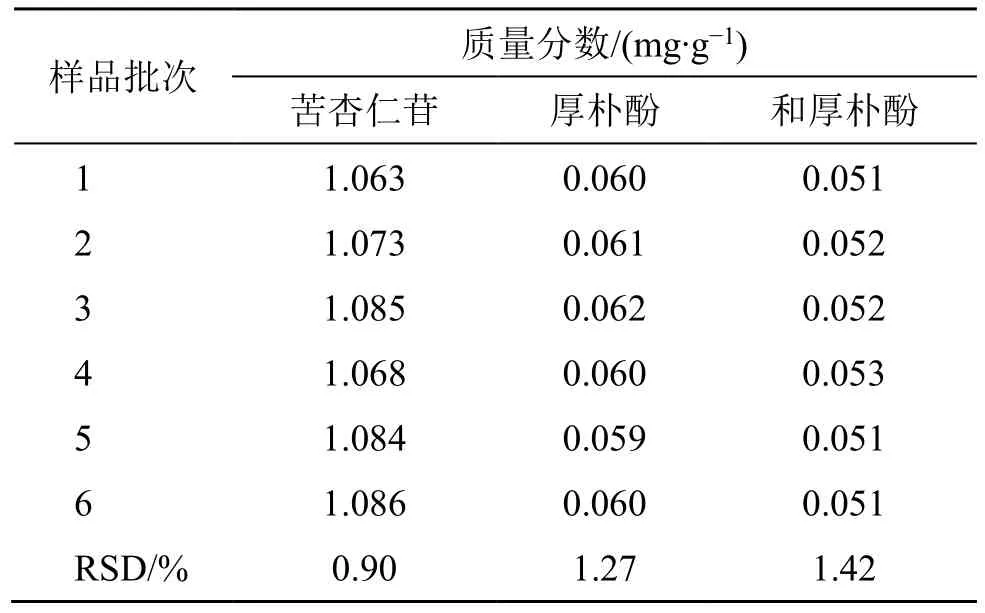
表10 6 批三仁颗粒含量测定Table 10 Determination of six batches of Sanren Granules
3 讨论
发展古代经典方剂,关键是要根据药效严格地控制药材的质量,而对复杂的中药配方,则要通过指纹图谱和多个指标的含量来进行质量评价[26-27]。本研究建立了苦杏仁苷、厚朴酚、和厚朴酚的含量测定方法,以多指标为依据,通过正交试验优选三仁汤最佳提取工艺。结果表明,三仁汤最佳提取工艺为加8 倍量水,煎煮2 次,每次1 h。颗粒剂在服用剂量、储存运输、质量监测等方面具有明显优势,竹叶石膏汤[28]、半夏白术天麻汤[29]、复方当归补血汤[30]等经典方剂都采用响应面法制成颗粒剂。因此,本研究通过CCD-RSM 优化三仁颗粒的成型工艺,筛选获得三仁颗粒最佳成型工艺为糊精为辅料,药辅比1∶1.5,乙醇体积分数78%,乙醇用量为药粉和辅料总量的21%。不同的方剂,其成分、剂量、给药方式存在较大的差异,为保证治疗的有效性以及降低用药风险,制定一套科学且合理的质量控制体系具有重要意义,其中中药质量控制与评价是中药现代化的关键[31]。中药质量控制与评价的方法主要体现在2 个方面,一是中药指纹图谱分析方法的建立[32],二是中药多成分的质量控制模式的建立[33]。本研究建立了3 种成分(苦杏仁苷、厚朴酚、和厚朴酚)的含量测定方法,并结合薄层鉴别,为其质量标准的完善和提高奠定了基础。本研究结果表明,苦杏仁、薏苡仁、厚朴的薄层鉴别方法稳定可靠,而淡竹叶、通草、姜半夏薄层鉴别时,由于有阴性干扰,故将苦杏仁、薏苡仁、厚朴的薄层鉴别作为三仁颗粒的质量控制标准之一。在《中国药典》2020年版中,仅对三仁汤中燀苦杏仁、豆蔻仁、薏苡仁、厚朴规定了含量测定项。本研究发现三仁汤水煎液中苦杏仁苷(燀苦杏仁)、厚朴酚(厚朴)、和厚朴酚(厚朴)的含量较高且易于监测,而桉油精(挥发油类,豆蔻仁)和甘油三油酸酯(有机酸酯类,薏苡仁)等成分在水煎液中含量较低且不稳定。其他研究者在对古方水煎液中豆蔻仁和薏苡仁的含量进行测定时也发现了类似问题[34-36]。因此,本研究选择苦杏仁苷、厚朴酚、和厚朴酚作为三仁颗粒质量控制中的含量评价指标。
中药的化学组分与其功效有直接联系,但由于其组成的复杂性,单一或少数指标难以完全地反映其品质。中药指纹图谱是一种可以用来研究中药质量标准的手段,可以将中药的整体化学特征反映出来,还可以在一定程度上将中药的真伪与优劣进行鉴别,从而实现对其质量的评价与控制[37]。因此,本研究建立了10 批三仁颗粒样品的指纹图谱,各样品间相似度均大于0.90,共指认15 个共有峰,说明三仁颗粒中主要化学成分组成具有一致性。另外,在指纹图谱方法开发时,0~70 min 内保持低比例甲醇浓度进行洗脱可使苦杏仁苷达到更好的分离效果,但厚朴酚、和厚朴酚因其极性较小需增大甲醇比例进行洗脱,70~100 min 内甲醇比例增大速度过快,从而导致信号线基线不稳、色谱峰紧密,但考虑到指纹图谱整体时间及各色谱峰分离度,最终确定以0.05%磷酸水与甲醇组合作为流动相,并对洗脱梯度进行优化。
利益冲突所有作者均声明不存在利益冲突
