基于网络药理学探讨黄芪抗阿霉素心肌细胞毒性的作用机制
2023-06-05侯宇芯任晋宏姚红马慧莱薛慧清
侯宇芯,任晋宏,姚红,马慧莱,薛慧清
(山西中医药大学 基于炎性反应的重大疾病创新药物山西省重点实验室,山西 晋中 030619)
0 引言
阿霉素(Doxorubicin,DOX)属于蒽醌类抗生素,临床上多用于治疗恶性肿瘤,然而高心脏毒性严重限制了其临床应用[1]。临床预防控制心脏毒性的途径主要是通过使用心脏保护剂、控制化疗药物剂量等方式,存在效果差、影响化疗疗效等不足,在治疗时采用中医的整体辩证观念对患者进行诊治能够取得较好的疗效,有效降低心脏毒性[2]。经过几十年的研究,阿霉素导致不可逆心脏毒性的主要因素被认为是造成心肌细胞凋亡和坏死[3-5]。
中医证候研究表明肿瘤化疗药物在祛除病邪的同时导致气血虚弱,机体状况进入恶性循环[6]。黄芪(AstragaliRadix)为补药之长,是血中之气药,补气生血,补气行血,疗诸脏之虚[7]。研究表明,黄芪水煎剂可以抑制神经内分泌激素CGRP、ANP、CNP、NPY 的分泌,改善心功能容量指标,增加心脏射血能力[8]。贺智慧等研究表明黄芪注射液可以减少大鼠左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end systolic dimension,LVESD),增加左心室射血分数(left ventricular ejection fraction,LVEF),减少内质网应激伴侣蛋白Grp78、ATF-4 及CHOP 表达,增多缝隙连接蛋白Cx43 表达,减少p-Cx43 表达,改善心肌病理及超微结构,减少心肌细胞凋亡[9]。但目前尚不明确黄芪抗阿霉素心肌细胞毒性的有效成分和分子机制。
本研究利用基因表达数据库,以“doxorubicin cardiotoxicity”为关键词,获取GSE79413 与GSE157282 基因芯片数据,应用R 4.1.0 筛选差异表达基因(DEGs);借助中药系统药理学分析平台(TCMSP)筛选黄芪活性化合物,运用chemmapper、SwissTarget、pubchem、SEA 数据库预测有效成分靶点;取DEGs 与药物预测靶点的交集,整合转录组学与网络药理学构建 “药物-成分-靶点-疾病” 网络,预测黄芪抗阿霉素心肌细胞毒性的分子机制,并建立阿霉素心肌细胞毒性细胞模型,对可能的分子机制进行验证,从而为黄芪的临床应用提供基础研究数据。
1 材料与方法
1.1 数据库及软件
TCMSP,PubChem,SwissTargetprediction,PharmMapper,ChemMapper,SEA,GEO 数据库,VENNY 2.1.0,STRING,Uniprot,PDB,Graphpad prism 8.0.2,Cytoscape 3.7.2,PyMOL 1.8,R 4.1.0,AutoDockTools 1.5.6 及Vina 1.1.2。
1.2 细胞株、试验药物
大鼠胚胎心肌细胞H9C2 为山西中医药大学科研实验中心细胞室保存;黄芪注射液(黑龙江珍宝岛药业股份有限公司,批号:A03201104 295,规格为每支装10 mL,相当于原药材20 g);阿霉素(美国MCE 生物科技公司,批号:97451,规格为每瓶50 mg)。
1.3 试剂
胎牛血清购自浙江天杭生物科技股份有限公司;DMEM 高糖培养基购自博士德生物工程有限公司;青-链霉素、0.25%(体积分数)胰蛋白酶消化液(不含EDTA,不含酚红)、0.25%(体积分数)胰蛋白酶消化液(含EDTA,不含酚红)购自武汉赛维尔生物科技有限公司;1×PBS、MTT、DMSO 购自北京索莱宝科技有限公司;Trizol、扩增试剂盒、逆转录试剂盒购自日本TaKaRa 公司;细胞凋亡试剂盒购自北京赛文创新生物科技有限公司;细胞周期试剂盒购自江苏凯基生物技术股份有限公司;水为超纯水;甲醇、磷酸为色谱纯,购自天津市科密欧化学试剂有限公司;槲皮素、异鼠李素、刺芒柄花素对照品均购自成都曼斯特生物科技有限公司。
1.4 仪器
Waters 高效液相色谱仪;生物安全柜购自上海博讯实业有限公司医疗设备厂;CO2培养箱购自英国New BRUNSWICK;离心机购自德国Eppendorf;荧光定量PCR 仪购自美国Thermo公司;Multiskan FC 酶标仪购自美国Thermo Fisher 公司。
1.5 黄芪有效成分及其潜在靶点预测
以huangqi(黄芪)为关键词,在TCMSP 数据库中检索其活性成分,筛选条件为药物相似性(DL)≥0.18、口服生物利用度(OB)≥30%;利用Pubchem 数据库获取SMILES 号、3D 结构文件用于化合物的靶点预测和后续的分子对接。根据靶点活性成分,检索chemmapper、SwissTarget、Pubchem、SEA 数据库预测其靶点。
1.6 获取阿霉素心肌细胞毒性相关靶点
以“doxorubicin cardiotoxicity”为关键词,在基因表达数据库(GEO)筛选并下载两套符合条 件 的 基 因 芯 片 数 据(GSE79413 和GSE157282),获取阿霉素处理组与正常对照组的基因表达谱[10]。使用R 4.1.0 中limma 包进行处理,筛选出正常空白组与阿霉素模型组之间的DEGs,筛选条件:(1)采用t检验,定义校正后P<0.05;(2)|logFC| ≥1,FC表示差异倍数(Fold change),绘制火山图。
1.7 构建 “药物-成分-靶点-疾病” 网络及筛选核心靶点
采用VENNY 在线程序,将化合物靶点与疾病靶点取交集获得潜在治疗靶点,绘制韦恩图。运用Cytoscape 软件将活性成分与潜在治疗靶点进行可视化,构建“药物-成分-靶点-疾病”网络图。将潜在治疗靶点导入STRING 数据库,获得蛋白互作网络图(PPI),挖掘蛋白互作网络中的核心基因。
1.8 GO分析和KEGG分析
通过R 4.1.0 软件,安装Bioconductor 中DOSE、pathview 和limma 等程序包,对核心网络基因进行GO 富集分析与KEGG 通路分析。
1.9 主要活性成分与核心靶点的分子对接
利用PubChem 数据库下载小分子配体3D结构,借助Chem3D 17.1 能量最小化,作为分子对接的配体分子。通过PDB 数据库获取对接靶点的3D 结构文件,借助PyMOL 软件去除配体、去水、加氢等,作为受体分子。运用AutoDockTools 1.5.6 转换结构文件格式为pdbqt,通过vina 进行分子对接。配体分子与靶点之间存在结合活性时对接分数>4.25,结合活性较高时对接分数>5.0,存在强烈的结合活性时对接分数>7.0[11]。采用PyMOL 软件对选定结果进行可视化。
1.10 黄芪注射液的HPLC分析[12]
对照品溶液的制备:制备浓度均为50 μg/mL 的槲皮素、异鼠李素及刺芒柄花素的混合对照品溶液。
供试品溶液的制备:将黄芪注射液30 倍浓缩,取2 mL 浓缩后黄芪注射液,用甲醇定容至10 mL,12 000 r/min 离心10 min,取上清液,超声30 min,0.22 μm 微孔滤膜滤过,即得供试品溶液。
色谱条件:色谱柱为Diamonsil C18 色谱柱(4.6 mm×250 mm,5 μm),流速0.8 mL/min,进样量10 μL,柱温30 ℃,检测波长为254 nm。流动相为A:甲醇,B:体积分数0.4% 磷酸水;线性洗脱条件为:0 min~5 min:10% ~15% A;5 min~10 min:15% ~20% A;10 min~15 min:20% ~25% A;15 min~20 min:25% ~35% A;20 min~30 min:35% ~37% A;30 min~35 min:37% ~40% A。
1.11 细胞实验验证
在DMEM 高糖培养基(含体积分数10%的胎牛血清及体积分数1%青链霉素溶液)中培养大鼠心肌细胞H9C2。以0.7×104个/孔接种处于对数生长期的H9C2 细胞至96 孔板,培养12 h,用梯度浓度DOX(0、0.1、0.25、0.5、1 μg/mL)处理12 h[13]。MTT 法检测细胞活力,以半数抑制浓度(IC50)作为模型浓度。按前述方法接种细胞,给药组用不同浓度的黄芪注射液(25、50、75、100、150、200、400 mg/mL)处理细胞[14],培养12 h,MTT 法检测黄芪注射液对细胞活力。研究黄芪注射液对阿霉素心肌细胞毒性的影响时实验分组设置为正常对照组、模型组及给药组,各设6 个复孔。接种细胞,给药组用不同浓度的黄芪注射液(25、50、75、100、150、200 mg/mL)处理细胞,培养箱孵育12 h后,模型组和给药组加入阿霉素,使阿霉素浓度为0.5 μg/mL,12 h 后用MTT 法测定各组细胞活力。
1.12 流式细胞术检测H9C2细胞凋亡率
用不含EDTA 的胰蛋白酶消化液离心收集细胞,PBS 洗涤细胞两次,再用Annexin Buffer使细胞悬浮,加入Annexin V-FITC 和PI,在避光条件下4 ℃,细胞孵育5 min,采用流式细胞仪检测细胞凋亡率。
1.13 流式细胞术检测H9C2周期分布
用PBS 洗涤细胞(2000 r/min,离心5 min)收集并调整细胞浓度为1×106mL-1,取1 mL 单细胞悬液,离心后去除上清,向细胞中加入500 μL预冷的体积分数70%的乙醇,于4 ℃固定12 h,使用PBS 洗涤细胞,加入提前配置好的500 μL PI/RNase A 染色工作液,室温避光30 min~60 min,使用流式细胞仪检测细胞周期分布。
1.14 RT-qPCR法检测基因相对表达差异
根据以上1.7 方法得到关键蛋白,通过生工生物有限公司官网上设计基因的引物序列,将引物加无酶水配成终浓度为10 μmol/L 用于后续实验。按照1.10 方法培养细胞,然后使用总RNA 提取试剂盒提取细胞总RNA;去除基因组DNA 后进行反转录,将总RNA 逆转录成cDNA;根据扩增试剂盒说明书,以三磷酸-甘油醛脱氢酶(GAPDH)作为内参,采用实时荧光定量PCR 方法检测基因相对表达量,结果使用相对定量法进行分析。
1.15 数据处理
借助Graphpad 5.0 软件进行数据处理,在方差齐性条件下采用单因素方差分析One-way ANOVA,##与空白组比较,P<0.01;*与模型组比较,P<0.05;**与模型组比较,P<0.01。
2 结果
2.1 黄芪化学活性成分与靶点预测
通过检索TCMSP 数据库及查阅文献,获得黄芪有效成分21 个,如表1 所示;收集SwissTarget、chemmapper、SEA 数据库中药物靶标,筛选后得到活性成分靶点996 个。
2.2 差异基因的筛选
依据差异基因筛选条件,将阿霉素处理组与正常对照组比较,基因芯片GSE79413 共有185 个基因发生显著变化,其中上调基因34 个,下调基因151 个;基因芯片GSE157282 共获得2566 个差异表达基因,其中上调基因1537 个,下调基因1029 个。合并两个芯片差异基因,去重包括2705 个差异基因,结果如图1 所示。
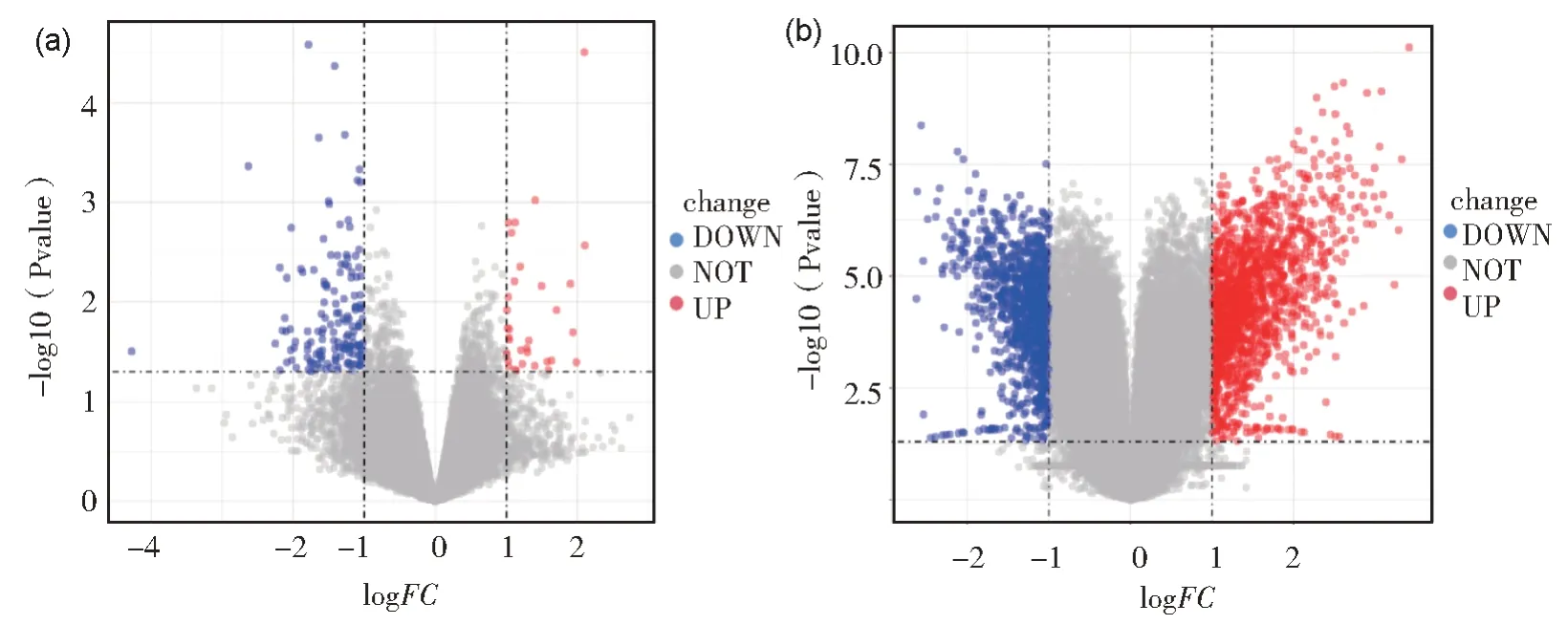
图1 差异表达基因火山图(a)基因芯片GSE79413; (b)基因芯片GSE157282,红色代表上调基因,蓝色代表下调基因,筛选标准为|logFC|≥1Fig.1 Volcanic map of differential genes(a) Gene chip GSE79413; (b) Gene chip GSE157282, red represents up-regulated genes, blue represents down-regulated genes,and the screening criteria is |logFC| ≥1
2.3 黄芪化合物靶点和疾病靶点交集结果
将黄芪有效成分预测靶点、差异基因两者的潜在靶点经过韦恩分析后,共有792 个交集靶点。
2.4 黄芪抗阿霉素心肌细胞毒性网络模型的构建及分析
运用Cytoscape 软件构建“药物-成分-疾病-靶点”网络图,如图2 所示。根据网络拓扑学性质,选取degree 值较高药物活性成分排名靠前的前五个化合物,分别是7-O-甲基异丁香酚、山柰酚、槲皮素、刺芒柄花素、异鼠李素,这五个成分很可能是黄芪抗阿霉素心肌细胞毒性的主要物质基础。
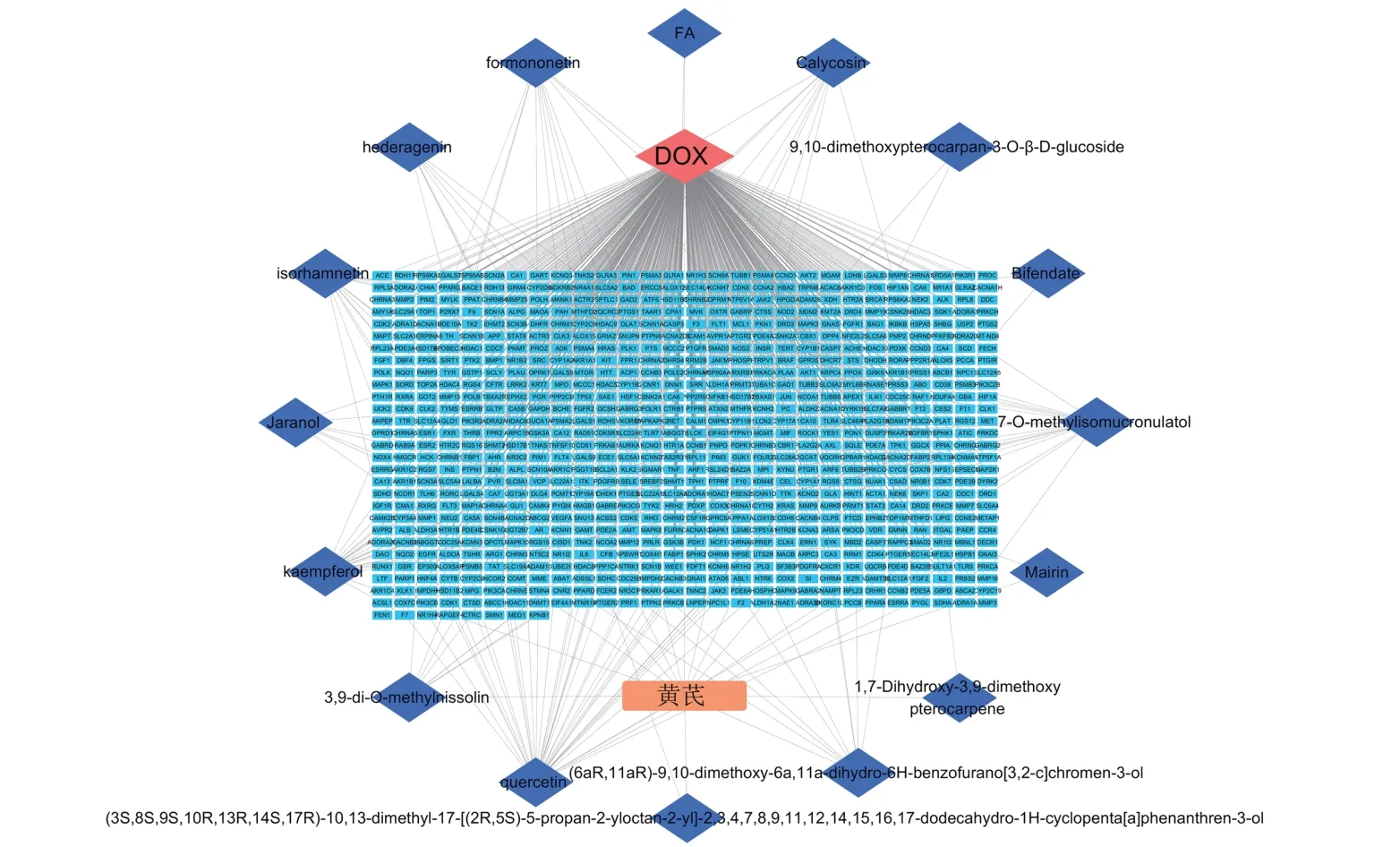
图2 黄芪抗阿霉素心肌细胞毒性网络图Fig.2 Myocardial cytotoxicity network diagram of Astragalus injection gainst adriamycin
2.5 潜在靶点PPI网络的构建
通过STRING 数据库,将潜在靶点按照默认参数生成PPI 网络;导入Cytoscape 软件获得一个包含110 个节点的初级PPI 网络;经拓扑分析及MCC 插件计算,依次得到含51 个节点的次级PPI 网络与包括STAT3、AKT1、MAPK1、TP53等12 个基因的核心PPI 网络,结果如图3所示。
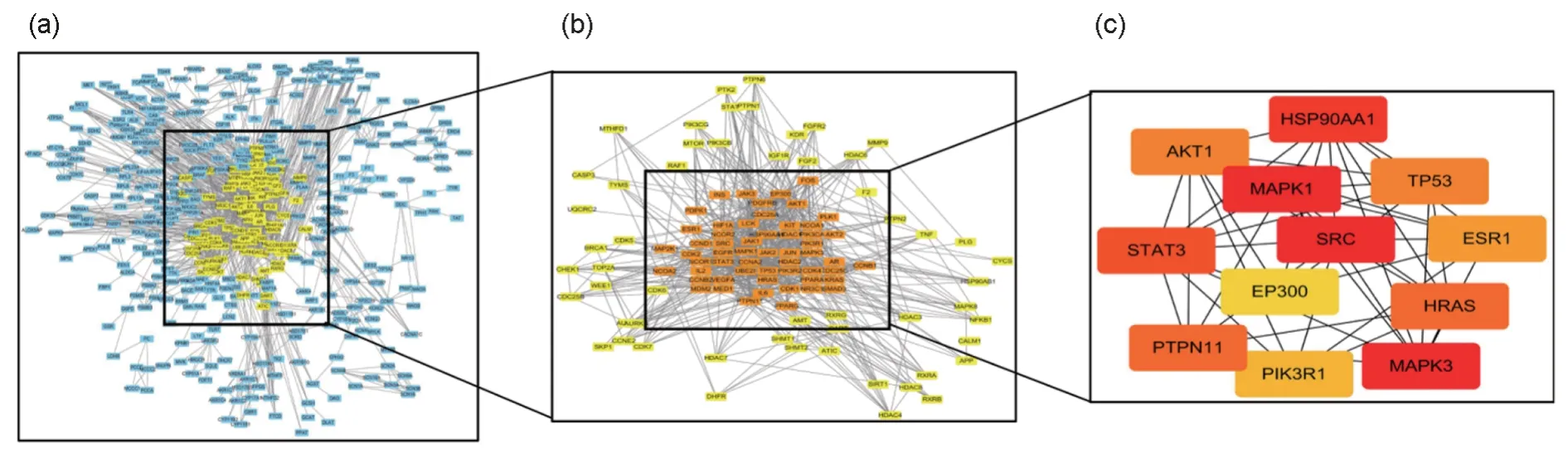
图3 黄芪抗阿霉素心肌细胞毒性靶点PPI网络构建及核心网络筛选(a)黄色为初步筛选的基因;(b)橘色为拓扑分析后筛选的基因;(c)为筛选出的12个核心基因Fig.3 PPI network construction and core network screening of Astragalus anti-adriamycin cardiomyocyte toxicity target(a) Yellow indicates the preliminary gene being screened; (b) Orange indicates the screened gene after topological analysis; (c) 12 Screened core genes
2.6 GO富集分析
采用R 软件及Bioconductor 程序包对上述药物-疾病共同靶点进行生物过程生物过程(biological processes,BP)、细胞组分(cellular components,CC)和分子功能(molecular functions,MF)3 部分筛选,每一分类校正count 值最大的前7 条目,结果如图4 所示。BP 分类包括细胞对药物反应、对化学应急反应、调节膜电位、调节类固醇代谢、调节脂质代谢过程等3060 个条目;CC 分类包括突触膜、跨膜转运复合物、膜筏、膜质微区、膜区等197 个条目;MF 分类主要包括蛋白质丝氨酸/苏氨酸激酶活性、通道活动、被动跨膜转运蛋白活性、离子通道活动、内肽酶活性参与凋亡过程等375 个条目。
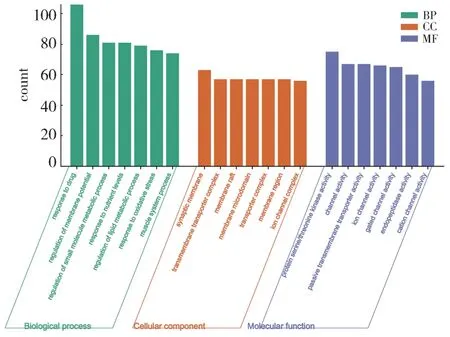
图4 GO富集分析结果Fig.4 GO enrichment analysis results
2.7 KEGG通路分析
结果表明有114 条信号通路被显著富集,依据P<0.05 排序得到前20 条通路,包括PI3K-AKT 信号通路、MAPK 信号通路等,如图5 所示。其中PI3K-AKT 信号通路排名靠前,且MAPK1、AKT1等基因均在该通路发挥重要作用。
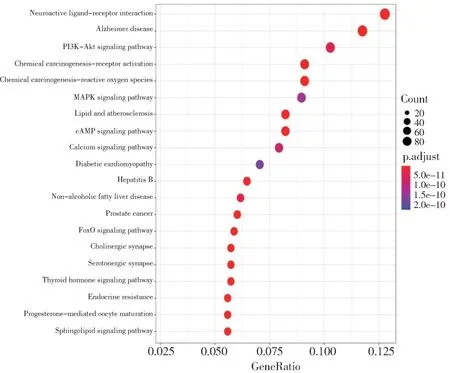
图5 KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis
2.8 黄芪主要活性成分与核心靶点的分子对接
7-O-甲基异丁香酚、山柰酚、槲皮素、刺芒柄花素、异鼠李素经Chem3D 17.1 软件能量最小化参数分别为20.064 9、14.623 0、15.048 6、34.041 4、20.414 9 kcal/mol,TP53、STAT3、AKT1、MAPK1degree 值较高且经查阅文献与心肌细胞毒性疾病相关。将2.4 黄芪抗阿霉素心肌细胞毒性网络中具有最高连接度的前5 个化学成分分别与其分子对接,活性成分与关键靶点结合能均小于-5.0 kcal/mol,有较好的结合能力,如表2 所示。槲皮素与AKT1、TP53、MAPK1、STAT3具有最强结合能力,槲皮素与AKT1在VAL-123、LYS-72 处形成氢键;与TP53在GLN-72 处形成氢键;与MAPK1在ARG- 处形成氢键;与STAT3在GLU-638、GLY-656 处形成氢键,如图6 所示。综合上述结果,黄芪中活性成分可能通过调控PI3K-Akt通路中MAPK1、AKT1、TP53、STAT3核心基因发挥对阿霉素心肌细胞毒性的保护作用。
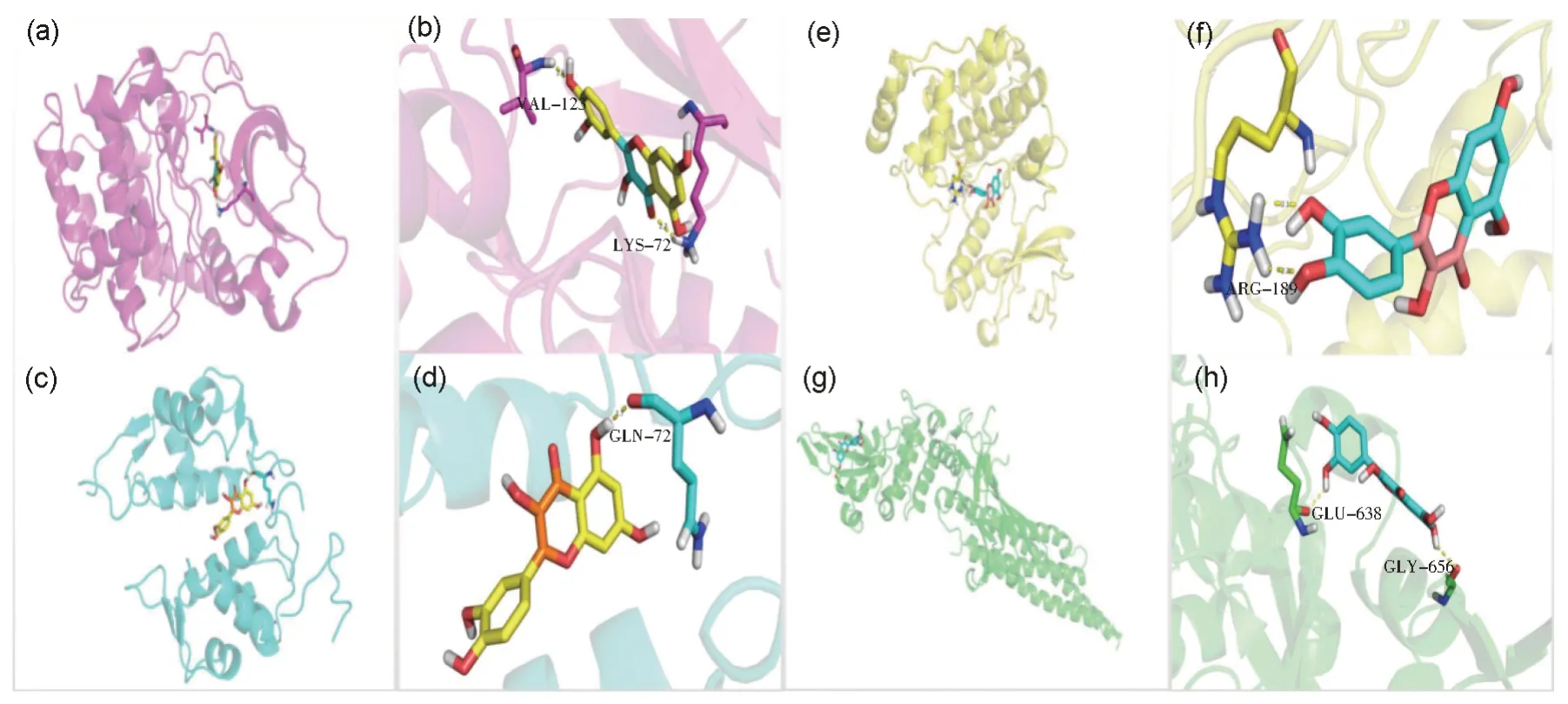
图6 槲皮素与关键靶点分子对接图(a)AKT1与槲皮素分子对接复合物的三维结构;(b)AKT1蛋白与槲皮素的详细结合位点呈现;(c)TP53与槲皮素分子对接复合物的三维结构;(d)TP53蛋白与槲皮素的详细结合位点呈现;(e)MAPK1与槲皮素分子对接复合物的三维结构;(f)MAPK1蛋白与槲皮素的详细结合位点呈现;(g)STAT3与槲皮素分子对接复合物的三维结构;(h)STAT3蛋白与槲皮素的详细结合位点呈现Fig.6 Docking diagram of quercetin with key target molecules(a) Three-dimensional structure of AKT1-quercetin complex; (b) Detailed binding sites of quercetin in AKT1 protein;(c) Three-dimensional structure of TP53-quercetin complex; (d) Detailed binding site of quercetin in TP53 protein;(e) Three-dimensional structure of MAPK1-quercetin complex; (f) Detailed binding sites of quercetin in MAPK1 protein;(g) Three-dimensional structure of STAT3-quercetin complex; (d) Detailed binding site of quercetin in STAT3 protein
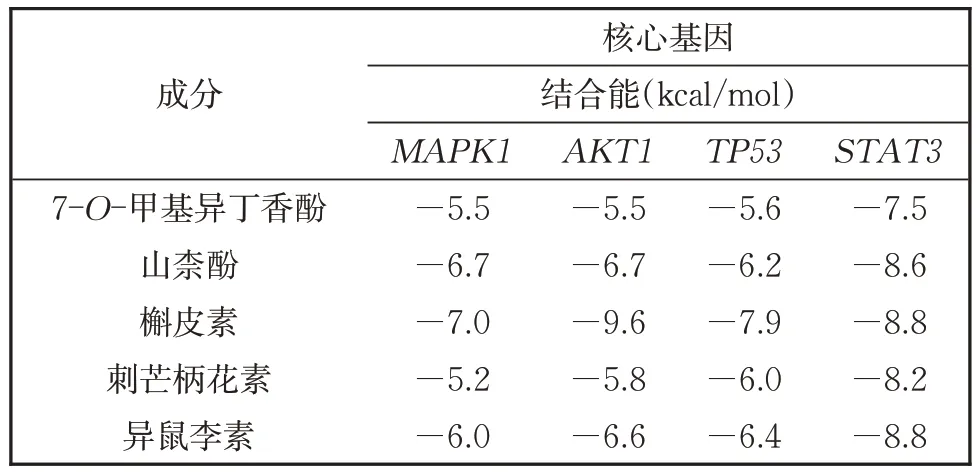
表2 黄芪有效成分与核心基因的分子对接Table2 Molecular docking between the effective components of Astragalus and core genes
2.9 黄芪注射液的HPLC分析
本研究采用HPLC 检测黄芪注射液中槲皮素、异鼠李素、刺芒柄花素的含量。依照方法学考察要求,分别进行精密度、稳定性、重复性及加样回收率考察,结果分别为精密度:槲皮素峰面积RSD 为1.1%,异鼠李素峰面积RSD为1.6%,刺芒柄花素峰面积RSD 为1.5%;稳定性实验分别于0、2、4、6、8、12 h 测定黄芪注射液供试品溶液中槲皮素峰面积RSD 为1.1%,异鼠李素峰面积RSD 为1.2%,刺芒柄花素峰面积RSD 为1.2%;考察重复性时取黄芪注射供试品溶液,依法平行测定5 份,槲皮素峰面积RSD 为1.1%,异鼠李素峰面积RSD 为1.5%,刺芒柄花素峰面积RSD 为1.1%;对槲皮素、异鼠李素、刺芒柄花素做加样回收率的考察,得槲皮素、异鼠李素、刺芒柄花素平均回收率分别为97.04%、98.75%、99.59%,RSD 分别为0.3%、0.5%、1.2%。
标准化合物的校准曲线方程槲皮素:Y=3E+06X+120 975,R2=0.999 8;异鼠李素:Y=4E+06X+142 692,R2=0.996 9;芒柄花素:Y=7E+06X-19 336,R2=0.999 2。记录峰面积并按外标法计算样品含量,每样品平行测定3 次,取平均值,计算得黄芪注射液中槲皮素、异鼠李素、刺芒柄花素含量分别为0.447 7、0.240 7、0.281 2 μg/mL,见图7。
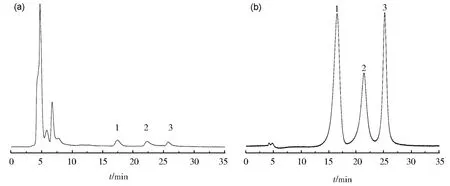
图7 对照品及黄芪注射液在254 nm处的HPLC色谱图(a)对照品;(b)黄芪注射液;1-刺芒柄花素;2-槲皮素;3-异鼠李素Fig.7 HPLC chromatograms of reference substance and Astragalus injection at 254 nm(a) mixed reference substance; (b) Astragalus injection; 1-formononetin; 2-quercetin; 3-isorhamnetin
2.10 不同浓度阿霉素对心肌细胞的毒性
随着阿霉素浓度(0、0.1、0.25、0.5、1.0 μ g/mL)的增加,细胞存活率显著下降,除0.1 μ g/mL 组外,与正常对照组相比,其余各剂量组细胞存活率均具有极显著性差异(P<0.01),如图8 所示。计算阿霉素的IC50 值为0.519 0 μg/mL,选取阿霉素0.5 μg/mL 作为模型浓度。

图8 阿霉素浓度对细胞存活的影响Fig.8 Effect of adriamycin concentration on cell survival
2.11 不同浓度黄芪注射液对心肌细胞的保护
随着黄芪注射液浓度(0、25、50、75、100、150、200、400 mg/mL)的增加,细胞存活率逐渐升高,当浓度达到400 mg/mL 组时,与正常对照组相比细胞存活率显著降低(P<0.01),如图9 所示。
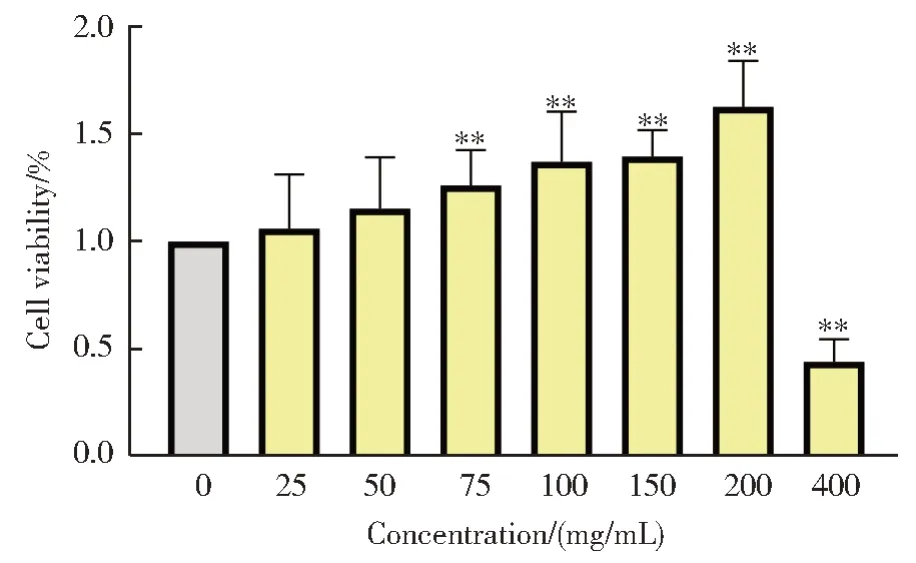
图9 黄芪注射液对细胞存活的影响Fig.9 Effect of Astragalus injection on cell survival
2.12 黄芪注射液抗阿霉素心肌细胞毒性
黄芪注射液可以促进阿霉素毒性心肌细胞的增殖,且呈剂量依赖性,在200 mg/mL 处发挥最佳的保护效果(P<0.01),如图10 所示。
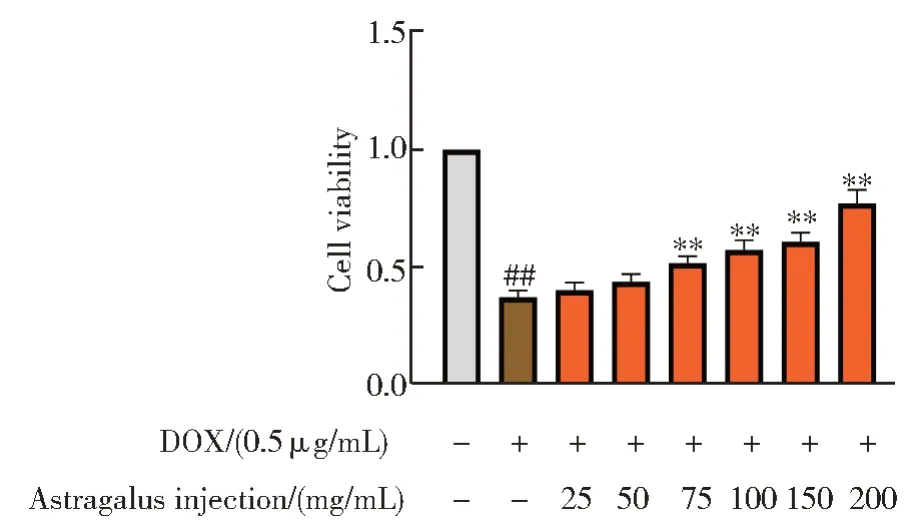
图10 黄芪注射液对阿霉素毒性细胞存活的影响Fig.10 Effect of Astragalus injection on the survival of adriamycin toxic cells
2.13 黄芪注射液减少阿霉素诱导的心肌细胞凋亡
如图11 所示,图11(a)中左上象限Q1 代表坏死细胞,右上象限Q2 代表晚期凋亡细胞,右下象限Q3 代表早期凋亡细胞,左下象限Q4 代表活细胞,细胞凋亡率为Q2 与Q3 象限百分率之和。与对照组比较,模型组细胞凋亡率显著升高(P<0.01);与模型组相比,黄芪注射液在75、100 mg/mL 可以显著减少 H9C2 细胞凋亡(P<0.01)。

图11 黄芪注射液对阿霉素毒性的 H9C2 细胞凋亡的影响Fig.11 Effect of Astragalus injection on apoptosis of adriamycin toxic H9C2 cells
2.14 黄芪注射液调节细胞周期减轻阿霉素心肌细胞毒性
结果显示,与对照组相比,模型组细胞G1 期显著减少,G2 期显著升高(P<0.01),表明细胞在G1 期被促进,G2 期被阻滞;与模型组比较,给药组黄芪注射液在 75、100 mg/mL 时G1 期细胞显著升高,G2 期细胞显著减少(P<0.01),如图12 所示。
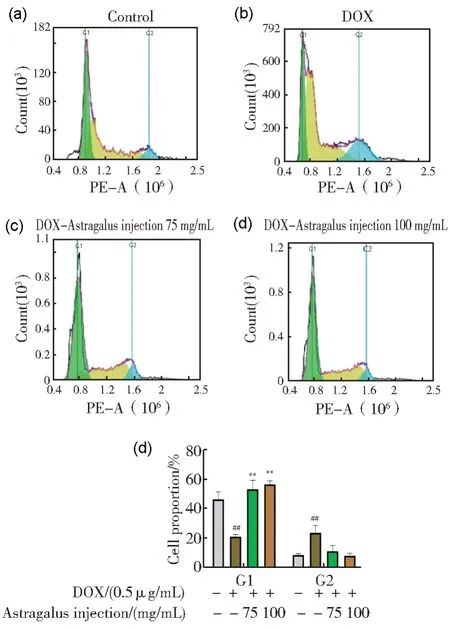
图12 黄芪注射液对阿霉素毒性的 H9C2 细胞周期的影响(a)对照组;(b)DOX 组;(c)黄芪注射液 75 mg/mL;(d)黄芪注射液 100 mg/mL;(e)各组H9C2细胞中G1、G2细胞周期的变化。(a)、(b)、(c)、(d)图中草绿色为G1期,亮蓝色代表G2期Fig.12 Effect of Astragalus injection on H9C2 cell cycle induced by adriamycin toxicity(a) Control group; (b) DOX group; (c) Astragalus injection 75 mg/mL ; (d) Astragalus injection 100 mg/mL ; (e) Changes in the G1 and G2 cell cycles of each group of H9C2 cells.Grass green represents G1 phase , and light biue represents G2 phase in(a), (b), (c), and (d)
2.15 黄芪注射液抗阿霉素对核心基因mRNA 表达的调节
通过荧光定量PCR 检测核心基因mRNA 相对表达量发现:阿霉素造模后,MAPK1、TP53、STAT3基因mRNA 相对表达量均出现上调趋势,AKT1基因mRNA 相对表达量出现下调趋势,随着黄芪注射液给药浓度的增加,MAPK1、TP53、STAT3基因mRNA 相对表达量减少,AKT1基因mRNA 相对表达量上升,如图13 所示。
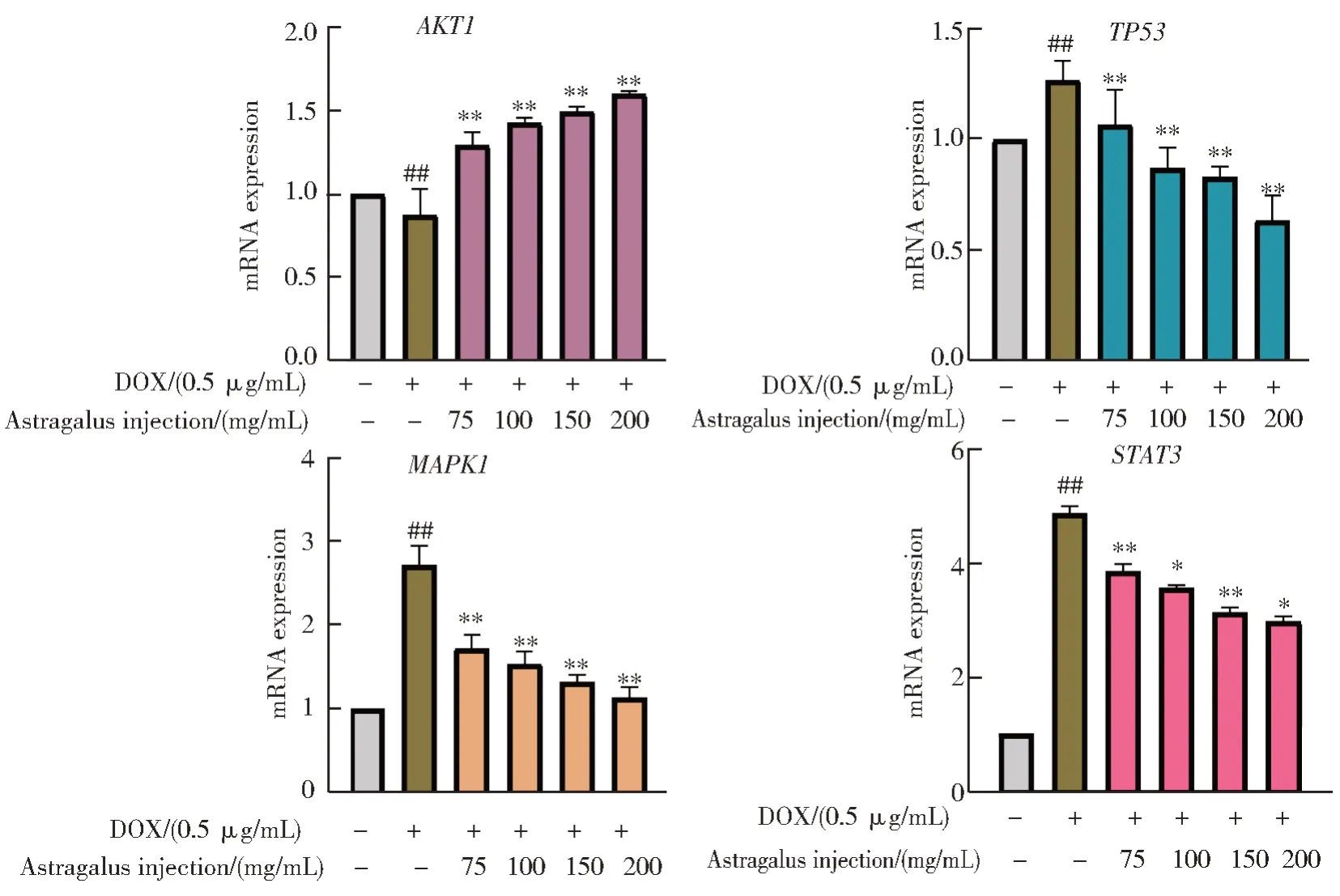
图13 黄芪注射液对AKT1、TP53、MAPK1、STAT3 mRNA相对表达量的影响Fig.13 Effects of Astragalus injection on mRNA expression levels of AKT1, TP53, MAPK1 and STAT3
3 讨论
化疗药物阿霉素临床应用呈现出广泛严重的心脏毒性,发现时通常已心力衰竭[15]。临床观察发现黄芪注射液可以改善患者心脏功能,治疗慢性顽固性心衰[16]。黄芪注射液联合右丙亚胺可以改善心功能,减少心电图发生异常的情况,使心脏各项生化指标趋于正常,从而达到防治阿霉素所致化疗后心脏毒性的功效[17]。但是其发挥作用的有效成分和分子机制尚不清晰,故本研究采用DOX 诱导H9C2 建立心肌细胞毒性模型,结合网络药理学和实验验证初步探析黄芪抗阿霉素心肌细胞毒性的有效成分和作用机制,为黄芪注射液临床应用提供理论基础。
多项研究表明黄芪参与调控多种生物过程,包括细胞程序性死亡、抗氧化等,其成分发挥补气、强心、等功效主要是通过皂苷类、槲皮素、毛蕊异黄酮等关键成分发挥作用[18-20]。研究发现PI3K/Akt 通路与心血管疾病预防和治疗密切相关,该通路通过调控细胞周期、细胞凋亡不同阶段的相关凋亡因子、心肌细胞的增值、自噬与坏死等过程控制心肌细胞存活和功能[21]。研究还发现绞股蓝中槲皮素能够通过调节P53、AKT、MAPK 等信号分子,调节氧化应激、线粒体稳态达到防治阿霉素心肌病的目的[22]。本研究网络分析结果表明黄芪可能通过调控PI3K-Akt、P53、MAPK 等信号通路中核心基因MAPK1、AKT1、TP53、STAT3对阿霉素所致心肌细胞毒性发挥保护作用。分子对接结果提示,活性成分槲皮素与AKT1、TP53、MAPK1、STAT3关键靶点结合打分均较高,为中药单体对阿霉素减毒作用研究提供参考[23]。
研究发现黄芪注射液对心肌细胞保护作用主要通过减轻小鼠心脏肥大,提高心肌内GSH含量,稳定线粒体膜电位,抑制心肌细胞发生异常凋亡来实现[24]。研究发现黄芪注射液能显著减轻阿霉素所致小鼠心肌组织病理及超微结构损伤,并有效维护其心肌纤维及膜系统的稳定性[25]。研究表明STAT3参与细胞内基因转录,调控细胞增殖、凋亡等反应[26]。研究还发现硫化氢可能通过下调STAT3改善MMPs/TIMPs 失调,从而改善高甲状腺素诱导的心肌纤维化[27]。肿瘤蛋白P53(TP53)为PI3K/PTEN/AKT 信号通路关联基因之一,为常见促癌基因,且参与众多肿瘤发病[28]。TP53通过调节下游靶基因的转录,合成细胞周期相关蛋白,调控细胞增殖和凋亡,并且在多种肿瘤的发生发展以及治疗和预后方面扮演重要角色[29]。AKT 参与癌症、心血管等疾病的发生发展,通过调控细胞周期、细胞存活等多种生物过程发挥作用。苗艳菊等从正反两方面研究证实AKT1可以促进心肌纤维化,主要是通过促进炎性反应,导致成纤维细胞转分化实现的[30]。研究表明MAPK 在心肌纤维化的信号调控中发挥着重要的作用[31]。本研究网络分析中,7-O-甲基异丁香酚、山柰酚、槲皮素、刺芒柄花素、异鼠李素显示了较高的度值,分子对接打分提示槲皮素与AKT1、TP53、MAPK1、STAT3具有最强结合能力;体外细胞实验证实,黄芪注射液可以调节细胞周期,减少阿霉素导致的心肌细胞凋亡,其机制为调控核心基因STAT3、TP53、AKT1、MAPK1的表达来发挥作用。该研究结果为黄芪抗阿霉素心肌细胞毒性的有效成分和作用机制提供理论基础。
综上所述,本研究阐述了黄芪抗阿霉素心肌细胞毒性的有效活性成分、关键靶点及重要通路,并在理论上预测中药单体槲皮素有保护阿霉素心肌细胞毒性的潜力,下一步应更深入研究中药单体槲皮素抑制阿霉素心肌细胞毒性的具体机制,并进一步通过体内实验验证黄芪注射液抗阿霉素心肌细胞毒性的作用机制,为临床减轻阿霉素引起的心脏毒性提供参考。
