基于生物信息学筛选卵巢癌患者预后的相关趋化因子并构建预后模型△
2023-06-05杨志新覃淑一邹丹杨丽华
杨志新,覃淑一,邹丹,杨丽华
昆明医科大学第二附属医院妇科,昆明 650101
卵巢癌是病死率最高的妇科肿瘤,2020年全球新增卵巢癌病例31.4 万例,病死超过20.7 万例,病死率达60%[1]。由于缺乏有效的筛查手段,卵巢癌确诊时多已进展至晚期,5年总生存率不足50%[2],且超过70%的晚期卵巢癌患者会出现化疗耐药,预后较差[3],因此,研究卵巢癌恶性生物学行为的相关影响因子,寻找更有效的早期诊断、预后预测的方法和指标,具有重要意义。肿瘤微环境已被证实在大多数肿瘤的发生、发展中具有重要作用[4]。肿瘤微环境中存在多种活性细胞和活性分子,它们共同构成复杂的信号网络调控体系。间质细胞与肿瘤细胞的协同作用是肿瘤微环境的重要部分,趋化因子及其受体构建了肿瘤细胞与间质细胞之间的信号体系,是细胞迁移、趋化过程中的重要超家族。趋化因子及其受体通过抑制或刺激免疫系统促进或抑制肿瘤进展,与患者的预后密切相关[5]。免疫细胞也是肿瘤微环境的重要组成部分,肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)在不同趋化因子的刺激下可极化为M1 型和M2 型,M1 型巨噬细胞为抗肿瘤巨噬细胞,可诱导细胞凋亡,抑制肿瘤细胞增殖、迁移和新生血管生成;M2 型巨噬细胞为亲肿瘤细胞,可促进肿瘤的生长和转移[6]。中性粒细胞自身可以释放多种细胞因子和趋化因子,这些细胞因子和趋化因子可以决定中性粒细胞自身的亲肿瘤或抗肿瘤行为,在肿瘤微环境中呈现抗肿瘤性的N1 型和亲肿瘤性的N2 型[7-8]。趋化因子与免疫细胞的关系复杂且紧密,探究二者之间相互影响的作用机制对研究肿瘤的发生发展、转移有重要意义。目前,包含基因表达和临床特征的大规模公开数据为分析卵巢癌患者的预后提供了更便利的条件。本研究基于生物信息学方法分析卵巢癌患者预后的相关趋化因子,构建多基因预后模型,并分析其与趋化因子相关的免疫细胞功能,旨在探讨趋化因子在卵巢癌预后评估中的意义,为卵巢癌的诊疗提供参考,现报道如下。
1 资料与方法
1.1 资料收集及处理
从基因型-组织表达(Genotype-Tissue Expression,GTEx)数 据 库(https://www.gtexportal.org/home/)下载108 例正常卵巢组织数据及临床资料。从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库SangerBox 界面(http://sangerbox.com/)下载379 例卵巢癌组织数据及临床资料,其中有4 份样本为同一卵巢癌患者取样两次所得,在进行生存分析时被去除,另外3 份非原发样本也被去除。采用R 语言载入factoextra 包对卵巢癌组织和正常卵巢组织的数据进行主成分分析(principal component analysis,PCA)降维处理,采用sva 软件包对数据归一化,并对样本进行质控评估及预处理。此外,从GeneCards 数据库(https://www.genecards.org/)收集48个以“X-C Motif Chemokine”“C-C Motif Chemokine”“C-X-C Motif Chemokine”“C-X3-C Motif Chemokine”开头的趋化因子,进行差异分析及后续的模型构建。
1.2 差异趋化因子的筛选
载入经归一处理后的数据,采用R 语言的Limma 包比较GTEx(正常卵巢组织样本)和TCGA(卵巢癌组织样本)获取样本中差异表达的基因(筛选标 准:P≤0.05 且|log2FC|≥1),并采用R语言的pheatmap 包绘制差异基因聚类热图。载入所有差异表达基因及下载的趋化因子数据,利用Intersect函数分析卵巢癌中差异表达的趋化因子,结果以韦恩图进行展示。
1.3 预后模型的构建与评价
通过单因素Cox 比例风险回归分析筛选与卵巢癌患者预后有关的趋化因子,采用R 语言的Survival 包的coxph 函数构建预后模型,然后通过多因素Cox 比例风险回归分析得到最优模型。采用Survival 包中的predict 函数计算卵巢癌风险评分中位数,并以此将卵巢癌患者分为高风险组和低风险组,绘制Kaplan-Meier 曲线分析两组患者的总生存期(overall survival,OS),组间比较采用Log-rank检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评估趋化因子模型对卵巢癌患者预后的预测价值。
1.4 趋化因子与免疫浸润细胞的相关性分析
在CIBERSORTx 网站(https://cibersort.stanford.edu/)中上传TCGA 数据库下载的所有卵巢癌组织样本数据,比较高风险组与低风险组卵巢癌组织样本中免疫浸润细胞的比例,并使用R 语言Hmisc包中rcorr 函数分析建模趋化因子与免疫浸润细胞的相关性。
2 结果
2.1 TCGA 及GTEx 数据库组织样本质控
整合TCGA 和GTEx 数据库下载的数据,经PCA 降维后的卵巢癌组织和正常卵巢组织的数据在二维主成分图中各自聚集较好,即组内一致性较好,且组间具有较好区分度,说明该数据可进行后续分析。(图1)
2.2 差异趋化因子的筛选
比较卵巢癌组织和正常卵巢组织中的基因表达 情 况,共 发 现6813 个差异基因(P≤0.05 且|log2FC|≥1),其中表达上调3085 个,表达下调3728个。分析6813 个差异基因与48 个趋化因子之间的基因交叉情况发现,卵巢癌组织与正常卵巢组织中存在27 个差异表达的趋化因子,分别为CC 趋化因子配体(CC chemokine ligand,CCL)2、CCL3、CCL4、CCL5、CCL7、CCL8、CCL11、CCL14、CCL20、CCL21、CCL25、CCL26、CCL27、CCL28、CXC 趋化因子配体(C-X-C chemokine ligand,CXCL)1、CXCL5、CXCL6、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CXCL13、CXCL14、CXCL16、CXCL17、XC趋化因子配体2(X-C chemokine ligand 2,XCL2)。(图2)

图2 正常卵巢组织和卵巢癌组织差异表达基因和趋化因子的韦恩图
2.3 卵巢癌预后相关趋化因子挖掘
绘制Kaplan-Meier 曲线,依据趋化因子表达量中位值将372 例卵巢癌患者分为高表达组和低表达组,分组均为高表达组186 例,低表达组186 例。采用单因素Cox 比例风险回归模型分析差异表达的趋化因子与卵巢癌患者OS 的关系,结果发现,卵巢癌组织中CCL8、CCL25、CXCL9、CXCL10、CXCL11、CXCL13这6个趋化因子的表达情况与卵巢癌患者的OS 有关(P﹤0.05),趋化因子表达水平越高,患者的预后越好。(图3)
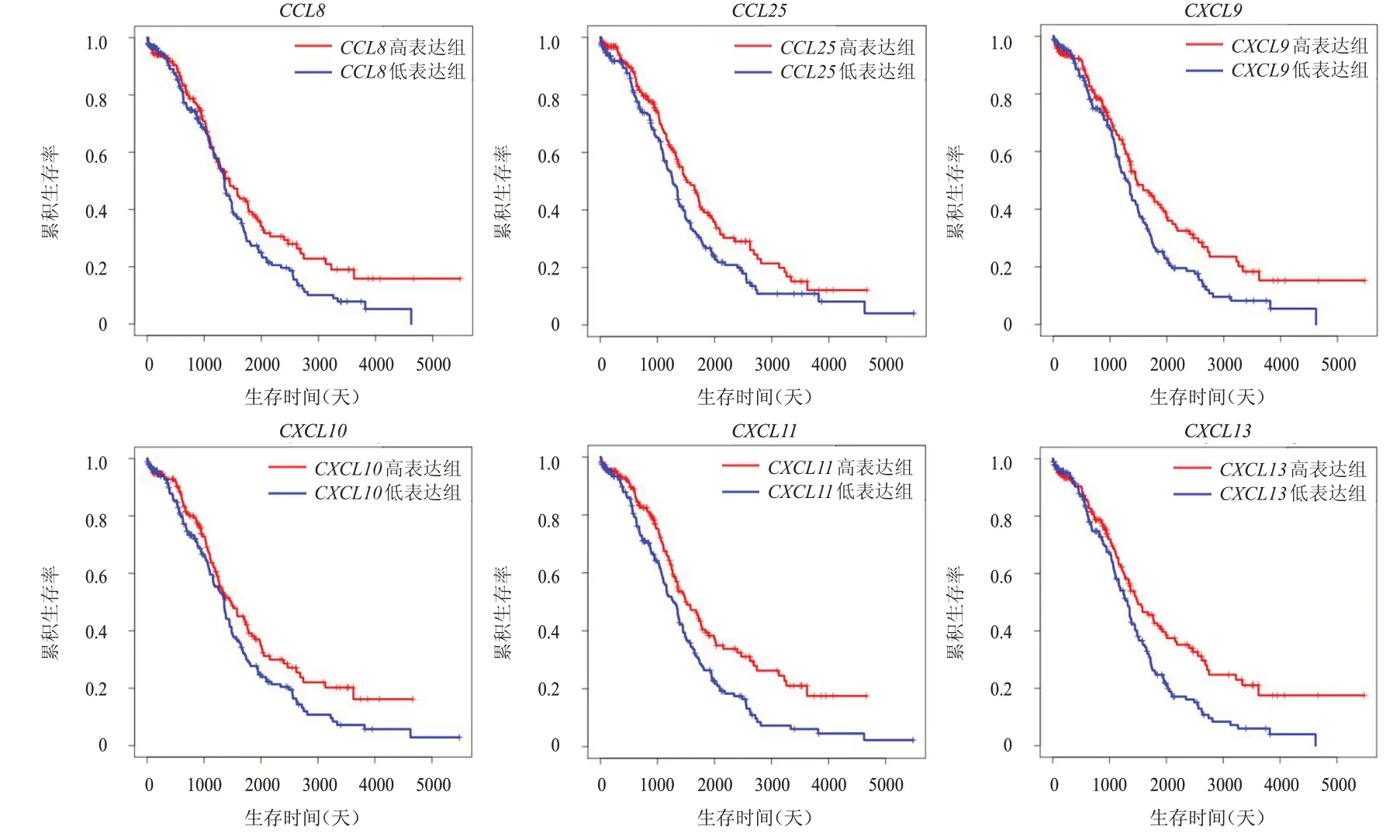
图3 各趋化因子不同表达情况卵巢癌患者的OS曲线
2.4 趋化因子相关预后模型的构建
将卵巢癌预后相关的趋化因子CCL8、CCL25、CXCL9、CXCL10、CXCL11、CXCL13纳入多因素Cox 比例风险回归模型分析,选取前4 个趋化因子(CXCL10、CXCL11、CXCL13和CCL25)构建预后模型(表1),由预后模型得出生存风险评分中位数,并以此将卵巢癌患者分为高风险组(n=186)和低风险组(n=186),结果显示,高风险组卵巢癌患者的OS 短于低风险组患者,差异有统计学意义(P﹤0.05)(图4)。绘制ROC 曲线评估该模型对卵巢癌患者预后的预测效能,结果显示,该预测模型预测卵巢癌患者1年、3年及5年预后的AUC 分别为0.563(95%CI:0.519~0.607)、0.617(95%CI:0.562~0.672)、0.653(95%CI:0.615~0.691),具有较好的预测效能(图5)。
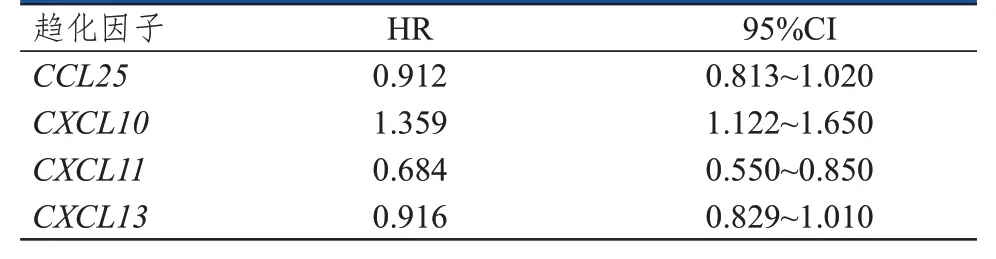
表1 CXCL10、CXCL11、CXCL13和CCL25预测卵巢癌患者预后的多因素Cox回归模型
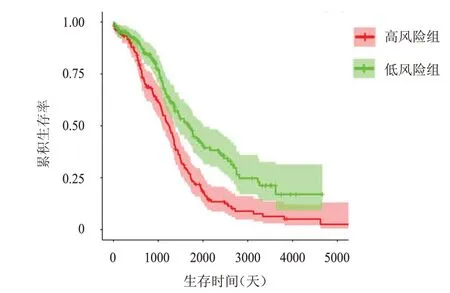
图4 高风险组(n=186)和低风险组(n=186)卵巢癌患者的OS曲线
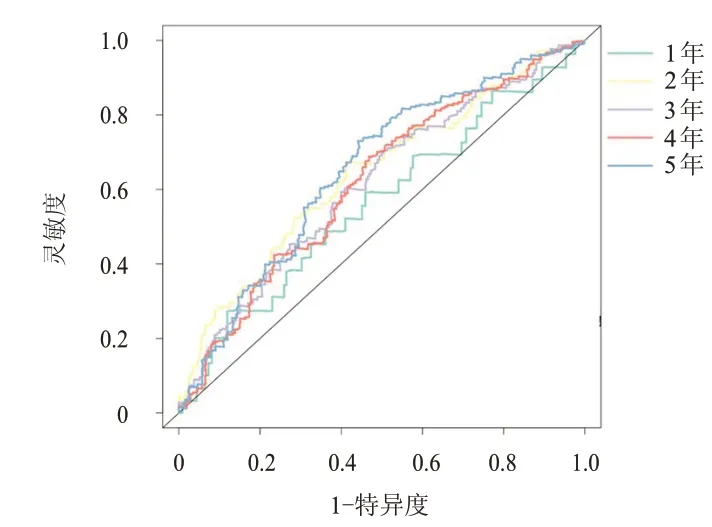
图5 趋化因子模型预测卵巢癌患者预后的ROC曲线
2.5 卵巢癌预后相关趋化因子与卵巢癌患者免疫浸润细胞的相关性分析
通过CIBERSORTx 网站分析卵巢癌组织中免疫浸润细胞的分布情况、高风险组与低风险组卵巢癌患者各免疫浸润细胞的比例,结果发现,高风险组卵巢癌患者卵巢癌组织中M2 型巨噬细胞、活化的树突状细胞和中性粒细胞比例均高于低风险组患者,差异均有统计学意义(P﹤0.05)。卵巢癌预后模型中CXCL10、CXCL11、CXCL13、CCL25的表达与M1 型巨噬细胞均呈正相关(P﹤0.05),CCL25的表达与M2 型巨噬细胞呈负相关(P﹤0.01),CXCL13的表达与成熟树突状细胞呈负相关(P﹤0.01),CCL25、CXCL13的表达与中性粒细胞均呈负相关(P﹤0.05)。(表2)

表2 CXCL10、CXCL11、CXCL13 和CCL25 与主要免疫浸润细胞的相关性
3 讨论
1990—2019年,中国卵巢癌发病率逐年升高,标化发病率与粗发病率平均每年分别上升2.03%、3.85%[9],因此,寻找有效的生物标志物预测卵巢癌患者的预后对卵巢癌患者的治疗和管理非常重要。卵巢癌的肿瘤微环境与肿瘤细胞的生长、侵袭和转移密切相关,而趋化因子在上述过程中也发挥重要作用[10],但目前关于趋化因子与卵巢癌患者预后关系的研究还很少。本研究基于生物信息学的方法筛选出27 个在卵巢癌组织与正常卵巢组织间差异表达的趋化因子,进一步分析发现,其中6个趋化因子与卵巢癌患者的预后有关,分别为CCL8、CCL25、CXCL9、CXCL10、CXCL11及CXCL13。
趋化因子是一类能趋化细胞定向移动的小分子分泌蛋白,与其受体共同构成复杂的网络,介导免疫细胞招募,形成免疫抑制或免疫促进,影响肿瘤的发生发展过程。CCL8是趋化因子家族成员,可以在炎症反应和肿瘤免疫等方面发挥重要作用,在肿瘤微环境中发挥重要作用[11]。CCL25及其受体——趋化因子受体9(CC chemokine receptor 9,CCR9)能够抑制结直肠癌细胞的侵袭和转移[12];CCL25高表达预示三阴性乳腺癌患者的预后良好[13],阻断CCR9/CCL25通路可促进肿瘤进展和远处转移[14-15]。CXCL10是由肿瘤坏死因子(tumor necrosis factor,TNF)-γ诱导产生的一类趋化因子,其高表达与直肠癌[16]、胃癌[17]、肝细胞癌[18]等患者更好的预后相关。CXC 趋化因子受体3(CXC chemokine receptor 3,CXCR3)是CXCL10基因的唯一受体,研究表明,CXCR3 与其配体CXCL10、CXCL9 结合对高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSC)患者的预后会产生正向影响,是晚期HGSC的有利预后指标[19]。CXCL11也表现为有利于肿瘤患者的预后,γ干扰素(interferon-γ,IFN-γ)和TNF-α可诱导CXCL11和CXCL9的分泌增加,并在甲状腺乳头状癌中表现为抗肿瘤细胞增殖作用[20],但与卵巢癌的关系尚未见报道。CXCL13已在乳腺癌[21]、结直肠癌[22]等多种实体肿瘤中证实为有利于患者的预后,CXCL13可以在HGSC 中形成免疫活性肿瘤微环境并增强程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)检查点阻断的效果[23]。本研究发现,卵巢癌组织中CCL8、CCL25、CXCL9、CXCL10、CXCL11及CXCL13的表达情况与卵巢癌患者的预后有关,提示上述基因有潜力成为卵巢癌患者的预后标志物,但其确切作用尚需进一步进行功能和机制研究探索。随后本研究筛选其中4 个趋化因子构建卵巢癌预后模型,该预测模型预测卵巢癌患者OS 的价值较高。
为了解趋化因子在卵巢癌中的作用机制,本研究分析了不同生存风险评分及建模趋化因子与肿瘤免疫浸润细胞间的关系,结果显示,高风险组卵巢癌患者卵巢癌组织中巨噬细胞、树突状细胞和中性粒细胞比例均高于低风险组患者,差异均有统计学意义(P﹤0.05)。研究表明,高密度的M2 型巨噬细胞与上皮性卵巢癌患者较差的预后和较低的总生存率有关,而高M1/M2 型巨噬细胞比例则预示着卵巢癌患者更好的预后[24-25]。树突状细胞是免疫系统的前哨细胞,通常提供常规的T 细胞刺激信号,从而激发强大的抗肿瘤免疫反应[26],人和小鼠晚期卵巢肿瘤中虽然伴有大量的成熟树突状细胞浸润,且能够表达相对较高水平的共刺激分子,但始终表现出抗原提呈能力缺失,最终阻断了肿瘤内T 细胞的局部活化和扩增,导致肿瘤进展[27]。中性粒细胞与淋巴细胞比值(neutrophil-tolymphocyte ratio,NLR)是肿瘤患者预后的独立影响因素。刘楠等[28]发现,高NLR 水平卵巢癌患者的OS 较短,且高NLR 与卵巢癌患者国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期晚、腹腔积液及化疗敏感性降低有关。本研究发现,CXCL10、CXCL11、CXCL13、CCL25的表达与M1 型巨噬细胞均呈正相关(P﹤0.05),CCL25的表达与M2 型巨噬细胞呈负相关(P﹤0.01),CXCL13的表达与成熟树突状细胞呈负相关(P﹤0.01),CCL25、CXCL13的表达与中性粒细胞均呈负相关(P﹤0.05)。提示卵巢癌微环境中趋化因子CXCL11、CXCL13、CCL25可能介导了巨噬细胞、中性粒细胞等免疫浸润细胞的数量增加,从而提高了抗肿瘤免疫效应,解除免疫抑制,减缓卵巢癌进展,有利于卵巢癌患者的预后。
综上所述,基于生物信息学方法筛选趋化因子构建卵巢癌患者预后的多因素Cox 回归模型,并发现CXCL10、CXCL11、CXCL13和CCL25这4 个趋化因子与免疫浸润细胞有关,有助于对卵巢癌患者进行分层并预测其预后生存情况,为卵巢癌的后续研究提供了新见解。
