基于生物信息学筛选Tlr4 基因用于诊断外周动脉疾病
2023-06-05李沛玲张永海杨梦渠刘丹妮
王 阳, 李沛玲, 张永海,, 巩 凡, 杨梦渠,, 刘丹妮
(1. 宁夏医科大学,银川 750004; 2. 宁夏回族自治区人民医院,银川 750002)
外周动脉疾病(peripheral artery disease,PAD)是一种动脉粥样硬化病变,主要累及下肢动脉,可引发管腔狭窄和闭塞。PAD 影响全球约2 亿人[1],在60 岁及以上人群中发病率为12%~20%[2],在85 岁及以上人群中这一比例已升至50%[3]。PAD 会导致肢体严重缺血,进而引起静息性疼痛、趾端坏疽甚至截肢[4]。患者的症状、体征和超声多普勒检查是目前诊断PAD 的主要方法[5],但具有典型征象的PAD 患者只有10%[6]。随着基因测序、微阵列和蛋白质组学在内的生物信息学的快速发展,生物信息学已被应用于癌症、呼吸系统、神经系统、心血管系统等各个医学领域[7-11]。本研究利用生物信息学方法从GEO 数据库中对比小鼠正常下肢肌肉组织与小鼠缺血下肢肌肉组织的基因表达差异,发现枢纽基因,进而探求该枢纽基因与PAD 的关系。
1 材料与方法
1.1 利用生物信息学方法发现枢纽基因
本研究从公共高通量基因表达资源库(GEO)中下载GSE3313 微阵列数据集,GSE3313 中包含了小鼠术前(股动脉结扎离断术)下肢肌肉组织样本及术后3 个不同时间点(术后1 d、术后7 d和术后14 d)的肌肉组织样本,对每个样本采用3 个独立的重复实验[12],采用两组间基因表达量比值FC(fold change)来描述差异显著性情况。通过GEO2R 从数据集中筛选出差异表达基因(DEGs)[13],筛选条件:同时满足log2FC>1 或<-1和错误发现率(FDR)<0.05。采用韦恩图发现各组中共同的DEGs。将得到的DEGs 进行基因本体论(GO)[14]分析和京都基因、基因组百科全书(KEGG)[15]分析,再对DEGs 进行蛋白-蛋白相互作用网络(PPI)分析(PPI 交互作用值设定为≥0.4)[16]。最后使用Cytoscape 软件的MCODE 和cytoHubba 插件[17]发现枢纽基因(MCODE 选择标准为评分>2,截断值=2,节点截断值=0.2,最大深度=100,k 评分=2)。
1.2 小鼠下肢缺血模型构建
BALB/c 野生型裸鼠(雌性18 只,8~10 周)购自宁夏医科大学实验动物中心。使用异氟烷诱导麻醉,将小鼠仰卧固定,给予麻醉面罩进行持续麻醉。在解剖显微镜下,交替使用碘伏和乙醇消毒后,从左膝关节至大腿内侧做约1 cm 的切口,用棉签剥离切口周围的皮下脂肪组织,暴露股动脉鞘,分离股动脉。在股动脉近端和远端进行双结结扎,随后在两个结点之间剪断建立重度缺血模型。在股动脉中段打1 个活结用来建立轻、中度缺血模型。使用激光散斑分析仪(PeriCamPSI,瑞典)[18]分别在术前和术后1 d 测量小鼠下肢血流量,根据再灌注率将小鼠分为轻度缺血组(>70%)、中度缺血组(40%~70%)、重度缺血组(<40%),每组6 只,每只小鼠的右侧下肢作为正常组。实验获得宁夏医科大学动物伦理委员会批准(IACUCNYLAC-2020-169)。
1.3 实时荧光定量聚合酶链式反应(qPCR)
从各组小鼠缺血下肢肌肉组织中提取总RNA。采用ABScript 3 RT Master Mix for qPCR with gDNA Remover(RK20429,ABclonal,中国)试剂,经PCR 仪(T100 Thermal Cycler,BIO-RAD,美国)逆转录为cDNA。采用Universal SYBR Green Fast qPCR Mix(RK21203,ABclonal,中国)试剂,经SYBRGreen 1 嵌合荧光法在CFX96 Real-Time System(C1000 Touch Thermal Cycler,BIORAD,美国)上检测Tlr4 基因表达水平。Tlr4 引物序列Forward:TTCAGAACTTCAGTGGCTGG,Reverse:TGTTAGTCCAGAGAAACTTCCTG。采用比较周期阈值(Ct)法检测基因表达,通过2-△△Ct计算各组Tlr4 基因相对表达量。
1.4 Western blot
分别提取正常组、轻度缺血组、中度缺血组、重度缺血组小鼠的下肢肌肉组织蛋白,BCA 法测定总蛋白含量。各组按每10 μL 含20 μg 蛋白体系加入适量5×SDS-PAGE 蛋白上样缓冲液及无菌水,使各组间达到等体积等蛋白含量。将混合物煮沸5 min,每组取10 μL 混合物加入8% SDS聚丙烯酰胺凝胶进行分离。再将印迹转移到聚偏二氟乙烯膜(PVDF)上,快速封闭液封闭15 min。加入稀释比例为1∶1 000 Tlr4 抗体(A11226,ABclonal,中国)及稀释比例为1∶2 000 β-actin 内参抗体(AC026,ABclonal,中国),4 °C 孵育过夜。使用二抗稀释比例为1∶4 000 HRP Goat Anti-Rabbit IgG(AS014,ABclonal,中国)孵育1 h,最后用发光液进行曝光。采用Image J 软件进行数据分析。
1.5 免疫荧光染色
将不同缺血程度的小鼠下肢组织浸入OCT包埋剂(Sakura Finetek,日本),再转至-80 ℃冰箱冷冻至固态。将组织包埋块切为5 μm 薄片后制成玻片,加入稀释比例为1∶100 Tlr4 抗体(A11226,ABclonal,中国),4 °C 孵育过夜;再加入驴抗兔稀释比例为1∶400 IgG H&L 二抗(ab150075,Abcam,英国)及DAPI 染色剂(S2110 Solarlio,中国)。用倒置荧光显微镜(Zeiss,Oberkochen,德国)拍照,选取每张组织玻片的3 个随机区域,使用Image J 软件对阳性区域进行量化。
1.6 统计学方法
采用SPSS 26.0 与GraphPad Prism 9 软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 DEGs 的筛选
使用火山图描绘不同组之间的DEGs,根据DEGs 的筛选标准,术后1、7、14 d 组与术前组相比分别有1 055、7 098 和5 952 个DEGs(图1A);使用韦恩图发现了3 个比较组的DEGs 中有368个共同基因(图1B);最后利用聚类热图对共同基因的表达情况进行描绘(图1C)。
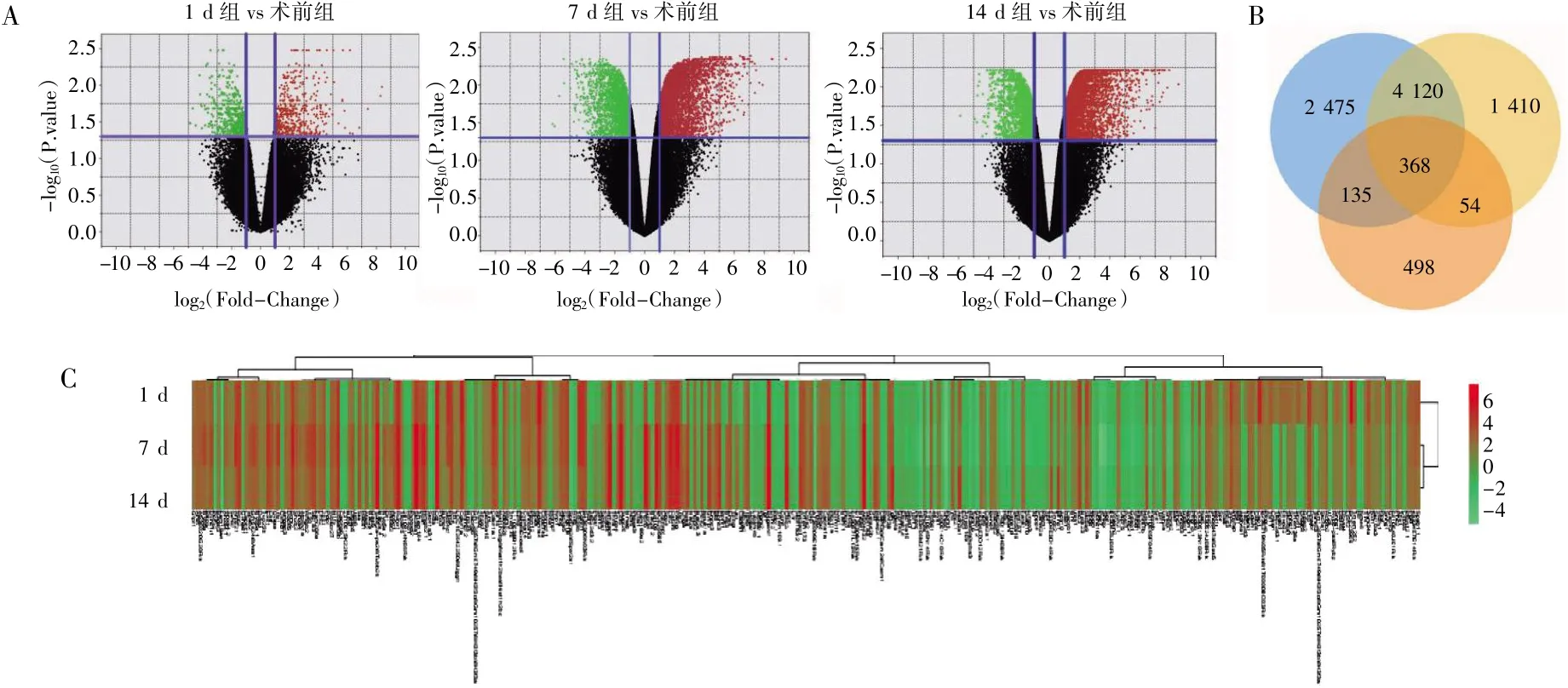
图1 DEGs 的火山图、韦恩图及聚类热图
2.2 KEGG 和GO 功能分析
KEGG 分析发现,Tlr4 信号通路和先天免疫反应正向调节通路是DEGs 的关键信号通路(图2A)。GO 富集分析提示DEGs 主要存在于细胞膜和细胞核中,其主要分子功能是进行蛋白质结合与离子结合,主要参与生物调控、代谢进程和刺激应答的生物过程(图2B)。将DEGs 的GO 富集结果(图2C)展示为气泡图,x 轴表示富集率,y轴表示GO 富集名称,圆圈的大小表示DEGs 基因的数量,圆圈的色调表示调整后的P值(-Log10Pvalue)(图2D)。

图2 DEGs 的GO 和KEGG 分析
2.3 PPI 网络与Cytoscape 软件分析
剔除无关联的188 个基因后,PPI 网络包含180 个节点和268 条边(图3A)。将PPI 网络分析得到的基因导入Cytoscape 软件,利用MCODE 插件对各个基因团簇进行评分,得到排名前5 的团簇分别为:6 分组包含13 个节点和36 条边,4.5分组包含5 个节点和9 条边,3.429 分组包含8个节点和12 条边,3 分组包含3 个节点和3 条边,2.75 分组包含9 个节点和11 条边(图3B)。根据cytoHubba 插件的degree 模式确定得分前10 的基因,排名依次为Tlr4、Ar、Lgf1、Hmgb2、Cebpb、Tbk1、Slc7a5、Cdt1、Exo1、Itpr1(图3C)。其中Tlr4 处于得分最高的团簇中(6 分),同时Tlr4也是cytoHubba 插件的degree 模式中排名第一的基因(15 分)。因此选择Tlr4 作为关键枢纽基因进行研究。首先比较4 组基因芯片中Tlr4 的绝对表达量,数据显示Tlr4 峰值出现在术后1 d(图3D),因此以术后1 d 作为研究时间点。
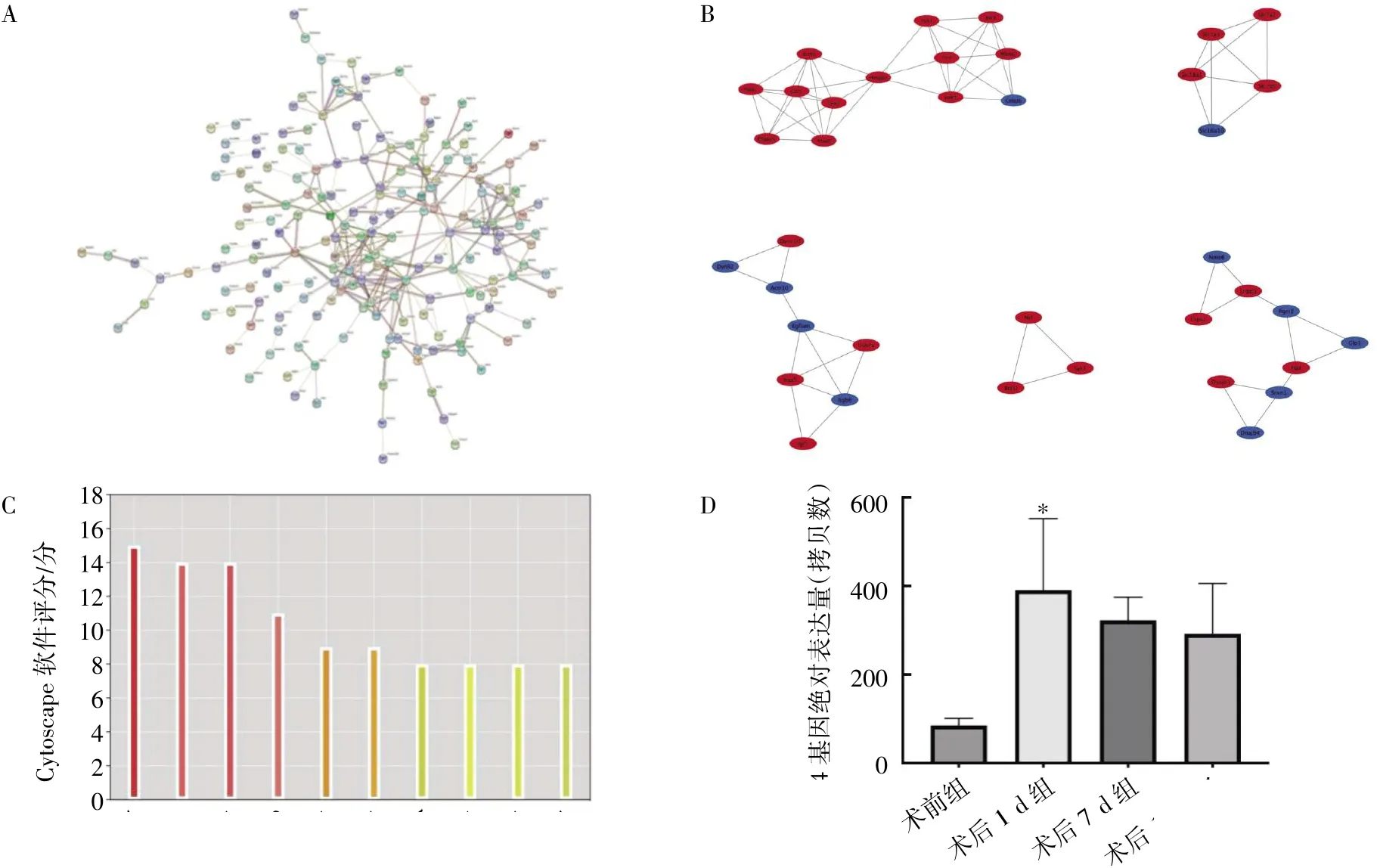
图3 PPI 网络及Cytoscape 软件分析结果
2.4 建立小鼠下肢缺血模型
采用激光散斑分析仪评估术前及术后1 d小鼠下肢血流,结果见图4。
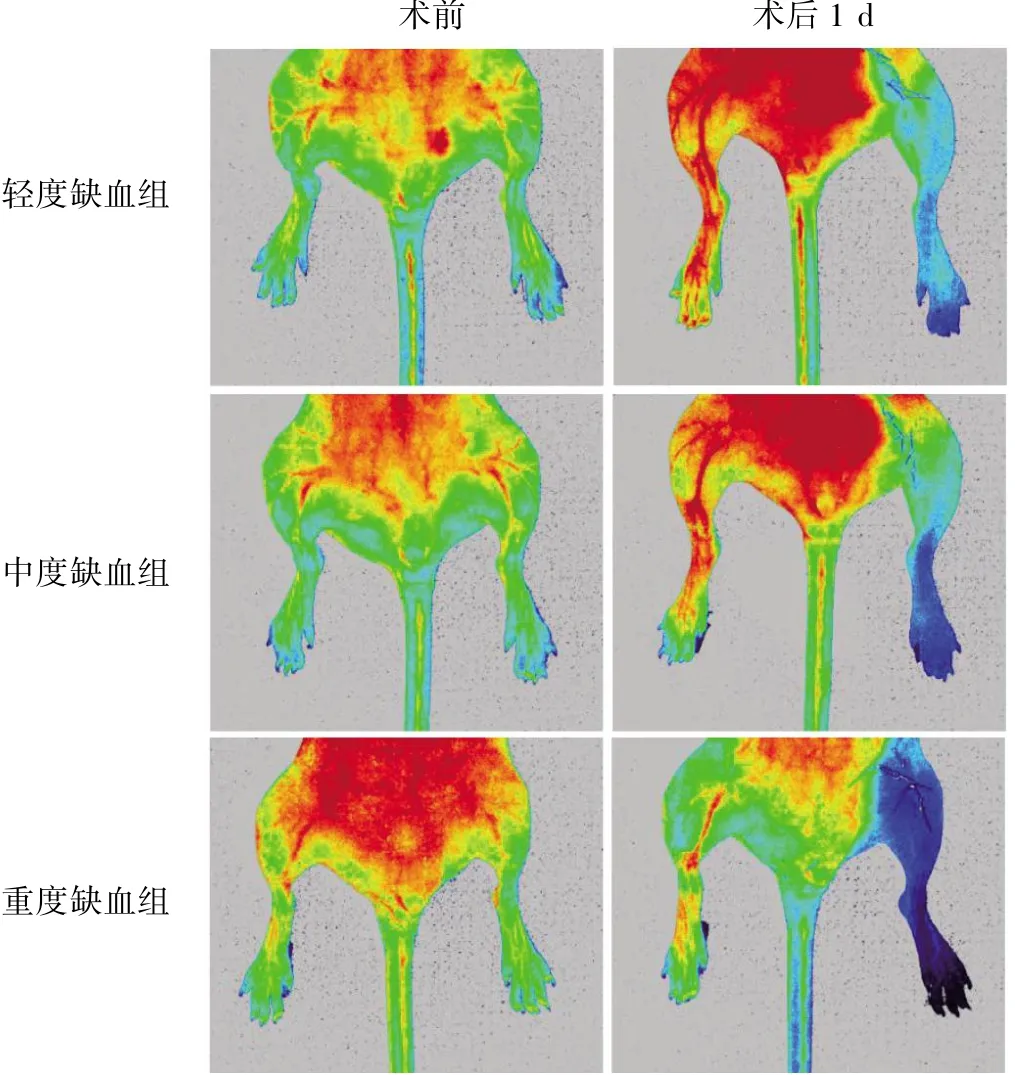
图4 采用激光散斑分析仪评估术前及术后1 d 小鼠下肢血流
2.5 qPCR
qPCR 结果显示,重度缺血组的Tlr4 基因相对表达量均高于中度缺血组、轻度缺血组及正常组(P均<0.01),见图5。

图5 Tlr4 基因在各组中的相对表达量
2.6 Western blot
结果显示,重度缺血组Tlr4 蛋白表达量高于中度缺血组、轻度缺血组和正常组(P均<0.01),中度缺血组Tlr4 蛋白表达量高于正常组与轻度缺血组(P均<0.05),轻度缺血组Tlr4 蛋白表达量高于正常组(P<0.05),见图6A、图6B。
2.7 免疫荧光染色
定量结果显示,重度缺血组Tlr4 含量高于中度缺血组、轻度缺血组和正常组(P均<0.01),中度缺血组Tlr4 含量高于正常组与轻度缺血组(P均<0.05),轻度缺血组Tlr4 含量高于正常组(P<0.05),见图7。

图7 Tlr4 在各组中的免疫荧光染色情况
3 讨论
本研究应用生物信息学方法,筛选出PAD关键枢纽基因Tlr4,随后建立小鼠下肢缺血模型,使用qPCR、Western blot 及免疫荧光染色检测各组Tlr4 表达情况。结果显示,与正常组相比,缺血组Tlr4 表达量增加,其表达水平与下肢缺血严重程度呈正相关。因此,Tlr4 基因可作为潜在生物标记物用于PAD 诊断。
Toll 样受体是一种非特异性免疫蛋白,在病原体识别和先天免疫激活中起重要作用。在Toll样受体不同的亚型中,Tlr4 参与了PAD 的炎性反应。Tlr4 通过丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)通路激活转录因子,导致多种促炎因子合成,诱导氧自由基的产生,加速调亡过程,从而加重下肢缺血及组织坏死[19]。Tlr4 还可以经活化B 细胞核因子kappa-轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)通路,激活NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体,进而激活半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)与白细胞介素-1β(Interleukin-1β,IL-1β),活化的Caspase-1 能够裂解GSDMD(gasdermin D),导致细胞膜形成孔隙,引起细胞焦亡,同时,释放出的IL-1β 刺激炎性细胞,促发炎性级联反应,加重下肢缺血。在下肢缺血组织中存在一种特殊的炎性细胞——巨噬细胞,它具有两种表型,M1 型能够加速炎性过程,起到促炎作用;M2 型具有促进血管新生、抑制炎性等作用。下肢缺血坏死后,细胞碎片、基质降解产物可以经Tlr4 受体激活NLRP3 炎症小体通路,使组织间隙的IL-1β 增多从而诱导巨噬细胞向M1表型极化,在加重PAD 炎性反应过程中起关键作用[20]。综上所述,Tlr4 与PAD 关系密切,Tlr4 可以通过炎性级联反应、调节局部免疫、影响血管新生等多种途径参与PAD 的发生、发展,因此Tlr4 在PAD 诊断中具有重要意义,同时Tlr4 基因也是治疗PAD 疾病的潜在靶点。
在本实验中只有一个数据集被使用,同时仅创建了小鼠下肢缺血模型进行研究,对Tlr4 与PAD 之间的确切联系并无临床实验数据支持。为了评估Tlr4 基因在诊断PAD 中的应用价值,需要进行大规模的数据挖掘和临床实验。
