芳香烃受体介导四溴双酚A 致斑马鱼成鱼心脏毒性作用
2023-06-05马小发吴梦宇林雨佳徐海明
单 婧, 马小发, 吴梦宇, 林雨佳, 王 义, 王 蕊, 徐海明
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏回族自治区环境因素与慢性病控制重点实验室,银川 750004)
四溴双酚A(tetrabromobisphenol A,TBBPA)是应用最广泛的溴系阻燃剂(BFRs)之一,在生产和使用过程中会释放到环境中,其在大气、土壤、水体中均被检出[1-2],甚至在鱼类、鸡蛋、牛奶以及人类母乳等食品样品中也检测到了TBBPA[3-4]。TBBPA 可通过皮肤接触、呼吸及饮食等途径进入生物和人体内,产生心脏、生殖、内分泌和神经等毒性作用[5-8],对生物存在健康风险。Alzualde 等[8]研究也证实了BFRs 及其替代物暴露后,导致斑马鱼产生心脏毒性的浓度可能处于人类暴露的较高范围内。
芳香烃受体(aryl hydrocarbon receptor,AhR)又称二噁英(TCDD)受体,属于碱性螺旋-环-螺旋(basic helix-loop-helix Per-Arnt-Sim homologydomain bHLH-PAS)转录因子家族[9],是一种最早被发现的环境污染物多环芳烃类配体激活转录因子[10],具有诱导多种重要外源性化合物代谢酶的作用,可介导TCDD 和其他平面芳香烃的毒性[11]。镉可以通过抑制代谢降解6-甲酰基吲哚[3,2-b]咔唑(6-Formylindolo[3,2-b]carbazole,FICZ)并干扰AhR 的正常功能,后者在心脏发生过程中具有生理性调节Wnt/β-catenin 通路的作用[12]。另有研究[13]表明,PM2.5的有机物(EOM)能激活斑马鱼胚胎AhR,导致心脏发育关键表达异常。因此,AhR 是否能介导TBBPA 致斑马鱼心脏发育毒性成为本次研究重点。
由于斑马鱼(Danio rerio,Zebrafish)生长繁殖快、饲养成本低,80%基因与人类疾病基因同源,且其信号传导通路和人类近似,已经成为现代毒理学常用的模型生物之一。本研究以斑马鱼为模式生物,使用AhR 抑制剂CH223191(以下简称CH),通过TBBPA 和/或CH 暴露对斑马鱼成鱼体质量、体长、AhR 相关基因、心脏功能关键基因、氧化应激相关基因以及抗氧化酶活性的影响来探讨AhR 在TBBPA 致心脏毒性效应中的作用。
1 材料与方法
1.1 实验动物饲养
实验选用4 月龄AB 系野生型斑马鱼,共300条,雌雄各半,循环水系统适应性饲养2 周。自来水充分曝气48 h 以充分除氯,除氯水中添加碳酸氢钠以保持pH 值为7.4,水温恒温(28±1)℃,光照周期为12 h/12 h,每日早晚各喂食1 次冻干丰年虾[14]。
1.2 主要试剂
TBBPA(Sigma 公司,美国),CH(MedChemExpress 公司,美国);二甲基亚砜(dimethyl sulfoxide,DMSO)(北京索莱宝科技有限公司,中国);总RNA 提取试剂盒、cDNA 第一链合成预混试剂盒、RealUniversal 彩色荧光定量预混试剂盒(北京天根生化科技有限公司,中国);实时荧光定量(qRT-PCR)引物(上海生工生物工程股份有限公司,中国);超氧化物歧化酶(SOD)测定试剂盒、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所,中国)、谷胱甘肽过氧化物酶(GSHPx/GPX)活性检测试剂盒(北京索莱宝科技有限公司,中国)。
1.3 实验方法
1.3.1 斑马鱼暴露实验 将TBBPA 溶于DMSO溶剂中,配制成浓度为0.1 mol·L-1的TBBPA 贮存液。用DMSO 稀释贮存液至浓度分别为0.1、1、10 mmol·L-1,按0.01%加入水中,至水中TBBPA终浓度分别为10、100、1 000 nmol·L-1;将CH 加入DMSO 溶剂中,配制成浓度为2.5 mmol·L-1的贮存液,后稀释至0.5 mmol·L-1,按0.01%加入水中,至水中CH 浓度为0.05 μmol·L-1。实验分为溶剂对照组(DMSO 组)、CH 组(0.05 μmol·L-1)、TBBPA 暴露组(10、100、1 000 nmol·L-1)和CH+TBBPA 干预组(1 000 nmol·L-1),各组均含0.02%体积的DMSO。从同一驯养池中按随机抽样的方法将斑马鱼分别放入对应的暴露缸中,每缸8 条鱼,雌鱼、雄鱼各4 条。同步设置两个平行组,鱼缸体积为6 L,暴露液4 L,斑马鱼暴露液每隔1 d更换1 次,暴露持续30 d,暴露期间观察各组斑马鱼的生长状况。暴露结束后用滤纸吸干表面水分,称重并测量每条鱼的体长,后迅速将每条鱼置于冰面解剖其心脏和肝组织后转移至无RNA 酶离心管中冷冻保存在-80 ℃超低温冰箱中。
1.3.2 qRT-PCR 本研究涉及的基因包括AhR 相关基因(ahr2、cyp1a1、cyp1a2)[15]、心脏功能关键基因(sox9b、nkx2.5、gate4、myh6、tbx5、vmhc)[16-20]和氧化应激相关基因(nrf2、gpx1a、sod1、sod2、cat)[21],所有引物序列合成均使用软件Primer 5 设计,并通过Primer-BLAST(http://blast.ncbi.nlm.nih.gov)验证其特异性,引物序列见表1。将斑马鱼的心脏组织置于预先加入RNA 裂解液的离心管中进行匀浆操作(4 ℃),充分研磨后进行离心操作(12 000 r·min-1,4 ℃,10 min),取上清液。严格按照试剂盒说明书进行总RNA 提取、逆转录和qRT-PCR 操作。以gapdh为内参基因,每个样品设3 个复孔,采用2-ΔΔCt法计算基因的相对表达量。

表1 qRT-PCR 引物序列
1.3.3 抗氧化酶检测实验 将斑马鱼的肝组织置于预先加入生理盐水的离心管中进行匀浆操作(4 ℃),充分研磨后,12 000 r·min-1、4 °C 离心10 min,取上清液进行抗氧化酶活性检测。分别采用WST-1 法、钼酸铵法及微量法测定SOD、CAT及GSH-Px/GPX 活性,均严格按照试剂盒说明书进行检测。
1.4 统计学方法
采用SPSS 26.0 软件对实验数据进行分析,采用GraphPad Prism 9.4.1 作图。计量资料经正态性检验均符合正态分布,以均数±标准差(±s)描述,组间比较采用单因素方差分析(one-way ANOVA)。在进行多重比较时,方差齐性则采用LSD-t检验,方差不齐采用Dunnett-t检验。检验标准为α=0.05(双侧)。
2 结果
2.1 暴露对斑马鱼成鱼生长发育的影响
在整个暴露过程中,未发现有明显的畸形及死亡情况。雌、雄鱼按照性别区分比较,与DMSO组相比,各暴露组和干预组体质量、体长差异均无统计学意义(P均>0.05),见图1。
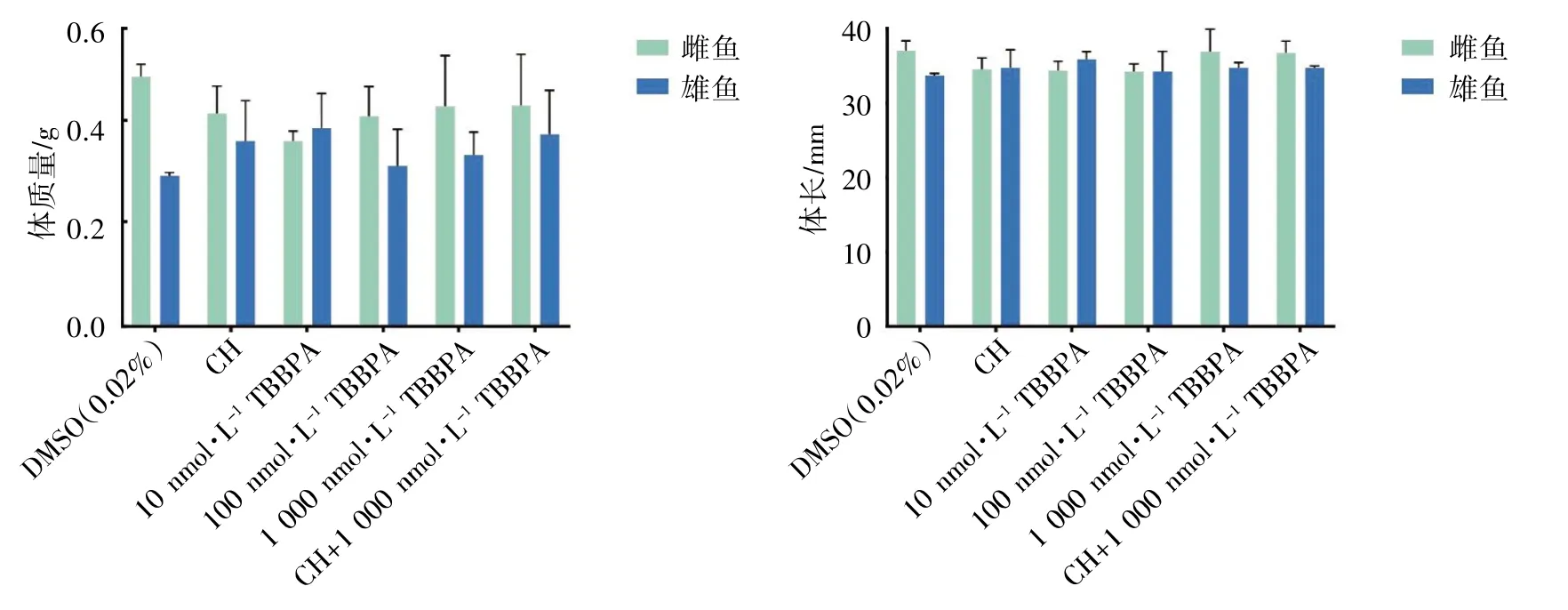
图1 TBBPA 和/或CH 暴露对斑马鱼成鱼体质量、体长的影响(n=4)
2.2 暴露对斑马鱼成鱼AhR 信号通路相关基因表达的影响
TBBPA 暴露30 d 后,与DMSO 组相比,AhR相关基因ahr2、cyp1a1 和cyp1a2 在CH 组中表达下调(ahr2、cyp1a1:P均<0.05),其中cyp1a2 差异无统计学意义(P>0.05);ahr2、cyp1a1 和cyp1a2 在1 000 nmol·L-1TBBPA 暴露组和CH+1 000 nmol·L-1TBBPA 干预组中表达均上调(P均<0.05)。与1 000 nmol·L-1TBBPA 暴露组相比,ahr2、cyp1a1和cyp1a2 在CH+1 000 nmol·L-1TBBPA 干预组中表达水平下降(P均<0.05),见图2。
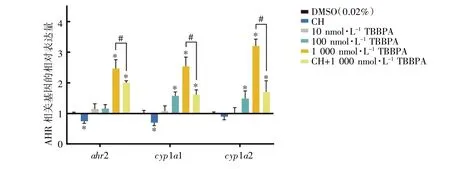
图2 TBBPA 和(或)CH 暴露对斑马鱼成鱼AhR 信号通路相关基因mRNA 相对表达水平的影响(n=8)
2.3 暴露对斑马鱼成鱼心脏功能关键基因表达的影响
TBBPA 暴露30 d 后,与DMSO 组相比,nkx2.5和tbx5 在100 nmol·L-1TBBPA 暴露组表达下调(P均<0.05);sox9b、nkx2.5、gate4、myh6、tbx5和vmhc在1 000 nmol·L-1TBBPA 暴露组表达均下调(P均<0.05)。与1 000 nmol·L-1TBBPA 暴露组相比,CH+1 000 nmol·L-1TBBPA 干预组各指标表达均上调(P均<0.05),见图3。
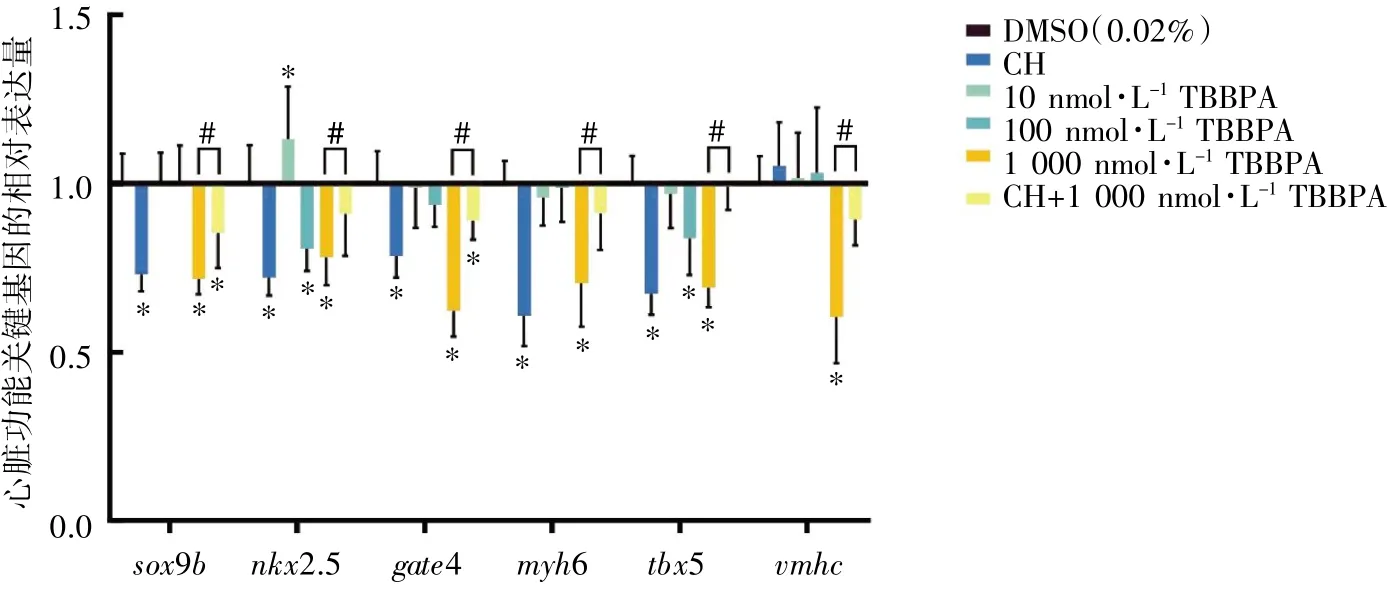
图3 TBBPA 暴露对斑马鱼成鱼心脏功能关键基因mRNA 相对表达水平的影响(n=8)
2.4 暴露对斑马鱼成鱼氧化应激相关基因表达水平的影响
在TBBPA 暴露30 d 后,与DMSO 组相比,gpx1a、sod1 和sod2 在100 nmol·L-1TBBPA 暴露组表达均下调(P均<0.05);gpx1a、sod1、sod2 和cat在1 000 nmol·L-1TBBPA 暴露组表达下调,nrf2表达上调(P均<0.05)。与1 000 nmol·L-1TBBPA 暴露组相比,gpx1a、sod1、sod2 和cat在CH+1 000 nmol·L-1TBBPA 干预组表达上调,nrf2 表达下调(P均<0.05),见图4。
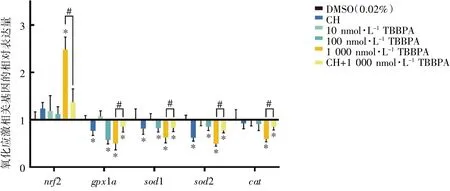
图4 TBBPA 暴露对斑马鱼成鱼氧化应激相关基因mRNA 相对表达水平的影响(n=8)
2.5 暴露对斑马鱼成鱼肝脏抗氧化酶的影响
经过30 d 暴露之后,与DMSO 组相比,CH 组SOD、CAT 和GSH-Px/GPX 活性无变化(P>0.05),1 000 nmol·L-1TBBPA 暴露组这三种抗氧化酶活性均下降(P均<0.05),活性分别相当于DMSO组的0.45、0.57 和0.44 倍。与1 000 nmol·L-1TBBPA暴露组相比,CH+1 000 nmol·L-1TBBPA 干预组各指标均有所上升(P均<0.05),见图5。
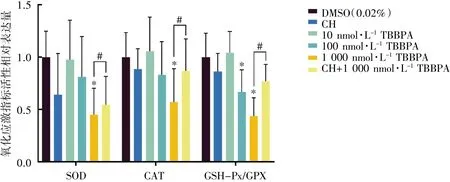
图5 TBBPA 和(或)CH 暴露对斑马鱼成鱼肝脏抗氧化酶水平的影响(n=8)
3 讨论
本研究以斑马鱼为对象,探究TBBPA 暴露对斑马鱼心脏毒性效应以及AhR 在此过程中的作用机制。在参考国内多地环境水体中TBBPA 实际剂量的基础上[22],本研究选取10、100、1 000 nmol·L-1作为暴露剂量。在参考相关研究的基础上,CH 暴露剂量设置为0.05 μmol·L-1[23]。本研究结果显示,斑马鱼成鱼暴露TBBPA 后,各暴露组和干预组与DMSO 组相比差异无统计学意义,体质量、体长无明显变化,表明环境相关剂量的TBBPA 暴露对斑马鱼成鱼生长发育无影响。
某些特定结构的环境化合物可以通过激活AhR 信号通路而活化下游信号,引起一系列毒理学与健康效应[24]。本研究发现TBBPA 暴露30 d后,ahr2、cyp1a1 以及cyp1a2 表达水平均上调,CH 可以使其表达水平降低。这一结果提示,TBBPA 暴露后会激活AhR 信号通路。氧化应激是导致机体组织产生病理表现的关键因素,心血管、肝脏等疾病都与活性氧(ROS)密切相关[25]。AhR 被激活后通过上调机体内细胞色素酶P450的表达水平,引起ROS 水平升高,最终导致氧化损伤[15]。本研究首先关注了TBBPA 暴露对斑马鱼心脏组织中氧化应激相关基因表达水平的影响。同时,考虑到肝脏是机体内最容易受到应激损伤的器官之一,所以进一步探究了TBBPA 暴露对斑马鱼肝组织中抗氧化酶活性的影响。
nrf2 是抗氧化反应中关键的转录因子,可通过与多个抗氧化基因启动子区抗氧化反应元件(ARE)的结合来诱导下游基因表达。Zhang 等[21]的研究证实,TBBPA 暴露能够激活nrf2 信号通路。本研究结果显示,TBBPA 暴露可以引起斑马鱼心脏组织中nrf2 基因表达水平上调,同时导致gpx1a、sod1、sod2 和cat的表达水平下调。进一步的研究表明,TBBPA 暴露可降低斑马鱼肝组织中抗氧化酶SOD、CAT 和GSH-Px/GPX 的活性,CH可从一定程度上逆转TBBPA 所致的氧化损伤,提示AhR 信号通路介导了TBBPA 所致的氧化损伤效应。
本研究选择了sox9b、nkx2.5、gate4、myh6、tbx5 和vmhc这6 个与心脏功能密切相关的基因作为探究TBBPA 所致斑马鱼心脏毒性的分子指标。Wnt/β-catenin 通路在心脏发育及正常功能的发挥过程中起着至关重要的作用,可调控心衰、心肌梗死后重构和心律失常等心脏疾病的病理进程[16,26-27]。β-catenin 靶基因sox9b 和nkx2.5是心脏发育关键转录因子。sox9b缺失会导致斑马鱼心包水肿和心脏肿大[17]。nkx2.5 位于众多心脏结构基因的上游,维持正常心脏结构功能,nkx2.5基因突变或缺失会导致斑马鱼心脏畸形[18]。myh6参与构成心肌细胞骨架,斑马鱼wea突变体可干扰myh6 基因表达而导致斑马鱼心房收缩障碍[19]。tbx5 基因突变可导致多种类型的先天性心脏病[20]。本次实验结果表明,TBBPA 暴露可导致斑马鱼心脏内sox9b、nkx2.5、gate4、myh6、tbx5 和vmhc基因表达下调,提示TBBPA 可导致一定的心脏毒性。
综上所述,环境相关剂量的TBBPA 暴露对斑马鱼成鱼体质量及体长无影响,但可通过激活AhR 信号通路,引起氧化损伤并影响心脏功能关键基因的表达水平,最终导致心脏毒性作用。
