间充质干细胞诱导的神经干细胞对脑出血大鼠的神经保护作用
2023-06-05刘佳鑫曹传尚金毅然马晓娜李家辉郭松林牛建国梁雪云
刘佳鑫, 曹传尚, 金毅然, 马晓娜, 李家辉, 郭松林, 牛建国, 梁雪云
(1.宁夏医科大学总医院,宁夏干细胞与再生医学重点实验室,银川 750004;2. 宁夏医科大学,宁夏颅脑疾病重点实验室,银川 750004)
脑卒中分为缺血性脑卒中和出血性脑卒中,其中出血性脑卒中占全部脑卒中的15%左右[1]。尽管脑出血(intracerebral hemorrhage,ICH)发病率低于脑缺血,但其更高的病死率和致残率值得高度重视[2]。ICH 通常表现为脑内动脉突然破裂,血液释放压迫周围脑组织,引起颅内压迅速升高,继而导致脑水肿,导致炎症、氧化应激的发生和血脑屏障破坏[3-4]。当前对于ICH 的治疗主要体现在手术清除血肿、药物止血以及调节血压[5],但疗效以及预后仍不理想,给患者以及社会带来沉重的负担[6]。因此,探寻理想的ICH 治疗手段仍是当前研究者面临的一项挑战。
间充质干细胞(mesenchymal stem cells,MSCs)因其具有自我更新、免疫原性低、多向分化潜能及免疫调节等生物学特性[7],已被应用于治疗多种疾病的动物模型中,例如ICH[8]、脑缺血[9]、脊髓损伤[10]、糖尿病[11]、关节炎等[12],并展现出良好的治疗效果。MSCs 对ICH 具有一定的治疗作用[13],但是对于ICH 这类神经系统损伤的疾病,移植神经干细胞(neural stem cells,NSCs)对神经系统的损伤修复可能更精准、更高效[14-15]。内源性NSCs 来源有限,不能满足临床移植所需,且不易对其标准化制备[16]。研究[17-18]发现,MSCs 具备在一定条件下能被诱导分化为NSCs 的潜能,这将为解决NSCs 移植治疗ICH 等疾病面临的细胞数量少、细胞标准化制备等难题提供新思路。
本课题组前期已经将胎盘间充质干细胞(placental mesenchymal stem cells,pMSCs)在诱导培养基的作用下诱导生成神经干细胞(induced neural stem cells,iNSCs)[19],且iNSCs 条件培养基具有良好的抗氧化特性,能够促进受损海马神经干细胞的修复[20]。因此,本研究将进一步探讨iNSCs 对ICH 大鼠的神经保护作用。
1 材料与方法
1.1 实验材料与试剂
实验中所用P3 代次的pMSCs 由宁夏医科大学总医院宁夏干细胞与再生医学重点实验室提供,细胞的采集及获取获得宁夏医科大学总医院伦理委员会批准(伦理编号:2020-289)。实验所用的SPF 级SD 雄性大鼠(250~280 g)购自宁夏医科大学实验动物中心,并按宁夏医科大学实验动物伦理规定进行操作。Neurobasal-A Medium、B-27 Supplement(50×)、N-2 Supplement(100×)、胰蛋白酶、GlutaMAXTMSupplement、磷酸缓冲盐溶液(PBS)购自美国Gibco 公司;UltraCULTURETMSerum-free Medium 购自瑞士LONZA 公司;ultroser G 血清替代物(ultroser G serum substitute,UG)购自美国PALL 公司;表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自美国PeproTech 公司;Heparin 购自加拿大STEMCELL公司;层粘连蛋白包被液购自瑞典BioLamina 公司;Ⅶ型胶原酶购自美国Sigma-Aldrich 公司;兔抗Sox-2、β-actin,山羊抗兔CoraLiteR488 购自美国Proteintech 公司;兔抗GAP-43、超氧化物歧化酶(SOD),鼠抗NeuN,山羊抗兔Alexa FluorR555、H&L(HRP),山羊抗鼠Alexa FluorR488 均购自英国Abcam 公司;兔抗Nestin 购自美国Invitrogen 公司;兔抗Cleaved-Caspase-3 购自美国Affinity 公司;A 型胶原酶购自瑞士Roche 公司;异氟烷购自深圳市瑞沃德生命科技有限公司;尼氏染色试剂盒、HE 染色试剂盒、4%多聚甲醛、羊血清、含DAPI 封片剂购自北京索莱宝科技有限公司;ECL 检测试剂盒购自凯基生物公司;CO2恒温培养箱、PRIMO 台式高速离心机购自美国Thermo Fisher 公司;倒置显微镜购自日本Olympus 公司;其他细胞培养皿、细胞培养板、细胞筛等耗材购自美国Corning 公司。
1.2 方法
1.2.1 pMSCs 分离及培养 pMSCs 采集方法沿用课题组前期研究[21],简要描述如下:获取人源性胎盘母体侧组织,采用无菌操作方法将其剪碎,PBS 洗涤后用0.1%的A 型胶原酶于37 ℃水浴处理2 h,每隔20 min 颠倒混匀,并将消化后的细胞悬液通过100 μm 的细胞筛,离心并弃掉上清液,加入适量培养液,将细胞混合液转至培养皿中,于37 ℃、5% CO2培养箱中培养,待细胞密度至80%左右进行传代。
复苏P3 代次的pMSCs 并将其培养于添加了UG 的通用型无血清培养基(ultraculture serumfree medium)中,次日换液,待细胞密度达到80%左右,传代扩增至P5 代用于诱导神经干细胞。
1.2.2 iNSCs 诱导方法 配制iNSCs 诱导培养基,其比例分别为Neurobasal-A Medium(97%)、B-27(2%)、N-2(1%)、bFGF(10 mg·L-1)、EGF(20 mg·L-1)、Heparin(2 mg·L-1)。将细胞数为2×106的P5 代pMSCs 重悬于10 mL 的iNSCs 诱导培养基中并接种在100 mm 的细胞培养皿悬浮诱导,每3 d 向培养皿中补充3 mL 的诱导培养基,只补液不弃液。
1.2.3 iNSCs 及pMSCs 的免疫荧光染色鉴定 复苏P5 代次的pMSCs,以及在诱导后第7 天,收集直径在100 μm 左右的iNSCs,将其轻柔吹散成单个细胞,将上述细胞接种在预先用层粘连蛋白包被的12 孔板中,过夜培养,待次日细胞贴壁后,弃掉培养液,PBS 清洗2 遍,用4%的多聚甲醛室温固定细胞20 min,加入0.5% Triton X-100室温破膜20 min,再用5%的羊血清室温封闭1 h后,分别与以下一抗,即Nestin(1∶200)、GAP-43(1∶500)、Sox-2(1∶500)于4 ℃孵育过夜。次日用PBS 清洗3 次,每次10 min,然后分别加入荧光二抗Alexa FluorR555(1∶500)或CoraLiteR488(1∶500)室温避光孵育2 h。加入DAPI 染液对细胞核染色,并在荧光显微镜下观察采集图像。每组蛋白鉴定设置3 个复孔,每个样本孔随机拍摄5个视野,计算阳性细胞率,最后再计算出各组蛋白阳性细胞率的均值。
1.2.4 大鼠ICH 模型 将大鼠随机分为假手术组(Sham 组)、脑出血组(ICH 组)和诱导的神经干细胞移植组(iNSCs 组),每组10 只。用异氟烷麻醉大鼠,将其固定在手术台面,备皮,碘伏消毒,沿两眼中点做矢状切口暴露前囟,以前囟为坐标原点,向后0.2 mm,向左旁开3.0 mm,深度6.0 mm 为左侧纹状体内囊定位点,用微量注射器以0.4 μL·min-1的速率缓慢注射2 μL 的Ⅶ型胶原酶(0.2 U)。注射结束需停针10 min,垂直缓慢拔出针头,并用骨蜡封闭针孔以及缝合伤口。ICH 模型以注射Ⅶ型胶原酶24 h 完成,Sham组在不注射胶原酶的情况下进行相同的操作。
1.2.5 iNSCs 原位移植 将iNSCs 用胰酶预处理5 min 后,用培养基终止消化并轻柔吹打,使其成为单个细胞。大鼠麻醉、固定及纹状体定位同ICH 造模方法。当Ⅶ型胶原酶注射24 h 后,将1×106/30 μL 的iNSCs 用量程为100 μL 微量注射器原位缓慢注射到ICH 大鼠左侧纹状体内囊,退出针头,并用骨蜡封闭针孔以及缝合伤口。Sham组和ICH 组注射等体积的PBS,其他操作相同。
1.2.6 神经功能评估 1)前肢放置实验:用于评估动物的感觉运动功能障碍,实验前,让动物放松,轻柔抓住大鼠使其四肢自由悬空,让大鼠的右侧胡须触碰桌角,诱导其将前肢放置于桌面,大鼠发生ICH 后,会对侧前肢放置呈现一定障碍,每只大鼠测试10 次,记录大鼠右侧前肢放置成功的百分率反映动物的损伤情况。分值越高,代表动物损伤情况相对越小。2)转角实验:用以评估动物的肢体协调功能的损伤情况,将大鼠置于由两块挡板形成的30°夹角装置中,大鼠会转身,每只大鼠测试10 次,记录大鼠右转的百分率,每次测试间隔>30 s。分值越高,代表动物损伤情况相对越小。3)改良神经功能缺损评分(modified neurological severity score,mNSS):用以反映动物神经功能缺损情况,主要包括对动物的运动、感觉、反射、平衡、肌力等功能的评价,其分值量化为0~18 分,分数越高,表明神经功能缺损越严重。
1.2.7 标本制备 将大鼠麻醉后,暴露心脏,将灌注针头沿左心室插入主动脉,剪开右心耳,并灌注生理盐水,待右心耳流出的液体变澄清时,换4%的多聚甲醛继续灌注,待动物肢体变硬后,停止灌注并取出整个脑组织,置于4%的多聚甲醛4 ℃过夜,30%的蔗糖溶液脱水完成后,去除脑干和小脑,以进针点的冠状面为基准,向其前后各延伸1 mm,获取2 mm 厚度的脑组织切片,并制备厚度为10 μm 的冰冻切片用于后续的组织免疫荧光、HE 及尼氏(Nissl)染色。
1.2.8 血肿体积量化 取材各组大鼠脑组织切成连续的组织切块用以观察血肿大小,并用Image J 量化各组大鼠脑组织的血肿大小,计算公式:血肿体积率(%)=血肿体积/全脑体积×100%。
1.2.9 HE 和Nissl 染色 HE 染色用以观察脑组织周围正常和病变细胞的形态、数量及分布情况。Nissl 染色用以观察神经元胞质和树突内的尼氏小体的大小和数量。根据HE、Nissl 染色试剂盒的说明,将各组冰冻切片按照提示进行染色,在正置显微镜下观察并采集图像。
1.2.10 组织免疫荧光染色 将各组厚度为10 μm的冰冻切片用PBS 洗涤3 次,每次10 min。滴加0.5% Triton X-100 室温破膜20 min,5%的羊血清室温封闭1 h,分别与以下一抗,即NeuN(1∶200)、Cleaved-Caspase-3(1∶300)于4 ℃孵育过夜。次日将切片用PBS 洗涤3 次,每次10 min,然后分别加入荧光二抗Alexa FluorR555(1∶500)或Alexa FluorR488(1∶500)室温避光孵育2 h,并在切片上滴加DAPI 染液,封片,在荧光显微镜下观察并采集图像。
1.2.11 Western blot 检测 麻醉各组大鼠,迅速取出全脑,以注射点的冠状面为基准向其前后分别扩展1 mm,获取厚度为2 mm 的脑组织,并分离出损伤侧纹状体组织,迅速放入液氮速冻,再转入-80 ℃冰箱保存。向分离的脑组织中加入蛋白裂解液,并于组织研磨仪中研磨15 min,然后在4 ℃下,12 000 r·min-1离心15 min,收集上清液,并用BCA 试剂盒测取样品中的蛋白质浓度。将蛋白质总含量为50 μg 的样品加载到10%的SDS-PAGE 凝胶中分离各类蛋白质,湿转至PVDF 膜上,并用5%的脱脂奶粉封闭2 h。随后分别在4 ℃下孵育SOD,β-actin 一抗过夜,次日用Tris 缓冲盐溶液(TBST)清洗3 次后加入HRP标记的二抗室温孵育1 h,对膜上的蛋白条带用ECL 检测试剂盒通过凝胶成像系统显影。用Image-J 软件分析各组蛋白条带相对表达量。
1.3 统计学方法
采用GraphPad Prism 9.0 进行绘图和统计分析,计量资料采用均数±标准差(±s)表示,两组样本均数的比较采用t检验,多组间的均数比较采用单因素方差分析(one-way ANOVA)。P≤0.05 为差异具有统计学意义。
2 结果
2.1 pMSCs 诱导成iNSCs 形态学变化
pMSCs 是一种呈梭形、旋涡状生长的贴壁细胞,将pMSCs 用诱导培养基悬浮诱导,可在24 h后发现细胞开始聚集成团生长,并有少量小细胞团出现。在第7 天可见大量直径在100 μm 左右状态良好的iNSCs,iNSCs 折光性强,细胞之间聚合紧密呈桑葚样或球体形态,见图1。
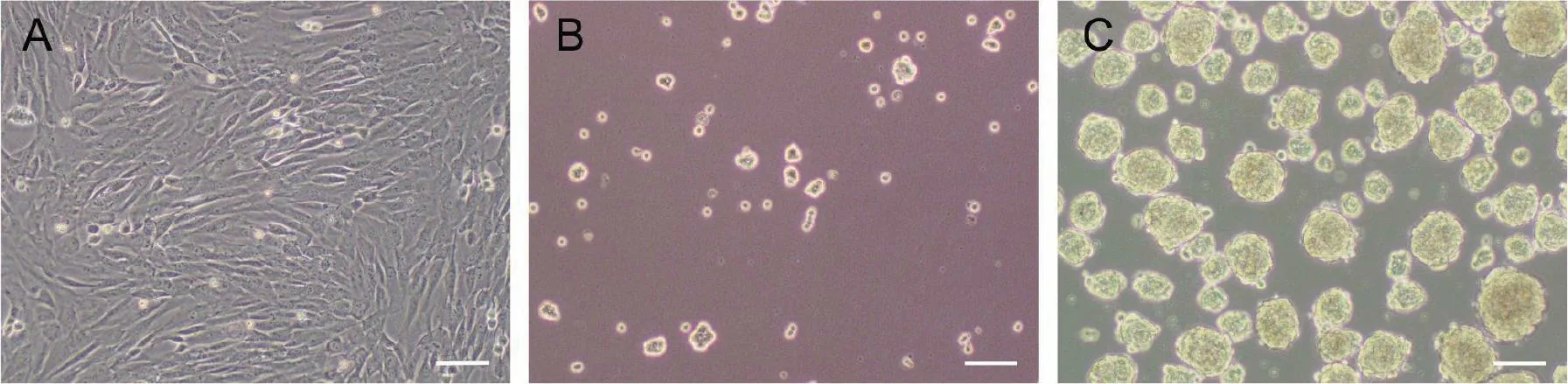
图1 iNSCs 诱导成球过程光镜图
2.2 pMSCs 及iNSCs 表达神经干细胞相关标志蛋白的鉴定
对pMSCs 及iNSCs 进行神经干细胞标志蛋白鉴定,结果显示,85%以上的iNSCs 均表达Nestin、Sox-2 及GAP-43,而pMSCs 低表达上述蛋白(P均<0.05),见图2。
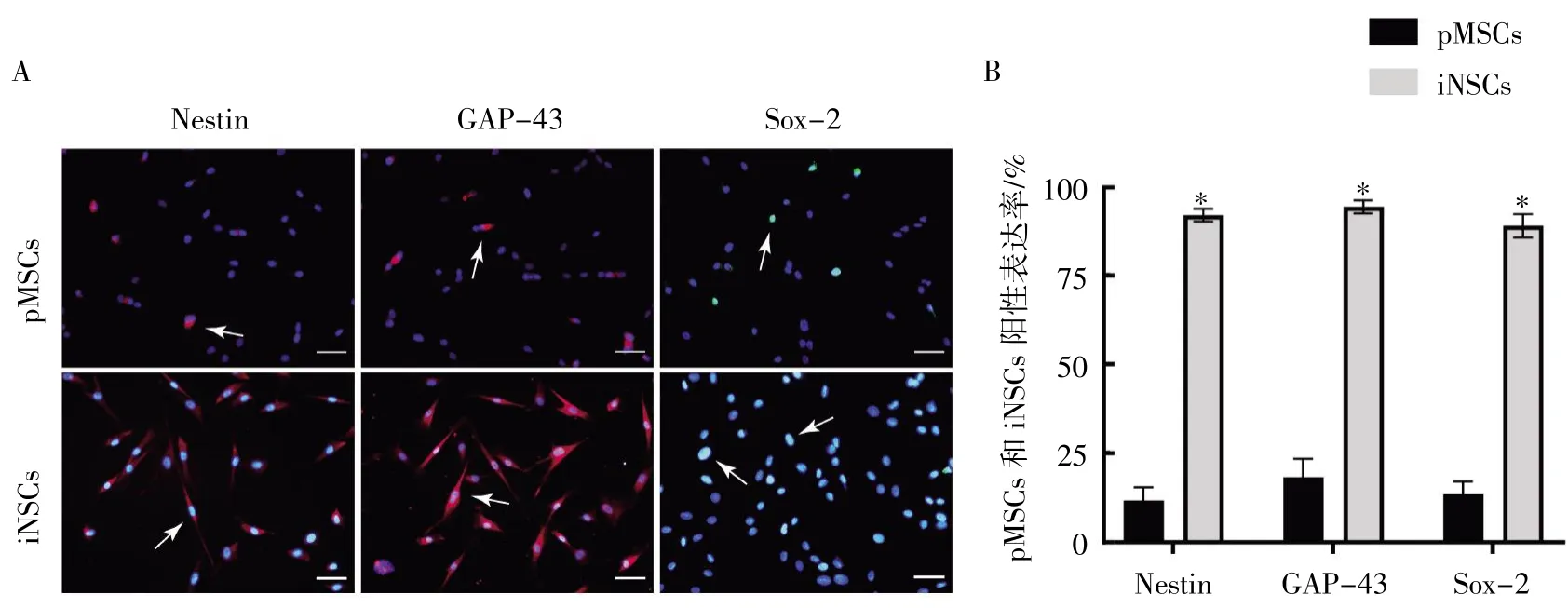
图2 pMSCs 及iNSCs 免疫荧光染色鉴定
2.3 iNSCs 移植有效降低ICH 大鼠脑血肿体积
iNSCs 移植后在第7 天,取材各组大鼠脑组织并测量血肿大小。Sham 组大鼠脑血肿体积率为(0.5±0.1)%,ICH 组为(9.2±0.6)%,iNSCs 组为(5.6±0.9)%。与ICH 组比较,iNSCs 组大鼠的脑血肿体积率降低(P<0.05),见图3。
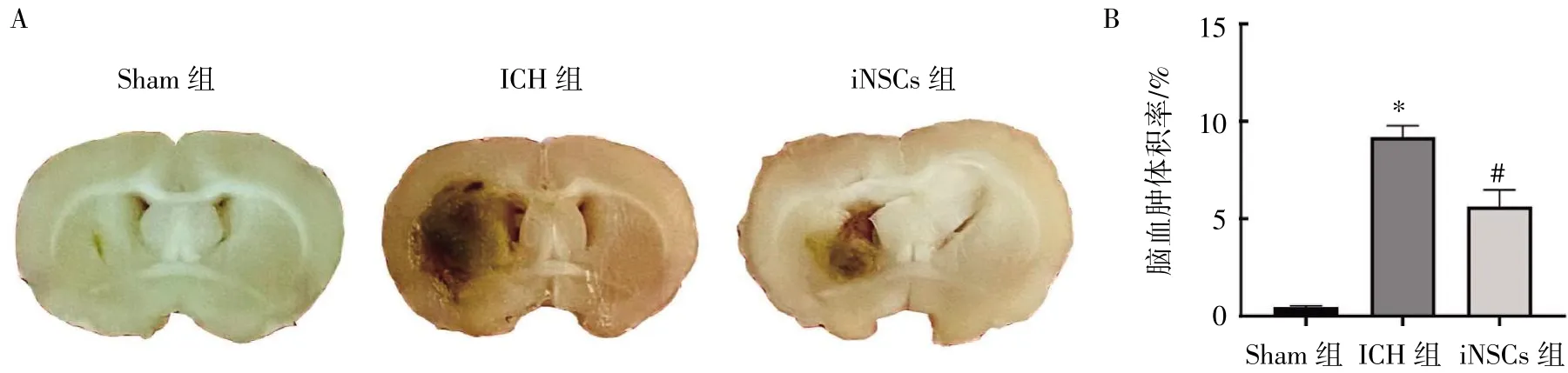
图3 iNSCs 移植对ICH 大鼠血肿体积的影响
2.4 iNSCs 移植有效改善ICH 大鼠神经功能缺失
iNSCs 移植后第7 天,前肢放置试验、转角试验和mNSS 评分的结果显示,与ICH 组比较,iNSCs 组大鼠的前肢放置成功率和右转成功率升高,mNSS 评分下降(P均<0.05),见图4。
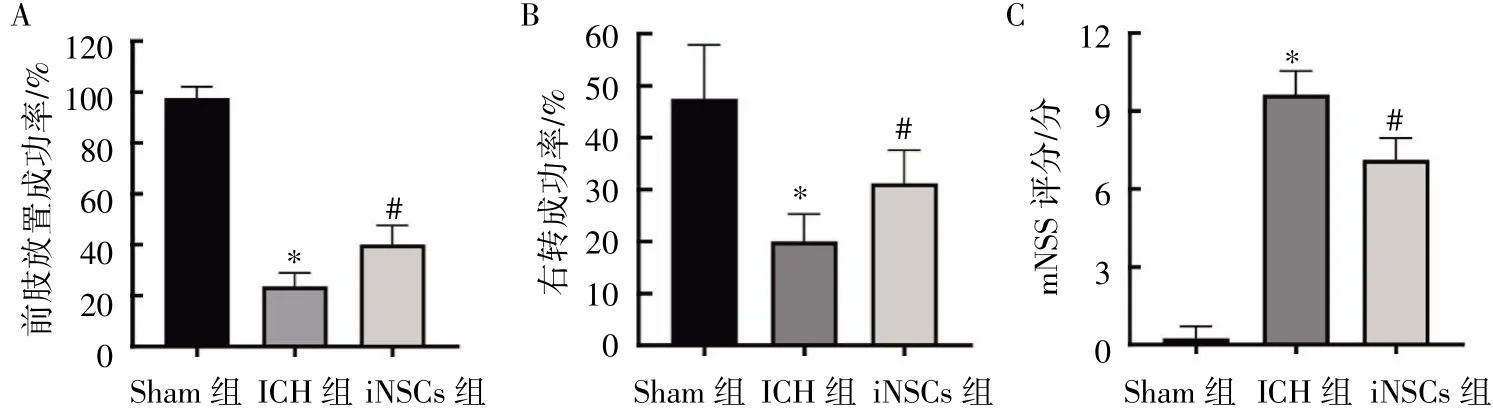
图4 iNSCs 移植对ICH 大鼠神经功能缺失影响
2.5 iNSCs 移植有效改善ICH 大鼠神经元损伤程度
对各组脑切片进行HE 以及尼氏染色。HE染色结果显示,Sham 组大鼠的细胞形态规则,分布均一,胞体完整,染色均匀。ICH 组大鼠可见大量的炎细胞浸润,细胞肿胀,胞膜边界不清,细胞排列紊乱。而与ICH 组比较,iNSCs 组大鼠的细胞肿胀减轻,炎细胞浸润减少,细胞排列相对均匀。尼氏染色结果显示,Sham 组大鼠的尼氏小体阳性的神经元数量较多,神经元内的尼氏小体含量高,细胞形态规则,染色均匀。ICH 组大鼠的尼氏小体阳性的神经元比例减少,部分细胞形态不规则,胞膜破碎,染色较浅。而与ICH 组比较,iNSCs 组大鼠的尼氏小体阳性神经元百分率增加(P<0.05),凋亡退化的神经元数量减少,细胞形态相对规则,染色均匀,见图5。
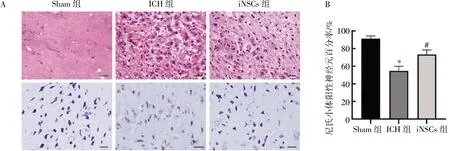
图5 iNSCs 移植对ICH 大鼠神经元损伤的影响
2.6 iNSCs 移植有效抑制ICH 大鼠血肿周围神经元的凋亡
各组脑切片NeuN/Cleaved-Caspase-3 免疫荧光双标染色分析结果显示,与Sham 组比较,ICH 组大鼠血肿周围NeuN/Cleaved-Caspase-3阳性的凋亡神经元数量增加(P<0.05);与ICH 组比较,iNSCs 组大鼠血肿周围凋亡神经元数量减少(P<0.05),见图6。
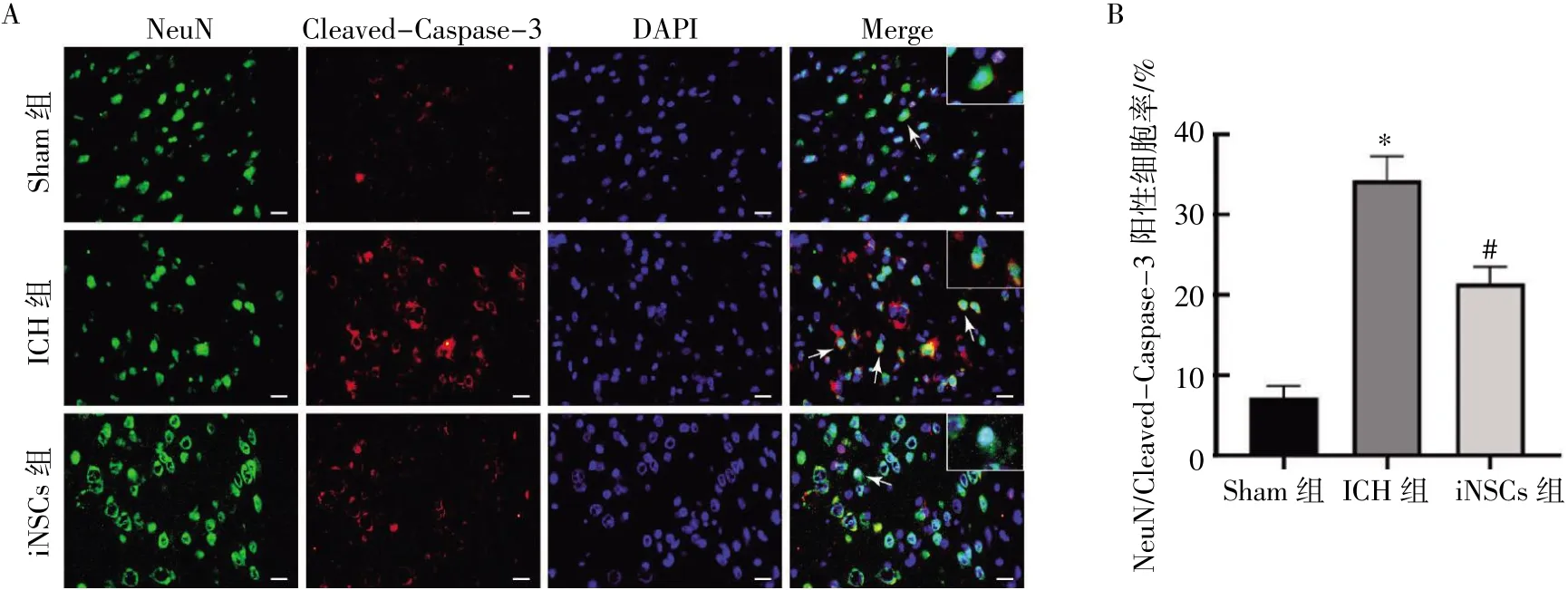
图6 iNSCs 移植对ICH 大鼠血肿周围神经元凋亡的影响
2.7 iNSCs 移植有效提高ICH 大鼠血肿周围SOD 蛋白的表达
Western blot 结果显示,与Sham 组比较,ICH组大鼠SOD 蛋白的表达水平降低(P<0.05);与ICH 组比较,iNSCs 组大鼠SOD 蛋白的表达水平升高(P<0.05),见图7。
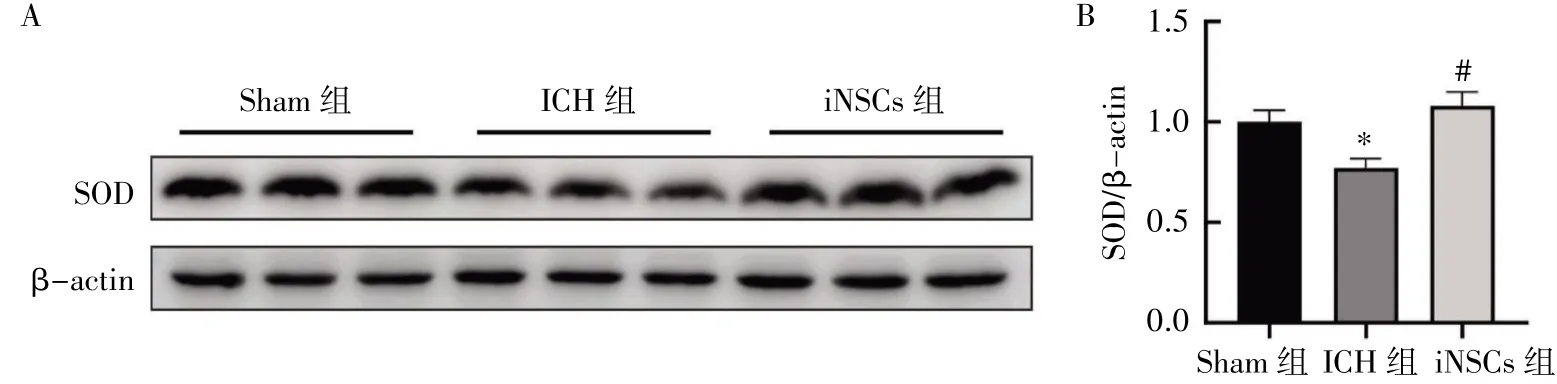
图7 iNSCs 移植对ICH 大鼠血肿周围SOD 蛋白表达的影响
3 讨论
ICH 是一种极具破坏性的脑血管病,一旦发生,会促使脑组织中的大量神经细胞死亡,引发神经炎症和神经功能障碍,继而导致患者偏瘫或死亡[22]。然而,当前常规的手术疗效有限,对于ICH 的长远治疗急需探寻新型理想的治疗手段。有研究[23]发现,神经干细胞具有免疫调节以及多向分化的潜能,能够向大脑损伤区分化为神经元和星形胶质细胞,帮助损伤区的神经网络重建,对于ICH 疾病的治疗表现出巨大的潜力。内源性NSCs 主要存在于大脑脑室下区和海马齿状回颗粒下区,数量较少,其临床应用受限[24]。有研究[25]利用干细胞多向分化的特性,将诱导性多能干细胞(induced pluripotent stem cells,iPSCs)诱导为神经嵴干细胞用于增强神经肌肉再生。并且MSCs 来源广泛,也具备向NSCs 分化的特性[18],提示可将MSCs 诱导分化为NSCs 用以弥补内源性NSCs 数量稀少等不足。以往的研究[20]发现,MSCs 诱导分化的iNSCs 在治疗神经损伤中具有较好的潜力。本研究重点观察了iNSCs 移植治疗ICH 大鼠的效果及其对损伤区神经元的影响,目前类似的研究较少。
Nestin、Sox-2 是神经干细胞的标志蛋白[26],GAP-43 是神经生长相关蛋白,在神经发育和轴突再生中具有重要意义[27]。本研究鉴定了iNSCs表达神经干细胞相关蛋白的情况,发现其高表达神经干细胞的标志蛋白Nestin、Sox-2 以及促进神经发育的GAP-43 蛋白,说明成功将间充质干细胞诱导成了具有神经干细胞特性的细胞。
纹状体内囊为常见的ICH 部位,内囊出血后通常引起严重运动神经功能障碍[28]。为了评价iNSCs 对ICH 大鼠的治疗效果,本课题组构建了大鼠纹状体出血模型后,将iNSCs 原位移植于ICH 大鼠内囊区。结果发现,iNSCs 移植能够改善ICH 大鼠的运动功能。
ICH 会引发神经元凋亡[29],Caspase-3 是细胞凋亡中的关键蛋白,Cleaved-Caspase-3 是其活性形式[30]。本研究将NeuN 与Cleaved-Caspase-3 共同标记用以观察各组神经元凋亡情况,结果发现,iNSCs 移植抑制了ICH 大鼠神经元的凋亡。同时,组织形态学结果表明,iNSCs 移植能够减轻ICH 造成的脑组织炎细胞浸润,促进损伤区受损神经元修复。以上结果均证明,iNSCs 移植可以通过保护损伤区神经元,进而促进ICH 大鼠神经功能恢复。
细胞过氧化损伤是ICH 的病理改变之一,SOD 是一种具有抗氧化应激特性的蛋白[31]。过表达铜锌超氧化物歧化酶(copper/zinc-superoxide dismutase,SOD1)的神经干细胞通过其旁分泌功能和抗氧化损伤能力发挥对ICH 大鼠的神经保护作用[32]。本研究发现,iNSCs 移植可提高ICH 大鼠大脑SOD 蛋白表达水平,说明iNSCs 可能通过良好的抗氧化功能发挥其神经元保护功能。
综上所述,iNSCs 可能通过发挥其抗氧化作用,抑制受损神经元凋亡,进而促进神经功能恢复。后续将进一步探讨iNSCs 发挥神经保护作用的具体机制。本研究结果将为今后临床应用iNSCs 移植治疗ICH 提供理论基础。
