小鼠腔前卵泡在淋巴结脱细胞支架中发育的研究
2023-06-05任贺贺吴梦静
任贺贺, 吴梦静, 常 青
(1.宁夏医科大学基础医学院,银川 750004; 2.宁夏医科大学生育力保持教育部重点实验室,宁夏回族自治区生殖与遗传重点实验室,银川 750004)
卵巢是女性重要的生殖与内分泌器官。在40 岁以下的女性中,1.0%~1.5%的女性因卵巢早衰(premature ovarian failure,POF)而面临提前绝经[1]。目前临床上对于卵巢早衰的治疗方法主要有激素疗法[2]。对于青春期前患者也采用卵巢组织冻存移植技术[3]。然而,激素疗法不能恢复POF患者的生育能力,同时具有潜在致癌风险,而卵巢组织冻存移植技术又有癌细胞回移至体内的风险[4]。因此,迫切需要一种安全有效的方法,恢复POF 患者的生育力和内分泌功能。组织工程卵巢重建有望解决这一问题[5]。近年来,细胞外基质(extracellular matrix,ECM)支架作为卵巢再生的方法在生殖医学领域引起了广泛的关注[6-10]。ECM是一种存在于细胞外的三维结构,由周围细胞分泌,主要由胶原蛋白、弹性蛋白、纤维连接蛋白和层粘连蛋白等组成[11-12]。细胞外基质支架一般由组织或器官脱细胞制作[13]。脱细胞化是通过物理、化学或组合方法从组织中去除细胞,只留下具有三维结构的细胞外基质支架[14-16]。已有报道[17]称ECM 支架可以与卵泡体细胞进行细胞信号传导,促进卵泡生长和分化,以及卵母细胞减数分裂能力。目前用于卵泡培养的ECM 支架多来源于异体的卵巢,这就存在免疫排斥的可能[2]。为了克服这个缺点,本研究选用自体腋下淋巴结作为ECM 支架的来源进行卵巢再生和观察支架的结构及毒性,并植入腔前卵巢观察卵泡的生长和功能。
1 材料与方法
1.1 实验动物
C57BL/6J 小鼠购自宁夏医科大学实验动物中心,在SPF 实验室饲养。本实验通过了宁夏回族自治区动物保护委员会的批准[SCXK(宁)2014-050]。
1.2 小鼠淋巴结的获取与脱细胞处理
收集8~10 周龄C57BL/6J 小鼠的淋巴结。分离剔除结缔组织和脂肪,用磷酸盐缓冲盐水(phosphate buffer saline,PBS)洗涤淋巴结,然后在-80 ℃冷冻以进行后续实验。
脱细胞过程如下所示,分别在-80 ℃和37 ℃进行3 次冷冻和解冻。将淋巴结分别用0.5%十二烷基磺酸钠(SDS,美国Sigma 公司)处理10 h和1% Triton X-100(美国Sigma 公司)处理24 h,置于室温下200 r·min-1的摇床上。之后,用50 mL DI-H2O 冲洗支架3 次,每次5 min,转移到新的50 mL DI-H2O 中,在室温下用摇床以200 r·min-1洗涤9 h。在37 ℃下,用脱氧核糖核酸酶Ⅰ(DNaseⅠ)溶液(40 IU·mL-1;美国Sigma 公司)处理30 min。然后用0.1%过氧乙酸消毒30 min,之后用含1% 100×青链霉素(美国Invitrogen 公司)的无菌PBS 洗涤24 h。将处理好的组织随后放到超低温冰箱进行保存,而用于再细胞化的淋巴结支架放于培养基中,之后在37 ℃、5% CO2的培养箱中放置24 h。
1.3 新鲜淋巴结与脱细胞淋巴结的形态分析
新鲜淋巴结、脱细胞淋巴结在4%多聚甲醛中固定6 h。常规脱水,石蜡包埋,连续切片,厚度为5 μm。石蜡切片常规脱蜡水合,苏木素染色1 min,盐酸乙醇分化3 s,流水冲洗15 min,伊红染色2 min,乙醇脱水,二甲苯透明封片。石蜡切片经脱蜡入水处理后,进行DAPI 染色(北京索莱宝科技有限公司,中国)检测组织中DNA 的残余量。封片剂(北京索莱宝科技有限公司,中国)干燥后,经荧光倒置显微镜(日本Olympus 公司)拍照观察上述组织结构。
为了观察脱细胞淋巴结的结构,脱细胞淋巴结预处理后,采用扫描电子显微镜(SEM,中国Servicebio 公司)对样品进行观察。
1.4 新鲜淋巴结与脱细胞淋巴结的DNA 含量分析
新鲜淋巴结与脱细胞淋巴结的样本经干燥冷冻机(美国Thermo 公司)干燥。使用电子天平(瑞士Mettle Ttoledo 公司)测量组织干重(G)。之后通过DNA 提取试剂盒(中国TianGen 公司)提取DNA。样本放入1.5 mL 离心管中,加入200 μL的蛋白酶K,56 ℃裂解3 h。余下提取步骤按说明书(DP304)执行。提取后的DNA 溶液(ng·mL-1)通过分光光度计NanoDropRND-1000(美国NanoDrop 公司)在480 nm 的波长下,测定DNA浓度(C)值,然后通过1.5% 琼脂糖凝胶电泳,每孔12 μL 的DNA 溶液与2 μL 上样缓冲液混合上样。DNA maker 采用1 kb DNA ladder(中国TianGen 公司)(80 V,70 min)。使用Azure C600对DNA 进行可视化和拍照(美国Azure Biosystems公司)。组织中DNA 的含量/干重(ng·mg-1)=(C×100/G)。C=脱细胞支架与新鲜淋巴结DNA 含量(ng·μL-1),每个测量样本的体积为100 μL,G=脱细胞支架与新鲜淋巴结的干重(mg)。
1.5 脱细胞淋巴结支架对细胞活性的影响
中国仓鼠卵巢细胞(CHO)在含有10%的胎牛血清(美国Invitrogen 公司)和1% 100×青链霉素的RPMI-1640 中培养。5×103(eus·mL-1)CHO细胞均匀铺在96 孔培养皿中,5% CO2、37 °C 培养24 h;24 h 后将脱细胞淋巴结支架切成小块放入各孔中;对照组CHO 细胞在无支架条件下培养。培养24、48、72 和96 h 后,分别添加10×CCK-8 溶液,培养4 h 后,在480 nm 的波长下测量各组的吸光度(A)值,计算细胞存活率。细胞存活率=[(As-Ab)/(Ac-Ab)]×100%。As 为含有细胞、培养基、CCK-8 和脱细胞支架孔的吸光度,Ab 为含有培养基和CCK-8 的孔的吸光度,Ac 为含有细胞、培养基和CCK-8 的孔的吸光度。
1.6 小鼠腔前卵泡的分离与注射
雌性C57BL/6J 小鼠出生后12.5 d,颈椎脱位处死。从肋骨脊角逐层切开皮肤和肌肉,露出卵巢。摘除卵巢后,立即将其置于操作培养基中洗涤3 次,该培养基含有L-15(美国Invitrogen 公司)、10%胎牛血清、1%青霉素。之后利用30 G注射针将小鼠的腔前卵泡剥离出来,分离后的卵泡在生长培养基中洗涤3 次,该培养基含有MEM-alpha(美国Invitrogen 公司)、0.33 mmol·L-1丙酮酸钠(瑞典Sigma 公司)、10%胎牛血清、1%青霉素、1% ITS(美国Invitrogen 公司)、100 mIU·mL-1FSH(中国宁波第二激素厂)。之后用内径大约200 μm 的玻璃管吸取70 μL 的包含5 个腔前卵泡的0.5%海藻酸盐溶液(瑞典Sigma 公司),之后将海藻酸盐包裹的卵泡注射到淋巴结内,最后将注射后的淋巴结放于140 mmol·L-1氯化钙溶液中进行交联反应。将支架用镊子夹出放于生长培养基中洗涤3 次后,将支架单独放置在96 孔板孔中,收集培养基上清液用于雌二醇(estradiol,E2)检测。收集再细胞化后的支架,检测CYP-17/A1 和FSHR 阳性的细胞。
1.7 观察再细胞化淋巴结支架内卵泡的形态
对再细胞化淋巴结进行HE 染色。组织在4%的多聚甲醛中固定6 h,常规脱水,石蜡包埋,连续切片至5 μm 厚。石蜡切片常规脱蜡水合,苏木素染色1 min,盐酸乙醇分化3 s,流水冲洗15 min,伊红染色2 min,乙醇脱水,二甲苯透明封片。采用TissueFAXS Viewer 软件(奥地利Tissue Gnostics公司)在第0、4、8、12 天测量再细胞化淋巴结中卵泡长轴和短轴的直径,取长轴与短轴的平均值作为支架中卵泡的直径。
1.8 再细胞化淋巴结支架分泌的E2 水平的检测
在培养再细胞淋巴结过程中,收集第0、4、8、12 天的培养基上清液,采用ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,中国)按试剂盒说明书操作,向孔中加入标准工作溶液和样品(每孔50 μL),每孔立即加入50 μL 生物素化检测Ab 工作液,37 °C 孵育45 min 后,洗涤3次后弃去洗涤液。每孔加入100 μL HRP 工作液,37 °C 孵育30 min。每孔加入90 μL 底物试剂,孵育约15 min,全程避光。加入50 μL 停止液后,在450 nm 处,立即测定每孔的光密度(OD)值。
1.9 再细胞化后淋巴结的免疫组化分析
组织在4%的多聚甲醛中固定6 h,常规脱水,石蜡包埋,连续切片,厚度为5 μm。石蜡切片常规脱蜡水合,微波法修复抗原。使用兔二步法试剂盒(北京中杉金桥生物技术有限公司,中国),之后孵育一抗,促卵泡刺激素受体(FSHR,1∶100,中国ABclonal 公司),17α-羟化酶(CYP-17/A1,1∶100,中国ABclonal 公司)37 ℃,60 min。然后按照说明操作。使用荧光倒置显微镜拍照观察上述组织结构和支架内卵泡样细胞CYP-17/A1和FSHR 的阳性表达情况。
1.10 统计学方法
所有数据使用SPSS 22.0 软件进行分析,图表由GraphPad Prism 8.0 软件绘制。计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 淋巴结脱细胞支架的形态学观察
与未脱细胞的淋巴结比较,淋巴结脱细胞后颜色由红色变为白色,呈半透明状,整体结构完整,器官体积变化不明显(图1a)。HE 染色见淋巴结经典的皮质和髓质结构,内部含大量的淋巴细胞(图1b)。淋巴结脱细胞支架内见网格状分布的纤维结构,未见到完整的细胞(图1c)。扫描电镜见支架内大量三维立体结构的细胞外基质纤维,纤维间形成小个空隙(图1d)。

图1 小鼠淋巴结脱细胞前后淋巴结的形态
2.2 脱细胞淋巴结支架细胞内容物的去除效率
为了进一步评估淋巴结组织中细胞内容物的去除情况,本研究对样本进行DAPI 染色。淋巴结脱细胞支架内见网格状分布的纤维结构,未见到完整的细胞。与新鲜淋巴结相比,脱细胞淋巴结的DNA 含量降低,去除率为88%[(1 390.0±248.6)ng·mg-1vs.(342.6±116)ng·mg-1](P<0.05)。此外,凝胶电泳证实脱细胞支架中DNA含量较低(图2c),无明亮的DNA 条带出现,见图2。
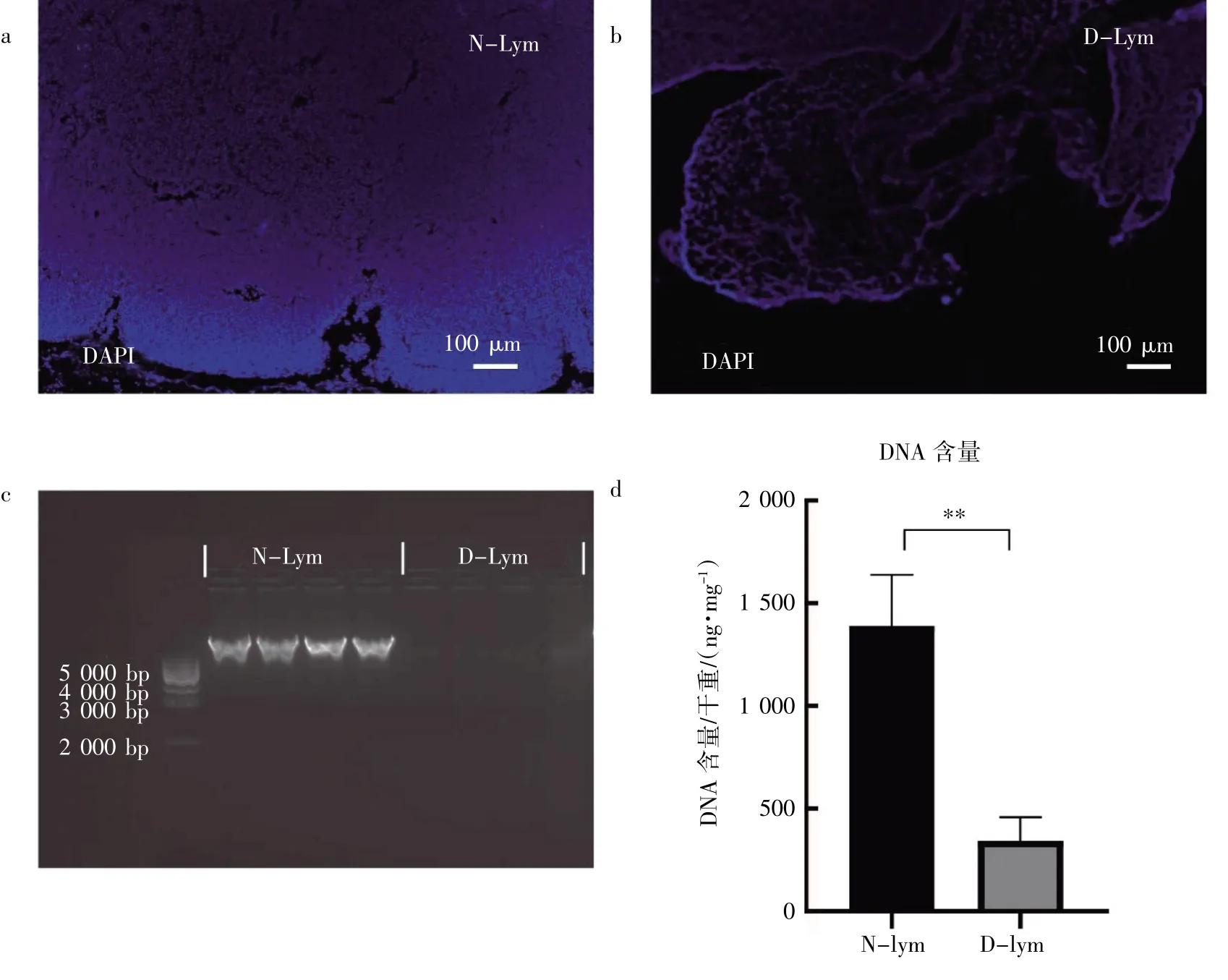
图2 小鼠脱细胞淋巴结支架细胞内容物的去除效率
2.3 脱细胞淋巴结支架对细胞活力的影响
CCK-8 检测小鼠淋巴结脱细胞支架在与CHO 共培养24、48、72 和96 h 后细胞活力的变化结果显示,对照组与脱细胞支架组的细胞活力24、48 和96 h 时差异均无统计学意义(P均>0.05),见图3。
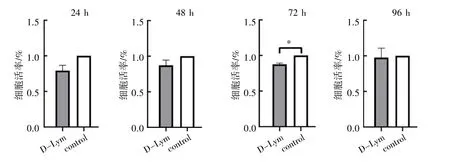
图3 脱细胞淋巴结支架对细胞活力的影响
2.4 再细胞化淋巴结支架内的卵泡形态
HE 染色后共培养第4、8、12 天后的再细胞支架结果显示,淋巴结内部的腔前卵泡从第0 天的2~3 层颗粒细胞逐步增殖到多层颗粒细胞。随着培养天数的增加,卵母细胞偏向卵泡的边缘,与卵巢内卵泡发育类似。但是随着颗粒细胞与膜细胞的增殖,卵泡内部细胞出现核碎裂或消失,见图4。
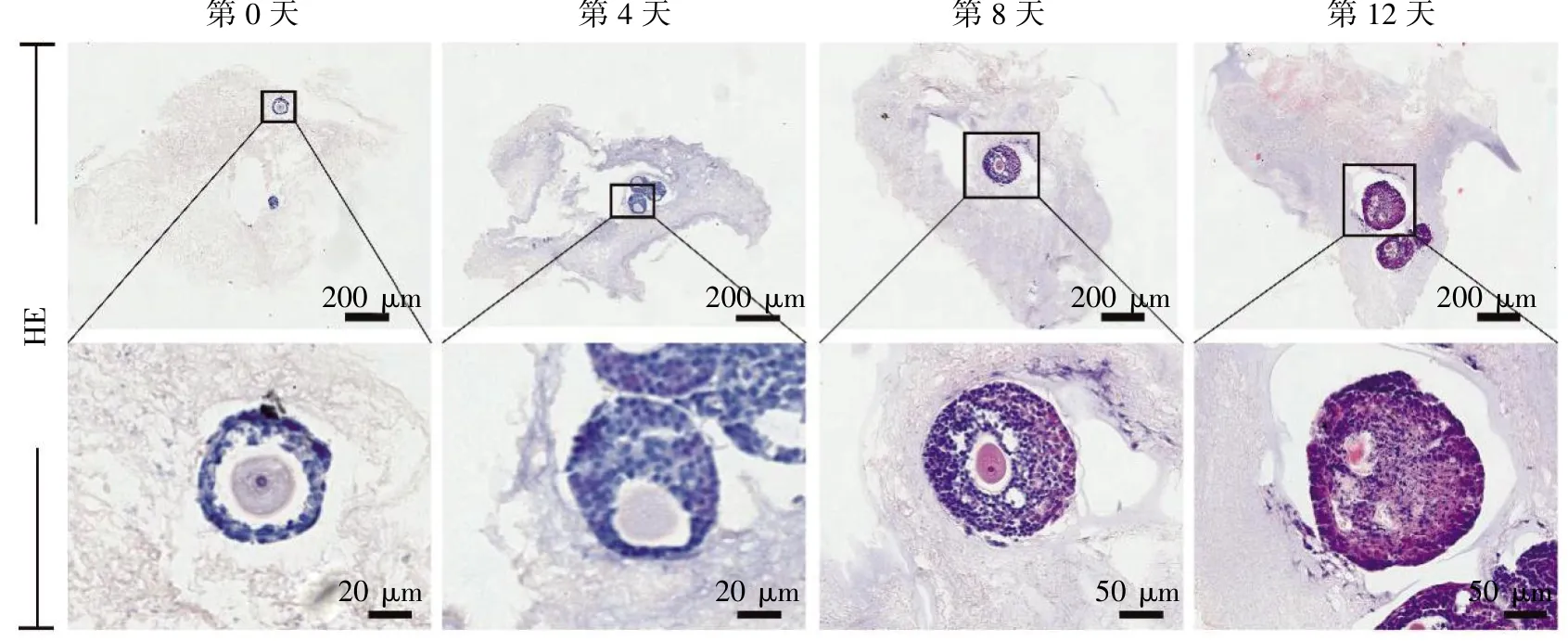
图4 共培养后再细胞化淋巴结支架中卵泡的形态
2.5 再细胞化淋巴结支架的卵泡直径与分泌的E2 水平比较
再细胞化淋巴结HE 染色后测量再细胞化淋巴结中卵泡的直径结果显示,第0、4 天的卵泡直径增长保持稳定,第8、12 天卵泡直径增长加速。培养到第12 天卵泡直径可达到(248.4±28.9)μm,第8、12 天卵泡直径均大于第0 天(P均<0.05),见表1。
表1 再细胞化后淋巴结的体外生长和E2 分泌情况(±s)

表1 再细胞化后淋巴结的体外生长和E2 分泌情况(±s)
与第0 天相比*P<0.05。
?
ELISA 法检测培养后第0、4、8、12 天的E2水平结果显示,第0、4 天的E2平均分泌量保持稳定,第8、12 天E2水平升高。与第0 天相比,第8、12 天的雌激素水平分泌量均增多(P均<0.05),见表1。
2.6 再细胞化淋巴结支架中CYP-17/A1 和FSHR 阳性细胞的检测
免疫组化检测显示卵泡在脱细胞淋巴结中的生长状态。培养到第12 天后,支架内卵泡直径可达到300 μm 以上,大于注射前的卵泡直径。并且第12 天后开始出现卵泡腔。此外,在再细胞支架中观察到FSHR 和CYP-17/A1 阳性细胞,见图5。
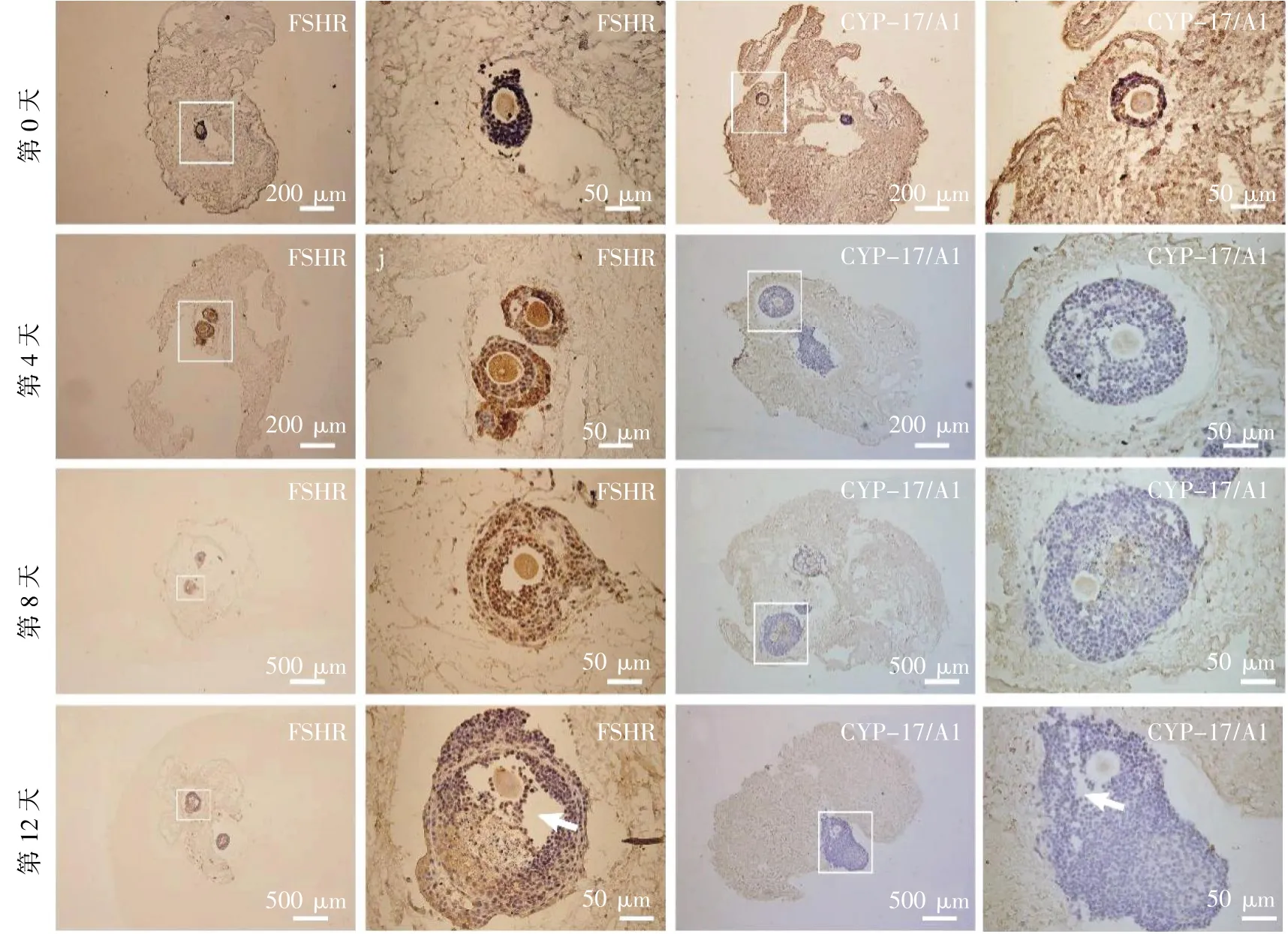
图5 再细胞化淋巴结支架中CYP-17/A1 和FSHR 阳性细胞的检测
3 讨论
组织工程卵巢对女性原发性卵巢功能不全(primary ovarian insufficiency,POI)患者的生育能力保存和恢复具有重要意义[18]。组织工程人工卵巢以患者自身细胞或干细胞为种子细胞来源,在异源或同种支架上播种,进行细胞培养,形成具有生殖功能的“人工卵巢”,最后移植入体内,恢复女性生殖内分泌功能[2]。
本研究使用0.5% SDS 振荡清洗联合反复冻融和核酸酶消化的方法制作淋巴结脱细胞支架,所形成的支架结构完整,有利于后期再细胞化和体内植入。显微结构显示支架内存在网格样分布的纤维以及纤维之间密集间隙,这为植入的细胞在细胞外基质之间的相互作用,并在空隙间迁移和生长提供了物理条件。Lenti 等[19]在构建淋巴结类器官的过程中也发现,脱细胞支架可以促进细胞迁移与增殖。也有研究[20]利用脱细胞淋巴结支架进行肾脏的再生。说明淋巴结脱细胞支架具有成为组织工程材料的基本特性,可为细胞的生长、增殖、迁移提供立体环境。
脱细胞支架中残余的DNA 是诱导不良免疫反应重要的物质[2],也会影响再细胞化后细胞的生长[21]。本研究通过DAPI 染色未在脱细胞淋巴结中发现细胞核的存在,并且通过DNA 定量分析发现脱细胞淋巴结的DNA 去除率为88%。DNA 去除率与其他研究[9]基本一致,达到组织工程DNA 残留量的要求,这表明脱细胞淋巴结支架可以为植入的细胞提供一个较低的无淋巴细胞干扰的培养环境,并可降低后续体内移植所引起的免疫反应。
由于脱细胞过程中使用SDS 去垢剂,残余量过高时会影响细胞的活力。本研究通过CCK-8检测脱细胞淋巴结支架对细胞活力的影响。结果表明,在支架与CHO 共培养的过程中,经过多次洗涤后,SDS 处理的支架对细胞活力的影响较小。24、48、96 h 与对照组的细胞活力保持相似。Alshaikh 等[8]也证明经SDS 去垢剂处理后的组织工程支架,经洗涤后也不会影响细胞的生长活力。这表明本研究中制作的支架适合卵巢细胞的生长。
本研究将小鼠的腔前卵泡注射到支架内后,经过HE 染色发现,支架内的卵泡可以维持一个球形立体的方式生长,卵泡中央为卵母细胞,卵母细胞外周是多层的颗粒细胞,颗粒细胞外侧见卵泡膜。随着培养时间的延长,卵泡逐渐增大,培养第12 天时卵泡的直径达到第0 天直径的2 倍多。这表明卵泡可以在脱细胞淋巴结支架内生长,并与卵巢内的生长模式相类似[22]。Nikniaz 等[23]也成功证明了卵泡在脱细胞支架中能够生长到腔前卵泡阶段。培养基中分泌的E2表明,随着培养天数的增加,再细胞化淋巴结中的卵泡可以合成雌激素且恢复一定的内分泌功能。
FSHR 主要在颗粒细胞中表达,与FSH 结合后刺激颗粒细胞中类固醇激素合成限速酶的表达,在卵泡发育与卵子成熟中有重要意义[4]。CYP-17/A1 在卵泡膜细胞中表达,主要在调节类固醇生成过程中起作用[24]。将腔前卵泡注入脱细胞淋巴结培养第12 天后,再细胞化淋巴结中发现FSHR 阳性和CYP-17/A1 阳性细胞,表明淋巴结支架中有维持卵母细胞发育成熟所需的关键细胞的存在,并且随着卵泡体积的增大出现卵泡腔样的结构,与体内卵泡发育情况相似[25]。因此,本实验的脱细胞淋巴结支架可以支持小鼠腔前卵泡的体外生长。
本研究仍存在部分缺点需要改进。与体外第3 天培养的卵泡相比[26],支架内的卵泡虽然能保持一个发育的状态,但其内部结构出现一定的核固缩等凋亡现象。这可能由于支架的阻碍,细胞无法有效地与培养基进行互换。因此寻找一种合适的培养方法很重要。未来使用一种微流装置进行动态培养可能会有改善效果[27]。
综上所述,淋巴结脱细胞后形成细胞外基质支架,可以支持小鼠腔前卵泡的生长并具有内分泌功能,可作为组织工程材料用于人工卵巢的构建。
