地西他滨通过甲基化调控DU145 细胞中miR-3064-5p 的表达
2023-06-05杨晓莹胡东来楚元奎
杨晓莹, 胡东来, 李 元, 杨 华, 楚元奎,2
(1. 宁夏医科大学临床医学院,银川 750004; 2. 宁夏医科大学总医院医学实验中心,银川 750004)
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一。2020 年,全球有近140 万PCa 新发病例,37.5 万人因PCa 死亡[1]。在中国男性癌症患者中,PCa 的发病率排名第6(8.16%),病死率排名第七(13.61%)[2]。目前,前列腺特异性抗原(prostate specific antigen,PSA)筛查[3]结合影像学检查有效地增强了PCa 的临床诊断效果[4]。但雄激素受体的变异和PCa 的耐药及转移等使其诊断、预后和治疗变得更难。因此进一步揭示PCa 的分子发病机制,寻找新的更加有效地诊断和治疗靶点对于PCa 的临床诊治具有积极意义[5]。
MicroRNAs(miRNAs)是一类非编码RNA,可通过识别靶基因3’-非翻译区的互补序列导致mRNA 降解或抑制蛋白的翻译,包括PCa 在内的一些恶性肿瘤的起始和进展与miRNAs 的异常表达密切相关[6]。miR-30 和miR-214-5p 可抑制前列腺癌细胞的增殖、转移和上皮间充质转化[7-8]。已知miR-3064-5p 在肝癌、胃癌、宫颈癌等多种癌症中表达下调,并发挥抑癌作用[9-11]。作为抑癌分子的miR-3064-5p 在多种癌症中表达下调,其机制尚未见报道。有研究[12]表明,包括DNA 甲基化、组蛋白修饰等在内的表观遗传学修饰调控着癌症进展中抑癌分子的表达。DNA 甲基化修饰可通过增强miRNAs 启动子内CpG 区域的甲基化,导致miRNAs 的表达下调[13-14]。一些抑癌miRNAs,如miR-27a、miR-141 和miR-200C 已被证明在PCa 中呈高甲基化状态[15-16]。
课题组前期研究[17]证实,miR-3064-5p 在PCa细胞中的表达降低。生物信息学分析发现,miR-3064-5p 启动子区存在CpG 岛,提示其可能受到了DNA 甲基化调控的影响。本研究通过使用去甲基化药物地西他滨(decitabine,DAC)处理PCa细胞,甲基化特异性PCR(methylation-specific PCR,MSP)和qRT-PCR 检测miR-3064-5p 启动子的甲基化状态和表达水平,明确PCa 细胞中miR-3064-5p 的沉默是否与甲基化调控有关,以期为后续miR-3064-5p 的相关抗肿瘤研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人前列腺癌细胞22RV1、DU145、PC3 细胞及正常前列腺细胞RWPE-1 购自中国科学院典型培养物保藏委员会细胞库。
1.1.2 试剂 RPMI1640 培养基和DMEM 高糖培养基购自上海源培生物科技股份有限公司;胎牛血清购自以色列Biological Industries 公司;DAC购自上海蓝木化工有限公司;二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;Lipofectamine 2000 transfection kit、TRNzol A-RNA 提取试剂盒购自Invitrogen 公司;逆转录试剂盒、荧光定量PCR 试剂盒购自南京诺唯赞生物科技股份有限公司;全蛋白提取试剂盒、BCA 蛋白浓度测定试剂盒购自江苏凯基生物技术股份有限公司;血液/细胞/组织基因组DNA 提取试剂盒、重亚硫酸盐转化试剂盒、Golden Easy PCR System 产品购自天根生化科技(北京)有限公司;E-Cadherin、Vimentin和PCNA 抗体购自Santa Cruz 公司;β-Actin、GAPDH、DNMT3B、山羊抗兔IgG-HRP、山羊抗鼠IgG-HRP 购自Proteintech 公司;miR-3064-5p 模拟物(mimics)和阴性对照(NC)由广州锐博生物技术有限公司合成;引物均由生工生物工程(上海)股份有限公司合成。
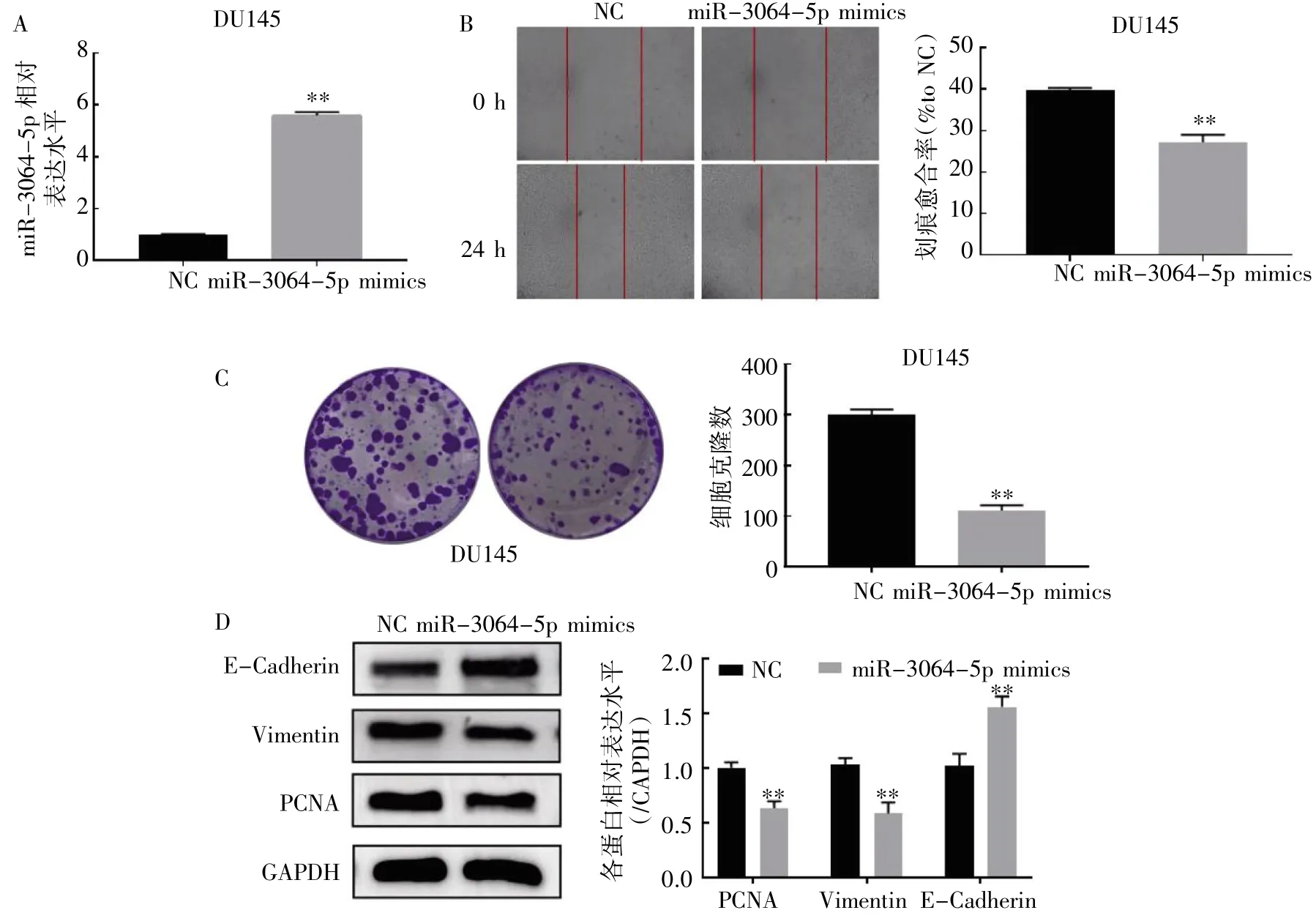
图1 过表达miR-3064-5p 对DU145 细胞增殖迁移能力的影响
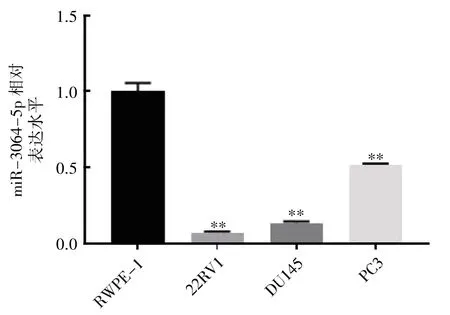
图2 miR-3064-5p 在正常前列腺上皮和前列腺癌细胞中的表达
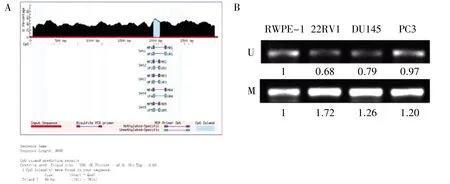
图3 miR-3064-5p 启动子甲基化分析

图4 DAC 对DU145 细胞中miR-3064-5p 启动子甲基化水平的影响
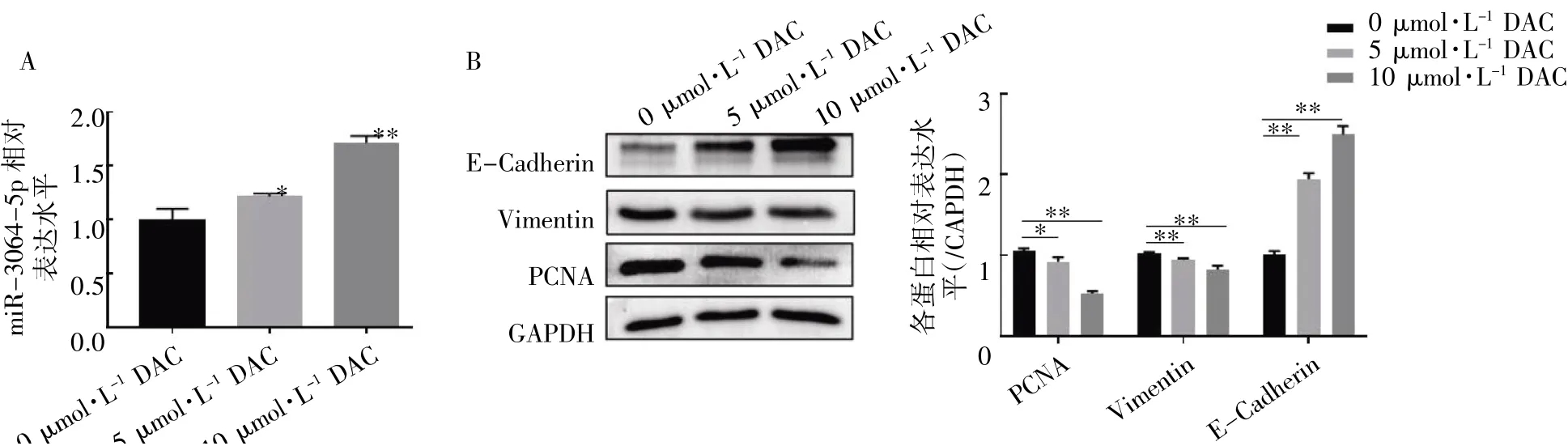
图5 DAC 通过DNA 甲基化对DU145 细胞中miR-3064-5p 的影响
1.2 方法
1.2.1 细胞培养与处理 DU145 和PC3 细胞使用RPMI1640 培养基培养;22RV1 细胞使用DMEM高糖培养基培养;RWPE-1 细胞使用KSFM 培养基培养。细胞置于37 ℃、5%CO2培养箱中培养,取对数生长期细胞进行后续实验。细胞转染以及药物处理:1)使用Lipofectamine 2000 试剂进行细胞转染,所有操作均按照试剂盒说明书要求进行。2)将DAC 溶于DMSO 配制成储存液,使用前加入完全培养液配制成浓度为5 μmol·L-1和10 μmol·L-1的工作液。
1.2.2 qRT-PCR 检测 TRizol 法提取各组细胞总RNA,NanoDrop one 分光光度计(Gene 公司)测定总RNA 浓度,使用逆转录试剂盒和ChamQ SYBR qPCR Master Mix 试剂盒(南京诺唯赞医疗科技有限公司)对RNA 样品进行反转录和PCR 检测,具体操作参照试剂盒说明书进行。使用StepOne 荧光定量PCR 仪进行PCR 扩增。PCR 反应体系20 μL,反应条件:95 ℃,5 min;95 ℃,15 s;58 ℃,15 s;70 ℃,15 s;共40 个循环。2-ΔΔCt法计算基因的相对表达量,以U6 作为内参对照。miR-3064-5p、U6 反转录引物和扩增引物序列见表1、表2。
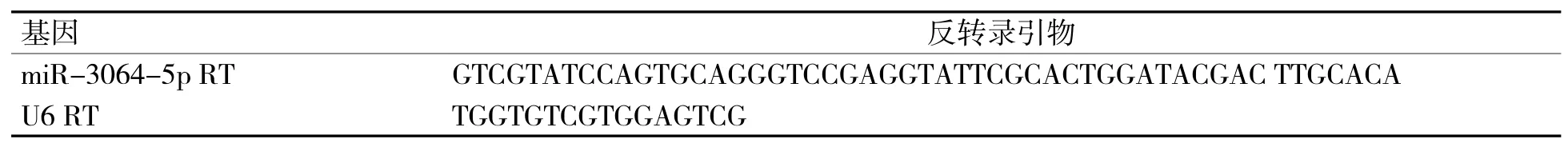
表1 反转录引物序列

表2 PCR 扩增引物序列
1.2.3 生物信息学分析 使用UCSC 基因组数据库(http://genome.ucsc.edu)提取miR-3064-5p启动子3 000 bp 的基因序列,以在线软件(https://www.genscript.com/sms2/cpg_islands.html)分析miR-3064-5p 上游3 000 bp 的启动子区域的CpG 岛。使用Methprimer 在线软件(http://www.urogene.org/methprimer/)在CpG 岛区域内设计甲基化和非甲基化检测引物。
1.2.4 DNA 的提取 使用血液/细胞/组织基因组DNA 提取试剂盒提取细胞总DNA,具体操作步骤参照试剂盒说明书。使用NanoDrop one 分光光度计测定总DNA 浓度。
1.2.5 DNA 重亚硫酸盐转化 使用重亚硫酸盐转化试剂盒对所得细胞的总DNA 进行亚硫酸盐修饰,具体操作步骤参照试剂盒说明书。
1.2.6 甲基化特异性PCR(MSP) 使用Golden Easy PCR System 产品,对重亚硫酸盐处理的DNA 样品进行PCR 检测。PCR 反应体系20 μL,反应条件:95 ℃,4 min;95 ℃,15 s;58 ℃,15 s;72 ℃,15 s;72 ℃,10 min;共35 个循环。取15 μL 反应产物,琼脂糖凝胶电泳检测(110 V,20 min)。Image J 测量各基因的相对表达量,GAPDH 作为内参。GAPDH 等扩增引物见表2。
1.2.7 平板克隆实验 将转染48 h 后的DU145细胞制成单细胞悬液,以300 个/孔的密度接种于6 孔板中。置于培养箱中,连续培养10 d。多聚甲醛固定细胞,结晶紫染色,计数>100 个细胞的克隆数。
1.2.8 划痕实验 取对数生长期的DU145 细胞接种于6 孔板中,每孔2×105个细胞,转染24 h后使用枪头对各孔平行画线,PBS 洗后加入新鲜培养液继续培养24 h 后,对各孔细胞于指定位置进行拍照,Image J 测量细胞迁移面积并进行统计学分析。
1.2.9 Western blot 检测 收集DAC 处理和转染的DU145 细胞,Western blot 法检测E-Cadherin、Vimentin、PCNA、DNMT3B、GAPDH 的表达。操作如下:使用试剂盒提取细胞总蛋白,蛋白定量检测(BCA)法测定蛋白含量,每组各取40 μg 蛋白进行SDS-PAGE 电泳,湿转至PVDF 膜,5% 脱脂奶粉溶液封闭,加入一抗4 ℃孵育过夜,TBST 漂洗,二抗室温孵育2 h,TBS-T 漂洗,ECL 化学发光试剂显影,照相,Image J 软件测量各条带灰度值。
1.3 统计学方法
使用Graphad Prism 8.0 和SPSS 19.0 分析软件对相关数据进行统计学分析。计量资料以均数±标准差(±s)表示。两组间比较采用t检验,多组间比较采用方差分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 过表达miR-3064-5p 降低DU145 细胞的增殖和迁移能力
qRT-PCR 检测miR-3064-5p mimics 的转染效果。结果显示,与NC 组相比,转染miR-3064-5p mimics 48 h 后,DU145 细胞中miR-3064-5p的表达水平增强(图1A)。划痕愈合实验、克隆形成实验和Western blot 实验。结果显示,与NC 组相比,miR-3064-5p 转染组DU145 细胞的迁移能力和克隆形成能力降低(图1B、图1C);miR-3064-5p 转染组PCNA 和Vimentin 的表达均降低,E-Cadherin 的表达升高(图1D)。
2.2 miR-3064-5p 在正常前列腺上皮和前列腺癌细胞中的表达
qRT-PCR 检测各细胞中miR-3064-5p 的表达结果显示,与正常前列腺上皮细胞RWPE-1细胞相比,前列腺癌细胞株中miR-3064-5p 的表达均下调(P均<0.01),见图2。
2.3 miR-3064-5p 启动子甲基化分析
使用UCSC 网站预测结果显示,miR-3064-5p 启动子区存在1 个CpG 岛(图3A)。MSP 检测结果显示,与正常前列腺上皮细胞相比,22RV1、DU145 和PC3 细胞中miR-3064-5p 启动子甲基化水平增强(图3B)。
2.4 DAC 对DU145 细胞中miR-3064-5p 启动子甲基化水平的影响
MSP 结果显示,DAC 处理后,DU145 细胞中miR-3064-5p 启动子甲基化特异性产物减少(图4A),Western blot 检测DNMT3B 的表达结果显示,DAC 处理后,DNMT3B 的表达降低(图4B)。
2.5 DAC 恢复了DU145 细胞中miR-3064-5p的表达和作用
qRT-PCR 检测结果显示,与0 μmol·L-1组相比,5 μmol·L-1和10 μmol·L-1DAC 处理的DU145 细胞中miR-3064-5p 的表达均升高(P均<0.05),并且在本研究剂量范围内,随着DAC浓度升高,miR-3064-5p 的表达也随之增强(图5A)。Western blot 结果显示,DAC 处理后,PCNA和Vimentin 的表达均降低,E-Cadherin 的表达增强(P均<0.05),并且随着DAC 处理浓度升高,PCNA 和Vimentin 的表达逐渐降低,E-Cadherin的表达则逐渐增强(图5B)。
3 讨论
PCa 在男性全球癌症发病率中排名第2,是男性癌症相关死亡的主要原因[1]。目前对PCa 的治疗方法,包括前列腺切除术、放疗和雄激素剥夺治疗(ADT)等,提高了存活率,但晚期PCa 治疗效果仍然较差。因此,开发针对PCa 的额外疗法具有重要意义。
miRNAs 是一种内源性非编码小分子,通过降解mRNAs 和抑制蛋白质合成来影响细胞的生物过程。研究[18]发现,miRNAs 影响着癌症发生发展的全过程,并且在多种癌症中被作为潜在的诊断和预后标记物。miR-30 可靶向PCa 中重要的致癌基因ERG,过表达miR-30 可抑制PCa 细胞的迁移和侵袭[7]。近年来,miR-3064-5p 作为抑癌基因在恶性肿瘤的发生、发展中发挥着重要作用,其表达在癌症的发生发展过程中存在失调,它的异常表达可参与肿瘤细胞的增殖和迁移[9-11]。有研究[9]报道,miR-3064-5p 在肝癌中低表达,可靶向HMGA2 来抑制HCC 的恶性进展;miR-3064-5p 在胃癌阿霉素耐药细胞中表达下调,过表达miR-3064-5p 逆转了对胃癌细胞的阿霉素耐药性和肿瘤进展的影响[10]。miR-3064-5p 作为一种抑癌分子,在多种癌中表达降低的调控机制报道较少。本课题组前期研究[17],发现miR-3064-5p 具有抑制PCa 细胞增殖和迁移的能力,与正常前列腺上皮细胞RWPE-1 相比,miR-3064-5p在22RV1、DU145 和PC3 细胞中的表达均降低。PCa 细胞中miR-3064-5p 表达降低而促进PCa进展的机制是本课题组关注的焦点。
DNA 甲基化、组蛋白修饰和染色质重塑的转录调控的表观遗传修饰驱动了前列腺的癌变[19]。PCa 的进展、神经内分泌转分化和治疗反应均受到表观遗传学的调控[20]。包括PCa 在内的许多癌症的异常是由DNA 甲基化调控miRNAs 的表观遗传变化引起的[21]。在PCa 中,miR-27a-5p 启动子被DNA 甲基化调控,其表达被沉默,从而刺激癌细胞增殖和存活,促进了PCa 的恶性进展[15]。本研究探究了miR-3064-5p 在PCa 细胞中表达沉默是否与DNA 甲基化调控有关,课题组使用生信软件预测miR-3064-5p 启动子区存在CpG岛,MSP 检测证实PCa 细胞中miR-3064-5p 启动子区的甲基化水平高于前列腺上皮细胞,因此推断miR-3064-5p 可能受到甲基化的调控。为进一步明确miR-3064-5p 启动子区的高甲基化状态与其低表达有关,DAC 处理DU145 细胞后,MSP 检测结果表明DAC 处理后miR-3064-5p启动子区的甲基化水平降低,Western blot 检测甲基化转移酶DNMT3B 蛋白表达降低,qRTPCR 检测发现miR-3064-5p 表达增强,并呈浓度依赖性升高。有研究[22]报道,miR-193b 启动子的高甲基化有助于侵袭性PCa 的进展,通过DNMT 抑制剂(DAC)和HDAC 抑制剂治疗可以恢复miR-193b 的表达从而抑制肿瘤的进展。本课题组使用Western blot 检测也发现对于miR-3064-5p 的重新激活,DAC 恢复了其对PCa 细胞增殖和迁移的抑制能力。上述结果证实,PCa 细胞中miR-3064-5p 的低表达确实与其启动子区的高甲基化状态有关,使用去甲基化药物DAC 可通过降低miR-3064-5p 启动子区的甲基化水平促进其表达,从而恢复它的抑癌能力。
本研究结果进一步揭示了PCa 细胞中miR-3064-5p 的表达调控机制,将有助于更好地阐释miR-3064-5p 的抑癌作用和机制,为未来表观遗传抑制剂或合成miR-3064-5p 模拟物作为治疗前列腺恶性肿瘤的辅助治疗提供了实验依据。
