基于脾虚湿阻研究佐剂性关节炎大鼠模型炎性因子、钠钾ATP酶及病理组织学变化
2023-05-30刘德芳张耀雷刘碧莹李莞刘涛郭明阳晏姣
刘德芳 张耀雷 刘碧莹 李莞 刘涛 郭明阳 晏姣


【摘 要】目的:建立基于脾虛湿阻环境下的佐剂性关节炎(AA)大鼠模型,观测其炎性关节的炎性因子、脾脏钠钾ATP酶(Na+,K+-ATPase)表达及关节的病理组织学变化。方法:将30只Wistar大鼠按照随机数字表法分为模型组、AA对照组、空白对照组,每组10只。模型组在脾虚湿阻环境下复制AA大鼠模型,AA对照组在常温常湿下复制AA模型,空白对照组给予常温常湿环境喂养。28 d后,观察大鼠的进食量、精神状态、毛发、关节肿胀度、活动情况,以及关节的病理组织学;检测血常规,炎性关节的白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)表达及脾脏的Na+,K+-ATPase活性。结果:与对照组比较,模型组大鼠精神萎靡,进食量减少,部分大鼠腹泻,毛发失去光泽,关节肿胀,部分足底部溃烂,活动迟缓或跛行;模型组大鼠关节的病理组织学表现为滑膜组织中大量淋巴细胞、浆细胞、巨噬细胞等炎性细胞浸润,滑膜增生呈多层化,纤维血管翳形成。血小板计数、中性粒细胞比率和单核细胞比率明显升高(P < 0.05),淋巴细胞比率明显降低(P < 0.05),IL-6、TNF-α、VEGF表达明显升高(P < 0.05),Na+,K+-ATPase活性减退(P < 0.05)。结论:模型组大鼠表现出关节明显肿胀,足底部溃烂,饮食量减少,大便溏泻,Na+,K+-ATPase活性减退,类同于中医痹病脾虚湿阻的范畴,血细胞计数、比率和IL-6、TNF-α、VEGF等异常表达,以及关节的病理组织学表现与类风湿关节炎患者表现一致。
【关键词】 类风湿关节炎;佐剂性关节炎;动物模型;炎性因子;钠钾ATP酶;大鼠
Study on Inflammatory Factors,Na+,K+-ATPase and Histopathological Changes of Adjuvant Arthritis Rat Model Based on Spleen Deficiency and Dampness Obstruction
LIU De-fang,ZHANG Yao-lei,LIU Bi-ying,LI Wan,LIU Tao,GUO Ming-yang,YAN Jiao
【ABSTRACT】Objective:To establish rat models of adjuvant arthritis(AA)based on the environment of spleen deficiency and dampness obstruction,and observe the inflammatory factors of its inflammatory joints,the expression of sodium potassium ATPase(Na+,K+-ATPase)in the spleen and the pathological changes of the joints.Methods:Thirty Wistar rats were randomly divided into a model group,an AA control group and a blank control group,with 10 rats in each group.The model group reproduced the AA rat model in the environment of spleen deficiency and dampness construction,the AA control group reproduced the AA model at normal temperature and humidity,and the blank control group was fed at normal temperature and humidity.After 28 days,
observe the rats' food intake,mental state,hair,joint swelling,activity,and joint histopathology,detect blood routine,IL-6,TNF-α,expression of VEGF and activity of Na+,K+-ATPase in spleen.Results:Compared with the control group,the rats in the model group suffered from mental depression,decreased food intake,diarrhea(some rats),loss of luster in hair,joint swelling,partial foot ulceration,slow movement or lameness;the pathological histology of the joints in the model group showed that a large number of inflammatory cells such as lymphocytes,plasma cells and macrophages infiltrated the synovial tissue,the synovial hyperplasia was stratified,and the fibrous pannus were formed.Platelet count,neutrophil ratio and monocyte ratio increased significantly(P < 0.05),lymphocyte ratio decreased significantly(P < 0.05),the expressions of IL-6,TNF-α and VEGF were significantly increased(P < 0.05),and the activity of Na+,K+-ATPase
was decreased(P < 0.05).Conclusion:The rats in the model group showed obvious joint swelling,foot ulceration,reduced diet,loose stool,decreased Na+,K+-ATPase activity,similar to the category of bi disease of spleen deficiency and dampness construction in traditional Chinese medicine.The abnormal expressions of blood cell count and ratio,IL-6,TNF-α and VEGF and the histopathological manifestations of joints were consistent with those of patients with rheumatoid arthritis.
【Keywords】 rheumatoid arthritis;adjuvant arthritis;animal model;inflammatory factors;Na+,K+-ATPase;rats
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为主的系统性自身免疫性疾病,主要表现为多关节肿痛、晨僵及多系统受累。我国RA患病率为0.34%~0.42%[1],患病人数达500万,而且高湿环境下居民发病率明显高于其他地区[2]。RA病因及发病机制目前尚不清楚。《黄帝内经》曰:“正气存内,邪不可干;邪之所凑,其气必虚。”因此,本研究基于脾虚的内环境及高湿的外环境即脾虚湿阻条件下建立佐剂性关节炎(AA)大鼠模型,观察其炎性因子、钠钾ATP酶(Na+,K+-ATPase)以及关节的病理组织学变化,现总结如下。
1 实验材料
1.1 实验动物 选取Wistar健康雄性大鼠30只,体质量150~180 g,均为SPF级实验动物,由成都达硕实验动物有限公司提供,实验动物生产许可证号SCXK(川)2015-030。
1.2 实验仪器 智能人工气候箱(RXZ-10000A,宁波市科技园区新江南仪器有限公司);加湿器(YC-D205,亚都);动物麻醉机(R580S,RWD Life Science);台式低温高速离心机(Thermo ST16R,美国热电公司);超低温冰箱(MDF-U53V,日本松下公司);血细胞分析仪(BC 6900,深圳迈瑞生物医疗电子股份有限公司);酶标仪(Multisan,美国热电公司);Real-time检测仪(ABI公司);低温冷冻离心机(上海卢湘仪离心机仪器有限公司);旋涡振荡器(青浦泸西仪器厂);电动匀浆机(FLUKO);液氮容器(东亚医疗电子器械公司);正置显微镜(德国Leica公司);生物安全台(BSC-130011A2,苏州安泰空气技术有限公司)。
1.3 实验试剂 弗氏完全佐剂(Sigma F5881);异氟烷(瑞沃德生命科技有限公司);大鼠IL-6 ELISA试剂盒、大鼠TNF-α ELISA试剂盒、大鼠VEGF ELISA试剂盒((ExCell Bio);苏木素-伊红染色液(Harris,珠海贝索生物技术有限公司);超微量ATP酶测试盒(南京建成生物工程研究所);RIPA裂解液(碧云天)。
2 实验方法
2.1 动物分组和造模 按照随机数字表法将30只大鼠随机分为模型组、AA对照组和空白对照组,每组10只。
模型组大鼠每日灌服油脂1 g·(100 g)-1,并置于高湿环境中喂养(人工气候箱,每天刺激8 h),相对湿度(90±4)%,温度(24±2)℃,持续2周后,采用体积分数为75 %的乙醇对左、右后足跖进行消毒,然后左、右后足跖皮下分别注射0.15 mL·kg-1的弗氏完全佐剂(CFA),21 d后等剂量加强免疫1次。AA对照组同样给予每只大鼠左、右后足的足跖部各皮下注射0.15 mL·kg-1的CFA,21 d后等剂量加强免疫1次,并置于常温常湿环境喂养,相对湿度(60±4)%,温度(24±2)℃。空白对照组仅给予常温常湿环境喂养,相对湿度(60±4)%,温度(24±2)℃。
2.2 标本收集及制备 造模后第28天,将大鼠置于麻醉机里麻醉,仰卧固定手术台,碘伏消毒,用手术剪沿腹正中线剪开腹腔,消毒棉签轻轻扒开血管周围组织,直到清晰看见腹主动脉,采血针以30°左右角度进针采血。分别用浅紫色头盖(血常规管)和黄色头盖真空管(生化管)各采1管,完整取下脾脏、左后肢膝关节及其以下部分。浅紫色头盖管即送检血常规。黄色头盖管静置1 h后离心,吸上清保存-80 ℃冰箱。每组随机取2只关节用甲醛固定,其余关节和脾脏采用锡箔纸包裹保存于-80 ℃冰箱。
2.3 观察指标
2.3.1 大鼠一般情况的观测 观察大鼠的进食量、精神状态、毛发、关节肿胀度及活动情况。
2.3.2 大鼠关节的病理组织学观察 按照常规操作方法进行透明及浸蜡→包埋→切片→展片与粘片→烤片→HE染色→封片→光学显微镜下观察,与空白对照组进行对照,观察模型组、AA对照组大鼠的关节组织学变化。
2.3.3 血常規的检测 采用血细胞分析仪检测血常规。
2.3.4 骨关节IL-6、TNF-α、VEGF的检测
2.3.4.1 组织匀浆的提取 在无菌操作平台上,大鼠左后肢关节常温解冻后,首先取下足跖部软组织,置于-80 ℃冰箱保存,然后去除周围附着的组织,称取处理后的骨关节10 g,液氮冷冻,组织粉碎机粉碎,加入裂解液1.5 mL,组织匀浆机匀浆,离心,吸出上清,再离心,取上清,置于-80 ℃冰箱保存。
2.3.4.2 采用酶联免疫吸附法(ELISA)检测 按照ELISA法进行检测,具体步骤:①取出试验所需板条。②空白孔加标准品,其余相应孔中加不同浓度标准品(每孔100 μL),用封板胶纸封住反应孔,37 ℃孵箱孵育90 min。③提前20 min准备生物素化抗体工作液;洗板5次。④空白孔加生物素化抗体稀释液,其余孔加入生物素化抗体工作液(每孔100 μL)。用新封板胶纸封住反应孔,37 ℃孵箱孵育60 min。⑤提前20 min准备酶结合物工作液。避光室温22~25 ℃放置;洗板5次。⑥空白孔加酶结合物稀释液,其余孔加入酶结合物工作液(每孔100 μL)。用新封板胶纸封住反应孔,37 ℃孵箱,避光孵育30 min。⑦打开酶标仪电源,预热仪器,设置好检测程序;洗板5次。⑧加入显色底物(TMB)每孔100 μL。避光37 ℃孵箱,避光孵育15 min。⑨加入终止液每孔100 μL,混匀后即刻测量OD450值(3 min内)。
2.3.5 脾脏组织Na+,K+-ATPase的检测
2.3.5.1 样本的准备 电子天平称取2 g脾脏组织加入2 mL裂解液,离心机以2500 r·min-1离心10 min,离心半径8 cm。取上清液100 μL,再加入900 μL生理盐水。即得到1%的组织匀浆液。
2.3.5.2 试剂的配制与操作 按照检测说明书,第一步进行基质液的配制,第二步定磷。
2.4 统计学方法 采用SPSS 25.0软件进行统计分析。计量资料符合正态分布以表示,组间比较采用成组样本t检验;计数资料采用χ2检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 3组大鼠一般情况比较 与空白对照组比较,AA对照组大鼠表现出精神萎靡,进食量减少,部分大鼠腹泻,毛发失去光泽,关节肿胀,有些出现足底部溃烂,活动减缓等;与AA对照组比较,模型组大鼠的精神更加萎靡,进食量更少,毛发光泽度更差。见图1。
3.2 3组大鼠关节病理组织学情况 组织病理学显示,空白对照组无炎性细胞浸润,无纤维组织增生和组织破坏。AA对照组大量的淋巴细胞、浆细胞等炎性细胞浸润,但是无血管翳形成。模型组滑膜组织中大量淋巴细胞、浆细胞、巨噬细胞等炎性细胞浸润,滑膜增生呈多层化,纤维血管翳形成。见图2。
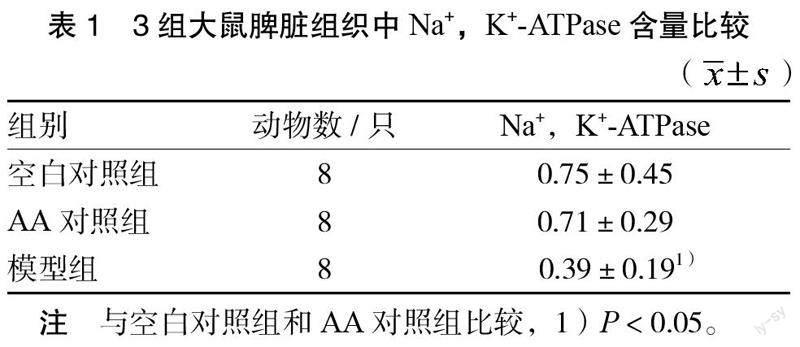
3.3 3组大鼠脾脏组织Na+,K+-ATPase的含量变化情况 Na+,K+-ATPase含量的标本数来源于8只大鼠,另外2只用于病理组织学检测。模型组大鼠脾脏组织Na+,K+-ATPase含量较AA对照组和空白对照组均明显降低(P < 0.05)。见表1。
3.4 3组大鼠血细胞水平比较 模型组白细胞计数(WBC)较AA对照组明显降低(P < 0.05),但皆在正常范围,与空白对照组比较,差异无统计学意义(P > 0.05)。模型组血小板、中性粒细胞比率、淋巴细胞比率、单核细胞比率与AA对照组比较,差异均无统计学意义(P > 0.05),血小板、中性粒细胞比率、单核细胞比率较空白对照组明显升高,淋巴细胞比率较空白对照组明显降低,差异有统计学意义(P < 0.05)。见表2。
3.5 3组大鼠骨关节IL-6、TNF-α、VEGF的变化情况 模型组大鼠骨关节组织IL-6、TNF-α、VEGF的表达水平与AA对照组比较,差异均无统计学意义(P > 0.05),較空白对照组明显升高,差异有统计学意义(P < 0.05)。见表3。
4 讨 论
RA属中医学“痹证”范畴,以风寒湿三气杂至为致病的外在条件,但正气虚衰则是本病的内在因素。《素问·百病始生篇》说:“风雨寒热不得虚,邪不能独伤人,卒然逢疾风暴雨而不病者,盖无虚,故邪不能独伤人,此必因虚邪之风,与其身形,两虚相得,乃客其形。”RA的外因多责之于湿邪,《景岳全书·湿证》云:“湿之为病……在经络则为痹……。”其内因离不开肺脾肾等脏腑功能失调,尤其与脾虚水湿不化密切相关。《中风历节病脉证并治第五》第7条曰:“盛人脉涩小……历节疼不可屈伸,此皆饮酒汗出当风所致。”[3]基于上述理论,参考孙晓静等[4-6]文献首先对大鼠施加内湿因素(肥腻饮食)致脾虚,以及“高湿环境”的外湿因素(人工气候箱),然后注射弗氏完全佐剂,从而复制出脾虚湿困下的AA大鼠模型。AA模型大多复制21 d开始药物干预[7],也有复制较短时间就开始药物干预的[8-9]。本研究按照常规的21 d复制出AA模型,模型大鼠表现出关节明显肿胀,甚至足底溃烂,精神萎靡、进食量减少,毛发失去光泽,脾组织Na+,K+-ATPase的活力明显降低。临床报道湿阻患者多表现出胸闷脘痞纳呆、身重肢倦、舌苔厚腻等[10],研究显示,湿阻证常出现Na+,K+-ATPase活性减低[11-12]。本研究结果与其他文献报道基本一致。
RA是一种慢性自身免疫性炎性关节疾病,细胞因子是炎症反应的关键调节因子,体内的促炎和抗炎细胞因子活性平衡失调会导致致病性炎症反应,促炎细胞因子的增加和抗炎细胞因子的减少可能影响RA的发展[13]。已有研究显示,促炎细胞因子IL-1β、IL-6和TNF-α是炎症的生物标志物[14]。KAYA等[15]报道TNF-α可能是RA的主要病理生理因素,是疾病活动的标志物。本研究团队既往研究发现,RA湿热痹阻证患者外周血血清中IL-1、IL-6、TNF-α较健康对照组明显升高,关节液中IL-1、IL-6、TNF-α较外周血显著升高[16]。RA受累关节的滑膜组织中有大量的炎性细胞浸润,在疾病早期,炎性细胞因子及细胞因子受体的表达已经增加[17]。VEGF是一种高度特异性的促血管内皮细胞生长因子,可促进RA血管内物质外渗,导致炎性滑膜组织血管新生,加重组织炎症,形成血管翳,导致关节畸形和强直,是炎症持续过程起破坏作用的细胞因子[18]。炎症细胞因子之类的免疫相关分子不仅可加剧RA的炎症,还会破坏其骨骼[19]。本研究复制的模型表现出的细胞因子IL-6、TNF-α、VEGF升高与RA活动期表现是一致的。另外,临床中,RA患者多数有轻度的正细胞正色素性贫血,血小板增多症也很常见,而且与疾病活动性密切相关。少数病情较重者,全身性炎症反应明显的患者可表现出白细胞总数和中性粒细胞比率升高。本研究发现,模型大鼠的血细胞变化情况与临床RA患者的表现基本一致。
参考文献
[1] 曾小峰,朱松林,谭爱春,等.我国类风湿关节炎疾病负担和生存质量研究的系统评价[J].中国循证医学杂志,2013,13(3):300-307.
[2] 吴振彪,王宏坤,郑朝晖,等.我军不同兵种在不同地区类风湿性关节炎患病的流行病学调查[J].第四军医大学学报,2004,25(23):2190-2192.[3] 中医研究院研究生班.《金匮要略》注评典藏版[M].2版.北京:中国中医药出版社,2018:104.
[4] 孙晓静,徐澍,贾晓益,等.大鼠佐剂性关节炎病程不同阶段T细胞亚群及重要器官的病理学变化[J].中国药理学通报,2015,31(4):475-481.
[5] 陈刚.外湿模型大鼠免疫功能变化的研究[J].中国现代医生,2007,45(11):1-2.
[6] 韦嵩,劳绍贤,黄志新,等.湿热三因素对大鼠胃黏膜水通道蛋白3、4基因表达的影响[J].中国中医药信息杂志,2008,15(6):34-36.
[7] 赖梁明,卞仪泽,林振东,等.用全基因组芯片筛选出佐剂性关节炎大鼠滑膜组织中表达热休克蛋白90客户蛋白的基因[J].中国临床药理学杂志,2020,36(16):2463-2467.
[8] 何东初,张倩.从JAK-STAT信号通路探讨痹证宁对风寒湿痹型类风湿关节炎的作用机制[J].风湿病与关节炎,2020,9(4):1-5.
[9] 徐愿,阎小萍,肖诚,等.补肾祛寒治尪汤对胶原诱导关节炎大鼠抗炎与抗骨破坏的作用及对Wnt/β-catenin通路的影响[J].北京中医药大学学报,2020,43(4):289-295.
[10] 刘德芳,郭明阳,刘太华,等.平胃散加味对湿阻证舌苔的影响[J].中国中医药信息杂志,2007,14(11):64-66.
[11] 王琦越,杨旭,王吉娥,等.基于Na+-K+-ATP酶活性变化评价湿阻中焦证Cajal间质细胞模型的研究[J].中国中医基础医学杂志,2017,23(5):630-633.
[12] 杨旭,王琦越,黄秀深,等.基于水协同转运蛋白KCC1、KCC3、KCC4、NKCC1含量及Na+-K+-ATP酶活性变化研究湿阻中焦证的水液代谢机制[J].辽宁中医杂志,2018,45(3):627-630.
[13] KRISHNA PRIYA EK,SRINIVAS L,RAJESH S,et al.Pro-inflammatory cytokine response pre-dominates immuno-genetic pathway in development of rheumatoid arthritis[J].Mol Biol Rep,2020,47(11):8669-8677.
[14] APOSTOLOVA E,LUKOVA P,BALDZHIEVA A,et al.Immunomodulatory and anti-inflammatory effects of fucoidan:a review[J].Polymers(Basel),2020,12(10):2338-2364.
[15] KAYA F?,CEYLANER Y,?PEK B?,et al.Can cytokines be used as an activation marker in rheumatoid arthritis?[J].Endocr Metab Immune Disord Drug Targets,2021,21(8):1459-1465.
[16] 劉德芳,郭明阳,呼永河,等.类风湿关节炎湿热痹阻型患者血清和关节液IL-1、IL-6、TNF-α的表达研究[J].免疫学杂志,2014,30(5):447-451.
[17] CHALAN P,BIJZET J,KROESEN BJ,et al.Altered natural killer cell subsets in seropositive arthralgia and early rheumatoid arthritis are associated with autoantibody status[J].J Rheumatol,2016,43(6):1008-1016.
[18] SONE H,KAWAKAMI Y,SAKAUCHI M,et al.Neutralization of vascular endothelial growth factor prevents collagen-induced arthritis and ameliorates established disease in mice[J].Biochem Biophys Res Commun,2001,281(2):562-568.
[19] KOMATSU N.Immune molecules and the mechanism of joint destruction[J].Clin Calcium,2016,26(5):683-689.
收稿日期:2022-10-11;修回日期:2022-11-22
