多芯片联合药物靶点基因探讨骨关节炎患者滑膜中生物标志物和治疗靶点
2023-05-30陈莉华曾平陈财黄悦陆冠宇熊波刘金富
陈莉华 曾平 陈财 黄悦 陆冠宇 熊波 刘金富


【摘 要】目的:探索骨关节炎滑膜组织中的差异基因和相关通路,寻找骨关节炎的关键基因,阐明骨关节炎的发病机制。方法:从GEO数据库中收集4个相关数据集,分别是GSE1919、GSE32317、GSE41038和GSE82107,包括37个骨关节炎滑膜组织样本和16个正常滑膜组织样本,鉴定出差异表达基因(DEGs)。对这些DEGs进行GO功能富集分析和KEGG通路富集分析,使用Cytoscape软件构建DEGs的蛋白质相互作用(PPI)网络,筛选Degree前10位的基因。通过Drugbank数据库筛选获准的用于治疗骨关节炎的药物,Drug Gene Interaction数据库挖掘这些药物的靶基因。利用微生信在线作图工具将药物靶基因和PPI Degree前10位的基因取交集,获得药物靶基因与PPI Degree前10位基因相同的基因靶点。最后,再利用定量逆转录聚合酶链反应(qRT-PCR)对临床样本检测评估关键基因的基因表达量。结果:总共鉴定出68个DEGs,包括29个上调的DEGs(MRC2、CDH11、HK3等)和39个下调的DEGs(ADH1B、APOD、ADIPOQ等)。其功能主要富集在皮质类固醇的反应、血液循环、氧化还原酶活性和冷诱导产热的正向调节过程,以及IL-17信号通路、PPAR信号通路、肿瘤坏死因子信号通路和糖酵解。PPI Degree前10位的基因分别是LEP、MMP-9、FOS、CXCL10、MMP-1、TNFSF11、ADIPOQ、FABP4、LPL和MMP-3。通过Drugbank数据库和Drug Gene Interaction数据库共挖掘出30种获得批准的治疗骨关节炎药物及对应的284个靶基因。利用微生信在線作图工具,获得治疗骨关节炎药物靶基因与PPI Degree前10位的基因交集为MMP-9、LPL和MMP-1。定量逆转录聚合酶链反应结果显示,MMP-9在骨关节炎患者滑膜中呈高表达,且差异有统计学意义(P < 0.01);LPL在骨关节炎患者滑膜中呈低表达,且差异有统计学意义(P < 0.05)。结论:LPL和MMP-9是用于治疗骨关节炎的有效分子靶标。
【关键词】 骨关节炎;滑膜组织;微阵列芯片;生物标志物;靶点基因
Study on Biomarkers and Therapeutic Targets in Synovium of Patients with Osteoarthritis by Multi Chip Combined with Drug Target GeneCHEN Li-hua,ZENG Ping,CHEN Cai,HUANG Yue,LU Guan-yu,XIONG Bo,LIU Jin-fu
【ABSTRACT】Objective:To explore the differential genes and related pathways in the synovium of osteoarthritis,find the key genes of osteoarthritis,and clarify the pathogenesis of osteoarthritis.Methods:Four related data sets were collected from GEO database,namely GSE1919,GSE32317,GSE41038 and GSE82107,including 37 synovial tissue samples of osteoarthritis and 16 normal synovial tissue samples,and differential expression genes(DEGs)were identified.GO function enrichment analysis and KEGG pathway enrichment analysis were carried out for these DEGs,and protein interaction(PPI)network of DEGs was constructed using software Cytoscape to screen the top 10 genes of Degree.The Drugbank database was used to screen approved drugs for the treatment of osteoarthritis,and the Drug Gene Interaction database was used to mine the target genes of these drugs.The drug target gene and the top 10 genes of PPI Degree were intersected by using the online mapping tool of Bioinformatics to obtain the same gene target of the drug target gene and the top 10 genes of PPI Degree.Finally,quantitative reverse transcription polymerase chain reaction(qRT-PCR)was used to detect and evaluate the gene expression of key genes in clinical samples.Results:A total of 68 DEGs were identified,including 29 up regulated DEGs(MRC2,CDH11 and HK3)and 39 down regulated DEGs(ADH1B,APOD and ADIPOQ).Their functions are mainly concentrated in the positive regulation process of corticosteroid response,blood circulation,oxidoreductase activity and cold induced thermogenesis,as well as IL-17 signal pathway,PPAR signal pathway,tumor necrosis factor signal pathway and glycolysis.The first 10 genes of PPI Degree are respectively LEP,MMP-9,FOS,CXCL10,MMP-1,TNFSF11,ADIPOQ,FABP4,LPL and MMP-3.Through the Drugbank database and the Drug Gene Interaction database,a total of 30 approved drugs for the treatment of osteoarthritis and their corresponding 284 target genes were mined.Using the online mapping tool of Bioinformatics,the intersection(MMP-9,LPL and MMP-1)of the drug target gene for osteoarthritis and the top 10 genes of PPI Degree were obtained.Quantitative reverse transcription polymerase chain reaction showed that MMP-9 was highly expressed in synovium of patients with osteoarthritis,and the difference was statistically significant(P < 0.01);LPL was expressed low in synovium of patients with osteoarthritis,and the difference was statistically significant(P < 0.05).Conclusion:LPL and MMP-9 are effective molecular targets for the treatment of osteoarthritis.
【Keywords】 osteoarthritis;synovial tissue;microarray chip;biomarkers;target gene
骨关节炎(osteoarthritis,OA)是一种常见的与年龄相关的致残性疾病,通常涉及关节软骨、滑膜、软骨下骨、韧带、包膜和关节周围肌肉的结构改变[1]。随着病情的发展,患者最终会出现关节疼痛、肿胀、僵硬和行动受限,目前临床治疗只能对症处理,尚无有效的早期干预措施阻止病情发展[2],因此,寻找OA的关键基因,阐明其发病机制是迫切需要的。
滑膜是覆盖关节囊表面的一种疏松结缔组织,最近研究发现,滑膜与OA的发生和发展密切相关[3-5]。研究人员认为,滑膜促炎介质是诱导OA发病的重要因素[6],可能通过促进软骨退化发生作用[7]。
通过整合、分析来自不同平台的基因表达谱,有助于扩大样本量,从而更准确地探索OA的发病机制和关键基因。本研究从基因表达综合数据库(GEO)下载了4个系列矩阵文件(包括GSE1919、GSE32317、GSE41038和GSE82107),其中有37個OA滑膜组织样本和16个健康对照者的滑膜组织样本。鉴定OA和健康对照者之间的差异表达基因(DEGs),并对DEGs进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)通路富集分析。然后构建蛋白质-蛋白质相互作用(PPI)网络,将治疗OA的药物靶基因和PPI Degree前10位的基因取交集,获得治疗OA药物靶基因与PPI Degree前10位基因相同的基因靶点。最后,利用定量逆转录聚合酶链反应(qRT-PCR)对临床样本检测评估关键基因的基因表达量。本研究试图获得对OA分子通路的更多见解,并为OA治疗确定更多潜在的靶基因。
1 资料和方法
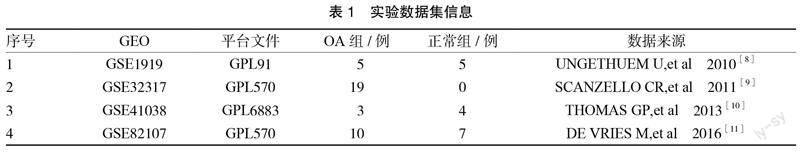
1.1 资料来源 使用关键词“osteoarthritis”,从公共数据库GEO(https://www.ncbi.nlm.nih.gov/geo/)上搜索微阵列数据集,下载OA滑膜相关芯片数据集GSE1919、GSE32317、GSE41038和GSE82107,见表1。共计纳入OA滑膜组织(OA组)37例,正常滑膜组织(正常组)16例。
1.2 分析方法
1.2.1 数据处理 利用R语言软件(版本3.4.3,http://www.r-project.org/)中的Perl软件(https://www.perl.org/)将从GEO数据集下载的原始数据的探针名转换成基因名,获得整合的基因表达矩阵。然后再利用实验室Limma软件包(http://www.bioconductor.org/packages/release/bioc/html/limma.html)和Sva包(http://bioconductor.org/packages/release/bioc/html/sva.html)对数据进行分析。
1.2.2 DEGs筛选 R语言软件中Limma包是为检查DEGs而设计。设定P < 0.05和|log2FC(fold change)|≥1作为阈值。差异结果用热图及火山图进行可视化呈现。
1.2.3 GO和KEGG功能富集分析 GO是高通量基因组或转录组数据的一种常用方法,用于识别基因表达调控系统的特征生物学功能。生物过程(BP)、细胞成分(CC)和分子功能(MF)是GO分析的三大组成部分。KEGG是一个系统分析基因功能的知识库,将基因组信息与高阶功能信息联系起来。在实验中,基于g:Profiler工具进行了GO富集分析和KEGG途径富集分析。筛选条件设定g:SCS < 0.05作为阈值。
1.2.4 PPI网络构建及关键基因筛选 蛋白质之间的功能相互作用可以为细胞加工的分子机制提供背景。STRING在线数据库(https://string-db.org/)是检索相互作用基因的搜索工具,其可以构建DEGs的PPI网络[12]。在本研究中,使用STRING在线数据库,导出最低可信度“combined score > 0.7”的分析结果。之后将网络数据通过Cytoscape绘制差异基因的PPI网络模型。利用CytoHubba插件计算PPI网络中每个节点的Degree值。Degree值大的蛋白被认为是网络中的关键蛋白。
1.2.5 治疗OA药物和靶基因的鉴定 Drugbank(https://www.drugbank.ca/)是一个提供有关药物、药物靶标、药物作用和药物相互作用详细信息的在线网站。以“osteoarthritis”为关键词,收集治疗OA的获得批准的药物。在Drug Gene Interaction数据库(http://www.dgidb.org/)中确定了所选药物的靶标。然后将治疗OA的药物靶基因与PPI Degree前10位的基因利用微生信(http://www.bioinformatics.com.cn/)在线作图工具取交集,获得治疗OA的药物靶基因与PPI Degree前10位的基因相同的基因靶点。
1.2.6 定量逆转录聚合酶链反应(qRT-PCR)验证 为了证实生物信息学分析的结果,收集4例OA患者和4例无OA患者的滑膜组织用于qRT-PCR验证。该研究方案经广西中医药大学第一附属医院伦理委员会批准,所有患者均签署知情同意书。采用TRIzol试剂提取滑膜组织中的总RNA,将来自总RNA的RNA样品反转录为cDNA,然后采用Revert Aid First Strand cDNA Synthesis Kit(Fermentas,美国)进行qRT-PCR,GAPDH作为内参。使用2-ΔΔCt方法计算相对mRNA表达。
1.3 统计学方法 采用SPSS 20.0软件进行统计分析。采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结 果
2.1 差异基因鉴定 根据矫正后的P < 0.05和|log2FC(fold change)|≥1作为标准,与正常组相比,从OA组中总共获得68个DEGs,包括29个上调的DEGs和39个下调的DEGs。差异结果采用热图及火山图进行可视化表达,见图1。
2.2 DEGs的GO、KEGG富集分析 GO富集分析表明,在MF中,DEGs在乙醇脱氢酶活性、视黄醇脱氢酶活性、氧化还原酶活性,胶原结合、环磷酸腺苷依赖性蛋白激酶调节剂活性丰富。在BP中DEGs主要参与对皮质类固醇的反应、血液循环、氧化还原酶活性和冷诱导产热的正向调节过程。此外,CC中的DEGs主要富集细胞外区域、细胞外空间、细胞外小泡和细胞外细胞器。KEGG通路富集结果表明,DEGs富集在IL-17信号通路、PPAR信号通路、肿瘤坏死因子信号通路和糖酵解。见图2。
2.3 DEGs的PPI网络分析 本次实验构建的PPI网络由26个节点和35条线组成,见图3(1)。度中心性定义为相邻链接的数量,也就是将一种蛋白质与其相邻蛋白质相互作用的次数,是网络理论中的基本参数,用于评估网络中的节点,DEGs的Degree得分如图3(2)所示,瘦素(LEP,Degree = 14),基质金属蛋白酶-9(MMP-9,Degree = 14),核磷蛋白(FOS,Degree = 12),C-X-C基序趋化因子-10(CXCL10,Degree = 8),基质金属蛋白酶-1(MMP-1,Degree = 8),脂肪坏死因子配体超家族成员11(TNFSF11,Degree = 8),脂联蛋白(ADIPOQ,Degree = 6),脂肪酸结合蛋白酶4(FABP4,Degree = 6),脂蛋白酯酶(LPL,Degree = 6)和基质金属蛋白酶-3(MMP-3,Degree = 6)是该网络中排名前10的关键基因。
2.4 治疗OA药物和相关靶基因的挖掘 通过Drugbank数据库筛选出30种获得批准的治疗OA的药物,在Drug Gene Interaction数据库共挖掘出这些药物对应的284个靶基因,见表3。治疗OA的药物及其靶标基因的网络图见图4。MMP-9、LPL和MMP-1是治疗OA相关药物的靶基因和DEGs PPI Degree前10位基因的交集基因,见图5。
2.5 关键基因的验证 为了驗证微阵列的结果,用qRT-PCR系统检测相同基因的表达水平。统计结果显示,与对照组相比,OA组中LPL下调,差异有统计学意义(P < 0.05);MMP-9上调,差异有统计学意义(P < 0.01)。见图6。
3 讨 论
OA是全球致残的主要原因之一,由于发病机制尚不清楚,对疾病预防和早期治疗仍具挑战性[13]。近年来,微阵列技术被广泛用于预测OA的潜在诊断和治疗靶点,有望成为早期诊断和探索疾病治疗靶标的有效工具[14]。在本研究中,基因表达谱GSE1919、GSE32317、GSE41038和GSE82107从GEO数据库下载,包括37个OA滑膜样品和16个正常滑膜样品。与正常组相比,在OA组的滑膜组织中鉴定出68个DEGs,包括29个上调的DEGs和39个下调的DEGs。这些DEGs可能与OA有关,并且可能用作潜在的药物靶标。通过GO和KEGG富集分析,进一步了解它们的调控机制。使用STRING数据库挖掘DEGs之间的相互关系,构建PPI网络进一步研究DEGs在蛋白质水平上的相互作用。Drugbank数据库和Drug Gene Interaction数据库共挖掘出30种获得批准的治疗OA药物及对应的284个靶基因,其中MMP-9、LPL、MMP-1是治疗OA药物的靶基因和DEGs PPI Degree前10位基因相同的基因。为进一步验证,笔者分别收集了4例OA患者和非OA患者滑膜组织进行qRT-PCR验证,发现MMP-9在OA患者滑膜中呈高表达,且差异有统计学意义(P < 0.01);LPL在OA患者滑膜中呈低表达,且差异有统计学意义(P < 0.05),因此认为,MMP-9与LPL很有可能成为OA诊断的生物标志物。
本研究发现,DEGs主要参与对皮质类固醇的反应过程。皮质类固醇是肾上腺皮质产生的类固醇,类固醇引起的骨病与骨细胞数量减少有关[15-16],WEINSTEIN等[17]的小鼠模型研究也证明骨细胞凋亡与皮质类固醇的使用相关。骨细胞是负责骨骼生产和重塑的间质衍生细胞,通过产生细胞外基质蛋白调节骨骼结构和骨基质矿化,并通过产生细胞因子或直接细胞接触诱导骨细胞生成。而OA的特征之一就是骨细胞的凋亡[18]。因此,DEGs可能通过影响骨细胞凋亡从而诱发OA。
在KEGG通路富集分析中,DEGs富集主要在IL-17信号通路、PPAR信号通路、肿瘤坏死因子信号通路和糖酵解参与反应。IL-17家族包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F,它们可以调节宿主防御和慢性炎症,导致组织损伤和自身免疫效应,并与细胞和组织中表达的特定受体结合,有学者认为,IL-17在OA的病理生理过程中起着重要的作用[19]。IL-17在OA患者的滑膜中过度表达,且IL-17在体外能刺激骨吸收和胶原破坏[20]。IL-17缺陷可以保护宿主免受胶原诱导小鼠关节炎的损害,IL-17基因治疗可能导致进一步恶化[21]。因此,OA中的IL-17可引起炎症和骨破坏,抑制IL-17信号通路可能是治疗OA的重要途经。过氧化物酶体增殖物激活受体(PPAR)是属于类固醇激素受体超级家族的配体激活转录因子,包括3个主要成员:PPARα(也称为NR1C1)、PPARβ/δ(也称为NR1C2)和PPARγ(也称为NR1C3)[22]。VASHEGHANI等[23]通过小鼠PPARγ敲除实验发现,被基因敲除的小鼠骨关节软骨退化增加,软骨细胞凋亡。研究表明,PPARγ的激活可以降低OA最相关的分解代谢和炎症因子的表达和合成。这些因素包括炎性细胞因子(如IL-1β、肿瘤坏死因子-α和IL-6)和MMPs(如MMP-1和MMP-13)。最近研究发现,PPARγ激动剂可以在半月板切除术诱导的关节炎豚鼠模型中减少OA的进展[24-26]。糖酵解是软骨细胞代谢缺氧环境中的主要供能方式[27]。关节软骨是一种特殊类型的结缔组织,没有血管,糖酵解供给维持软骨合成代谢和分解代谢之间的微妙平衡。而这对于软骨组织的长期完整性和自我修复能力至关重要[28]。在OA病理过程中,促炎和分解代谢因子显著增加,分解代谢加快,同时细胞糖酵解水平增加。糖酵解会促进驱动因子缺氧诱导因子-1(HIF-1)的产生,YUDOH等[29]发现,HIF-1的表达与软骨退变过程密切相关,其数量随着OA严重程度的增加而增加。
笔者将DEGs PPI Degree排名前10位的基因和治疗OA药物的靶基因取交集,得到了MMP-9、MMP-1和LPL。对这3个基因进行qRT-PCR验证,发现MMP-9、LPL与DEGs筛选的结果一致,因此认为,MMP-9与LPL很有可能成为OA诊断的生物标志物。
LPL是丝氨酸酯酶家族的一员,是从乳糜微粒和极低密度脂蛋白中水解甘油三酯的限速酶[30]。DRAGOJEVI?等[31]实验发现,OA与健康对照组相比,因为脂肪代谢的减低,OA组织显示较低的LPL、成骨细胞生成以及较高的破骨细胞生成。LPL能介导甘油三酯水解产生游离脂肪酸,在LPL生成较低的脂肪代谢中,小鼠骨髓培养物和大鼠细胞系中的破骨细胞生成增加从而造成骨组织的损害[32]。几项体外研究也表明,由LPL组成的脂联素通过抑制破骨细胞形成和活性,促进成骨细胞分化和增殖,对骨产生消极影响[33-35]。LPL在OA中的低表达会促进破骨细胞的生成,抑制成骨细胞分化从而影响软骨下骨。而关节软骨组织退化是造成OA的主要病理变化[36]。HEILPERN等[37]将小鼠MMP-9基因敲除后发现,OA动物模型表型显著减少。MMP-9能促进Ⅳ型胶原蛋白水解活性,通过降解OA患者关节内非胶原基质成分,使关节内结缔组织遭到破坏[38]。在导致OA的潜在机制中,重要的是机械应力,包括关节不稳定和损伤,以及易患OA的因素,如衰老。这些因素导致软骨细胞中生化途径的激活,从而导致细胞外基质被MMPs和聚集蛋白聚糖酶(ADAMTSs)降解[39]。此外,MMP-9在OA的早期阶段主要通过降解细胞外基质发挥作用。
与以往研究不同的是,我们新发现LPL在OA中的重要作用,这些关键基因可能会或为OA的生物标志物,以检测疾病的发生、发展。同时发现IL-17信号通路、PPAR信号通路、肿瘤坏死因子信号通路和糖酵解的生物通路可能与OA发展有关,其具体机制尚需进一步的研究验证。但本文尚存在不足之处,例如筛选差异表达基因来源的样本量较少,且样本源自于美国OA患者,与国内OA患者存在一定的种族差异,今后需要获取更多的国内样本进行验证。
参考文献
[1] BRANDT KD,RADIN EL,DIEPPE PA,et al.Yet more evidence that osteoarthritis is not a cartilage disease[J].Ann Rheum Dis,2006,65(10):1261-1264.
[2] 章曉云,张驰,宋世雷,等.基于网络药理学和蛋白模块分析淫羊藿治疗OA的作用与机制[J].中国组织工程研究,2020,24(17):2660-2666.
[3] MATHIESSEN A,CONAGHAN PG.Synovitis in osteoarthritis:current understanding with therapeutic implications[J].Arthritis Res Ther,2017,19(1):1-9.
[4] SUN ARJ,PANCHAL SK,FRIIS T,et al.Obesity-associated metabolic syndrome spontaneously induces infiltration of pro-inflammatory macrophage in synovium and promotes osteoarthritis[J].PLoS One,2017,12(8):1-27.
[5] WEI Y,BAI L.Recent advances in the understanding of molecular mechanisms of cartilage degeneration,synovitis and subchondral bone changes in osteoarthritis[J].Connect Tissue Res,2016,57(4):245-261.
[6] BERENBAUM F.Osteoarthritis as an inflammatory disease(osteoarthritis is not osteoarthrosis!)[J].Osteoarthritis Cartilage,2013,21(1):16-21.
[7] SCANZELLO CR.Role of low-grade inflammation in osteoarthritis[J].Curr Opin Rheumatol,2017,29(1):79-85.
[8] UNGETHUEM U,HAEUPL T,WITT H,et al.Molecular signatures and new candidates to target the pathogenesis of rheumatoid arthritis[J].Physiol Genomics,2010,42(4):267-282.
[9] WANG Q,ROZELLE AL,LEPUS CM,et al.Identification of a central role for complement in osteoarthritis[J].Nat Med,2011,17(12):1674-1679.
[10] THOMAS GP,DUAN R,PETTIT AR,et al.Expression profiling in spondyloarthropathy synovial biopsies highlights changes in expression of inflammatory genes in conjunction with tissue remodelling genes[J].BMC Musculoskelet Disord,2013,14(1):1-9.
[11] BROEREN MGA,DE VRIES M,BENNINK MB,et al.Functional tissue analysis reveals successful cryopreservation of human osteoarthritic synovium[J].PLoS One,2016,11(11):1-22.
[12] SZKLARCZYK D,FRANCESCHINI A,WYDER S,et al.STRING v10:protein-protein interaction networks,integrated over the tree of life[J].Nucleic Acids Res,2015,43(D1):447-452.
[13] CROSS M,SMITH E,HOY D,et al.The global burden of hip and knee osteoarthritis:estimates from the global burden of disease 2010 study[J].Ann Rheum Dis,2014,73(7):1323-1330.
[14] H?GG S,GANNA A,VAN DER LAAN SW,et al.Gene-based meta-analysis of genome-wide association studies implicates new loci involved in obesity[J].Hum Mol Genet,2015,24(23):6849-6860.
[15] O'BRIEN CA,JIA D,PLOTKIN LI,et al.Glucocorticoids act directly on osteoblasts and osteocytes to induce their apoptosis and reduce bone formation and strength[J].Endocrinology,2004,145(4):1835-1841.
[16] CANALIS E,MAZZIOTTI G,GIUSTINA A,et al.Glucocorticoid-induced osteoporosis:pathophysio-logy and therapy[J].Osteoporos Int,2007,18(10):1319-1328.
[17] WEINSTEIN RS,JILKA RL,PARFITT AM,et al.Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids.Potential mechanisms of their deleterious effects on bone[J].J Clin Invest,1998,102(2):274-282.
[18] MARUOTTI N,CORRADO A,CANTATORE FP.Osteoblast role in osteoarthritis pathogenesis[J].J Cell Physiol,2017,232(11):2957-2963.
[19] REINERT-HARTWALL L,HONKANEN J,SALO HM,et al.Th1/Th17 plasticity is a marker of advanced β cell autoimmunity and impaired glucose tolerance in humans[J].J Immunol,2015,194(1):68-75.
[20] ROELEVELD DM,KOENDERS MI.The role of the Th17 cytokines IL-17 and IL-22 in rheumatoid arthritis pathogenesis and developments in cytokine immunotherapy[J].Cytokine,2015,74(1):101-107.
[21] HU F,LI Y,ZHENG L,et al.Toll-like receptors expressed by synovial fibroblasts perpetuate Th1 and th17 cell responses in rheumatoid arthritis[J].PLoS One,2014,9(6):1-12.
[22] FANALE D,AMODEO V,CARUSO S.The interplay between metabolism,PPAR signaling pathway,and cancer[J].PPAR Res,2017,26(4):1-4.
[23] VASHEGHANI F,ZHANG Y,LI YH,et al.PPARγ deficiency results in severe,accelerated osteoarthritis associated with aberrant mTOR signalling in the articular cartilage[J].Ann Rheum Dis,2015,74(3):569-578.
[24] AMORUSO A,FRESU LG,DALLI J,et al.Characterization of the anti-inflammatory properties of NCX 429,a dual-acting compound releasing nitric oxide and naproxen[J].Life Sci,2015,21(1):28-36.
[25] DELL'ACCIO F,SHERWOOD J.PPARγ/mTOR signalling:striking the right balance in cartilage homeo-stasis[J].Ann Rheum Dis,2015,74(3):477-479.
[26] VASHEGHANI F,ZHANG Y,LI YH,et al.PPARγ deficiency results in severe,accelerated osteoarthritis associated with aberrant mTOR signalling in the articular cartilage[J].Ann Rheum Dis,2015,74(3):569-578.
[27] LANE RS,FU Y,MATSUZAKI S,et al.Mitochondrial respiration and redox coupling in articular chondro-cytes[J].Arthritis Res Ther,2015,17(1):1-14.
[28] KONG P,CHEN R,ZOU FQ,et al.HIF-1α repairs degenerative chondrocyte glyc olytic metabolism by the transcriptional regulation of Runx2[J].Eur Rev Med Pharmacol Sci,2021,25(3):1206-1214.
[29] YUDOH K,NAKAMURA H,MASUKO-HONGO K,et al.Catabolic stress induces expression of hypoxia-inducible factor(HIF)-1α in articular chondrocytes:involvement of HIF-1α in the pathogenesis of osteoarthritis[J].Arthritis Res Ther,2005,7(4):904-914.
[30] WANG H,ECKEL RH.Lipoprotein lipase:from gene to obesity[J].Am J Physiol Endocrinol Metab,2009,297(2):271-288.
[31] DRAGOJEVI? J,ZUPAN J,HARING G,et al.Triglyceride metabolism in bone tissue is associated with osteoblast and osteoclast differentiation:a gene expression study[J].J Bone Miner Metab,2013,31(5):512-519.
[32] CORNISH J,MACGIBBON A,LIN JM,et al.Modulation of osteoclastogenesis by fatty acids[J].Endocrinology,2008,149(11):5688-5695.
[33] LUO XH,GUO LJ,YUAN LQ,et al.Adiponectin stimulates human osteoblasts proliferation and differentiation via the MAPK signaling pathway[J].Exp Cell Res,2005,309(1):99-109.
[34] OSHIMA K,NAMPEI A,MATSUDA M,et al.Adiponectin increases bone mass by suppressing osteoclast and activating osteoblast[J].Biochem Biophys Res Commun,2005,331(2):520-526.
[35] YAMAGUCHI N,KUKITA T,LI YJ,et al.Adiponectin inhibits induction of TNF-α/RANKL-stimulated NFATc1 via the AMPK signaling[J].FEBS Lett,2008,582(3):451-456.
[36] DUAN B,LIU Y,HU H,et al.Notch1-ADAM8 positive feed-back loop regulates the degradation of chondrogenic extracellular matrix and osteoarthritis progre-ssion[J].Cell Commun Signal,2019,17(1):1-17.
[37] HEILPERN AJ,WERTHEIM W,HE J,et al.Matrix metalloproteinase 9 plays a key role in lyme arthritis but not in dissemination of Borrelia burgdorferi[J].Infect Immun,2009,77(7):2643-2649.
[38] BLOM AB,VAN LENT PL,LIBREGTS S,et al.Crucial role of macrophages in matrix metalloproteinase-mediated cartilage destruction during experimental osteoarthritis:involvement of matrix metalloproteinase 3[J].Arthritis Rheum,2007,56(1):147-157.
[39] LI H,WANG D,YUAN Y,et al.New insights on the MMP-13 regulatory network in the pathogenesis of early osteoarthritis[J].Arthritis Res Ther,2017,19(1):248-254.
收稿日期:2022-09-10;修回日期:2022-10-28
