广东佛山地区鸭圆环病毒分子流行株遗传变异分析
2023-05-29鲁绍芳王梦瑶李梦莉张喜文通信作者
武 娴,鲁绍芳,陈 帅,王梦瑶,李梦莉,赵 瑜,张喜文通信作者
1.信阳农林学院 动物科技学院,河南 信阳 464000 2.信阳农林学院动物科技学院河南省水禽资源开发利用与疫病防控工程技术研究中心,河南 信阳 464000
0 引言
遗传变异分鸭圆环病毒病(duck circovirus disease,DuCVD)是由鸭圆环病毒(duck circovirus,DuCV)感染各种日龄和品种的鸭而引起的传染病[1],临床表现为羽毛蓬乱、呼吸困难、贫血、生长迟缓、体重下降、甚至零星死亡。2003年,DuCV被Hattermann et al.[2]在德国首次报道,之后在美国、匈牙利、韩国等多个国家和地区相继被发现。近年来,中国大陆各养鸭业较为发达的省市也报道了该疾病的流行。DuCV通过侵害免疫系统而引起被感染鸭发生免疫抑制,导致机体的免疫机能下降,对其他条件性病原抵抗性下降,使其更易受到其他病原的侵袭[3],最终形成严重混合感染,导致鸭群的疾病更加复杂,发病率和死亡率增加[4]。DuCV多以亚临床感染的形式出现,近些年,该病已受到大部分鸭养殖国家的特别关注。
DuCV基因组为单股环型DNA,长度为1988~1996 nt[5]。全基因组中存在3个保守的开放阅读框(open reading frame,ORF),即ORF1编码复制蛋白(REP蛋白),ORF2编码衣壳蛋白(CAP蛋白)及ORF3编码细胞调亡相关蛋白[1]。REP蛋白由292个氨基酸组成,氨基酸同源性较高,是病毒复制所必须的蛋白。CAP蛋白由257个氨基酸组成,是DuCV仅有的结构蛋白,具有良好的免疫原性[6]。根据Cap基因的碱基数量不同,DuCV可被分为DuCV-1型和DuCV-2型[7]。DuCV ORF3调控细胞凋亡并可引起鸭淋巴细胞损伤[8]。
目前,DuCVD已成为危害养鸭行业最重要的传染病之一,每年给我国养鸭业带来严重的经济损失。由于各地区的DuCV流行毒株不同,我国DuCVD疫情变得更加复杂[3]。DuCV发现较晚,目前国内外对鸭圆环病毒的研究还处于起步阶段。为了解在广东省佛山地区鸭群流行DuCV的优势基因型,以及Rep基因和Cap基因的遗传变异情况,本研究通过对广东佛山地区的已确诊为DuCV感染阳性病鸭组织扩增出Rep基因部分片段和Cap基因,进行核苷酸序列测定,对推导出的氨基酸序列进行进化树构建、相似性和氨基酸变异分析,为该地区有效防控DuCV在鸭群中的流行提供理论依据。
1 材料与方法
1.1 材料
1.1.1 采样对象
样品采自广东佛山地区的3个鸭养殖场,且为已经确诊为DuCV感染的病鸭组织(包括肝脏、肺脏、肾脏、脾脏等),送至信阳农林学院预防兽医学实验室,-20 ℃保存。
1.1.2 主要试剂及仪器
病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司;DNA Ladder 2000、2×Taq Master Mix购自近岸蛋白质科技有限公司;胶回收试剂盒购自生工生物工程(上海)股份有限公司,琼脂糖购自广州赛国生物科技有限公司。快速自动编辑PCR仪(Bio-Rad C1000 Touch型)、电游仪(Bio-Rad PowerPac Basic)购自伯乐实验室设备有限公司;紫外透射分析仪(UV-3A)购自珠海黑马医学仪器有限公司;数显恒温水浴锅(HH-2)购自常州朗越仪器制造有限公司。
1.2 方法
1.2.1 引物设计与合成
根据张济培 等[9]报道合成扩增Rep基因部分片段的引物DuCV1-F/DuCV1-R。参照GenBank中登录的DuCV全基因序列(登录号:MT084134),利用软件Premier premier 5.0设计扩增包含有Cap基因的片段的引物Cap-F/Cap-R,序列见表1。引物由生工生物(上海)股份有限公司合成。
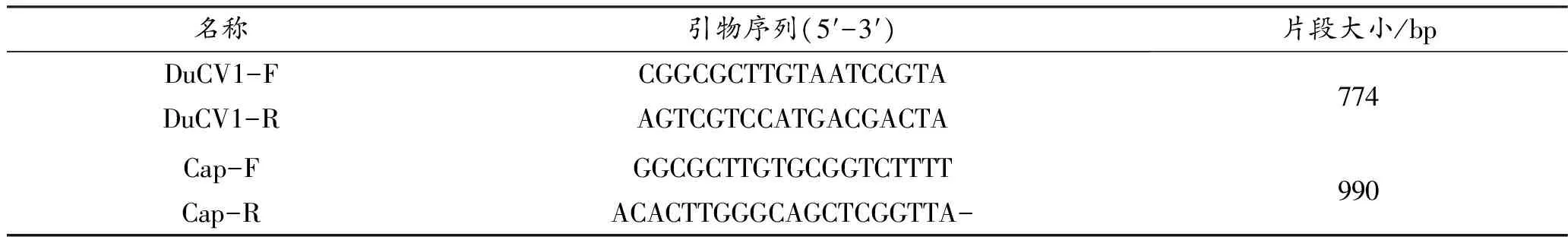
表1 DuCV扩增引物序列
1.2.2 组织处理及DNA提取
将采集的病鸭组织经玻璃匀浆器制成匀浆,用灭过菌的PBS按1:5稀释。反复冻融3次,4 ℃、12 000 r/min离心5 min,取上清液置于灭菌离心管中备用。使用病毒基因组DNA/RNA提取试剂盒提取DNA,-20 ℃保存备用,分别命名为GDFS-1、GDFS-2、GDFS-3。
1.2.3 DuCV的Rep和Cap基因克隆
以提取出的DNA为模板,分别进行Rep基因部分片段和包含有Cap基因片段的扩增。PCR反应体系(25 μL):2×Taq Master Mix 12.5 μL,引物DuCV1-F(Cap-F)1 μL,引物DuCV1-R(Cap-R)1 μL,DNA 1.5 μL,ddH2O 9.0 μL。PCR反应程序:94 ℃预变性4 min;94 ℃变性35 s,52 ℃退火35 s,72 ℃延伸45 s,共30个循环;72 ℃再延伸7 min。取 PCR 产物经1.5%琼脂糖凝胶电泳并观察结果。使用胶回收试剂盒对扩增出的目的基因进行纯化,胶回收产物送至生工生物工程(上海)有限公司进行核苷酸序列测定。
1.2.4 DuCV的Rep和Cap基因序列分析
利用生物学软件DNAMAN和MEGA11.0将3株DuCV流行株Rep基因部分片段和Cap基因推导的氨基酸序列与GenBank中登录的30株DuCV参考毒株中的Rep和Cap基因氨基酸序列进行同源性分析和氨基酸变异分析,并构建进化树。参考毒株序列信息见表2。
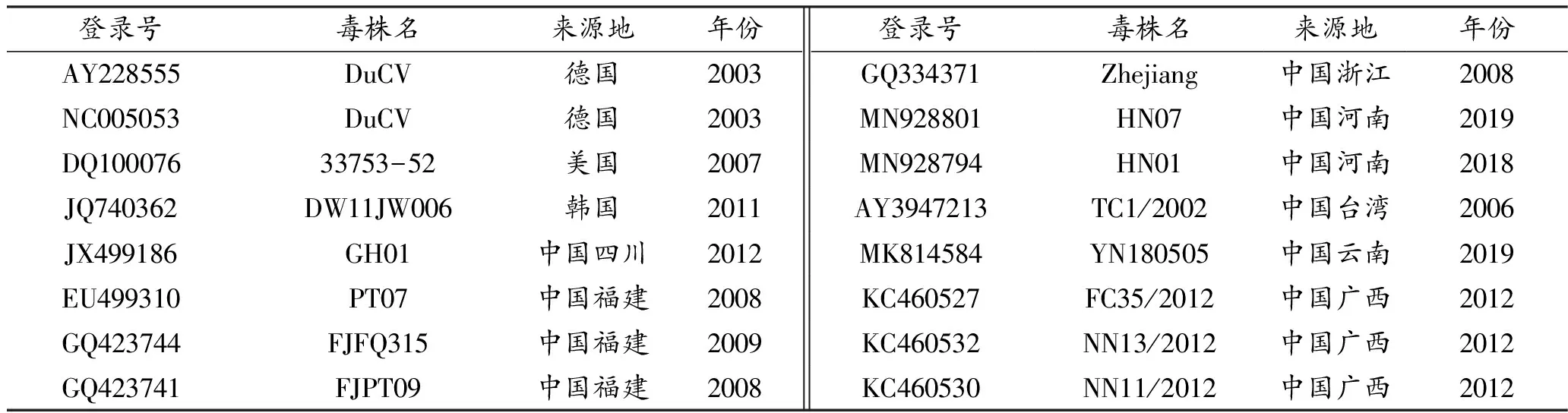
表2 DuCV参考毒株
2 结果
2.1 DuCV Cap基因和Rep基因部分片段扩增
由图1所示,以病鸭组织DNA为模板,DuCV1-F和DuCV1-R为引物,扩增出约990 bp的PCR产物;Cap-F和Cap-R为引物,扩增出约774 bp的PCR产物,上述结果均与预期相符。经核苷酸序列测定,证实成功扩增出DuCVCap基因和Rep基因部分片段。

M—DNA标准 DL 2000;1~3—GDFS-1、GDFS-2、GDFS-3 Cap基因扩增产物;4~6—GDFS-1、GDFS-2、GDFS-3 Rep基因部分片段扩增产物
2.2 DuCV流行株Cap基因遗传特性分析
采用MEGA 11.0软件对获得的3株DuCV流行株与参考毒株Cap基因推导氨基酸序列绘制遗传进化树。结果如图2所示,3株DuCV流行株与30株参考氨基酸序列存在2个明显的分支,分别以德国株为代表的Group I和以中国台湾株为代表的Group II。3株DuCV流行株与中国台湾株(AY3947213)在同一分支,位于Group II。3株DuCV流行株之间相似性为98.8%~100%;与Group II的15株氨基酸序列相似性为96.9%~100%,其中与福建株(EU499310,GQ423741)、广东株(KF941310,MK814575)、四川株(JX499186)的关系最近,相似性为98.8%~100%;与同属于基因2型的4株广东株参考序列相似性为97.7%~100%。3株DuCV流行株与Group I的16株参考序列的相似性为85.6%~88.7%,其中与江苏株(GU014543)、广西株(KC460530)关系较远,相似性为85.6%~86%。Cap基因氨基酸变异分析结果如表3所示,将3株DuCV流行株Cap基因推导氨基酸序列与中国台湾株(AY3947213)相比较,3株DuCV流行株发生了4处相同氨基酸置换(F23L、G106N、E193Q、K196T)。DuCV流行株GDFS-1和GDFS-2均在195位发生氨基酸置换(T195S),DuCV流行株GDFS-3的18位和240位氨基酸发生置换(G18A、D240N)。

●—本研究测定的毒株;▲—关键的参考毒株

表3 DuCV Rep部分基因和Cap基因推导氨基酸与中国台湾株(AY3947213)比较发生氨基酸置换
2.3 DuCV流行株Rep基因部分序列遗传特性分析
利用MEGA11.0软件对获得的3株DuCV与参考毒株的Rep基因部分片段推导氨基酸序列绘制遗传进化树,结果如图3所示。3株DuCV流行株与30株参考氨基酸序列存在2个明显的分支,分别以德国株为代表的Group I和以中国台湾株为代表的基因Group II。3株DuCV流行株之间相似性为99.5%~100%,位于Group II,与中国台湾株(AY3947213)相似性为99.5%~99%;与Group II的14株参考序列相似性为97.2%~100%,其中与广东株(FJ554673)、四川株(JX499186)、云南株(MK814584)的关系最近,相似性为99.5%~100%;与同属于基因2型的4株广东株参考序列相似性为97.2%~100%。3株DuCV流行株与Group I的16株参考序列的相似性为94.2%~95.7%,其中与河南株(MN928801)的关系最远,相似性为94.2%~94.7%。Rep基因氨基酸变异分析结果如表3所示,与中国台湾株(AY3947213)相比较,3株DuCV流行株均在第36位发生相同氨基酸置换(S36A);流行株GDFS-3的213位氨基酸发生氨基酸置换(Y213F)。

●—本研究测定的毒株,▲—关键的参考毒株
3 讨论
DuCVD比较常见,各种鸭、鹅均可感染,但主要感染鸭[10]。山东、江苏、福建等省均有DuCV感染,感染率为30%~84%,并有日益严重的趋势,其危害逐渐增大,因此,引起了人们的重视[10-14]。DuCV主要引起宿主的免疫抑制,与其他圆环病毒属成员一样,DuCV常常呈潜伏感染,并入侵鸭的免疫系统,导致机体的免疫机能下降,对其他条件性病原抵抗性下降,使其更易受到其他病原的侵袭[3]。本研究对来自广东佛山的3株DuCV的Rep基因部分片段和Cap基因进行扩增和氨基酸遗传变异分析,对该地区DuCVD防控具有重要意义。
根据DuCVRep和Cap基因的遗传进化分析显示,DuCV的进化特点表现为基因型有明显的地域性,美国和德国都是DuCV-1型,我国台湾为DuCV-2型[15]。据多数分析DuCV全基因序列研究显示中国大陆流行的DuCV呈现不同的亚型[16-17],而本研究以Rep和Cap基因的遗传进化树显示DuCV亚型分类并不明显,尤其是DuCV-2型,可能是测得的流行株与参考毒株的遗传关系较近从而聚集成簇。3株流行株均属于DuCV-2型,与张济培报道的一致[9]。这表明在广东DuCV-2型为优势流行株。
ORF V1编码DuCV的REP蛋白,REP蛋白与DuCV复制有关,含有能够滚环复制的保守序列(TPHLQG、YCSKE)和复制过程中与酶促反应dNTP结合的保守序列(FTINN、GPPGTGKS、DDFYGW)[18-20]。根据Rep基因部分片段推导氨基酸序列进化树分析结果证实,3个DuCV流行株属于Group Ⅱ,相似性分析结果表明,3株DuCV流行株相似性均在99.5%以上,与已报道4株广东株相似性在97%以上。与AY3947213氨基酸序列相比较,第36位发生相同氨基酸置换(S36A);流行株GDFS-3的213位氨基酸发生氨基酸置换(Y213F),上述结果表明DuCVRep基因的氨基酸同源性较高。3株DuCV流行株与中国台湾株其他位点均一致。DuCVRep基因的氨基酸具有良好的保守性。
ORF C1基因编码DuCV的衣壳蛋白CAP,CAP蛋白是DuCV的主要免疫保护性抗原。根据Cap基因组长度不同可将病毒分为DuCV-1型和DuCV-2型[7]。CAP蛋白氨基酸的进化树结果证实,3株DuCV流行株与中国台湾株(AY3947213)在同一分支,位于Group Ⅱ,与Group Ⅱ的相似性为96.9%~100%;与Group Ⅰ参考序列遗传关系较远,相似性为85.6%~88.7%。与Rep基因结果相比,Cap基因的同源性较低,与张志龙[3]报道结果相一致。与中国台湾株(AY3947213)氨基酸序列相比较,3株DuCV流行株有4处相同氨基酸置换;GDFS-1和GDFS-2均在1处发生氨基酸置换;GDFS-3有2处氨基酸发生突变。通过Cap基因和Rep基因氨基酸序列比较,可以发现CAP蛋白的变异位点要多于REP蛋白,这可能与它们编码的蛋白质的功能有关。
4 结论
研究测得的3株DuCV流行株均属于DuCV-2型,在广东地区有一定范围的流行,且CAP蛋白的变异程度要高于REP蛋白,为该地区有效防控DuCV在鸭群中的感染提供理论依据。
