MITF基因在B16-F10细胞中的表达分析
2023-05-29赵金红孙晓燕婧通信作者
赵金红,孙晓燕,蒋 婧通信作者
1.重庆市畜牧科学院,重庆 402460 2.重庆市草业工程技术研究中心,重庆 402460 3.重庆市山羊工程技术研究中心,重庆 402460
0 引言
动物的毛色和肤色变异主要受黑色素细胞的增殖、分化、迁移,以及黑色素的合成与运输等生物过程调控[1]。黑色素的合成是一个由酶催化的复杂过程[2],由多个基因位点编码产物共同调控。黑色素细胞的增殖分化亦受多种相关基因表达和酶活性的影响,它们形成了1个复杂的调控网络[3]。小眼畸形相关转录因子(MITF)是神经嵴细胞定向分化发育成黑色素细胞过程中出现的最早标记基因之一,对黑色素细胞的存活、迁移、增殖和分化起着重要的作用[4]。此外,MITF处于黑色素合成调控网络中心位置,一方面同时受上游cAMP、Wnt、Kit信号通路的调控,另一方面调控下游酪氨酸基因家族(TYR、TYRP1、DCT)基因的表达,进而影响黑色素的生成[5]。本研究分析MITF基因在黑色素细胞(B16-F10)增殖和分化过程中的表达规律,探寻其是否参与了黑色素细胞行为学的调控,为MITF基因在皮肤色素沉积方面的分子机制提供理论依据。
1 材料与方法
1.1 主要材料与试剂
实验使用的主要试剂与材料如表1所示。

表1 主要试剂与材料
1.2 B16-F10细胞培养
细胞培养的步骤如下:在37 ℃ 水浴中复苏B16-F10细胞,离心3 min去除细胞冻存液,用RPMI 1640培养基重悬细胞,放入10 cm培养皿中,置于培养箱中培养(5% CO2,37 ℃ 条件);观察细胞,待融合度达到90 %左右时除去培养液,加入0.25 %胰蛋白酶进行消化,1 000 r/min离心10 min;弃上清液,用完全培养基RPMI 1640重悬后,按照1.0×105个/mL的密度接种于10个6孔板中,每板重复3次。其中5个六孔板置培养箱中继续培养(5% CO2,37 ℃ 条件),每2 d更换1次培养基,在接种后的6 h、24 h、72 h、120 h、168 h观察细胞生长状态并拍照记录,并在对应的各个时间收集细胞,用于提取总RNA备用;另外5个六孔培养板,当其融合度达到80%左右时除去培养基,用含2% 马血清的DMEM培养基诱导分化,每2 d更换1次培养基,分别在分化的6 h、24 h、72 h、120 h、168 h观察细胞生长状态,分别收集对应时间点的细胞,用于提取总RNA。
1.3 荧光定量PCR与结果分析
用TRIzol Reagent提取B16-F10细胞的总RNA,用NanoDrop 2000分光光度计检测总RNA浓度和质量。按照反转录试剂盒说明书合成cDNA。所用引物信息见表2,以β-actin为内参基因,采用ABI stepone实时荧光定量PCR仪,按照FastStart Universal SYBR Green Master(ROX)试剂盒说明书中的体系与条件进行操作。结果使用SPSS 18.0进行单因素方差分析,结果以“平均值±标准误”表示。

表2 引物序列信息
2 结果与分析
2.1 MITF基因在B16-F10增殖阶段的动态表达
为了探究MITF基因是否参与了对黑色素细胞行为的调控,本研究检测了它们在B16-F10增殖期过程中(1 d、3 d、5 d、7 d)的表达量。如图1所示,B16-F10细胞增殖培养1 d和3 d时,细胞结构清晰,随着培养时间的延长,细胞数量不断增加,结构越来越模糊,到7 d时,细胞已完全铺满整个六孔板,无法辨清单个细胞。

图1 B16-F10细胞不同时间的增殖培养结果(标尺=200 μm)
表达量检测结果发现,MITF基因相对表达量在B16-F10细胞增殖阶段前期快速增加,随后进入一个稳定状态,在3 d、5 d、7 d的表达量极显著高于1 d(P<0.01),在7 d的相对表达量显著低于3 d和5 d(P<0.05),如图2所示。

图2 B16-F10细胞增殖阶段MITF基因的mRNA相对表达量
2.2 MITF基因在B16-F10分化阶段的动态表达
进一步分析MITF等基因在B16-F10分化过程中(1 d、3 d、5 d、7 d)的表达规律,B16-F10细胞随着分化培养时间的延长,细胞数量越来越少,细胞突触增多、变长、相互交联,细胞核周围出现越来越多黑素体,黑色素分泌增多(见图3)。mRNA相对表达量结果显示,MITF基因相对表达量先下降后上升,在5 d的相对表达量最低,极显著低于1 d和3 d(P<0.01),显著低于7 d(P<0.05),如图4所示。
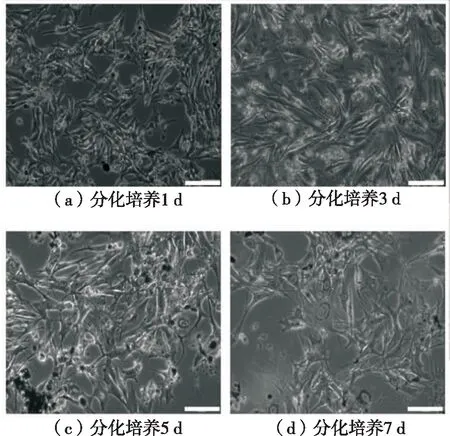
图3 B16-F10细胞不同时间分化培养结果(标尺=200 μm)

图4 B16-F10细胞分化阶段MITF基因的mRNA相对表达量
3 讨论与分析
动物皮肤中黑色素沉积情况影响着动物的毛色和肤色,黑色素的生物合成受多个信号通路的调控,并且不同的通路之间可发生交叉作用,体现了黑色素生成调控网络的复杂性[3],MITF基因是该网络的枢纽因子,在上游同时受cAMP、Wnt、Kit 3条信号通路和TNF-α、PAX3、SOX10、BRN-2等基因的调控,在下游则通过调控起关键限速作用的酪氨酸酶,来影响黑色素的生物合成[5]。干扰B16-F10细胞中MITF基因表达[6-7]或转染MITF优势负性突变[8]能够抑制色素合成有关基因TYR、TYRP1的表达量和活性,在绵羊黑素细胞中过表达MITF基因能增加TYR、TYRP1和DCT的表达量[9]。
大量研究表明[4,10-11],MITF基因能直接调控黑色素细胞生存、增殖周期、分化过程相关的基因,从而参与这些生物过程。在葡萄膜黑色素瘤细胞中下调MITF的表达水平可以抑制瘤细胞的增殖,促使细胞发生凋亡,说明MITF在葡萄膜黑色素瘤细胞的增殖过程中发挥重要作用[12]。本研究发现,MITF基因在B16-F10细胞增殖前期的mRNA相对表达量快速上升,随后进入一个稳定状态,最后略有降低,这一结果与项目组前期研究DCT基因在B16-F10细胞增殖过程中的表达趋势一致[13]。该基因在小鼠皮肤黑色素瘤细胞快速增殖时期高表达,而当细胞增殖速度慢下来后,它的相对表达量也趋于稳定,表明MITF基因高表达与黑色素瘤细胞的快速增殖有一定的正向关系。在黑色素瘤细胞分化过程中干扰MITF基因表达能抑制黑色素的合成与分泌,说明MITF基因对黑色素瘤细胞的分化功能造成直接的影响[6]。本研究发现MITF基因相对表达量在B16-F10细胞分化前期呈下降趋势,可能跟B16-F10细胞分化前期,细胞数量急剧下降有关,但在后期又显著上升,可能是由于分化后期,细胞内、外黑色素大量分泌导致的。这一结果再次说明,MITF基因高表达对黑色素细胞的增殖和分化均有促进作用。
4 结论
MITF基因的高表达对黑色素合成的限速酶活性有促进作用,同时促进黑色素的合成与分泌,从而促进动物皮肤黑色素的沉积,进而调控动物的毛色和肤色表型。MITF基因对黑色素瘤细胞的增殖和分化均有一定的促进作用。这些结果为MITF基因在皮肤色素沉积分子机制研究方面提供了理论依据。
