脊索瘤30例临床病理分析及文献复习*
2023-05-29李美蓉冉龙燕许多李晓晨孙兴旺郭庆喜
李美蓉,冉龙燕,许多,李晓晨,孙兴旺,郭庆喜
646000 四川 泸州,西南医科大学附属医院 病理科
脊索瘤是一类低度恶性的罕见骨肿瘤,1846年Virchow在颅底斜坡首次观察并描述了这种病变[1]。根据2020年第五版WHO《软组织与骨肿瘤分类》标准,脊索瘤分为经典型脊索瘤(包括软骨样亚型)、去分化型脊索瘤和差分化型脊索瘤[2]。为进一步认识脊索瘤,本文回顾性分析了30例脊索瘤的临床资料、病理特征及免疫表型,旨在探讨脊索瘤的临床病理特征及分子表型,为该病的病理诊断提供帮助。
1 材料与方法
1.1 一般资料
收集2011年4月至2022年1月西南医科大学附属医院脊索瘤手术病例的临床病理资料,参照2020年第五版WHO《软组织与骨肿瘤分类》标准对该组30例病例重新评估分类,并整理其临床、影像及病理特征。
1.2 方法
所有脊索瘤组织标本均经10%中性福尔马林溶液充分固定,常规取材、脱水、石蜡包埋后连续切片,厚度为4μm,常规HE染色,免疫组化采用EnVision两步法染色,光镜下观察。所用抗体:广谱细胞角蛋白(pancytokeratin,PCK),波形蛋白(vimentin, VIM),上皮膜抗原(epithelial membrane antigen, EMA) ,整合酶相互作用分子 1(integrase interactor-1,INI1),T 转录因子(Brachyury),增殖指数(Ki-67),S-100,P16均购买于福州迈新公司。PCK、VIM、EMA阳性定位于肿瘤细胞胞质,S-100阳性定位于肿瘤细胞胞质和胞核,Brachyury、P16、INI1阳性定位于肿瘤细胞胞核,颜色为棕黄色或棕褐色。采取门诊、电话等方式对病例进行随诊,记录是否复发、转移或者死亡。
2 结 果
2.1 临床特征
30例脊索瘤患者,男性16例,女性14例;年龄18 ~ 79岁,中位年龄63.5岁。病变位于骶尾部者21例,其中17例出现骶尾部疼痛,5例出现排便困难,2例出现下肢疼痛,1例出现单侧下肢麻木,1例出现会阴部感觉异常,1例因摔倒后偶然发现。病变位于颅底者9例,其中6例出现视物模糊,3例出现头痛,2例出现眼睑下垂,1例出现眼球活动受限,1例出现恶心、呕吐。30例患者均行CT检测,可见溶骨性破坏及不规则团块状软组织密度影,密度不均匀、增强呈不均匀轻度强化;19例行MRI检测,可见多发骨质破坏及不规则混杂信号肿块影,T1WI呈等低信号,T2WI呈高低混杂信号,增强扫描呈不均匀明显强化(图1);2例行PET-CT检测,葡萄糖代谢不均匀稍增高。30例患者均行手术治疗,5例因复发后行二次手术,3例因复发行3次手术,复发率26.7%;1例行放射治疗,均未行化疗。
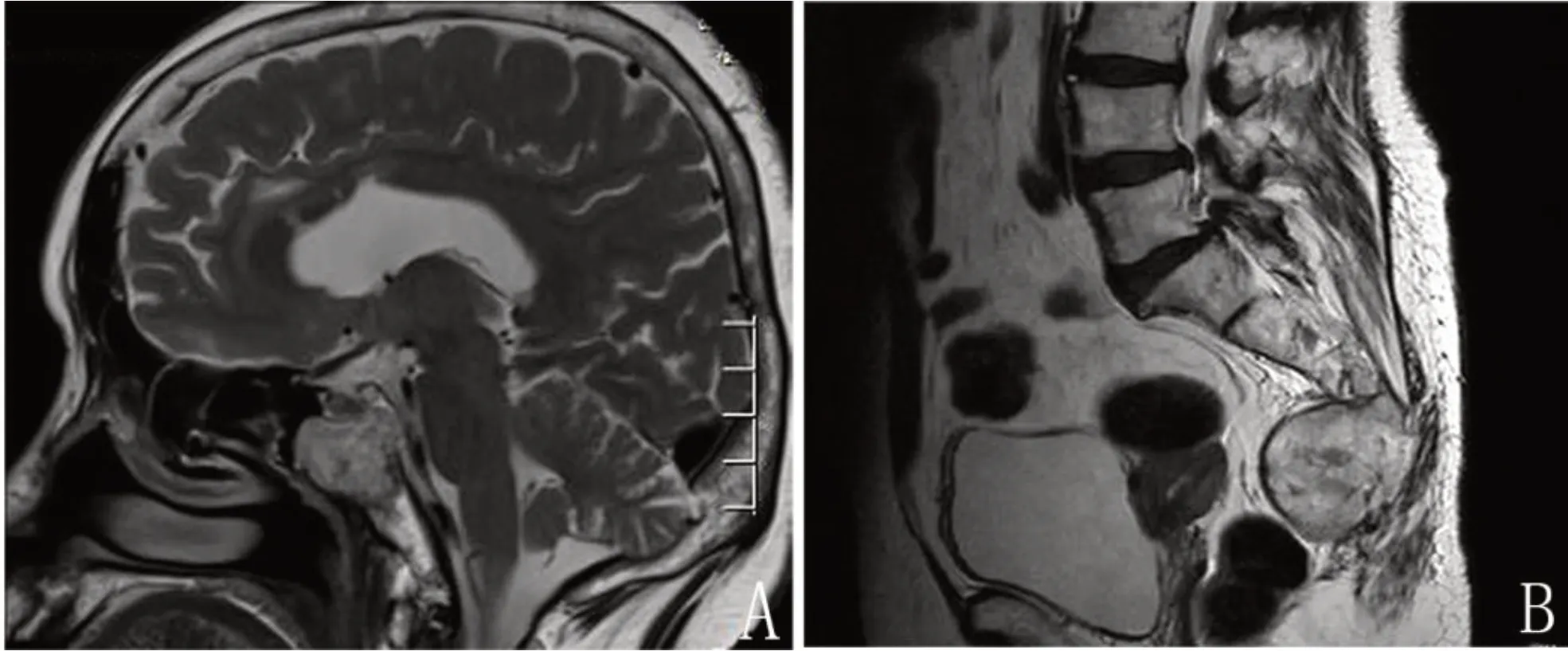
图1 不同部位脊索瘤的MRI影像表现Figure 1.MRI Manifestations of Chordomas at Different Sites
2.2 病理特征
肉眼观:肿瘤组织外观为灰白色、灰红色、实性或囊实性包块,最大径1.0 ~ 20.0 cm,中位最大径6.0 cm。其中10例有部分包膜,7例伴出血,6例切面呈囊性,5例切面呈胶冻状。
镜下观:显微镜下经典型脊索瘤28例,可见肿瘤组织被纤维结缔组织分隔成分叶状,侵犯宿主骨组织或软组织,与周围正常组织分界不清。肿瘤细胞由两种细胞构成,一种细胞为大的上皮样细胞,胞浆丰富,可见胞浆内空泡,细胞核中等大小。另一种细胞为小的星芒状细胞,胞浆嗜酸性,细胞核异型性小。这些细胞呈条索状镶嵌于黏液样基质中,部分病例伴灶性坏死(图2A)。差分化型脊索瘤1例,镜下由低分化的胞浆丰富的嗜酸性上皮样肿瘤细胞构成,细胞核大,部分呈空泡状,可见核仁、核分裂及瘤巨细胞,细胞异型性显著;可见少许黏液样基质(图2B)。去分化脊索瘤1例,镜下由经典型脊索瘤和高级别肉瘤区域混合组成(图2C)。
2.3 免疫表型
3种类型的脊索瘤肿瘤细胞胞质均阳性表达PCK、VIM、EMA 和 S-100,胞核 Brachyury(图 2D)和S-100表达阳性;仅11例经典型脊索瘤表达P16,而差分化型脊索瘤及去分化型脊索瘤P16表达均阳性(图2E),阳性率为43.3%;差分化型脊索瘤INI1表达缺失(图2F),经典型脊索瘤及去分化型脊索瘤中的去分化成分INI1表达阳性;Ki-67增殖指数2% ~ 30%。
2.4 随访
随访截止时间为2022年3月31日。共17例患者获得随访,失访13例,随访时间2 ~ 144月。随访中复发8例,复发率26.7%;1例出现肺转移,1例出现髂骨、腰5椎体转移,1例于术后11月死亡。
3 讨 论
脊索瘤是一类起源于胚胎残余脊索的罕见骨恶性肿瘤,发病率约为每年0.08/10万[3],5年和10年生存率分别为68%和40%,约占成人骨恶性肿瘤的10%[4]及儿童骨恶性肿瘤的 1% ~ 4%[5]。主要发生在中轴骨,如颅底及骶尾部,极少数可以发生在中轴骨外,如肺[6]、纵隔[7]、小指的屈伸滑膜鞘[8]、牙龈[9]等罕见部位。脊索瘤的临床症状没有特异性,通常因肿瘤压迫、阻塞而导致相应临床表现。本文中发生于蝶窦及鞍区患者表现为头痛、视物模糊、眼睑下垂等神经压迫症状;发生骶尾部患者表现为骶尾部疼痛、便秘、下肢麻木等症状。
病理组织学特点和分子表型是脊索瘤确诊的主要依据。本文中经典型脊索瘤28例,镜下见肿瘤细胞呈索状或巢状排列,嵌在丰富的细胞外黏液样基质中,肿瘤细胞呈两种形态,大的上皮样细胞及小的星芒状细胞。去分化型脊索瘤1例,镜下由经典型脊索瘤和高级别肉瘤混合组成。据文献报道,去分化的肉瘤成分可以为恶性纤维组织细胞瘤、纤维肉瘤、骨肉瘤、横纹肌母细胞瘤及横纹肌肉瘤等[10]。该例去分化成分为纤维肉瘤,与文献报道类型一致。差分化型脊索瘤报道较少,是一种伴有脊索分化的、以SMARCB1/INI1表达缺失为特征、预后极差的肿瘤[11-12]。本文中差分化脊索瘤1例,镜下由低分化上皮样细胞组成,胞浆丰富嗜酸性,细胞核不规则,核分裂多见,可见瘤巨细胞,在形态学分化较差的基础上,该病例还出现了INI1表达缺失以及Brachyury阳性表达,对差分化脊索瘤的诊断非常重要。
免疫表型结果显示,脊索瘤表达PCK、S-100、VIM、EMA 等非特异性的标记[13-14]。Brachyury是一种脊索细胞核中特异性转录因子,对脊索的正常发育和维持至关重要[15-16]。Brachyury作为脊索瘤的一个特异性指标,已经逐渐被应用到脊索瘤的诊断中。Brachyury在脊索瘤中特异性表达,但在包括关节、髓核和纤维软骨在内的非肿瘤性组织以及包括软骨肉瘤、黏液纤维肉瘤在内的其他类型的肿瘤组织中均不表达[14],对诊断和鉴别诊断有较大价值。在本文中,所有病例均有Brachyury阳性表达。
随着对脊索瘤发生、发展的分子机制研究的深入,一些关键分子和信号通路逐渐被发现。Brachyury是脊索瘤最关键的肿瘤驱动因子。除此之外,在散发性脊索瘤中还识别到CDKN2A、PTEN、SMARCB1、ALK等基因的缺失或突变[17]。CDKN2A是一种常见的抑癌基因,编码P16蛋白,CDKN2A/P16蛋白通过调节细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)在细胞周期中发挥作用,CDKN2A失活可能导致细胞增殖[18]。已有文献报道[18]P16缺失对CDK4/6抑制剂敏感,可能是潜在的预后标志物。本组30例脊索瘤中13例脊索瘤肿瘤组织P16蛋白表达阳性,阳性率为43.3%。根据以往报道的文献,散发性脊索瘤中存在CDKN2A突变或缺失,其突变或缺失的频率为 12% ~ 80%[17-19],这存在较大的异质性,且与肿瘤的取样相关。因此,P16蛋白的表达是否能可靠地预测脊索瘤较好的生存预后,可能需要更多的临床数据来说明。
诊断脊索瘤需注意与其他肿瘤相鉴别:(1)良性脊索细胞瘤是一类显示脊索分化的良性肿瘤,多于体检或尸检时偶然发现。良性脊索细胞瘤境界清楚,没有溶骨性破坏。显微镜下肿瘤细胞呈空泡状,细胞核小而扁平,常被挤压在细胞周围,似成熟脂肪细胞。鉴别主要依靠核异型性和浸润性生长方式,免疫组化指标Brachyury和Ki-67增殖指数并不是鉴别的要点[20];(2)软骨肉瘤多发生于老年人,显微镜下肿瘤呈分叶状生长,可见黏液样基质,肿瘤小叶浸润和包绕先前存在的骨小梁(软骨包骨),肿瘤细胞密度较丰富,细胞核大小不一、深染,双核细胞易见。免疫组化指标D2-40表达阳性,而Brachyury、EMA和PCK阴性表达[21]。在分子遗传学方面,大约半数的软骨肉瘤存在异柠檬酸脱氢酶突变[22];(3)脊索瘤样脑膜瘤[23]是一类少见亚型脑膜瘤,多见于儿童,位于幕上,与脑膜关系密切。显微镜下肿瘤细胞排列呈条索状分布于黏液样基质中,空泡细胞存在使其形似脊索瘤,但局灶漩涡状结构,肿瘤细胞核圆形、卵圆形似脑膜皮细胞,免疫组化指标PCK阴性可鉴别;(4)黏液乳头状室管膜瘤[24]为室管膜瘤的特殊亚型,起源于终丝、马尾、圆锥的神经胶质细胞。当脊索瘤有丰富的黏液样的基质且发病部位位于骶尾部时,需与脊索瘤鉴别。但黏液乳头状室管膜瘤特征性假乳头结构、血管周围无核区和微囊,且免疫组化GFAP阳性可辅助鉴别;(5)转移性癌。当脊索瘤上皮样特征明显、异型性增加、细胞核分裂象增多时,可考虑转移性癌可能,此时应注意寻找原发病灶。转移性癌有其特有的形态学特点及免疫表型,可供鉴别。
目前,脊索瘤的治疗仍是现代医学需要攻克的难题,手术切除是其首选的治疗方法[5]。由于脊索瘤浸润性的生长方式及其生长部位周围复杂的神经血管结构,手术难以完全切除,复发的风险高。且脊索瘤对常规放疗和化疗反应差,尤其是去分化型脊索瘤和差分化型脊索瘤。目前,放化疗并不是脊索瘤常规的治疗手段。在本文病例中,仅有1例患者在复发时受肿瘤大小及位置影响导致切缘阳性而追加了放射治疗。随着研究进展,针对脊索瘤关键分子及信号通路的靶向治疗也取得了一定的进展。DeMaria等[25]研究发现,诱导针对Brachyury的免疫应答的治疗性癌症疫苗可以产生免疫相关的肿瘤破坏。Scheipl等[26]研究证实,表皮生长因子受体抑制剂阿法替尼和厄洛替尼与酪氨酸激酶抑制剂联合用药可以明显增强对脊索瘤细胞的细胞毒性作用。而von Witzleben等[27]发现,CDK4/6抑制剂帕博西林可以抑制脊索瘤细胞的体外生长。这些研究结果都有望为脊索瘤的治疗提供新方法。
综上所述,三种脊索瘤亚型均具有独特的病理形态学特征和分子表型。Brachyury、INI1和高级别肉瘤成分对脊索瘤的诊断和分型有着重要作用。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
