长链非编码RNA MNX1-AS1在头颈鳞癌中的生物学功能及临床意义*
2023-05-29田然买尔哈巴米吉提张相民吴勇延高伟
田然,买尔哈巴·米吉提,张相民,吴勇延,高伟
030001太原, 山西医科大学 基础医学院(田然);030001太原,山西医科大学第一医院 耳鼻咽喉头颈肿瘤山西省重点实验室/耳鼻咽喉外科(田然、买尔哈巴·米吉提、吴勇延、高伟);518172 广东 深圳,深圳市龙岗区耳鼻咽喉医院 耳鼻咽喉头颈外科(张相民、吴勇延、高伟)
头颈癌是指发生在唇、口腔、鼻腔鼻窦、咽(鼻咽、口咽、喉咽)、唾液腺和喉等部位的恶性肿瘤,以鳞状细胞癌为主,其原发部位和病理类型之多,居全身肿瘤之首[1]。头颈癌位居全身恶性肿瘤的第六位,其具有侵袭力强以及早期颈部淋巴结转移的恶性生物学行为,是其主要致死的首要危险因素[2-3]。目前,头颈部鳞癌主要的治疗手段以手术为主,辅以放化疗等。然而大约2/3的患者确诊时已属晚期[4],5年生存率低于50%[5]。分子靶向治疗作为当今肿瘤治疗的新兴方式,在消化道、呼吸道以及妇科等肿瘤治疗中取得了较好效果,但头颈部鳞癌分子靶点以及靶向制剂进展有限。因此,挖掘头颈鳞癌中有效且特异的分子标志物,对于明晰其发病机理以及未来的精准诊疗有着重要的临床意义。
长链非编码 RNA(long non-coding RNA,lncRNA)为长度大于200 nt的非编码RNA,以往被认为是“转录垃圾”。随着新一代高通量测序技术的高速发展与广泛应用,越来越多lncRNA不断被发现,其生物学作用也不断突破认知,在肿瘤中的重要生物学功能备受学者关注。lncRNA MNX1-AS1位于人的7号染色体,在卵巢癌[6]、宫颈癌[7]、胶质母细胞瘤[8]等多种癌症中发现其表达异常,可通过调控下游信号通路影响癌细胞的增殖、侵袭迁移和凋亡等生物学表型。但lncRNA MNX1-AS1在头颈部鳞癌中的生物学功能和临床价值尚不明晰。本研究提取TCGA数据库中的头颈癌转录组数据,分析其表达水平与患者临床病理参数的相关性,利用实时荧光定量(quantitative realtime ,qPCR技术检测lncRNA MNX1-AS1在头颈癌细胞系中的表达水平,并检测其在头颈癌细胞系增殖、侵袭和迁移恶性表型中的生物学功能,为头颈鳞癌挖掘新的分子靶点提供理论依据。
1 材料和方法
1.1 材料
人胚肺二倍体细胞系2BS、人永生化表皮细胞HaCaT与人舌鳞癌细胞系CAL-27购自中国典型培养物保藏中心,人喉鳞癌细胞系FD-LSC-1由复旦大学附属眼耳鼻喉医院头颈外科团队馈赠,人咽鳞癌胸水转移细胞系Detroit562购自中国科学院上海细胞库。主要试剂包括DMEM(Gibco,美国),胰蛋白酶(Sigma,美国),Trizol(Invitrogen,美国),反转录试剂盒(EasyScript,中国),实时荧光定量PCR试剂盒(TransGen Biotech,中国),LipofectamineTM3000 转染试剂(Invitrogen,美国),CCK-8(TransGen Biotech,中国),Matrigel基质胶(Corning,美国),细胞凋亡检测试剂盒(Zeta Life,中国),细胞周期检测试剂盒(Yeasen,中国)等。常温高速离心机(德国Eppendorf),双人超净工作台(上海智城分析仪器制造有限公司),荧光定量 PCR 仪(美国 Roche),CO2培养箱(德国 Eppendorf)等。
1.2 方法
1.2.1 细胞培养与转染 FD-LSC-1培养基为BEGM,2BS、HaCaT、CAL-27以及Detroit562培养基为DMEM,均含10%FBS+1%青链霉素于37℃、5% CO2的培养箱中培养。待长到对数生长期时传代。取上述细胞系,采用胰酶消化、中和、离心后接种于12孔板,待细胞融合度达到80%左右,用LipofectamineTM3000进行siRNA转染,6 h后更换为完全培养基继续培养48 h检测转染效率。实验分为阴性对照(siRNANC,si-NC)和实验组 siRNA-lncRNA MNX1-AS1实验组(分别转染si-lncRNA MNX1-AS1-635或silncRNA MNX1-AS1-986),每组设置三个复孔。
1.2.2 qPCR检测 上述培养板中加入Trizol提取细胞总RNA,核酸分析仪检测总RNA的浓度与纯度。采用TransGen Biotech进行反转录获得cDNA后进行 qPCR,采用 2(-△△CT)法计算目的基因相对表达量,以18S作为内参基因,检测细胞中lncRNA MNX1-AS1的表达水平,qPCR引物和siRNA序列如 下:qMNX1-AS1-2F:GGCTCCACACTGCTTTCTGG;qMNX1-AS1-2R:GTTGTATGTTGTCTGCGTTGTT;18S-F:TGGATACCGCAGCTAGGA,18SR:CGGCGCAATACGAATGCCCC。LncMNX1-AS1 siRNA序列如下:si-lncRNA MNX1-AS1-635正义链:GAGUCUUGCAAAGAGGAGAUCUUUA,si-lncRNA MNX1-AS1-635反义链:UAAAGAUCUCCUCUUUGCAAGACUC。si-lncRNA MNX1-AS1-986正 义 链:GGCACUCCUUUAGAACCCACCUGUU;si-lncRNA MNX1-AS1-986反义链:AACAGGUGGGUUCUAAAGGAGUGCC。以上引物由生工生物工程(上海)股份有限公司合成,siRNA购自上海吉玛制药技术有限公司。
1.2.3 CCK-8细胞增殖能力检测实验 将呈对数增长的细胞铺至6孔板中,分为si-NC组和si-lncRNA MNX1-AS1组。在细胞转染24 h后接种于96孔板中,置于培养箱中静置培养。检测时每孔加入110 μL CCK-8检测混合溶液后避光孵育1 h。分别在0 h、24 h、48 h、72 h用酶标仪检测450 nm处的光密度值,绘制生长曲线。
1.2.4 克隆形成实验 细胞转染24 h后,消化、中和、离心后,接种于6孔板后置于培养箱中培养。待培养10天左右观察克隆形成情况,待肉眼可见克隆形成后弃上清,室温下用4%多聚甲醛固定和0.1%结晶紫染色,拍照并计数细胞克隆数。
1.2.5 Transwell侵袭和迁移实验 细胞转染24 h后,进行消化离心后,将培养液换为无FBS培养基培养洗涤两次后。取200 μL含细胞的悬液加入Transwell细胞培养板的上室(侵袭实验在上室加入Matrigel基质胶并待形成膜后加入细胞悬液),在下室加入600 μL含20% FBS的培养基。培养箱中培养48 h后取出小室,用棉擦除上室细胞,PBS浸洗。4%多聚甲醛固定和0.1%结晶紫染色后晾干拍照,统计穿过小室的细胞数量。
1.2.6 TCGA数据分析 从TCGA数据库(https://portal.gdc.cancer.gov/)下载头颈鳞癌转录组测序数据及相应临床信息,采用FPKM格式对lncRNAs的表达水平进行统计学分析。在R语言(3.6.3版本)中,利用“ggplot2”R包将分析结果可视化。使用“DEseq2”R包筛选差异表达基因,设置筛选阈值,上调性基因的筛选条件设置为log2FC > 0且P < 0.05,下调性基因的筛选条件设置为 log2FC < 0 且 P < 0.05。
1.2.7 统计学方法 数据采用SPSS 22.0 软件进行统计学分析,采用GraphPad Prism 6进行作图。计量资料以均数标准差()表示。两组间比较采用独立样本t检验。多组间比较用单因素方差分析。所有检验均为双侧。以P < 0.05为差异有统计学意义,P < 0.001为差异有显著统计学意义。
2 结 果
2.1 LncRNA MNX1-AS1在头颈癌细胞系的表达水平
头颈鳞癌细胞系FD-LSC-1、CAL-27以及Detroit562的表达较正常细胞系人胚肺二倍体细胞2BS和人永生化表皮细胞HaCaT中的相对表达倍数为309.781±52.769、300.607±65.519、86.657±37.356倍 和 9.637±1.519、9.613±0.965和 2.670±0.538(t值分别为 10.135、7.920、3.972 和 9.850、15.451、5.379,均 P < 0.01),表明 lncRNA MNX1-AS1 在头颈鳞癌细胞系中显著高表达(图1),提示lncRNA MNX1-AS1与头颈鳞癌的发生发展密切相关。

图1 LncRNA MNX1-AS1在头颈鳞癌细胞系中的表达水平Figure 1. Expression of LncRNA MNX1-AS1 in HNC Cell Lines
2.2 LncRNA MNX1-AS1的表达水平与头颈癌患者临床病理参数的相关性
从TCGA数据库查找519例头颈鳞癌组织样本和44例正常对照组织的转录组测序数据,去除临床病理信息不全的病例,最终纳入502例头颈鳞癌组织样本进行差异表达分析。结果表明头颈鳞癌组织中lncRNA MNX1-AS1表达水平高于正常对照组织(头颈鳞癌组织 vs 正常对照组织 = 0.323 vs 0.088;t = 5.024,P < 0.05);在 G3 + G4 病理分级头颈鳞癌中相对表达量为0.442±0.768,显著高于G1和G2病理分级的相对表达量0.279±0.445(t = -2.207,P < 0.05)。临床相关性分析发现,有吸烟史患者组中其表达水平高于无吸烟史患者组(0.351±0.577 vs 0.227±0.463;t = -2.342,P < 0.05);在 临 床分期Ⅲ+Ⅳ期患者头颈鳞癌组织中相对表达量为0.358±0.587,显著高于Ⅰ+Ⅱ期患者头颈鳞癌组织中的相对表达量0.219±0.416(t = -2.803,P < 0.05)。生存分析发现,lncRNA MNX1-AS1 高表达组的患者总生存率显著低于低表达组患者总生存率(P < 0.05),其中中位生存时间分别为 42.97 个月、61.27个月(图2)。

图2 LncRNA MNX1-AS1表达与患者临床参数的关系Figure 2.Relation of LncRNA MNX1-AS1 Expression to Clinical Parameters of Patients
2.3 LncRNA MNX1-AS1敲降效果
结果显示,相比对照组si-NC,FD-LSC-1实验组细胞转染siRNA (si-lncRNA MNX1-AS1-635和si-lncRNA MNX1-AS1-986)之后的相对表达量分别为0.597±0.064和 0.557±0.023,t值分别为10.866和 33.250,均 P < 0.001;CAL-27实验组中的相对表达量分别为0.473±0.125(t = 7.296,P <0.05) 和 0.460±0.056(t = 16.799,P < 0.001)。Detroit562实验组中的相对表达量分别为0.500±0.205和0.563±0.185(t = 4.221,t = 4.094,均 P < 0.05),达到预期敲降效果(图3)。
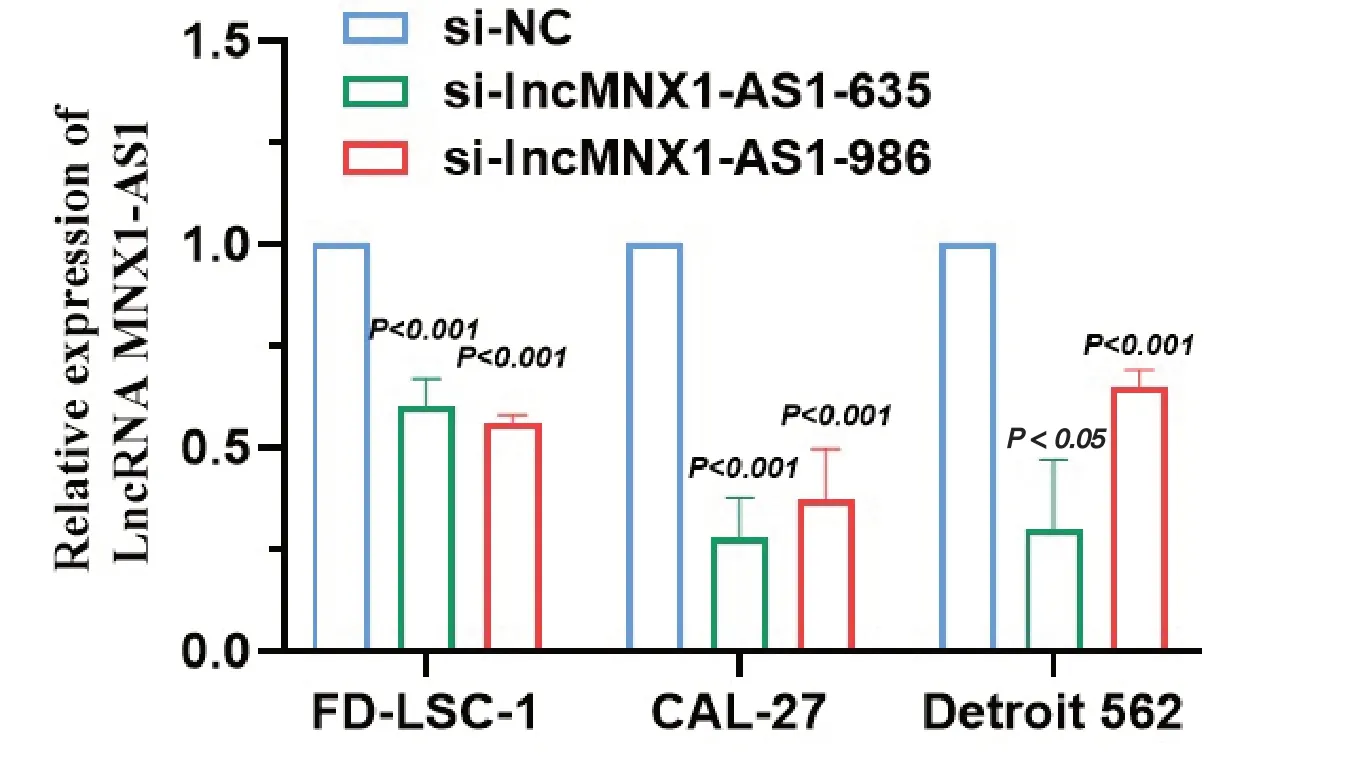
图3 转染siRNA后头颈鳞癌细胞系中lncRNA MNX1-AS1的相对表达量Figure 3.Expressions of lncRNA MNX1-AS1 in HNC Cell Lines after Being Transfected by siRNA
2.4 LncRNA MNX1-AS1对头颈癌细胞增殖活力的影响
生长曲线结果显示,转染si-lncRNA MNX1-AS1后,3个头颈鳞癌细胞系的增殖活力均下降,t值分别为 11.920和 10.331、28.382±0.201和 27.976、5.311 和 4.394, P 均 < 0.05(图 4)。

图4 LncRNA MNX1-AS1对头颈鳞癌细胞系增殖活力的影响Figure 4.Effects of LncRNA MNX1-AS1 on the Viability of HNC Cell Lines
2.5 LncRNA MNX1-AS1对头颈癌细胞的克隆形成能力的影响
结果显示,转染si-lncRNA MNX1-AS1后,3个头颈鳞癌细胞系克隆形成能力均显著低于阴性对照 si-NC组,t值 分 别 为 10.577和 19.101、4.246和7.515、3.707和8.241,差异具有统计学意义(P < 0.05),见图 5。
2.6 头颈鳞癌细胞系敲降lncRNA MNX1-AS1后迁移能力的变化
结果显示,转染si-lncRNA MNX1-AS1后,3个头颈鳞癌细胞系的迁移能力均显著低于阴性对照si-NC组,差异具有统计学意义(P < 0.05),结果表明敲降lncRNA MNX1-AS1显著抑制头颈鳞癌细胞系的迁移能力(图6)。

图6 LncRNA MNX1-AS1对细胞迁移能力的影响Figure 6.Effects of LncRNA MNX1-AS1 on the Migration of HNC Cell Lines
2.7 头颈鳞癌细胞系敲降lncRNA MNX1-AS1后侵袭能力的变化
Transwell侵袭实验结果如图7。结果显示转染si-lncRNA MNX1-AS1后,3个头颈鳞癌细胞系的侵袭能力均显著低于阴性对照si-NC组,差异具有统计学意义(P < 0.05),结果表明敲降 lncRNA MNX1-AS1显著抑制头颈鳞癌细胞系的侵袭能力。

图7 LncRNA MNX1-AS1对细胞侵袭能力的影响Figure 7.Effects of LncRNA MNX1-AS1 on the Invasion of HNC Cell Lines
3 讨 论
肿瘤综合治疗取得了长足进步,分子靶向治疗、免疫治疗以及放化疗等方式发挥着重要作用。其中靶向治疗作为特异性较强的的治疗手段能够有效提高患者治疗疗效并延长生存期,因此寻找头颈癌新的分子治疗靶点有着重要临床意义。随着对lncRNA深入研究,发现它能在多个层面参与调控肿瘤的恶性表型,包括恶性增殖侵袭、迁移以及放化疗抵抗等诸多恶性生物学进程等[9]。本课题组前期通过TCGA数据库分析头颈癌组织中差异表达的lncRNA,发现lncRNA MNX1-AS1在头颈癌组织中差异表达,可能是头颈癌中重要的分子靶点。因此我们进一步探讨了lncRNA MNX1-AS1在头颈癌中的细胞生物学功能与临床价值。
LncRNA MNX1-AS1已经被证实参与多种癌症的发生发展过程,如,lncRNA MNX1-AS1在恶性胶质瘤中表达上调且促进癌细胞的侵袭[8];在宫颈癌组织和细胞中显著上调,并通过MAPK通路参与癌症进展[7];在骨肉瘤组织中高表达并通过抑制KISS1来促进骨肉瘤细胞的增殖和侵袭[10];在卵巢癌中表达显著上调,敲降lncRNA MNX1-AS1后细胞的增殖、迁移和侵袭能力显著下降[11];前列腺癌中lncRNA MNX1-AS1表达上调影响了癌细胞的活力、侵袭和迁移并且通过miR-2113来调节癌症的进展[12],Liu 等[13]发现 lncRNA MNX1-AS1 促进肺腺癌的发生发展通过下游miR-34a/SIRT1信号通路。此外,还有许多关于lncRNA MNX1-AS1在癌症中高表达并且影响癌细胞的增殖、侵袭和迁移作用的相关研究[10,14-20]。以上报道表明 lncRNA MNX1-AS1与肿瘤的增殖和转移相关,与上述结果一致。本研究采用siRNA干扰lncRNA MNX1-AS1的表达,功能实验发现头颈癌细胞增殖活力、侵袭和迁移能力均降低,但目前关于lncRNA MNX1-AS1在头颈癌中的作用机制的相关研究较少,其机制尚不清楚,应予以进一步深入探索。
综上,本研究发现lncRNA MNX1-AS1在头颈癌中异常高表达,发挥促进肿瘤细胞增殖、迁移和侵袭的重要生物学功能,可能是头颈癌中重要的新型分子靶点。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
