趋化因子CXCL11与其受体CXCR3在口腔鳞状细胞癌中的表达及临床意义*
2023-05-29李勇李全乔飞刁艳菲黄云生戚晓峰安莉
李勇,李全,乔飞,刁艳菲,黄云生,戚晓峰,安莉
215004 江苏 苏州,苏州大学附属第二医院 口腔科(李勇、李全、黄云生、戚晓峰);215002 江苏 苏州,苏州卫生职业技术学院附属口腔医院 牙体牙髓病科(乔飞、刁艳菲、安莉)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面头颈部最常见的恶性肿瘤之一,该病五年生存率不足50%[1],好发于唇、舌、牙龈等部位[2],具有较高的复发率和转移率。寻找与OSCC发生、转移及预后相关的蛋白质和基因,将有助于医务工作者进行疾病的预防筛查和治疗。
CXC型趋化因子配体11(C-X-C-motif chemokine ligand11, CXCL 11)是趋化因子家族中的一员,机体稳定状态下,具有运输免疫细胞、诱导细胞增殖和凋亡等功能。但在肿瘤组织中, CXCL11常与CXC趋化因子受体3(C-X-C-motif chemokine receptor 3,CXCR3)结合,进而调节各种实体瘤的生长和转移。CXCL11在肿瘤发生的部位可与受体结合进而刺激下游信号通路,这些信号通路参与癌细胞的致瘤性、凋亡、血管生成、侵袭和转移[3-5]。然而,CXCL11和CXCR3在口腔鳞癌中的表达情况和作用尚不明确。本研究通过生物信息学手段分析相关基因差异表达的情况,通过采取免疫组化染色法检测CXCL11和CXCR3的表达情况,探讨CXCL11及受体CXCR3与OSCC发生、转移之间的相关性,为OSCC的治疗找到新的靶点,为探索OSCC发生侵袭和迁移的机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 研究对象 随机选取2015年1月至2022年9月间苏州大学附属第二医院就诊,且病理科已确诊的口腔鳞癌患者肿瘤组织石蜡标本67例作为OSCC组。同时选取从口腔外科其他手术切取的正常口腔黏膜组织28例,作为对照组。所有标本均由患者自愿提供,并经过苏州大学附属第二医院伦理委员会审批同意(伦理文件批号:JDLK-2022-166-01)。
1.1.2 主要仪器及试剂 Leica RM2016切片机(上海徕卡仪器有限公司),组织摊片机(金华市科迪仪器设备有限公司),烤箱(上海慧泰仪器制造有限公司),显微镜(尼康仪器有限公司);CXCL11兔抗人多克隆抗体购自江苏亲科生物研究中心有限公司, 兔抗人多克隆CXCR3抗体购于美国Abcam 公司。SP免疫组化试剂盒、DAB 试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 生物信息学方法 本研究在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索关键词“oral”“cancer”“tumor”相应的数据集,下载微列阵数据GSE30784进行分析,以正常口腔黏膜组作为对照,从而分析口腔鳞癌中差异表达的基因。同时利用Cytoscape 3.7.2 数据库进行基因本体(Gene Ontology,GO)的富集分析,检验差异表达基因在某个网络中是否富集,分析上调的差异表达基因的生物学行为。
1.2.2 资料收集 所选取病例均已经过手术治疗,术前未曾接受化疗、放疗等其他辅助治疗。通过借阅OSCC组术后病理报告及查阅患者的住院记录,对所选取的病理标本进行分析。依据国际抗癌联盟2010版的原则进行分类,并记录患者性别、年龄、肿瘤直径、分化程度及淋巴结转移情况等信息,同时电话随访所有实验组患者,收集其术后生存状态。对照组则选自如外伤创缘修整、开窗助萌等手术过程中废弃的正常口腔黏膜组织。将以上收集到的信息进行整理。
1.2.3 免疫组织化学染色 对所选取的石蜡标本做4 μm厚连续切片,切片置烤箱中以67℃烤90 min,脱蜡,水化,枸橼酸抗原修复液进行抗原修复,喷气后3 min,室温冷却,PBS冲洗 5 min×3 次,滴加CXCL11多克隆抗体 (1∶200) 及CXCR3多克隆抗体 (1∶200) ,4℃恒温下孵育过夜,次日滴入二抗工作液,37℃ 孵育 30 min ; 使用蒸馏水冲洗 3 min ,继而 PBS 冲洗 3 min × 3 次; DAB 显色,蒸馏水冲洗终止显色反应。苏木精复染,蒸馏水充分冲洗,梯度乙醇脱水,二甲苯透明,封片。
1.3 免疫组化结果判定
所用切片经过两位专职的病理科医师,双盲法进行独立评估,互换切片后,再次进行判断,当结果有异,交换意见或由上级医师做最终判断。随机选取每个切片5个高倍镜(×400)下无重叠的视野,各视野分别计数200个细胞,根据染色的强弱及阳性细胞的占比情况,采取半定量积分法进行分析:(1)根据染色强度:无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;(2)阳性细胞比率0~5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分,将染色强度评分与相应的阳性细胞比率评分乘积(0~12)作为判定依据,乘积≥2计为阳性,乘积 < 2计为阴性。
1.4 统计学方法
本实验应用 SPSS 26.0 统计软件对数据进行统计分析,通过χ2检验分析 CXCL11和 CXCR3的表达与口腔鳞癌临床病理特征之间的关系,对CXCL11和CXCR3在OSCC中的表达相关性分析采用Spearman 等级相关性分析,采用Kaplan-Meier对存活率进行分析,并应用对数秩检验计算差异,以P < 0.05 为差异有统计学意义。
2 结 果
2.1 生物信息学结果
在GSE30784数据集中,共167例OSCC样本和45例正常口腔黏膜组织样本纳入研究,CXCL11在OSCC组与对照组中呈现差异性表达,且CXCL11在OSCC 中表达上调(LogFC = 3.545,P <0.001),位于火山图中红色区域(图1A)。进一步通过GO富集分析,结果显示CXCL11主要富集于细胞侵袭和细胞迁移(图1B),说明CXCL11可能参与了OSCC的发生发展过程。
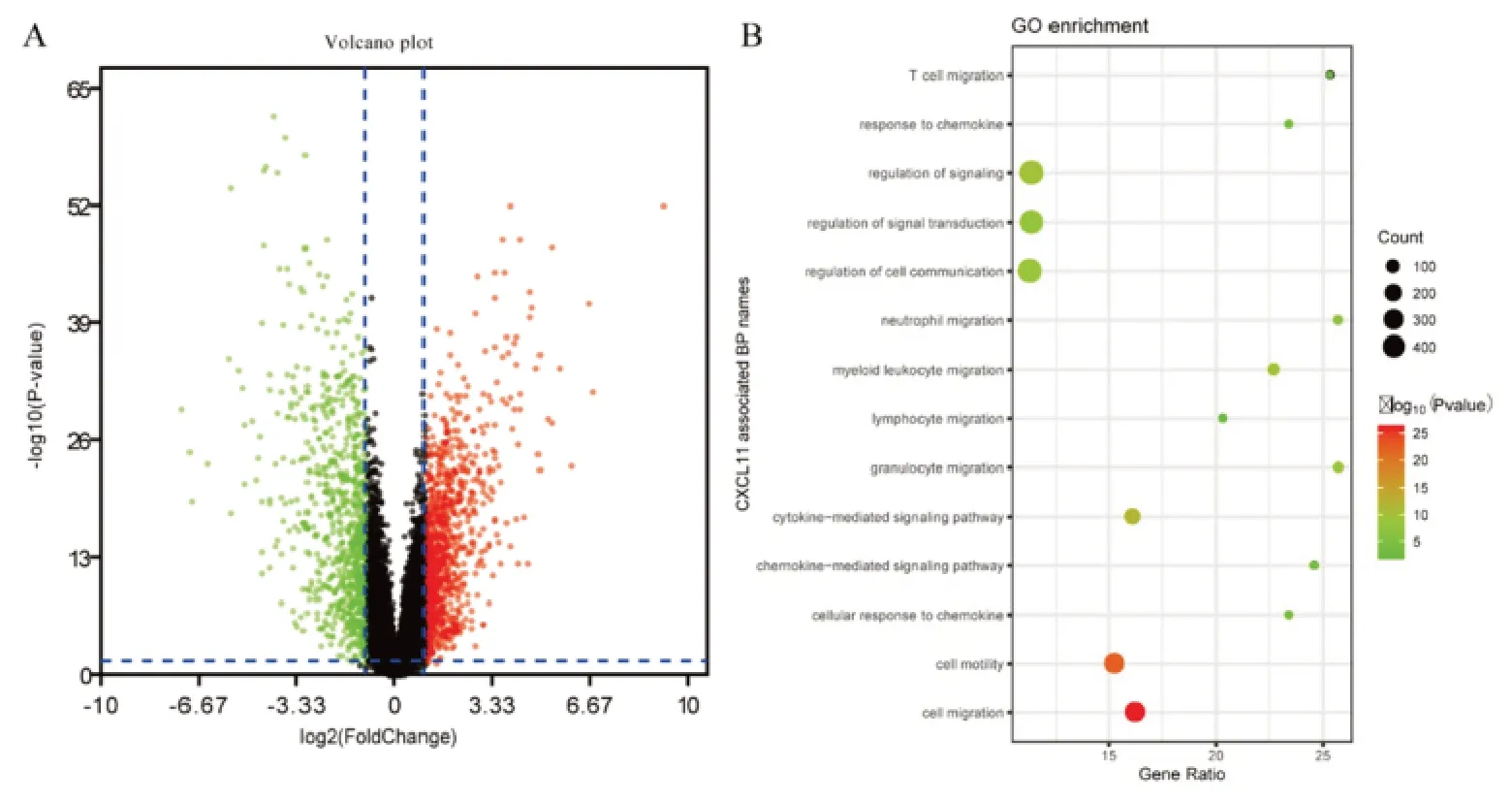
图1 生物信息学结果分析Figure 1.Analysis of Bioinformatics Results
2.2 免疫组化结果
图2显示CXCL11表达于细胞质中,弥漫或散在分布,表现为棕色、棕褐色颗粒;CXCR3主要定位于细胞膜和细胞质中,阳性表达的细胞被染色为黄色、棕色或棕褐色。
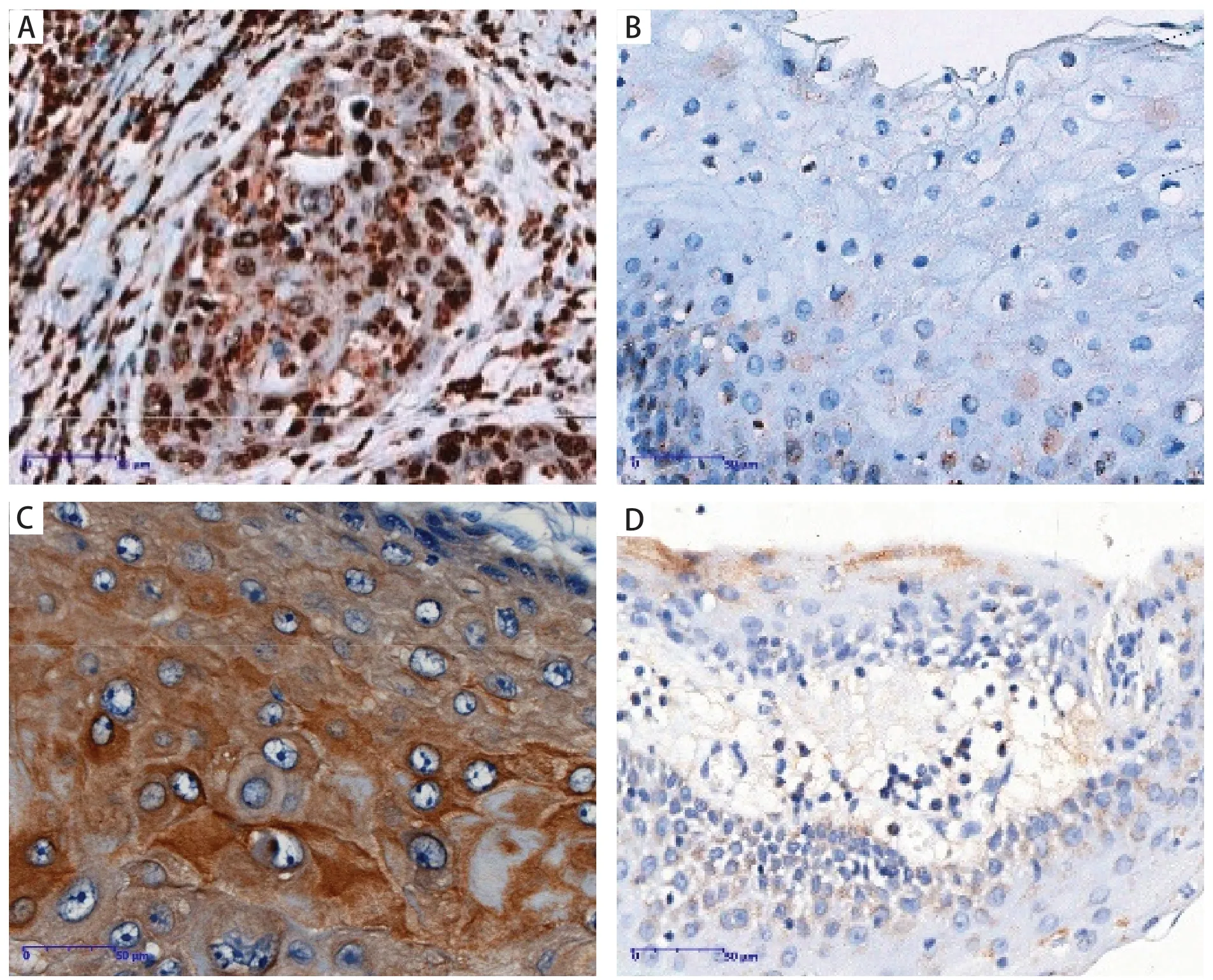
图2 CXCL11和CXCR3在OSCC组织和正常口腔黏膜组织中的表达(SP法,×400)Figure 2.Expressions of CXCL11 and CXCR3 in OSCC (SP, ×400) and Normal Oral Mucosa Tissues (SP, ×400)
2.3 CXCL11和CXCR3在OSCC及正常口腔黏膜组织中的表达
CXCL11及CXCR3在OSCC组中阳性表达率分别为 68.7%(46/67)和 74.6%(50/67),显著高于在对照组中的检出率32.1% (9/28)和39.3%(11/28),两组之间差异具有统计学意义(P < 0.05;表1)。

表1 CXCL11和CXCR3在正常口腔黏膜和口腔鳞癌组织中的表达Table 1.Expressions of CXCL11 and CXCR3 in Normal Oral Mucosa and Oral Squamous Cell Carcinoma Tissues
2.4 OSCC组中CXCL11、CXCR3与临床病理参数的关系
OSCC组中高分化口腔鳞癌42例,中、低分化25例;男性37例,女性30例;肿瘤直径 > 4 cm 有27例,≤4 cm 有40例;患者年龄34~82岁;临床分期:I~II期48例,III~IV 期19例;淋巴结转移26例,无淋巴结转移41例。表2结果显示,CXCL11的阳性表达与OSCC的分化程度(χ2= 13.856,P < 0.001)、临床分期程度(χ2= 5.341,P = 0.021)、淋巴结转移(χ2= 5.028,P = 0.025)之间具有显著相关性,差异均有统计学意义;CXCR3的阳性表达与 OSCC 分化程度(χ2= 6.357,P = 0.012)、临床分期程度(χ2= 5.664,P = 0.017)、淋巴结转移(χ2=7.015,P = 0.008)相关。然而,CXCL11 和 CXCR3与患者的年龄、性别、肿瘤直径的大小均无关,差异无统计学意义(P > 0.05)。
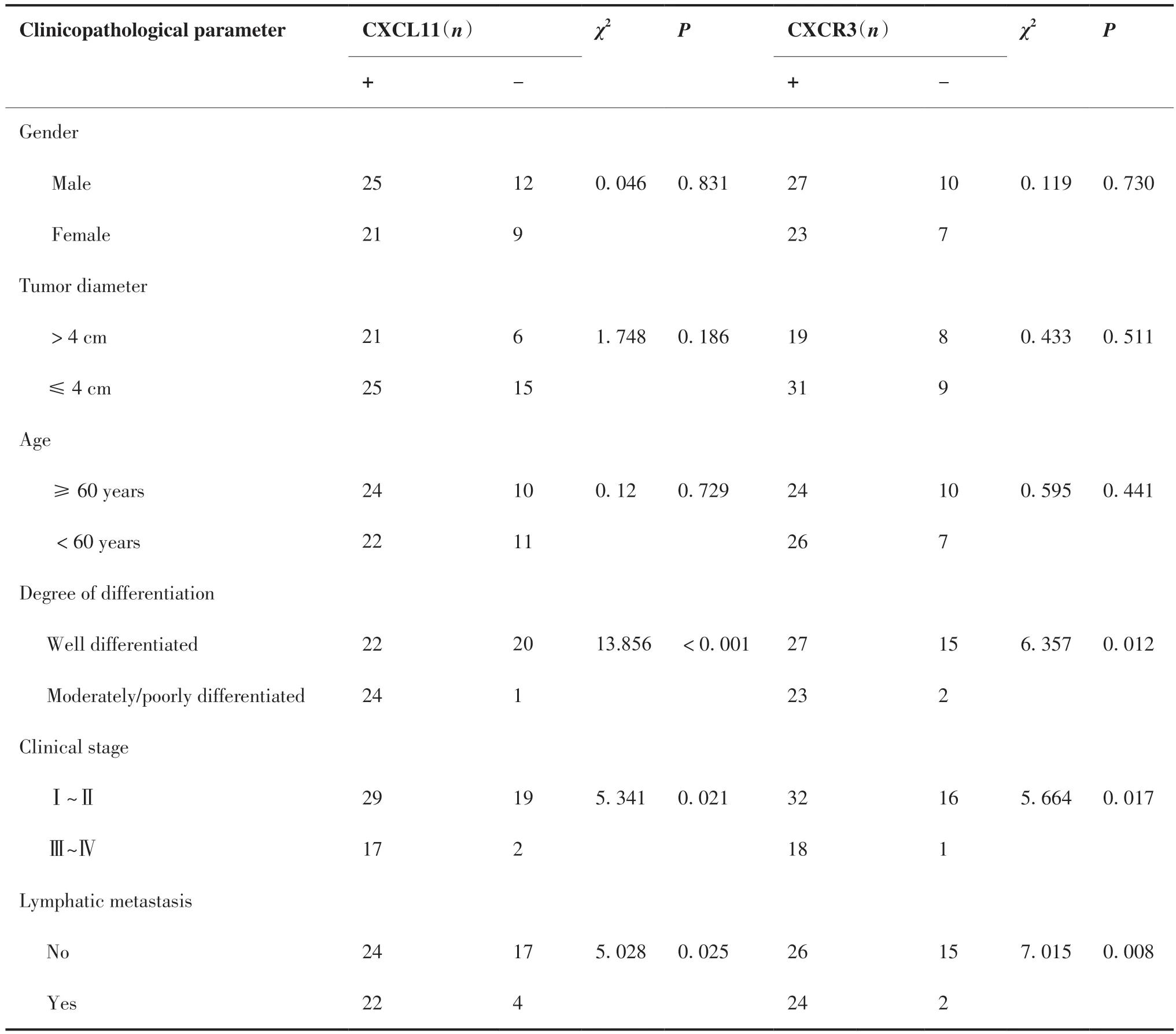
表2 CXCL11和CXCR3的表达与口腔鳞癌临床病理参数的关系Table 2.Relationship between the Expression of CXCL11 and CXCR3 and the Clinicopathological Parameters of Oral Squamous Cell Carcinoma
2.5 OSCC组织中CXCL11和CXCR3 表达的相关性
67例口腔鳞癌组织中,CXCL11阳性表达有46例,表达率为68.7%,CXCR3阳性表达50例,表达率为74.6%。Spearman相关性分析检验显示:r= 0.271,P = 0.026,二者的表达可能存在相关性。
2.6 CXCL11和CXCR3的表达与OSCC患者5年生存期情况
随访2015年1月至2017年12月期间诊治的31位患者,肿瘤未发生复发、转移的存活病例共13例,其中CXCL11阳性表达有7例,CXCR3阳性表达有8例;复发或死亡病例共18例,其中CXCL11阳性表达14例,CXCR3阳性表达有15例。结合免疫组化实验结果进行Kaplan-Meier 生存分析(图 3、4),结果表明:OSCC患者较短的生存期可能与 CXCL11、CXCR3阳性表达有关(HR = 4.456,P = 0.016;HR = 3.579,P = 0.036)。

图3 CXCL11表达与口腔鳞癌患者生存期分析Figure 3.CXCL11 Expression and Survival of Patients with OSCC

图4 CXCR3表达与口腔鳞癌患者生存期分析Figure 4.CXCR3 Expression and Survival of Patients with OSCC
3 讨 论
机体内免疫细胞受到多种不同细胞因子的调控,CXCL11与CXCR3的结合能诱导这些免疫细胞迅速浸润病变区域[6-7]。CXCL11经靶细胞分泌后,与表达于活化的T细胞、B细胞和NK细胞表面的CXCR3特异性结合,诱导细胞靶向迁移和免疫反应,在感染、自身免疫疾病和肿瘤免疫中发挥重要作用[8]。大量研究证实二者在多种恶性肿瘤中表达上调,朱晓斌[9]观察到CXCL11和CXCR3在晚期非小细胞肺癌组织中表达升高。在一项关于结直肠癌的研究中,也发现二者与肿瘤的发生存在较强的相关性[10]。本实验通过在GEO数据库下载GSE30784微阵列数据,观察到CXCL11在OSCC组织中的表达显著上调,与正常组织相比差异具有统计学意义(LogFC = 3.545,P < 0.001)。免疫组化实验结果显示,在OSCC组织中,CXCL11和CXCR3的阳性表达率分别为 68.7%(46/67)和 74.6%(50/67),与正常组织中的表达情况32.1% (9/28)和39.3%(11/28)相比,表达率明显增加,差异具有统计学意义(P < 0.001)。与王伊婷[11]在小鼠动物模型上取得的实验结果相似。在肿瘤生长过程中,CXCL11和CXCR3可以通过招募Th细胞、MDSCs和调节性T细胞,参与肿瘤的构建[12]。因此,作者认为CXCL11、CXCR3的表达上调可能与OSCC的发生存在一定的关联。
CXCL11与CXCR3的结合,具有促进肿瘤血管的生成、募集肿瘤细胞进行定植的能力,通过这样的方式可以促进卵巢癌[13]、多形性胶质母细胞瘤[14]、胆囊癌[15]等肿瘤的侵袭和淋巴结转移。本实验对生物信息学数据进行GO富集分析,继而绘制GO富集散点图,发现CXCL11富集于细胞侵袭和细胞迁移,表明CXCL11可能参与了OSCC的转移过程。结合免疫组化结果分析CXCL11、CXCR3与OSCC临床病理之间的关系,发现二者的表达与肿瘤分化程度、临床分期及淋巴结转移之间有相关性,差异具有统计学意义(P < 0.05) ,而与患者年龄、性别、肿瘤直径的大小均无关,差异无统计学意义(P > 0.05)。因此,本课题组猜想 CXCL11、CXCR3的过表达可能与促肿瘤作用相关(例如促进细胞增殖、趋化、侵袭和转移等),并最终导致不良结局的出现。
上皮间充质转化是肿瘤早期转移的关键步骤,这一过程中CXCL11和CXCR3的特异性结合起到了驱动作用[12]。Nazari等[16]发现,通过对 CXCL11-CXCR3轴进行干预,可以抑制膀胱癌的血管生成,导致肿瘤组织发生退化。对于大肠癌的一项研究发现,癌相关成纤维细胞分泌过表达的CXCL11,上调CXCR3,CXCL11-CXCR3的相互作用可激活PI3K/AKT通路,PI3K和AKT1磷酸化水平升高,导致癌组织中E-钙粘蛋白减少、波形蛋白增多,肿瘤的迁移和侵袭得到促进[17]。在本实验中,可以在OSCC组织中观察到CXCL11和CXCR3的过表达可能存在相关性(r = 0.271,P = 0.026)。因此,本课题组推测在OSCC发生的早期,对CXCL11-CXCR3轴进行干预,可能会对肿瘤的血管生成产生抑制作用,干扰肿瘤的侵袭和转移。
大量研究表明CXCL11和CXCR3的表达与癌症患者的预后相关,如卵巢癌[18]、黑色素瘤[19]和结直肠癌[10], CXCL11 和 CXCR3 过表达的患者预后较差,可能是由于CXCL11-CXCR3轴通过 STAT和PI3K/AKT途径,激活了PD-L1,有助于抗肿瘤免疫逃逸作用。本研究结果显示,在OSCC组中,CXCL11阳性患者,出现复发和死亡的时间短于CXCL11阴性表达的患者(HR = 4.456,P = 0.016),CXCR3阳性患者的健康生存期也同样短于CXCR3阴性表达患者(HR = 3.579,P = 0.036),CXCL11 和CXCR3的过表达可能增加了OSCC的复发或死亡风险,对预后产生不利的影响。综上所述,OSCC的形成、侵袭、淋巴结转移,及不良临床病理分型和预后,可能与CXCL11、CXCR3的过表达存在一定的关联性。CXCL11和CXCR3作为OSCC早期检验、预后判断的标志物具有一定的可行性。本课题组后续将增加样本总量,并构建OSCC细胞模型,通过分别抑制细胞系中CXCL11和CXCR3的表达,从而验证二者在OSCC侵袭、迁移中所起到的作用,并探索其作用机制,同时考虑增加对放化疗术后患者的随访与研究。
本研究发现,趋化因子CXCL11与其受体CXCR3可能与OSCC的发生、发展、侵袭和转移有关。本实验前期采取生物信息学手段进行备选基因的筛查,有助于高效地完成目标基因的定位,继而采用免疫组化的方式分析其表达情况。有望为OSCC早期发现、诊断、治疗探寻新的诊疗方向,进而降低口腔鳞癌的发病率,减轻患者家庭及整个社会的经济负担,具有一定的社会效应。综上,CXCL11及CXCR3有望成为OSCC治疗新的靶点,不仅能够为早期OSCC的诊断及治疗提供重要的实验证据,而且也能够为靶向治疗的研究提供新思路。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
