人羊膜上皮细胞对大鼠软骨损伤的修复作用
2023-05-27王康智晓东张玉强张文景王伟
王康,智晓东,张玉强,张文景,王伟
骨性关节炎(OA)是老年人致残的主要原因之一,而且随着人口老龄化进程其发生率逐年升高[1-2]。近年来,人羊膜上皮细胞(hAECs)引起了广泛关注,与其他类型的干细胞相比,hAECs 具有扩增能力更强、避免伦理争论、低免疫原性和非致瘤性等优势[3-4]。目前已发现hAECs 在治疗肝脏疾病、神经损伤、皮肤瘢痕等领域取得了良好的效果,有望成为再生医学中一种可靠的细胞来源[5]。JAK2/STAT3 信号通路可通过参与炎症反应来调控细胞的代谢和更新,目前已证实该通路的激活对心肌细胞、肺上皮细胞、肠黏膜细胞均有保护作用[6-7]。本文通过将hAECs 移植至大鼠关节腔,其对OA软骨的修复作用,并观察JAK2/STAT3信号通路在修复过程中的激活情况,报道如下。
1 资料与方法
1.1 实验动物 剖宫产后的羊膜样本收集自2021年锦州医科大学附属第一医院妇产科,获得锦州医科大学附属第一医院医学研究伦理委员会批准,产妇术前均签署知情同意书。成年健康雄性200 ~300 g 的SD 大鼠30 只,购自锦州医科大学动物中心,动物实验获得锦州医科大学实验动物伦理审查。
1.2 OA 模型的构建 采用改良Hulth 法建立大鼠OA 模型[8],饲养8 周后进行后续实验。
1.3 实验分组 将已造模成功的雄性SD大鼠随机分为实验组和阴性对照组,另设空白对照组(健康大鼠),各10 只。0.5%异氟烷轻度麻醉大鼠后,行膝关节腔内注射。实验组:注射100lDMEM-F12(含1×106个hAECs 细胞);阴性对照组:注射100l的DMEMF12;空白对照组不做任何处理。饲养1 个月之后进行后续实验。
1.4 hAECs的原代分离、纯化、培养以及传代 PBS洗涤羊膜组织,置于灭菌培养皿中。剪成3cm2左右,移至10cm 培养皿中。加入20ml 0.25%胰酶,37 ℃,1 200 r/min,消化10 min,将获得的消化液弃去;加入20 ml 0.25%胰酶,1 200 r/min 消化40 min,加入培养基终止消化,收集消化液,用300 目细胞筛网滤过,重复3 次。收集每次获得的过滤液,4 ℃,1 200 r/min离心10 min,弃上清,重悬沉淀,接种到培养皿中。培养箱静置培养,48 h 后首次换液,用0.25%胰酶消化传代培养,光镜下观察拍照。
1.5 免疫细胞化学鉴定hAECs 取第3 代hAECs,0.25%胰酶消化,接种于培养皿中,孵箱培养。24 h后PBS 洗涤,固定;通透,PBS 洗涤。封闭后,滴加一抗CK19 或Vimentin,4 ℃过夜,PBS 洗涤。滴加二抗,孵育1 h,PBS 洗涤。避光孵育5 min,PBS 洗涤;封片,镜下观察。
1.6 流式细胞仪鉴定hAECs 取第3 代hAECs,0.25%胰酶消化,分装到1.5 ml EP 管中。1 200 r/min离心5 min,弃去上清液,加入0.3%BSA 溶液,每管200l,室温密封30 min,1 200 r/min 离心5 min。弃上清,加入小鼠抗人单克隆抗体分化簇CD29、CD34、CD44、CD45、CD73、CD90、CD105,4 ℃静置20 min。PBS洗涤2 次,上流式细胞仪检测细胞表型。
1.7 膝关节软骨大体及组织化学染色观察 取大鼠膝关节行大体观察。制作切片染色10min,PBS 洗涤,分化15 s,见切片变红,水洗2 min,甩干。返蓝10 s,水洗2min,甩干。滴加伊红染色液,染色45s。依次经过梯度乙醇脱水,二甲苯透明,封片,显微镜下观察。
1.8 免疫组化染色检测COL2、MMP和TIMP表达将石蜡切片加热2h。脱蜡,自来水洗5min,将脱蜡后的切片置于柠檬酸钠抗原修复液中,水浴50min。取出切片,PBS 清洗,加入COL2、MMP和TIMP 一抗,每张切片50l,4 ℃过夜,37 ℃复温45 min,PBS 洗涤。滴加二抗,室温孵育1 h。以DAB 显色液显色,脱水,二甲苯透明,封片,镜下观察。
1.9 Masson 染色 取大鼠膝关节,制石蜡切片,脱蜡,铬化。染核5 ~10 min。充分水洗,用丽春红酸性复红液5 ~10 min。以2%冰醋酸水溶液浸洗片刻,1%磷钼酸水溶液分化3 ~5min。苯胺蓝染5min,0.2%冰醋酸水溶液浸洗,脱水、二甲苯透明、封片,镜下观察拍照并记录。
1.10 番红固绿染色 取大鼠膝关节,制石蜡切片。脱蜡,自来水洗,固绿染色,自来水冲洗,至软骨呈无色,分化液浸泡,自来水稍洗。番红染色:切片入番红染液15 ~30 s,脱水,透明封片,观察拍照。
1.11 ELISA检测炎症因子含量 取冻存滑膜样本加入PBS,充分研磨,4℃条件下,2000r/min,离心20min,收集上清液,同时取冻存血清样本。细胞因子TNF- 、IL-1 、-IFN、IL-6 和IL-7 分别按厂家说明书用ELISA 试剂盒检测。
1.12 Western-bolt 检测EGFR信号通路相关蛋白取大鼠膝关节软骨组织,用Trizol 法提取蛋白质,经定量后取60g 蛋白质,凝胶电泳,转膜,滴加p-JAK2、JAK2、p-STAT3 和STAT3 一抗,4 ℃孵育过夜。滴加二抗,室温孵育2 h。加入A、B 液(ECL 系统)后化学发光,使用Quantity One 分析软件进行蛋白条带的定量分析。
1.13 统计方法 使用Image J 和SPSS 20.0 进行统计分析,计量资料以均数±标准差表示,3 组比较采用单因素方差分析,多重比较采用LSD 检验或NewmaneKeuls 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 hAECs 的特征鉴定 接种后2 d 内,细胞黏附在壁上,原代细胞(P0)呈现散在细胞团生长,第1 代和第2 代的hAECs增殖速度最快,第3 代hAECs形态最为典型,显示出铺路石样的上皮细胞形态,第4代胞质逐渐铺开,出现老化现象,见图1a;免疫荧光染色显示CK19 强表达,Vimentin 弱表达,见图1b;流式细胞术检测hAECs 表面标志物的表达,结果显示CD29、CD44、CD73、CD90 和CD105 呈阳性,CD34 和CD45 呈阴性,见图1c。
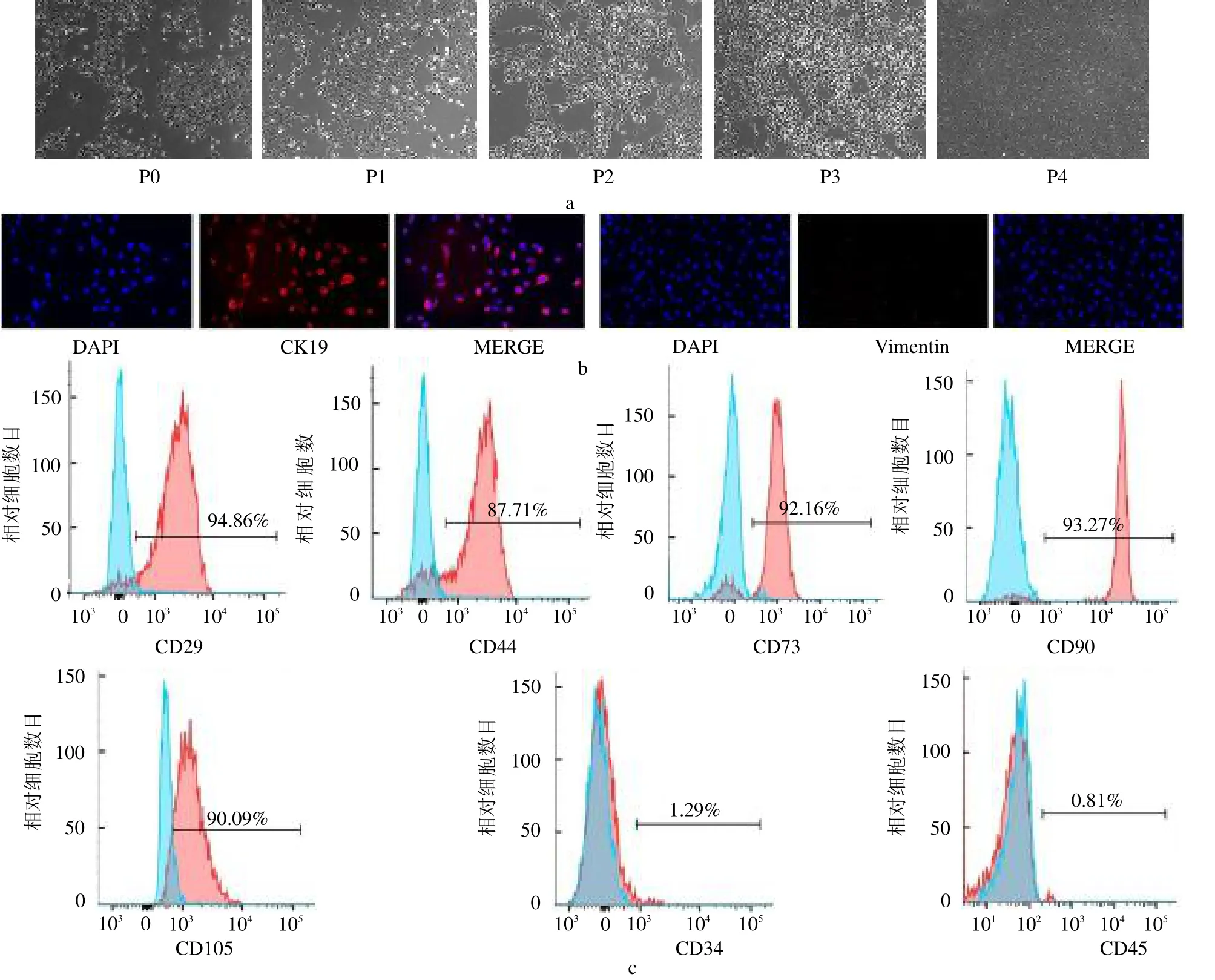
图1 hAECs 形态观察(×400),免疫荧光(×400)及流式细胞仪鉴定
2.2 关节软骨病理切片分析 观察各组软骨组织的大体形态,空白对照组膝关节软骨面光滑,无充血、裂纹等;阴性对照组关节腔内有明显关节积液,软骨表面磨损部分脱落缺损;实验组软骨表面较为光滑,可观察到明显的软骨再生。HE 染色显示空白对照组关节滑膜细胞形态良好,未见明显炎性细胞浸润;阴性对照组纤维软组织伴局部胶原化变,伴部分炎性细胞浸润;实验组关节腔面局部稍粗糙,纤维间质形态较规则,炎性细胞浸润不明显,见图2。

图2 大鼠膝关节大体观察和镜下观察(HE,×50)
2.3 Masson 染色和番红固绿染色观察 Masson 染色中,空白对照组染色正常,软骨胶原密集且排列整齐,表层光整,形态和分布均匀;阴性对照组的软骨蓝绿色染色丢失严重,表层不光整;实验组软骨排列略显不规则,但相较于阴性对照组软骨染色几乎保持完整着染,表层光整。番红固绿染色中,空白对照组显示软骨排列整齐,层次清晰,潮线完整;阴性对照组软骨细胞排列紊乱,中度失染,潮线模糊;实验组软骨细胞增生明显,排列稍乱但层次可分,见图3。
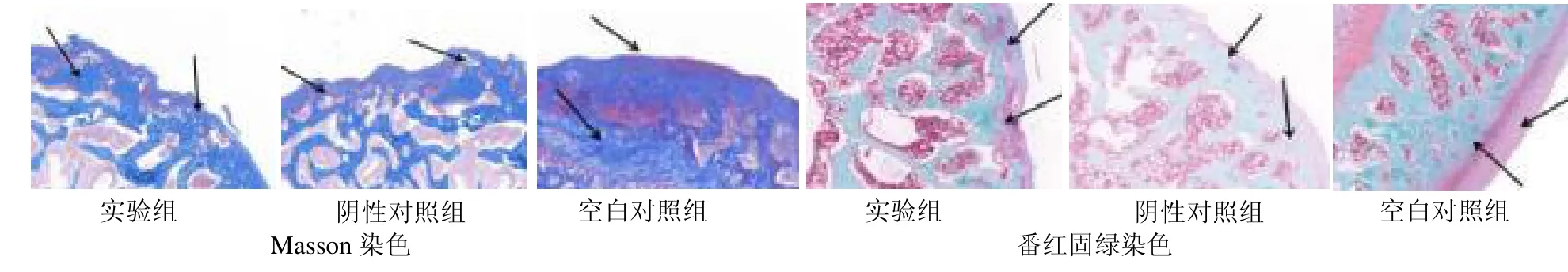
图3 大鼠膝关节软骨Masson 和番红固绿染色(×20)
2.4 COL2、MMP 和TIMP 免疫组化分析 COL2、MMP 和TIMP 蛋白表达均表达于细胞质(呈棕黄色颗粒)。阴性对照组的COL2 和TIMP 表达强度明显弱于空白对照组,MMP 表达强于空白对照组;实验组COL2 和TIMP表达强度明显强于阴性对照组,MMP 表达弱于阴性对照组,见图4。
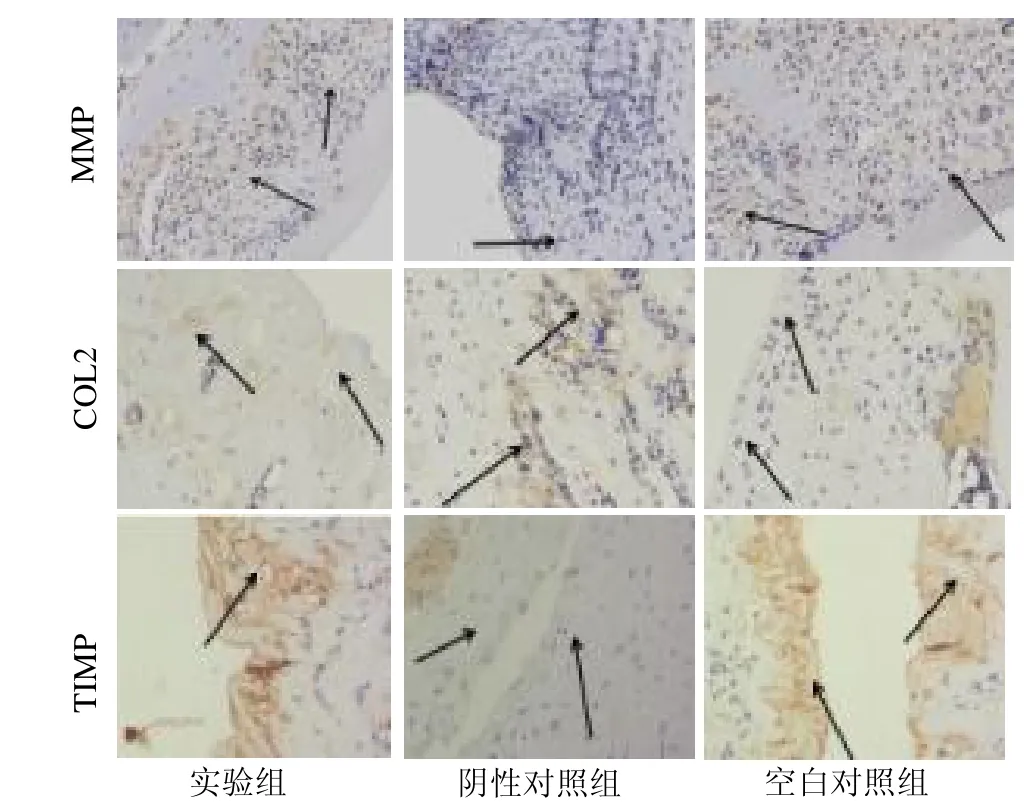
图4 大鼠膝关节软骨COL2、MMP 和TIMP表达(免疫组织化学染色,×20)
2.5 各组大鼠血清及滑膜中炎症因子含量比较 3组大鼠血清及滑膜中炎症因子含量差异均有统计学差异(F≥30.561,均P <0.05)。阴性对照组大鼠的血清及滑膜中TNF- 、IL-1 、-IFN、IL-6 和IL-7 含量均明显高于空白对照组(均P <0.05),实验组大鼠血清及滑膜中TNF- 、IL-1 、-IFN、IL-6 和IL-7 含量均明显低于阴性对照组(均P<0.05),见表1 ~2。

表1 各组大鼠血清中炎症因子含量比较

表2 各组大鼠滑膜中炎症因子含量比较
2.6 Western-bolt 检测JAK2/SATA3 信号通路相关蛋白表达情况 3 组大鼠膝关节软骨JAK2/SATA3 信号通路相关蛋白表达量差异均有统计学差异(F=34.176、9.273,均P <0.05)。阴性对照组内蛋白表达检测与空白对照组相比,p-JAK2 与p-STAT3 蛋白表达量均减少(均P <0.05)。实验组p-JAK2 与p-STAT3 蛋白表达量均高于阴性对照组(均<0.05),见封三彩图1。
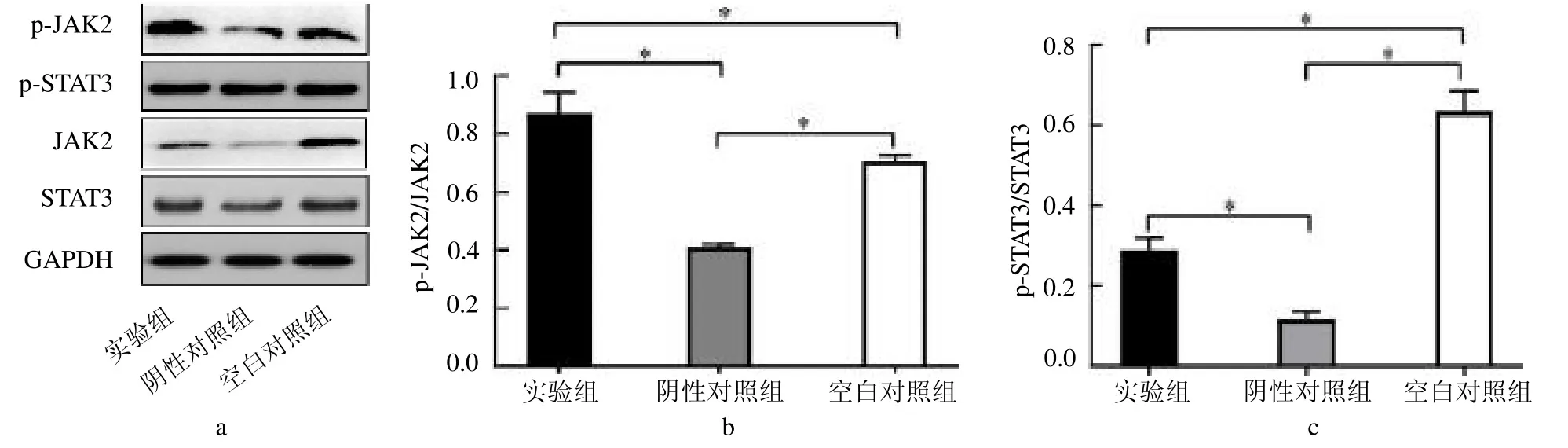
图1 各组大鼠膝关节软骨JAK2/SATA3 信号通路相关的蛋白表达
3 讨论
近年来,干细胞治疗OA 的良好效果受到了普遍的关注,在安全性、疼痛缓解和软骨再生方面显示出巨大潜力。本研究将提取到的hAECs 进行形态学观察、免疫荧光和流式细胞术鉴定,结果表明hAECs呈现典型的铺路石样形态,高表达CK19 而不表达波形蛋白。流式细胞仪检测结果表明提取的hAECs 表达干细胞表面标记物,与之前的研究结果一致[9-10]。
目前认为,COL2 是维持正常软骨结构、功能的重要组成部分之一[11],而MMP和TIMPs的变化能反映出软骨基质中Ⅱ型胶原的代谢变化[12]。本研究发现移植hAECs 能明显减轻软骨磨损,减少炎性细胞浸润;未接受hAECs 移植的OA 大鼠COL2 和TIMP表达和正常大鼠相比明显减弱,MMP 表达增强,而在移植了hAECs之后,COL2 和TIMP表达明显增多,而MMP 表达减弱。这表明hAECs 能有效调节大鼠软骨中COL、MMP 和TIMP 的含量,保护软骨细胞,修复受损组织,起到延缓关节软骨退变的作用。另外,本研究结果显示阴性对照组OA大鼠血清及滑膜中TNF- 、IL-1 、-IFN、IL-6 和IL-7 水平均高于空白对照组,移植hAECs 后可明显抑制上述炎症因子表达。这提示hAECs 可通过抑制OA 大鼠血液系统及局部滑膜部位炎性反应而改善大鼠膝关节结构及功能。
JAK2/STAT3 信号通路是调控OA 病程进展中重要的通路之一。本研究对比了各组JAK2/STAT3信号通路的相关蛋白的表达情况,结果显示p-JAK2和p-STAT3 在阴性对照组中表达相较于健康大鼠减弱,而在移植了hAECs 进行治疗后表达增强。因此,本研究认为hAECs 对于OA 的炎症因子、胶原蛋白以及相关蛋白酶的表达是通过JAK2/P-STAT3 信号通路来调控的。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王康:实验设计、实验操作、统计分析、论文撰写;智晓东:实验指导、数据整理;张玉强、张文景:细胞培养、实验检测;王伟:研究指导、论文修改、经费支持
