核转录因子-κB在慢性间歇低氧大鼠各脏器的表达及其介导的炎症因子变化
2023-05-24吴格怡黄心蔚郑美乔刘嘉慧
吴格怡 黄心蔚 郑美乔 刘嘉慧
(广东医科大学附属第二医院呼吸与危重症学科,湛江,524000)
阻塞性睡眠呼吸暂停低通气综合征(Obstructive Sleep Apnea-hypopnea Syndrome,OSAHS)是临床常见而又容易忽略的疾病,可引起多脏器损害,可并发原发性高血压、糖尿病、冠心病、心脑血管意外等全身性疾病,其根本原因为夜间的慢性间歇低氧引起的损害[1-3]。核转录因子-κB(NF-κB)是一种核转录因子,有观点认为OSAHS反复发作的呼吸暂停和低通气可激活一系列炎症相关机制,如慢性间歇缺氧条件下NF-κB的活化[4]。NF-κB与OSAHS之间的关系尚不十分明确。本研究观察核转录因子-κB(NF-κB)在正常大鼠及慢性间歇低氧大鼠的表达差异及其信号通路介导的慢性间歇低氧大鼠机体多种炎症因子变化。
1 材料与方法
1.1 材料
1.1.1 动物 选择广东医科大学动物研究实验中心提供标准SD雄性大鼠30只,体质量(210±20)g,实验动物合格证号:SYXK(粤)2020-0034。所有大鼠均在正常环境中以普通饲料及饮用水喂养8周。
1.1.2 药物 苯甲基磺酰氟(PMSF)裂解液(上海谷研实业有限公司,GOYK97200),10%水合氯醛(上海酶联生物科技有限公司,货号:mlsw-2012)。
1.1.3 试剂与仪器 间歇缺氧舱(S1008型,间歇氧浓度控制系统,上海玉研科学仪器有限公司),酶联免疫吸附法(ELISA)血清单核细胞趋化蛋白-1试剂盒(MCP-1,上海化邦生物科技有限公司,货号:HBP37057R)、肿瘤坏死因子-α试剂盒(TNF-α,西格玛奥德里奇(上海)贸易有限公司,货号:T6674-10UG,)、白细胞介素-6试剂盒(IL-6,上海化邦生物科技有限公司,货号:HBP31372R)、IL-8试剂盒(上海化邦生物科技有限公司,货号:HBP31375R)、C-反应蛋白试剂盒(CRP,深圳瑞清生物信息科技有限公司,货号:RQ-P-R0128,),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒((克拉玛尔)上海谱振生物科技有限公司),TBST洗涤缓冲液(深圳逗点生物技术有限公司,货号:TBST-510),辣根过氧化物酶标记山羊抗兔IgG二抗(南京沃博生物科技有限公司,货号:A21020),超敏ECL化学发光检测试剂盒WB显影液(南京江苑生物科技有限公司,货号:JY01051)。
1.2 方法
1.2.1 分组与干预方法 按随机原则分为观察组大鼠15只,对照组大鼠15只。对照组正常关灯睡眠。观察组大鼠放养于间歇缺氧舱内,每日9:30—16:30开舱,每日共7h,间歇向舱内循环充入氮气制造慢性间歇缺氧,8min为一个循环,使舱内氧浓度维持在8.5%~21%之间,以模拟阻塞性睡眠呼吸暂停呼吸时患者的缺氧状态。直视下抽取大鼠腹主动脉血检测动脉血气分析指标,直至提示达重度OSAHS表示造模成功。
1.2.2 检测方法 暴露结束后,于第8周将各组大鼠心脏采血后注射10%水合氯醛麻醉后处死。血液4 ℃静置、离心,上清液于-80 ℃冻存以备酶联免疫吸附法(ELISA)检测血清MCP-1、TNF-α、IL-6、IL-8、CRP含量。。处死后迅速整取其肺脏、心脏及脑组织,并将取出组织于液氮中冷却迅速冻存以备蛋白质印迹法(Western Blotting)检测NF-κB蛋白的表达。
1.2.3 检测指标与方法 1)ELISA检测:稀释标准品后,严格按ELISA说明书操作,在样品孔中加入待检炎症因子标本,封板膜封板,4 ℃过夜。取出后室温2 h,洗板;37 ℃室温下加入一抗孵育2 h,反复洗涤清除残留物;37 ℃室温下加入二抗孵育2 h,再洗涤。避光显色后终止反应,加入酶标仪中比色,分别计算2组血清MCP-1、TNF-α、IL-6、IL-8、CRP含量。2)Western Blotting检测:取出冻存的大鼠脑、心、肺组织,解冻后去血去污,液氮冰上研磨至粉末状。加入含苯甲基磺酰氟(PMSF)的裂解液400 μL,于匀浆器中匀浆,冰上孵育30 min后移入离心管,4 ℃离心15 000 r/min,20 min,取上清细胞裂解液用BCA法检测蛋白浓度。蛋白样品沸水加热5 min充分变性蛋白。制好十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶后加入1×上样缓冲液,蛋白样品冷却后加样进行电泳,电泳电压100 V,时间为90 min,结束后转膜,洗涤,5%脱脂奶粉室温封闭2 h。TBST洗涤缓冲液洗膜3次,加入1∶1 000比例一抗摇床上缓慢4 ℃孵育过夜,TBST洗涤缓冲液洗膜3次;加入1∶1 000辣根过氧化物酶标记的羊抗兔IgG二抗摇床上缓慢4 ℃孵育过夜,再TBST洗涤缓冲液洗膜3次。ECL化学发光显影液显影,凝胶成像系统曝光,分析NF-κB蛋白的表达。
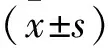
2 结果
2.1 2组大鼠脑、心、肺组织中NF-κB蛋白的表达 观察组大鼠脑、心、肺组织中NF-κB蛋白表达均明显高于对照组(见图1、图2、图3);观察组脑、心、肺组织NF-κB灰度值比较与蛋白表达相符,均高于对照组(均P<0.01)(见图4,图5、图6);脑、心、肺组织NF-κB蛋白相对表达量差异均有统计学意义(均P<0.01)(见表1)。本研究结果显示,在慢性间歇低氧大鼠器官组织中,NF-κB蛋白均为高表达。

图1 2组脑组织NF-κB蛋白表

图2 2组心组织NF-κB蛋白表达
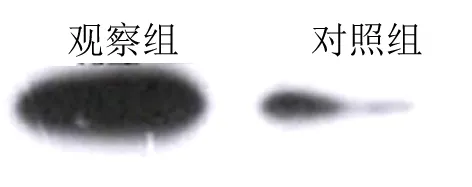
图3 2组肺组织NF-κB蛋白表达

图4 2组大鼠脑组织NF-κB蛋白比较
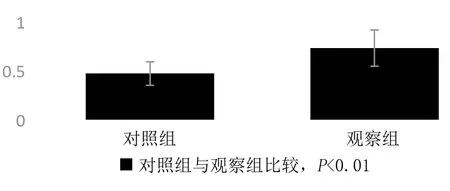
图5 2组大鼠心组织NF-κB灰度值比较
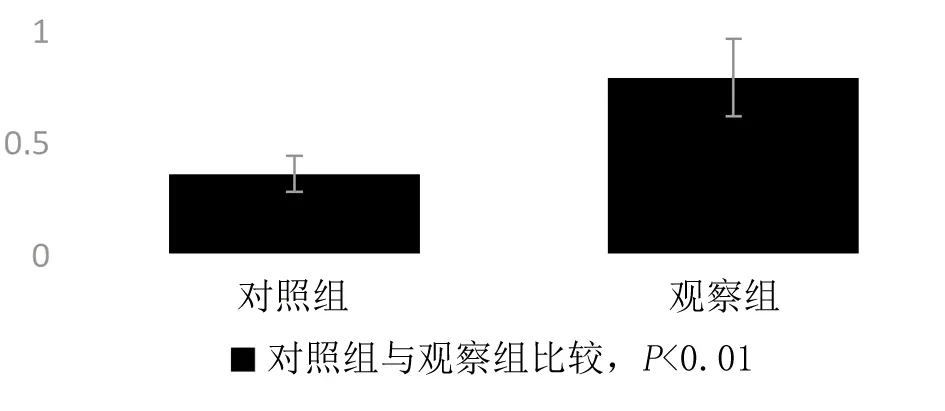
图6 2组大鼠肺NF-κB灰度值比较
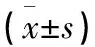
表1 2组大鼠脑、心、肺组织中NF-κB蛋白相对表达量比较
2.2 2组大鼠动脉血清MCP-1、TNF-α、IL-6、IL-8、CRP水平比较 观察组血清MCP-1、TNF-α、IL-6、IL-8、CRP水平均升高,与对照组比较差异均有统计学意义(P<0.05),慢性间歇低氧大鼠多种炎症介质均升高。见表2。
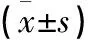
表2 2组大鼠血清MCP-1、TNF-α、IL-6、IL-8、CRP水平比较
3 讨论
NF-κB是一种核蛋白,在基因转录中至关重要。同时,其生物学活性广泛,主管着免疫和炎症反应,调控炎症介质和细胞因子的转录。当外界因素刺激时,inhibitor of NF-κB(IκB)磷酸化,原有的NF-κB/I-κB复合体解离,NF-κB游离出来并被转运至细胞核内,启动靶基因转录,生成相应的mRNA[5]。
MCP-1蛋白由单核细胞、巨噬细胞、T淋巴细胞或细支气管上皮细胞产生,作为单核细胞浸润的主要因子,MCP-1与NF-κB关系密切,并受NF-κB调控。因此,慢性间歇低氧大鼠体内NF-κB可能是MCP-1增加的主因[6]。糖尿病患者体内可发现二者均有增高,而抑制了肾脏NF-κB活性后,NF-κB表达减少,MCP-1的产生及巨噬细胞浸润也可随之减少,肾脏炎症状态随之缓解[7]。
慢性间歇低氧大鼠体内的多种炎症介质、因子包括TNF-α、IL-6、IL-8等均由NF-κB调控、转录。在生理状况下,NF-κB并不表达或表达很少,它与其抑制因子Inhibitor of NF-κB(IκB)结合,为无活性状态存在于胞浆中。疾病中任何的物理及化学因素刺激均可导致这种结合的分离,如病毒、细菌内毒素、氧化应激反应以及OSAHS的特征性改变——慢性间歇低氧。在这些变化刺激中,NF-κB与靶基因、增强子或早期炎症反应基因再结合,TNF-α、IL-6、IL-8等炎症因子大量产生。TNF-α是促炎因子,并且是机体免疫应答的重要因子,过度的应答聚集了大量中性粒细胞,继续上调IL-8的表达,IL-8可进一步趋化中性粒细胞,炎症反应更加严重[8]。
慢性间歇低氧大鼠的心肌细胞中NF-κB的表达对心脏炎症也起着至关重要作用[9],并有可能参与了心脏疾病的发生发展[10]。IL-6是一种糖蛋白,多种淋巴细胞和非淋巴细胞均可产生,其可以调节CRP的合成,增加心脏心肌黏附分子的表达,同时促进TNF-α释放[11]。IL-6、CRP、TNF-α和NF-κB共同维持着心脏炎症平衡,当炎症介质IL-6、TNF-α增多时,会反馈作用于NF-κB,造成心肌恶性损害[12]。通过抑制NF-κB介导的炎症反应有可能阻断炎症损害恶性循环,减轻心肌损伤程度[13]。
慢性间歇低氧引起的损伤特征是缺血再灌注损伤。反复的缺氧,复灌注是心肌梗死、心力衰竭死亡的主要原因[14]。MCP-1、TNF-α、IL-6、IL-8、CRP共同参与了炎症的发生发展过程,对心肌的缺血再灌注损伤起重要作用[15]。在缺血再灌注早期炎症细胞即可侵入心肌细胞,并释放这些炎症因子,诱导心肌损伤[16-17]。
本研究中,检测到慢性间歇低氧大鼠脑、心、肺组织的NF-κB表达增强,同时MCP-1、TNF-α、IL-6、IL-8、CRP不同程度激活,提示慢性间歇低氧是改变发生的根源。慢性间歇低氧可使机体氧化应激反应加强[18-19],如果NF-κB被激活,在氧化应激状态下,IL-6、TNF-α等因子随之增加,成为OSAHS患者的炎症反应基础[20]。因此,找到适合OSAHS人群,应用同时能阻断NF-κB过度激活带来的机体反应的药物,是我们治疗OSAHS疾病的方向。
利益冲突声明:无。
