药蜀葵茎叶化学成分及其体外抑制α-葡萄糖苷酶和5-脂氧合酶活性研究
2023-05-20薛涛涛唐志书段金廒阮凯华杨远贵宋忠兴许洪波
薛涛涛,唐志书, 3,段金廒,阮凯华,杨远贵,宋忠兴,许洪波*
药蜀葵茎叶化学成分及其体外抑制α-葡萄糖苷酶和5-脂氧合酶活性研究
薛涛涛1,唐志书1, 3,段金廒2,阮凯华1,杨远贵1,宋忠兴1,许洪波1*
1. 陕西中医药大学 陕西中药资源产业化省部共建协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西省中药产业研究院,陕西 咸阳 712083 2. 南京中医药大学 江苏省方剂高技术研究重点实验室,江苏省中药资源产业化过程协同创新中心,江苏 南京 210023 3. 中国中医科学院研究生院,北京 100700
对锦葵科蜀葵属植物药蜀葵茎叶的化学成分及其体外抑制α-葡萄糖苷酶和5-脂氧合酶活性进行研究。运用D101大孔吸附树脂、硅胶柱、MCI凝胶、Sephadex LH-20以及半制备HPLC等多种色谱方法进行分离纯化,根据波谱数据鉴定化合物的结构;通过测定化合物对α-葡萄糖苷酶和5-脂氧合酶体外抑制活性,评价化合物的降血糖和抗炎作用。从药蜀葵茎叶中共分离得到24个化合物,分别鉴定为腺苷(1)、4-羟基-2,6二甲氧基苯基-β吡喃葡萄糖苷(2)、苄基--β吡喃葡萄糖苷(3)、赤藓醇(4)、5-羟甲基-2-呋喃甲醛(5)、1-[5-(hydroxymethyl) furan-2-yl] ethenone(6)、黑麦草内酯(7)、isololiolide(8)、4-羟基苯甲醛(9)、对羟基苯甲酸甲酯(10)、催吐萝芙木醇(11)、(6,7,9)-roseoside(12)、二氢芥子醇(13)、3-(3,4,5-trimethoxyphenyl)propan-1-ol(14)、dihydrodehydrodiconifenyl alcohol(15)、齐墩果酸3-β吡喃葡萄糖苷(16)、紫云英苷(17)、反式银椴苷(18)、望春花黄酮醇苷(19)、apigenin 7--(6---coumaroyl-βglucopyranoside)(20)、香叶木素7--β吡喃葡萄糖苷(21)、田蓟苷(22)、芒柄花素7-葡萄糖苷(23)、acacetin 7--(6--coumaroyl)-βglucopyranoside(24)。生物活性测试结果表明,化合物18、19、24对α-葡萄糖苷酶半数抑制浓度(median inhibition concentration,IC50)为(12.2±1.3)、(2.8±0.6)、(31.1±3.9)μmol/L;化合物18、24对5-脂氧合酶的IC50为(34.76±4.3)、(25.37±2.4)μmol/L。化合物1~16、18~24为首次从该植物中分离获得。发现部分化合物具有较好的体外抑制α-葡萄糖苷酶(18、19、24)和5-脂氧合酶(18、24)作用,表明其具有潜在的降血糖活性和抗炎活性。
药蜀葵;黄酮;α葡萄糖苷酶;5-脂氧合酶;反式银椴苷;望春花黄酮醇苷;田蓟苷
药蜀葵Linn.为锦葵科(Malvaceae)蜀葵属的多年生直立草本植物,原产于欧洲和亚洲,我国多为栽培品种,收录于欧洲药典。作为欧洲传统药食两用植物,药蜀葵已有至少2000年的应用历史,其根、茎、叶、花和种子均可入药,用于治疗口腔和咽部黏膜刺激、干咳、轻度胃炎、皮肤烧伤,蚊虫咬伤、黏膜炎、溃疡、脓肿、便秘和腹泻[1];其茎叶可食用。此外,因药蜀葵花色艳丽,亦作为观赏性植物[2]。
迄今为止,关于药蜀葵功效物质基础研究比较薄弱,其主要药效物质不明确。此前,仅从该植物中分离鉴定46个化合物[3],主要为黄酮、酚酸、多糖、香豆素、甾体和氨基酸类成分[4]。现代药理实验表明药蜀葵提取物具有镇咳、抗炎、抗氧化[5]等作用,但研究对象主要为其提取物,对于单体化合物的药理活性研究相对不足。目前,药蜀葵资源量较大,但尚未得到充分的开发和利用。
本课题组前期研究发现,药蜀葵茎叶甲醇浸提物醋酸乙酯萃取部位对α-葡萄糖苷酶和5-脂氧合酶具有较好的体外抑制活性[6]。基于此,本研究拟通过多种色谱分离技术对药蜀葵醋酸乙酯萃取部位的化学成分进行更加系统深入的研究,并对获得的化合物进行体外酶抑制活性评价,以期为药蜀葵资源合理开发和充分的利用奠定科学基础。通过理化性质和波谱数据共鉴定了24个化合物,分别为腺苷(adenosine,1)、4-羟基-2,6二甲氧基苯基-β--吡喃葡萄糖苷(leonuriside A,2)、苄基--β--吡喃葡萄糖苷(benzyl--β--glucopyranoside,3)、赤藓醇(meso-erythritol,4)、5-羟甲基-2-呋喃甲醛(5-hydroxymethyl-2-furancarboxaldehyde,5)、1-[5-(hydroxymethyl) furan-2-yl] ethenone(6)、黑麦草内酯(loliolide,7)、isololiolide(8)、4-羟基苯甲醛(4-hydroxybenzaldehyde,9)、对羟基苯甲酸甲酯(methyl 4-hydroxybenzoate,10)、催吐萝芙木醇(vomifoliol,11)、(6,7,9)-roseoside(12)、二氢芥子醇(dihydrosyringenin,13)、3-(3,4,5- trimethoxyphenyl)propan-1-ol(14)、dihydro- dehydrodiconifenyl alcohol(15),齐墩果酸3--β--吡喃葡萄糖苷(oleanolic acid 3--β-- glucopyranoside,16)、紫云英苷(astragalin,17)、反式银椴苷(-tiliroside,18)、望春花黄酮醇苷(biondnoid I,19)、apigenin 7--(6′′---coumaroyl- β--glucopyranoside)(20)、香叶木素7--β--吡喃葡萄糖苷(diosmetin 7--β--glucopyranoside,21),田蓟苷(tilianin,22)、芒柄花素7-葡萄糖苷(formononetin 7-glucoside,23)、acacetin 7--(6-- coumaroyl)-β--glucopyranoside(24)。酶抑制结果表明,部分化合物具有较好的体外抑制α-葡萄糖苷酶(19、24)和5-脂氧合酶(18、24)活性。
1 仪器与材料
Varian Mercury plus-600型核磁共振仪(德国Bruker公司);半制备型高效液相色谱仪(日本岛津公司);半制备色谱柱(YMC,250 mm×20 mm,10 μm,日本YMC公司);EYELAN-1210旋转蒸发仪(上海爱郎仪器有限公司);Milli-Q integral制水机(美国密理博公司);Multiskan GO酶标仪(美国Thermo Scientific公司);D-101型大孔吸附树脂(天津允开树脂科技有限公司);MCI GEL填料(日本三菱化学公司);HSGF254硅胶板(烟台市化学工业研究所);Sephadex LH-20(瑞典Pharmacia生物技术有限公司);柱色谱硅胶(200~300目,青岛海洋化工有限公司);色谱级甲醇、乙腈(云南新蓝景化学工业有限公司);5-脂氧合酶(批号N25GS169274,5万U/mg,来源于大豆,上海源叶生物科技有限公司);亚油酸(批号BCBZ1990,质量分数≥98.5%);槲皮素(批号C01J10Y91727,质量分数≥98%,上海源叶生物科技有限公司);α-葡萄糖苷酶(批号M11GS141284,33 U/mg,来源于酵母,上海源叶生物科技有限公司);对硝基苯基-α葡萄糖吡喃苷(批号wkq20071504,质量分数≥98%,四川维克奇生物科技有限公司);阿卡波糖(批号RFS-A01411804026,质量分数≥98%,成都瑞芬思生物科技有限公司);其他试剂均为分析纯(天津科密欧化学试剂有限公司)。
实验用药蜀葵收集于陕西省咸阳市永寿县监军镇陕西辉胜现代农业园区,经陕西中医药大学许洪波副教授鉴定为锦葵科蜀葵属植物药蜀葵L.的干燥茎叶,标本(20190007)保存于陕西中医药大学陕西中药资源产业化省部共建协同创新中心。
2 提取与分离
干燥的药蜀葵茎叶45 kg,经甲醇室温浸渍提取3次,减压回收甲醇,将得到的干浸膏分散于水中,依次用石油醚和醋酸乙酯萃取得到相关部位,其中甲醇浸提物醋酸乙酯萃取部位浸膏0.5 kg过大孔吸附树脂柱,依次用水及30%、50%、70%和100%甲醇梯度洗脱,所得洗脱溶剂分别浓缩合并得5个组分(Fr. A~E)。组分Fr. B(8.3 g)经葡聚糖凝胶色谱甲醇体系洗脱,合并相同流分后,再经半制备高效液相色谱仪,以乙腈-水(24∶76)等度洗脱(3 mL/min),得到化合物1(4.3 mg,R=20.0 min)和2(5.2 mg,R=22.3 min)。组分Fr. C(6.4 g)经硅胶柱色谱,三氯甲烷-甲醇体系(13∶1、8∶1、4∶1、0∶1)洗脱,得到4个组分Fr. C-1~C-4,,Fr. C-1(1.2 g)经MCI色谱柱水-甲醇体系洗脱,洗脱溶剂浓缩合并得到4个组分(Fr. C-1-1~C-1-4),Fr. C-1-1(236.0 mg)经葡聚糖凝胶色谱甲醇体系洗脱,合并相同流分后,再经半制备高效液相色谱,以乙腈-水(23∶77)等度洗脱(3 mL/min),得到化合物11(21.2 mg,R=20.0 min)。Fr. C-1-2(85.0 mg)经葡聚糖凝胶色谱甲醇体系洗脱,得到化合物6(2.6 mg)和9(3.7 mg)。Fr. C-1-3(0.6 g)经硅胶柱色谱,三氯甲烷-甲醇体系(20∶1~0∶1)洗脱,得到3个组分(Fr. C-1-3-1~Fr. C-1-3-3),Fr. C-1-3-1(340.0 mg)经葡聚糖凝胶色谱甲醇体系洗脱,得到化合物5(8.9 mg)和13(7.9 mg),随后Fr. C-1-3-1剩余合并组分(225.0 mg),经半制备高效液相色谱,以乙腈-水(28∶72)等度洗脱(3 mL/min),得到化合物7(21.5 mg,R=17.5 min)。Fr. C-1-4(43.2 mg),经半制备高效液相色谱仪,以26%乙腈等度洗脱(3 mL/min),得到化合物8(20.4 mg,R=17.5 min)。Fr. E(138.7 g)经硅胶柱色谱,三氯甲烷-甲醇体系(18∶1、12∶1、6∶1、1∶1和0∶1)洗脱,所得洗脱溶剂分别浓缩合并得5个组分(Fr. E1~E5),Fr. E3(29.5 g)经硅胶柱色谱,三氯甲烷-甲醇体系(13∶1、8∶1、4∶1、0∶1)洗脱,得到Fr. E3-1~E3-4,4个组分,Fr. E3-2(7.0 g)经MCI色谱柱水-甲醇体系洗脱,洗脱溶剂浓缩合并得到4个组分(Fr. E3-2-1~Fr. E3-2-4),Fr. E3-2-2(1.1 g)经葡聚糖凝胶色谱甲醇体系洗脱,再经半制备高效液相色谱仪,以乙腈-水(26∶74)等度洗脱(3 mL/min),得到化合物20(6.2 mg,R=16.5 min)、21(7.0 mg,R=17.0 min);Fr. E3-2-3(2.7 g)经硅胶柱色谱,三氯甲烷-甲醇体系(10∶1~1∶1)洗脱,回收溶剂得到5个组分(Fr. E3-2-3-1~E3-2-3-5),Fr. E3-2-3-1(78.9 mg)经半制备高效液相色谱仪,以乙腈-水(26∶74)等度洗脱(3 mL/min),得到化合物16(3.2 mg,R=16.0 min)。Fr. E3-2-3-2(600.0 mg)经葡聚糖凝胶色谱(甲醇体系洗脱),得到化合物17(5.0 mg)和18(6.7 mg)。Fr. E3-2-3-3(160 mg)经半制备高效液相色谱仪,以乙腈-水(23∶77)等度洗脱(3 mL/min),得到化合物22(1.5 mg,R=16.5 min)、23(1.4 mg,R=16.0 min)、24(3.0 mg,R=17.8 min),Fr. E3-2-3-5(206.5 mg)经半制备高效液相色谱仪,以乙腈-水(30∶70)等度洗脱(3 mL/min),得到化合物19(75.3 mg,R=15.5 min)。Fr. E3-3(10.2 g)经MCI色谱柱水-甲醇体系洗脱,洗脱溶剂浓缩合并得到5个组分(Fr. E3-3-1~Fr. E3-2-5),Fr. E3-3-1(450.0 mg)经半制备高效液相色谱仪,以乙腈-水(28∶72)等度洗脱(3 mL/min),得到化合物10(1.3 mg,R=17.0 min)。Fr. E3-3-2(1.2 g)经葡聚糖凝胶色谱甲醇体系洗脱,经TLC检测合并相同流分,浓缩得到4个组分(Fr. E3-3-2-1~Fr. E3-3-2-4),Fr. E3-3-2-1(320.0 mg)经半制备高效液相色谱仪,以乙腈-水(30∶70)等度洗脱(3 mL/min),得到化合物12(2.0 mg,R=18.0 min),Fr. E3-3-2-3(160.0 mg)经半制备高效液相色谱仪,以乙腈-水(29∶71)等度洗脱(3 mL/min),得到化合物15(1.6 mg,R=18.5 min);Fr. E3-3-3(95.0 mg)经半制备高效液相色谱仪,以乙腈-水(29∶71)等度洗脱(3 mL/min),得到化合物14(2.0 mg,R=18.3 min);Fr. E3-3-5(76.0 mg)经半制备高效液相色谱仪,以乙腈-水(26∶74)等度洗脱(3 mL/min),得到化合物3(2.0 mg,R=16.5 min)和4(1.9 mg,R=19.0 min)。
3 结构鉴定
化合物1:白色粉末,C10H13N5O4。1H-NMR (600 MHz, CD3OD): 8.35 (1H, s. H-8), 8.13 (1H, s, H-2), 7.35 (2H, s, -NH2), 5.88 (1H, d,= 6.2 Hz, H-1), 4.61 (1H, t,= 4.9 Hz, H-2), 4.14 (1H, m, H-3), 3.96 (1H, q,= 3.4 Hz, H-4), 3.67 (1H, dd,= 12.2, 3.7 Hz, H-5a), 3.55 (1H, dd,= 12.2, 3.7 Hz, H-5b);13C-NMR (150 MHz, CD3OD): 152.4 (C-2), 149.1 (C-4), 119.4 (C-5), 156.2 (C-6), 139.9 (C-8), 87.9 (C-1), 73.4 (C-2), 70.7 (C-3), 85.9 (C-4), 61.7 (C-5)。以上数据与文献报道一致[7],故鉴定化合物1为腺苷。
化合物2:白色粉末,C14H20O9,1H-NMR (600 MHz, CD3OD): 6.13 (2H, s, H-2, 6), 4.66 (1H, d,= 7.5 Hz, H-1), 3.79 (6H, s, -OCH3), 3.78 (1H, dd,= 11.7, 2.5 Hz, H-6a), 3.67 (1H, dd,= 11.7, 5.2 Hz, H-6b), 3.33~3.45 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 129.6 (C-1), 94.5 (C-2, 6), 154.8 (C-3, 5), 129.6 (C-4), 106.2 (C-1), 75.7 (C-2), 77.8 (C-3), 71.3 (C-4), 78.3 (C-5), 62.6 (C-6), 56.8 (-OCH3)。以上数据与文献报道一致[8],故鉴定化合物2为4-羟基-2,6-二甲氧基苯基-β吡喃葡萄糖苷。
化合物3:白色粉末,C13H18O6,1H-NMR (600 MHz, CD3OD): 7.42 (2H, m, H-4, 8), 7.32 (2H, m, H-5, 7), 7.27 (1H, m, H-6), 4.93 (1H, d,= 11.8 Hz, Ha-2), 4.67 (1H, d,= 11.8 Hz, H-2b), 4.35 (1H, d,= 7.8 Hz, H-1), 3.89 (1H, dd,= 11.9, 2.2 Hz, H-6a), 3.68 (1H, dd,= 11.9, 5.8 Hz, H-6b), 3.20~3.45 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 71.7 (C-2), 139.1 (C-3), 129.2 (C-4, 8), 129.3 (C-5, 7), 128.7 (C-6), 103.3 (C-1), 75.2 (C-2), 78.1 (C-3), 71.7 (C-4), 78.1 (C-5), 62.8 (C-6)。以上数据与文献报道一致[9],故鉴定化合物3为苄基--β吡喃葡萄糖苷。
化合物4:白色粉末,C4H10O4,1H-NMR (600 MHz, CD3OD): 3.65 (2H, m, H-2, 3), 3.58 (2H, dd,= 11.2, 4.9 Hz, H-2a, 3a), 3.51 (2H, dd,= 11.2, 6.0 Hz, H-2b, 3b);13C-NMR (150 MHz, CD3OD): 73.9 (C-2, 3), 64.4 (C-1, 4)。以上数据与文献报道一致[10],故鉴定化合物4为赤藓醇。
化合物5:黄色油状物,C6H6O3,1H-NMR (600 MHz, CD3OD): 9.54 (1H, s, CHO), 7.39 (1H, d,= 3.5 Hz, H-3), 6.59 (1H, d,= 3.5 Hz, H-4), 4.63 (2H, s, CH2OH);13C-NMR (150 MHz, CD3OD): 153.9 (C-2), 124.4 (C-3), 110.9 (C-4), 163.2 (C-5), 179.4 (CHO), 57.6 (CH2OH)。以上数据与文献报道一致[11],故鉴定化合物5为5-羟甲基-2-呋喃甲醛。
化合物6:黄色油状物,C7H8O3,1H-NMR (600 MHz, CD3OD): 7.31 (1H, d,= 3.5 Hz, H-3), 6.52 (1H, d,= 3.5 Hz, H-4), 4.59 (2H, s, CH2OH), 2.45 (3H, s, CH3);13C-NMR (150 MHz, CD3OD): 188.69 (CO), 161.6 (C-2), 153.3 (C-5), 120.6 (C-3), 110.7 (C-4), 57.6 (CH2OH), 25.8 (CH3)。以上数据与文献报道一致[12],故鉴定化合物6为1-[5-(hydroxymethyl) furan-2-yl] ethenone。
化合物7:无色油状物,C11H16O3,1H-NMR (600 MHz, CD3OD): 5.76 (1H, s, H-7), 4.23 (1H, m, H-3), 2.00~2.40 (2H, d,= 14.0 Hz, H-4α, 4β), 1.76 (3H, s, H-11), 1.53~1.75 (2H, dd,= 14.4, 3.0 Hz, H-2α, 2β), 1.48 (3H, s, H-10), 1.27 (3H, s, H-9);13C-NMR (150 MHz, CD3OD): 37.2 (C-1), 48.0 (C-2), 67.2 (C-3), 46.4 (C-4), 88.9 (C-5), 185.7 (C-6), 113.3 (C-7), 174.4 (C-8), 27.4 (C-9), 27.0 (C-10), 31.0 (C-11)。以上数据与文献报道一致[13],故鉴定化合物7为黑麦草内酯。
化合物8:无色油状物,C11H16O3,1H-NMR (600 MHz, CD3COCD3): 5.71 (1H, s, H-7), 4.13 (1H, m, H-3), 2.88 (1H, m, H-4β), 2.44 (1H, d,= 11.7 Hz, H-2β), 2.05 (1H, m, H-4α), 2.00 (1H, d,= 12.8 Hz, H-2α), 1.55, (3H, s, H-11), 1.30 (3H, s, H-9), 1.28 (3H, s, H-10);13C-NMR (150 MHz, CD3COCD3): 35.7 (C-1), 50.8 (C-2), 64.7 (C-3), 49.1 (C-4), 87.0 (C-5), 182.1 (C-6), 113.6 (C-7), 171.5 (C-8), 26.0 (C-9), 25.4 (C-10), 30.3 (C-11)。以上数据与文献报道一致[14],故鉴定化合物8为isololiolide。
化合物9:白色粉末,C7H6O2,1H-NMR (600 MHz, CD3OD): 9.76 (1H, s, CHO), 7.78 (2H, d,= 8.3 Hz, H-3, 5), 6.91 (2H, d,= 8.3 Hz, H-2, 6);13C-NMR (150 MHz, CD3OD): 165.3 (C-1), 116.9 (C-2, 6), 133.4 (C-3, 5), 130.3 (C-4), 192.8 (-CHO)。以上数据与文献报道一致[15],故鉴定化合物9为4-羟基苯甲醛。
化合物10:白色粉末,C8H8O3,1H-NMR (600 MHz, DMSO): 7.80 (2H, d,= 8.8 Hz, H-3, 5), 6.83 (2H, d,= 8.6 Hz, H-2, 6), 4.05 (3H, s, H-8);13C-NMR (150 MHz, CD3OD): 159.3 (C-1), 115.4 (C-2, 6), 131.4 (C-3, 5), 120.0 (C-4), 165.3 (C-7), 51.6 (C-8)。以上数据与文献报道一致[16],故鉴定化合物10为对羟基苯甲酸甲酯。
化合物11:无色油状物,C13H20O3,1H-NMR (600 MHz, CD3OD): 5.88 (1H, s, H-2), 5.80 (2H, m, H-7, 8), 4.33 (1H, m, H-9), 2.49 (1H, d,= 17.1 Hz, H-6a), 2.17 (1H, d,= 17.1 Hz, H-6b), 1.92 (3H, s, 3-Me), 1.25 (3H, d,= 6.4 Hz, H-10), 1.05 (3H, s, H-5-Mea), 1.02 (3H, s, H-5-Meb);13C-NMR (150 MHz, CD3OD): 201.2 (C-1), 127.1 (C-2), 167.4 (C-3), 79.9 (C-4), 42.4 (C-5), 49.9 (C-6), 130.0 (C-7), 127.1 (C-8), 68.6 (C-9), 24.5 (C-10), 19.6 (3-Me), 24.8 (5-Mea), 23.8 (5-Meb)。以上数据与文献报道一致[17],故鉴定化合物11催吐萝芙木醇。
化合物12:无色油状物,C19H13O8,1H-NMR (600 MHz, CD3OD): 5.87 (1H, s, H-2), 5.86 (1H, m, H-7), 5.85 (1H, m, H-8), 4.33 (1H, d,= 7.8 Hz, H-1), 4.29 (1H, m, H-9), 3.86 (1H, d,= 2.2 Hz, Ha-6), 3.84 (1H, d,= 2.2 Hz, H-6b), 3.22~3.47 (4H, m, H-2~5), 2.52 (1H, d,= 16.9 Hz, H-4a), 2.14 (1H, d,= 16.9 Hz, H-4b), 1.98 (3H, s, H-3-Me), 1.29 (3H, d,= 6.3 Hz, H-10), 1.03 (6H, s, H-5-Me);13C-NMR (150 MHz, CD3OD): 167.2 (C-1), 127.12 (C-2), 201.2 (C-3), 50.7 (C-4), 42.4 (C-5), 80.0 (C-6), 131.5 (C-7), 135.3 (C-8), 78.1 (C-9), 21.2 (C-10), 24.7 (C-11), 23.4 (C-12), 21.1 (C-13), 102.7 (C-1), 75.3 (C-2), 77.3 (C-3), 71.7 (C-4), 78.1 (C-5), 62.8 (C-6)。以上数据与文献报道一致[18],故鉴定化合物12为(6,7,9)-roseoside。
化合物13:无色油状物,C11H16O4,1H-NMR (600 MHz, CDCl3): 6.42 (2H, s, H-2, 6), 3.87 (6H, s, 3, 5-OCH3), 3.68 (2H, t,= 6.1 Hz, H-9), 2.64 (2H, t,= 7.7 Hz, H-7), 1.88 (2H, m, H-8);13C-NMR (150 MHz, CDCl3): 133.1 (C-1), 105.1 (C-2, 6), 147.1 (C-3, 5), 132.9 (C-4), 32.5 (C-7), 34.6 (C-8), 62.4 (C-9), 56.4 (-OCH3)。以上数据与文献报道一致[19],故鉴定化合物13为二氢芥子醇。
化合物14:无色油状物,C12H18O4,1H-NMR (600 MHz, CD3OD): 6.44 (2H, s, H-2, 6), 3.72 (6H, s, 3, 5-OCH3), 3.71 (3H, s, 4-OCH3), 3.49 (2H, t,= 6.2 Hz, H-9), 2.77 (2H, m, H-7), 1.82 (2H, m, H-8);13C-NMR (150 MHz, CD3OD): 137.1 (C-1), 105.5 (C-2, 6), 153.4 (C-3, 5), 136.5 (C-4), 32.3 (C-7), 33.5 (C-8), 62.4 (C-9), 60.8 (4-OCH3), 56.1 (3, 5-OCH3)。以上数据与文献报道一致[20],故鉴定化合物14为3-(3,4,5-trimethoxyphenyl)propan-1-ol。
化合物15:白色粉末,C20H24O6,1H-NMR (600 MHz, CD3OD): 6.94 (1H, d,= 1.9 Hz, H-2), 6.82 (1H, dd,= 8.2, 2.0 Hz, H-6), 6.76 (1H, d,= 8.1 Hz, H-5), 6.72 (2H, s, H-2, 6), 5.49 (1H, d,= 6.3 Hz, H-7), 3.85 (3H, s, 3-OCH3), 3.82 (1H, d,= 5.9 Hz, H-9a), 3.81 (3H, s, 3-OCH3), 3.64 (1H, m, H-8), 3.56 (2H, t,= 6.5 Hz, H-9), 3.47 (1H, d,= 5.9 Hz, H-9b), 2.62 (2H, t,= 7.7 Hz, H-7), 1.82 (2H, m, H-8);13C-NMR (150 MHz, CD3OD): 136.9 (C-1), 110.5 (C-2), 149.1 (C-3), 147.5 (C-4), 114.1 (C-5), 119.7 (C-6), 88.0 (C-7), 55.5 (C-8), 65.0 (C-9), 134.8 (C-1), 116.1 (C-2), 145.2 (C-3), 147.5 (C-4), 129.9 (C-5), 117.9 (C-6), 33.1 (C-7), 32.9 (C-8), 62.2 (C-9), 56.7 (-OCH3-3), 56.3 (-OCH3-3)。以上数据与文献报道一致[21],故鉴定化合物15为dihydrodehydrodiconifenyl alcohol。
化合物16:白色粉末,C36H58O8,1H-NMR (600 MHz, CD3OD): 5.27 (1H, t,= 3.3 Hz, H-12), 5.09 (1H, d,= 7.2 Hz, H-1), 4.13 (1H, dd,= 11.6, 6.3 Hz, H-6a), 3.89 (1H, dd,= 11.6, 6.3 Hz, H-6b), 3.32~3.45 (4H, m, H-2~5), 3.23 (1H, dd,= 12.0, 4.5 Hz, H-3), 3.16 (1H, dd,= 14.3, 3.8 Hz, H-18), 1.27 (3H, s, 23-CH3), 1.19 (3H, s, 27-CH3), 1.04 (3H, s, 24-CH3), 0.94 (3H, s, 26-CH3), 0.90 (3H, s, 29-CH3), 0.83 (3H, s, 25-CH3), 0.77 (3H, s, 30-CH3);13C-NMR (150 MHz, CD3OD): 40.6 (C-1), 25.9 (C-2), 88.8 (C-3), 41.5 (C-4), 51.8 (C-5), 19.1 (C-6), 33.4 (C-7), 42.1 (C-8), 48.8 (C-9), 39.0 (C-10), 24.6 (C-11), 123.3 (C-12), 145.6 (C-13), 44.1 (C-14), 29.4 (C-15), 23.7 (C-16), 48.2 (C-17), 43.0 (C-18), 47.9 (C-19), 30.8 (C-20), 36.9 (C-21), 33.2 (C-22), 28.9 (C-23), 17.5 (C-24), 14.4 (C-25), 17.9 (C-26), 26.5 (C-27), 180.0 (C-28), 33.1 (C-29), 24.1 (C-30), 105.8 (C-1), 71.7 (C-2), 78.2 (C-3), 69.7 (C-4), 78.0 (C-5), 66.7 (C-6)。以上数据与文献报道一致[22],故鉴定化合物16为齐墩果酸3-β吡喃葡萄糖苷。
化合物17:黄色油状物,C21H20O11,1H-NMR (600 MHz, CD3OD): 8.03 (2H, d,= 8.9 Hz, H-2, 6), 6.87 (2H, d,= 8.9 Hz, H-3, 5), 6.26 (1H, s, H-8), 6.09 (1H, d,= 1.9 Hz, H-6), 5.14 (1H, d,= 7.5 Hz, H-1), 3.67 (1H, dd,= 11.9, 2.4 Hz, H-6a), 3.53 (1H, dd,= 11.9, 5.4 Hz, H-6b), 3.32~3.45 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 158.9 (C-2), 135.3 (C-3), 178.9 (C-4), 162.8 (C-5), 101.6 (C-6), 171.3 (C-7), 96.00 (C-8), 158.4 (C-9), 104.6 (C-10), 122.8 (C-1), 132.2 (C-2, 6), 116.1 (C-3, 5), 161.7 (C-4), 104.2 (C-1), 75.7 (C-2), 78.1 (C-3), 71.3 (C-4), 78.4 (C-5), 62.6 (C-6)。以上数据与文献报道一致[23],故鉴定化合物17为紫云英苷。
化合物18:黄色粉末,C30H26O13,1H-NMR (600 MHz, CD3OD): 8.07 (2H, d,= 8.7 Hz, H-2, 6), 7.64 (H, d,= 15.9 Hz, H-7), 7.45 (2H, d,= 8.4 Hz, H-2, 6), 6.91 (2H, d,= 8.7 Hz, 3, 5), 6.79 (2H, d,= 6.4 Hz, H-3, 5), 6.40 (1H, d,= 1.9 Hz, H-8), 6.34 (1H, d,= 15.9 Hz, H-8), 6.20 (1H, d,= 1.9 Hz, H-6), 5.38 (1H, d,= 7.8 Hz, H-1), 3.71 (1H, dd,= 11.7, 6.6 Hz, H-6a), 3.56 (1H, dd,= 11.7, 6.6 Hz, H-6b), 3.31~3.72 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 158.5 (C-2), 135.3 (C-3), 179.4 (C-4), 163.1 (C-5), 99.9 (C-6), 159.1 (C-7), 94.8 (C-8), 166.1 (C-9), 103.9 (C-10), 122.8 (C-1), 131.3 (C-2, 6), 116.8 (C-3, 5), 161.4 (C-4), 105.7 (C-1), 75.8 (C-2), 75.9 (C-3), 72.2 (C-4), 76.6 (C-5), 62.4 (C-6), 127.1 (C-1), 132.3 (C-2, 6), 116.2 (C-3, 5), 161.6 (C-4), 147.3 (C-7), 114.7 (C-8), 168.5 (C-9)。以上数据与文献报道一致[24],故鉴定化合物18为反式银锻苷。
化合物19:黄色粉末,C30H26O13,1H-NMR (600 MHz, CD3OD): 7.99 (2H, m, H-2, 6), 7.40 (1H, d,= 15.9 Hz, H-7), 7.32 (2H, m, H-2, 6), 6.81 (4H, m, H-3, 5, 3, 5), 6.31 (1H, d,= 2.1 Hz, H-6), 6.13 (1H, d,= 2.1 Hz, H-8), 6.08 (1H, d,= 15.9 Hz, H-8), 5.24 (1H, d,= 7.5 Hz, H-1), 4.29 (1H, dd,= 11.8, 2.3 Hz, H-6a), 4.19 (1H, dd,= 11.8, 6.7 Hz, H-6b), 3.31~3.53 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 158.5 (C-2), 135.2 (C-3), 179.4 (C-4), 163.0 (C-5), 100.1 (C-6), 166.4 (C-7), 94.9 (C-8), 161.5 (C-9), 104.0 (C-10), 122.7 (C-1), 131.2 (C-2, 6), 116.8 (C-3, 5), 159.3 (C-4), 105.5 (C-1), 75.7 (C-2), 75.8 (C-3), 71.7 (C-4), 78.0 (C-5), 64.3 (C-6), 127.1 (C-1), 132.2 (C-2, 6), 116.0 (C-3, 5), 161.2 (C-4), 145.6 (C-7), 114.7 (C-8), 168.8 (C-9)。以上数据与文献报道一致[25],故鉴定化合物19为望春花黄酮醇苷。
化合物20:黄色粉末,C30H26O12,1H-NMR (600 MHz, CD3OD): 7.98 (2H, d,= 8.9 Hz, H-2, 6), 7.41 (1H, d,= 15.9 Hz, H-7), 7.32 (2H, d,= 8.5 Hz, H-2, 6), 6.79 (4H, d,= 8.1 Hz, H-3, 5, 3, 5), 6.78 (1H, s, H-3), 6.23 (1H, d,= 1.8 Hz, H-8), 6.09 (1H, d,= 16.1 Hz, H-8), 6.07 (1H, d,= 2.0 Hz, H-6), 5.16 (1H, d,= 7.2 Hz, H-1), 4.29 (1H, dd,= 11.7, 6.6 Hz, H-6a), 4.16 (1H, dd,= 11.8, 6.6 Hz, H-6b), 3.32~3.48 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 161.5 (C-2), 104.4 (C-3), 178.9 (C-4), 161.4 (C-5), 101.4 (C-6), 162.8 (C-7), 95.8 (C-8), 158.0 (C-9), 104.5 (C-10), 122.8 (C-1), 131.2 (C-2, 6), 116.9 (C-3, 5), 160.2 (C-4), 107.0 (C-1), 75.1 (C-2), 78.1 (C-3), 71.1 (C-4), 75.8 (C-5), 64.3 (C-6), 127.0 (C-1), 132.1 (C-2, 6), 116.0 (C-3, 5), 158.8 (C-4), 146.6 (C-7), 114.7 (C-8), 168.8 (C-9)。以上数据与文献报道一致[26],故鉴定化合物20为apigenin 7--(6--- coumaroyl-βglucopyranoside)。
化合物21:黄色粉末,C22H22O11,1H-NMR (600 MHz, DMSO-6): 12.70 (1H, s, 5-OH), 7.69 (1H, dd,= 8.5, 2.3 Hz, H-6), 7.58 (1H, d,= 2.3 Hz, H-2), 7.05 (1H, d,= 8.6 Hz, H-5), 6.51 (1H, s, H-3), 6.46 (1H, d,= 1.7 Hz, H-8), 5.85 (1H, d,= 1.9 Hz, H-6), 4.41 (2H, d,= 7.7 Hz, H-1), 3.84 (1H, s, -OCH3), 3.69 (2H, d,= 2.2 Hz, H-6), 3.22~3.34 (4H, m, 2~5);13C-NMR (150 MHz, DMSO-6): 162.4 (C-2), 102.9 (C-3), 180.7 (C-4), 158.9 (C-5), 99.8 (C-6), 166.7 (C-7), 94.6 (C-8), 158.0 (C-9), 108.6 (C-10), 124.2 (C-1), 113.5 (C-2), 147.1 (C-3), 149.8 (C-4), 112.5 (C-5), 119.5 (C-6), 101.5 (C-1), 74.7 (C-2), 77.1 (C-3), 69.3 (C-4), 77.3 (C-5), 60.8 (C-6), 56.1 (-OCH3)。以上数据与文献报道一致[27],故鉴定化合物21为香叶木素7--β--吡喃葡萄糖苷。
化合物22:黄色粉末,C22H22O11,1H-NMR (600 MHz, CD3OD): 8.04 (2H, dd,= 8.5, 3.5 Hz, H-2, 6), 6.97 (2H, dd,= 8.5, 2.1 Hz, H-3, 5), 6.86 (1H, d,= 2.5 Hz, H-8), 6.72 (1H, s H-3), 6.39 (1H, d,= 3.6 Hz, H-6), 5.26 (1H, dd,= 7.5, 2.6 Hz, H-1), 4.59 (3H, s, -OCH3), 4.03 (1H, dd,= 11.8, 6.7 Hz, H-6a), 3.97 (1H, dd,= 11.8, 6.7 Hz, H-6b), 3.31~3.45 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 163.1(C-2), 103.9 (C-3), 179.4 (C-4), 158.5 (C-5), 100.2 (C-6), 166.5 (C-7), 94.9 (C-8), 159.2 (C-9), 105.5 (C-10), 122.7 (C-1), 116.1 (C-2, 6), 129.0 (C-3, 5), 161.6 (C-4), 103.8 (C-1), 75.7 (C-2), 75.8 (C-3), 71.5 (C-4), 77.9 (C-5), 64.5 (C-6), 56.5 (-OCH3)。以上数据与文献报道一致[28],故鉴定化合物22为田蓟苷。
化合物23:黄色粉末,C22H22O9,1H-NMR (600 MHz, CD3OD): 7.63 (1H, d,= 8.4 Hz, H-5), 7.61 (2H, d,= 8.4 Hz, H-2, 6), 6.86 (1H, s, H-3), 6.79 (2H, d,= 8.8 Hz, H-3, 5), 6.73 (1H, m, H-6), 6.69 (1H, d,= 8.2 Hz, H-8), 5.13 (1H, d,= 6.8 Hz, H-1), 3.66 (3H, s, -OCH3), 3.60 (1H, dd,= 11.9, 2.5 Hz, H-6a), 3.48 (1H, dd,= 11.9, 5.4 Hz, H-6b), 3.35~3.43 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 163.5 (C-2), 104.6 (C-3), 179.3 (C-4), 126.3 (C-5), 117.1 (C-6), 161.5 (C-7), 100.1 (C-8), 156.1 (C-9), 113.1 (C-10), 122.7 (C-1), 132.5 (C-2, 5), 115.9 (C-3, 6), 160.6 (C-4), 56.2 (C-OCH3), 111.9 (C-1), 71.2 (C-2), 78.2 (C-3), 69.7 (C-4), 78.0 (C-5), 62.5 (C-6)。以上数据与文献报道一致[29],故鉴定化合物23为芒柄花素7-葡萄糖苷。
化合物24:黄色粉末,C31H28O12,1H-NMR (600 MHz, CD3OD): 7.50 (2H, d,= 8.4 Hz, H-2, 6), 7.35 (1H, d,= 15.9 Hz, H-7), 7.21 (2H, d,= 8.6 Hz, H-2, 6), 6.78 (1H, s, H-3), 6.74 (2H, d,= 8.6 Hz, H-3, 5), 6.67 (2H, d,= 8.8 Hz, H-3, 5), 6.64 (1H, d,= 1.8 Hz, H-8), 6.20 (1H, d,= 1.9 Hz, H-6), 6.05 (1H, d,= 16.1 Hz, H-8), 5.22 (1H, d,= 7.6 Hz, H-1), 4.33 (1H, dd,= 11.8, 2.3 Hz, H-6a), 4.22 (1H, dd,= 11.8, 6.7 Hz, H-6b), 3.60 (3H, s, 4-OCH3), 3.35~3.47 (4H, m, H-2~5);13C-NMR (150 MHz, CD3OD): 161.4 (C-2), 103.8 (C-3), 179.6 (C-4), 161.2 (C-5), 99.8 (C-6), 163.7 (C-7), 94.2 (C-8), 159.4 (C-9), 106.1 (C-10), 122.6 (C-1), 131.2 (C-2, 6), 115.9 (C-3, 5), 160.9 (C-4), 56.2 (4-OCH3), 111.8 (C-1), 75.7 (C-2), 78.0 (C-3), 71.7 (C-4), 75.9 (C-5), 64.2 (C-6), 127.1 (C-1), 132.4 (C-2, 6), 116.8 (C-3, 5), 155.9 (C-4), 148.66 (C-7), 120.6 (C-8), 168.7 (C-9)。以上数据与文献报道一致[30],故鉴定化合物24为acacetin 7--(6--coumaroyl)-βglucopyranoside。
4 活性筛选
4.1 α-葡萄糖苷酶体外抑制活性测试
化合物对α-葡萄糖苷酶的体外抑制活性测试参考本课题组前期建立的测试方法[31]进行测定。采用100 mmol/L pH 6.9的磷酸盐缓冲液(PBS)精确配制0.1 U/mL的α-葡萄糖苷酶溶液和5 mmol/L的对硝基苯基-α吡喃葡萄糖苷(-nitrophenyl-α--glucopyranoside,pNPG)溶液备用。吸取50 μL样品溶液于96孔板中,加入100 μL酶液,混合均匀后于室温下孵育10 min,加入50 μL pNPG溶液启动反应,分别在反应0、5 min于酶标仪405 nm测吸光度(),以阿卡波糖为阳性对照,设定样品组和空白组(PBS代替样品),记录2次的差值,平行操作3次,按公式计算抑制率。
抑制率=(ΔC-ΔS)/ΔC
ΔC是空白组在0~5 min内的差值,ΔS是样品组在0~5 min内的差值
4.2 5-脂氧合酶体外抑制活性测试
化合物对5-脂氧合酶的体外抑制活性测试参考本课题组前期建立的测试方法[6]进行测定。简述如下,配制底物溶液:配制浓度为200 mmol/L pH 9.0的PBS缓冲液,精确吸取50 μL 聚山梨酯20分散在PBS缓冲溶液中,边摇动边加亚油酸50 μL,混合均匀后加入1 mol/L的氢氧化钠,边加边摇动,直到整个体系澄清,pH调至9.0,加PBS定容至100 mL;用PBS配制0.2 U/mL的5-脂氧合酶溶液。精确吸取50 μL样品溶液于96孔板中,加入100 μL的底物溶液,轻轻摇动混匀,室温孵育5 min,快速加入100 μL酶溶液,分别在反应0、5 min于酶标仪234 nm测值,以槲皮素为阳性对照,设定样品组和空白组(PBS代替样品),记录2次的差值,平行操作3次,按“4.1”项下公式计算抑制率。
4.3 实验结果
化合物在200、100 μmol/L时对α-葡萄糖苷酶和5-脂氧合酶的体外抑制活性测试结果见表1。在23个测试的化合物中(化合物4的量较少,未做活性测定),相较于其他类型的化合物,黄酮类化合物表现出较好的抑制活性,如化合物18、19、23和24在200 μmol/L下对α-葡萄糖苷酶的抑制率分别为50.66%、95.15%、48.90%和75.70%;化合物18、21和24在200μmol/L下对5-脂氧合酶的抑制率分别为84.87%、50.49%和83.96%。对活性较好的化合物18、19和24做进一步活性研究,并通过GraphPad Prism 8.0计算其半数抑制浓度(median inhibition concentration,IC50)值,实验结果见图1。
化合物18对α-葡萄糖苷酶的IC50值为(12.2±1.3)μmol/L,对5-脂氧合酶的IC50值为(34.76±4.3)μmol/L;化合物19对α-葡萄糖苷酶的IC50值为(2.8±0.6)μmol/L;化合物24对α-葡萄糖苷酶的IC50值为(31.1±3.9)μmol/L,对5-脂氧合酶的IC50值为(25.37±2.4)μmol/L。α-葡萄糖苷酶的阳性对照阿卡波糖的IC50值为(0.16±0.0)μmol/L,5-脂氧合酶的阳性对照槲皮素的IC50值为(19.8±0.3)μmol/L。
5 讨论
药蜀葵作为传统的药食两用植物,具有广泛的药理作用和潜在的经济价值。药蜀葵主要含有黄酮类、多糖类和酚酸类化合物,但从中分离鉴定出的化合物并不多,且国内对其研究相对较少;为了充分开发和利用药蜀葵资源,在本课题组之前的研究中,通过活性追踪方式确定了甲醇浸提物醋酸乙酯萃取部位为其抑制α-葡萄糖苷酶和5-脂氧合酶的活性部位。本研究通过系统分离纯化,从药蜀葵茎叶中鉴定了24个化合物,其中有23个化合物(除化合物17)为首次从药蜀葵中被发现;研究结果丰富了药蜀葵中化合物类型。

表1 23个化合物对α-糖苷酶和5-脂氧合酶的体外抑制活性结果
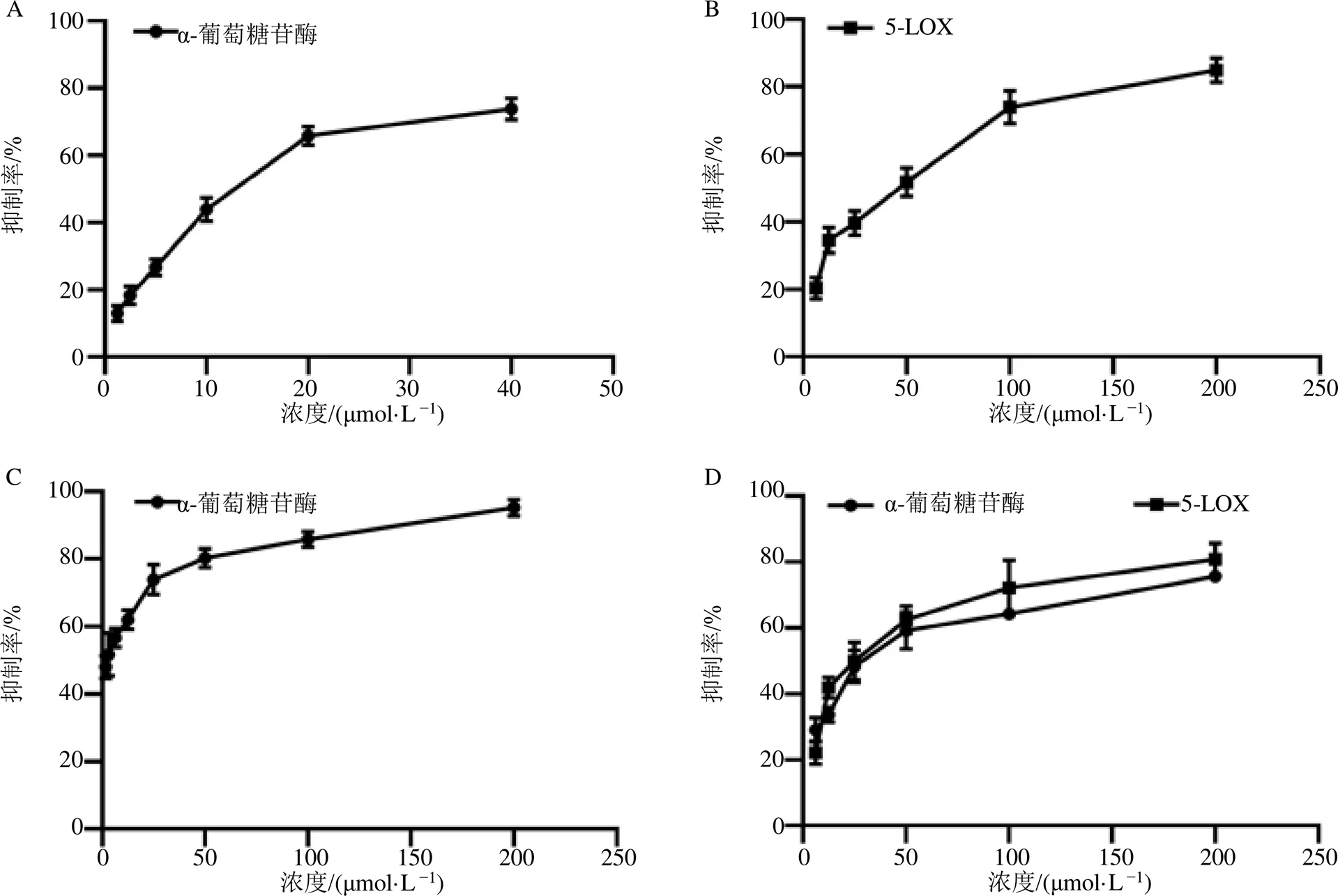
图1 化合物18 (A、B)、19 (C) 和24 (D) 对α-葡萄糖苷酶和5-脂氧合酶的体外抑制活性测试
α-葡萄糖苷酶是降低餐后血糖的有效分子靶标,有研究报道多酚类化合物对α-葡萄糖苷酶具有良好的抑制活性[32],而多羟基取代的类黄酮是有效的α-葡萄糖苷酶抑制剂,在A环的5和7或8位、B环的3和4位和C环3位的羟基化,以及C环2、3位的双键对黄酮类化合物的抑制活性至关重要[33]。本课题组之前发现从药蜀葵茎叶中富集纯化得到的总黄酮具有潜在的体外抑制α-葡萄糖苷酶活性[31]。在本研究开展活性测试的化合物中,相较于阳性对照阿卡波糖,黄酮类化合物均表现出一定的抑制活性,其中化合物18、19和24表现出较好的活性。此前,已有研究报道化合物18是1个潜在的α-葡萄糖苷酶抑制剂[34],化合物19由于其C环3位被羟基化,其活性最好。
5-脂氧合酶是从不饱和脂肪酸合成前列腺素和类花生酸的关键酶和介质,其参与各种炎症和过敏性疾病,如类风湿性关节炎等[35-36]。因此,5-脂氧合酶对于调节和消除炎症过程至关重要。本研究在对5-脂氧合酶的体外活性测试中,发现黄酮类化合物均表现出一定程度的抑制活性,其中化合物18和24表现活性较好,表明其具有潜在的抗炎作用。
本研究初步明确了药蜀葵降血糖及抗炎的可能物质基础,为药蜀葵茎叶的开发提供了科学参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Pakrokh Ghavi P. Modeling and optimization of ultrasound-assisted extraction of polysaccharide from the roots of[J]., 2015, 39(6): 2107-2118.
[2] Fahamiya N, Shiffa M, Aslam M,. Unani perspective of khatmi () [J]., 2016, 5(6): 357-360.
[3] Xue T T, Xu H B, Tang Z S,. Progress in chemical compositions and pharmacological activities of[J]., 2021, 5(2): 210002.
[4] Gudej J. Flavonoid compounds ofleaves. 1. Glucoside esters, monoglucosides [J]., 1985, 42(2): 192-198.
[5] Ali Shah S M, Akhtar N, Akram M,. Pharmacological activity ofL [J]., 2011, 5(24): 5662-5666.
[6] Xue T T, Yang Y G, Tang Z S,. Evaluation of antioxidant, enzyme inhibition, nitric oxide production inhibitory activities and chemical profiles of the active extracts from the medicinal and edible plant:[J]., 2022, 156: 111166.
[7] Yu Z Y, Han C Y, Yu B,. Taxonomic characterization, and secondary metabolite analysis ofsp. nov.: A novel actinomycete with antifungal activity [J]., 2020, 8(1): 77.
[8] Wang X G, Li Q, Jiang S R,. Chemical composition and insecticidal property of(Koidz.) Walker (Family: Myrsinaceae) On(Diptera: Muscidae) [J]., 2017, 170: 70-78.
[9] Jin Q H, Lee C, Lee J W,. Chemical constituents from the fruits of[J]., 2012, 18(3): 200-203.
[10] Shimura Y, Oh K, Kon M,. Enzymatic synthesis of novel branched sugar alcohols mediated by the transglycosylation reaction of pullulan-hydrolyzing amylase II (TVA II) cloned fromR-47 [J]., 2011, 346(13): 1842-1847.
[11] Shen Y M, Mu Q Z. New furans fromchlorolepis [J]., 1990, 56(5): 472-474.
[12] Nikolov P Y, Yaylayan V A. Thermal decomposition of 5-(hydroxymethyl)-2-furaldehyde (HMF) and its further transformations in the presence of glycine [J]., 2011, 59(18): 10104-10113.
[13] Willuhn G, Westhaus R G. Loliolide (calendin) from[J]., 1987, 53(3): 304.
[14] 徐秀丽, 印丽媛, 宋福行, 等. 海洋褐藻叉开网翼藻中的单萜成分研究 [J]. 海洋科学, 2012, 36(10): 81-84.
[15] Shubina L K, Makar′eva T N, Denisenko V A,. 4-hydroxybenzaldehyde from the baikal sponge[J]., 2005, 41(1): 93-94.
[16] 林玉萍, 张旭, 虎春艳, 等. 核桃壳的化学成分 [J]. 食品工业, 2020, 41(8): 300-303.
[17] Siddiqui B S, Kardar M N, Ali S T,. Two new and a known compound from[J]., 2003, 86(6): 2164-2169.
[18] Li L Z, Gao P Y, Song S J,. Monoterpenes and flavones from the leaves ofwith anticoagulant activities [J]., 2015, 12: 237-245.
[19] 朱虹, 唐生安, 秦楠, 等. 旋覆花中化学成分及其活性研究 [J]. 中国中药杂志, 2014, 39(1): 83-88.
[20] Kim K H, Moon E, Kim H K,. Phenolic constituents from the rhizomes ofand their biological evaluation on antitumor and anti-inflammatory activities [J]., 2012, 22(19): 6155-6159.
[21] Gu Q, Zhang X M, Zhou J,. One new dihydrobenzofuran lignan from[J]., 2008, 10(5/6): 499-502.
[22] Miyakoshi M, Shirasuna K, Hirai Y,. Triterpenoid saponins ofleaves [J]., 1999, 62(3): 445-448.
[23] Wei Y, Xie Q Q, Fisher D,. Separation of patuletin-3-O-glucoside, astragalin, quercetin, kaempferol and isorhamnetin from(L.) kuntze by elution-pump-out high-performance counter-current chromatography [J]., 2011, 1218(36): 6206-6211.
[24] 黄丽杰, 刘伟, 崔永霞. 胡颓子叶化学成分的研究 [J]. 中成药, 2015, 37(4): 796-800.
[25] 罗会畏. 辛夷化学成分及药理活性研究 [D]. 武汉: 中南民族大学, 2013.
[26] Plioukas M, Termentzi A, Gabrieli C,. Novel acylflavones fromssp. syriaca [J]., 2010, 123(4): 1136-1141.
[27] Gantimur D, Syrchina A I, Semenov A A. New glycosides from plants of the genus[J]., 1986, 22(1): 32-35.
[28] Nganou B K, Mbaveng A T, Fobofou S A T,. Furoquinolines and dihydrooxazole alkaloids with cytotoxic activity from the stem bark of[J]., 2019, 133: 193-199.
[29] Vijayalakshmi A, Geetha M. Anti-psoriatic activity of flavonoids fromleaves using the rat ultraviolet B ray photodermatitis model [J]., 2014, 24(3): 322-329.
[30] Vassallo A, Cioffi G, De Simone F,. New flavonoid glycosides fromand their antioxidant activity [J]., 2006, 1(12): 1089-1095.
[31] 薛涛涛, 唐志书, 孙强, 等. 药蜀葵中总黄酮提取工艺优化及其生物活性研究 [J]. 中南药学, 2022, 20(2): 334-339.
[32] Robak J, Gryglewski R J. Bioactivity of flavonoids [J]., 1996, 48(6): 555-564.
[33] Proença C, Freitas M, Ribeiro D,. α-Glucosidase inhibition by flavonoids: Anandstructure-activity relationship study [J]., 2017, 32(1): 1216-1228.
[34] Yuca H, Özbek H, Demirezer L Ö,.-Tiliroside: A potent α-glucosidase inhibitor from the leaves ofL [J]., 2021, 188: 112795.
[35] 蔡萧君, 李宇, 胡杨, 等. 基于血液代谢组学技术的甲氨蝶呤抗类风湿性关节炎作用机制研究[J]. 世界中医药, 2021, 16(2): 242-248.
[36] Steinhilber D, Hofmann B. Recent advances in the search for novel 5‐lipoxygenase inhibitors [J]., 2014, 114(1): 70-77.
Chemical constituents from arial part ofand their inhibition activitiestoward α-glucosidase and 5-lipoxygenase
XUE Tao-tao1, TANG Zhi-shu1, 3, DUAN Jin-ao2, RUAN Kai-hua1, YANG Yuan-gui1, SONG Zhong-xing1, XU Hong-bo1
1. Shaanxi Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, State Key Laboratory of Research and Development of Characteristic Resources of Qin Medicine, Shaanxi Institute of Traditional Chinese Medicine Industry, Shaanxi University of Chinese Medicine, Xianyang 712083, China 2. Collaborative Innovation Center of Chinese Medicinal Resources Industrialization of Jiangsu Province, Jiangsu Key Laboratory for Traditional Chinese Medical Formula Research, Nanjing University of Chinese Medicine, Nanjing 210023, China 3. Graduate School of China Academy of Chinese Medical Sciences, Beijing 100700, China
To study the chemical constituents from aerial part ofand their inhibition activitiestoward α-glucosidase and 5-lipoxygenas.Chemical constituents were separated and purified by column chromatography on D101 macroporous adsorption resin, silica gel, MCI gel, Sephadex LH-20, and semi-preparative RP-HPLC. The structures were characterized via spectroscopic data analysis. The inhibitory activities of the compounds against α-glucosidase and 5-lipoxygenasewere measured to evaluate its hypoglycemic and anti-inflammatory effects.Twenty-four compounds were isolated and identified as adenosine (1), leonuriside A (2), benzyl--βglucopyranoside (3), meso-erythritol (4), 5-hydroxymethyl- 2-furancarboxaldehyde (5), 1-[5-(hydroxymethyl) furan-2-yl] ethenone (6), loliolide (7), isololiolide (8), 4-hydroxybenzaldehyde (9), methyl 4-hydroxybenzoate (10), vomifoliol (11), (6,7,9)-roseoside (12), dihydrosyringenin (13), 3-(3,4,5-trimethoxyphenyl) propan-1-ol (14), dihydrodehydrodiconifenyl alcohol (15), oleanolic acid 3--βglucopyranoside (16), astragalin (17),-tiliroside (18), biondnoid I (19), apigenin 7--(6---coumaroyl-βglucopyranoside) (20), diosmetin 7--βglucopyranoside (21), tilianin (22), formononetin 7-glucoside (23), acacetin 7--(6--coumaroyl)-βglucopyranoside (24). The results of the bioactivity test showed that three of the 24 compounds (18, 19, 24) showed significant enzyme inhibitory activity against α-glucosidase [IC50values: (12.2 ± 1.3) μmol/L, (2.8 ± 0.6) μmol/L and (31.1 ± 3.9) μmol/L] and two compounds (18, 24) had significant enzyme inhibitory activity against 5-lipoxygenase with IC50values of (34.76 ± 4.3) μmol/L and (25.37 ± 2.4) μmol/L.Compounds 1—16, 18—24 were isolated fromfor the first time. Furthermore, it was found that compounds have great inhibitory activities toward α-glucosidase (18, 19, 24) and 5-lipoxygenase (18, 24), which show potential hypoglycemic activity and anti-inflammatory activity.
Linn.; flavonoid; α-glucosidase; 5-lipoxygenase;-tiliroside; biondnoid I; tilianin
R284.1
A
0253 - 2670(2023)10 - 3060 - 11
10.7501/j.issn.0253-2670.2023.10.003
2023-01-08
陕西省科技统筹创新工程计划项目(2016KTTSSF01-06-01);陕西省青年科技新星项目(2020KJXX-069);现代农业产业技术体系建设专项基金项目(CARS-21)
薛涛涛(1994—),男,硕士,研究方向为中药药剂。Tel: 18729079884 E-mail: xtt1221@email.sntcm.edu.cn
许洪波(1987—),副教授,硕士生导师,主要从事中药药效物质研究。Tel: (029)38182203 E-mail: xhb2005@sntcm.edu.cn
[责任编辑 王文倩]
