雷公藤甲素经皮给药制剂的研究与筛选
2023-05-20管咏梅雷方方王舒慧朱卫丰陈丽华陈颖翀
管咏梅,雷方方,王舒慧,朱卫丰,陈丽华,吴 璇,陈颖翀
雷公藤甲素经皮给药制剂的研究与筛选
管咏梅,雷方方,王舒慧,朱卫丰,陈丽华,吴 璇*,陈颖翀*
江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
为降低雷公藤甲素经皮给药刺激性、提高经皮渗透性,筛选雷公藤甲素经皮给药载体,为雷公藤甲素经皮给药新型给药系统的开发奠定基础。制备雷公藤甲素立方液晶、醇质体、胶束、凝胶等制剂,采用动态透析释药法考察雷公藤甲素不同剂型的体外释药特性;采用改良的Franz扩散池法考察雷公藤甲素不同剂型体外经皮渗透性能;通过皮肤刺激性实验评价雷公藤甲素不同剂型皮肤刺激性减毒效果。雷公藤甲素立方液晶、醇质体、胶束、凝胶8 h累积释放度分别为(51.40±1.19)%、(100.67±1.37)%、(89.25±4.27)%、(42.61±4.27)%,24 h累积渗透量分别为(0.46±0.02)、(0.48±0.04)、(0.44±0.03)、(0.27±0.02)mg/cm2。皮肤刺激性结果表明,雷公藤甲素立方液晶、醇质体、胶束均呈轻度刺激性,而凝胶为中等刺激性。雷公藤甲素不同剂型有着不同特性,相较醇质体、胶束、凝胶而言,雷公藤甲素立方液晶有良好的缓控释作用和经皮渗透效果,同时能显著降低雷公藤甲素的皮肤刺激性,是雷公藤甲素经皮给药最佳剂型。
雷公藤甲素;立方液晶;醇质体;胶束;凝胶;体外释放;经皮渗透性;皮肤刺激性
雷公藤甲素(triptolide,TP)是从雷公藤Hook. f.中提取的一种天然环氧二萜内酯类化合物,具有抗炎、抗肿瘤、免疫抑制等多种药理活性[1-3],在治疗类风湿性关节炎、胰腺炎、乳腺癌、系统性红斑狼疮等疾病中具有独特优势[4-5],但因其水溶性差、生物利用度低、半衰期短、治疗窗口窄、长期服用具有严重的全身毒性等缺点[6-9],限制了其临床应用。
经皮给药不仅能避免肝脏首过效应以及胃肠道不良反应,同时具有无痛、易操作、安全性高、患者依从性高等优点。透皮给药的疗效取决于药物透过皮肤的角质层屏障的能力[3],课题组前期对雷公藤经皮给药进行了系统研究,研究结果表明,雷公藤经皮给药能显著降低其的不良反应,且治疗类风湿性关节炎效果确切[10-11],但TP水溶性差、生物利用度低,且经皮给药具有皮肤刺激性。近年来新剂型因具有增加难溶性药物溶解度、提高生物利用度、促进吸收、靶向作用、缓控释作用等优点而受到广泛关注[12-13],而醇质体、立方液晶、胶束等新型给药系统均具有缓控释、靶向等作用,且皮肤刺激性小、生物利用度高[14-15]。
因此,本实验拟制备雷公藤甲素立方液晶(lipid cubic liquid crystalline nanoparticles,LCNPs)(TP@LCNPs)、醇脂体(ethosomes,ES)(TP@ES)、胶束(micelles,MS)(TP@MS)及凝胶(gel,GL)(TP@GL)等给药载体,采用体外释放实验、体外经皮渗透性实验、皮肤刺激性实验对制剂进行评价,以期筛选出TP经皮给药毒性低、生物利用度高、且具有长效作用的剂型,为雷公藤甲素新型给药系统的开发奠定基础。
1 仪器与材料
1.1 仪器
BSA224S型电子天平,赛多利斯科学仪器(北京)有限公司;ZNCL-BS1型智能磁力搅拌器,巩义市玉华仪器有限责任公司;TGL-20MC型高速冷冻离心机,湖南湘鑫仪器仪表有限公司;JY92-IIN型超声波细胞粉碎机,宁波新芝生物科技有限公司;EYEL4型旋转蒸发仪,上海爱朗仪器有限公司;SHB-III型循环水式多用真空泵,郑州长城科贸有限公司;KQ-500E型超声波清洗器,昆山市超声仪器有限公司;TT-6D Franz型扩散池,天津正通科技有限公司;Zetasizer Nano-S型纳米粒度仪及分析软件,英国Malvern公司;ECLIPSE Ci-S型正置显微镜,日本Nikon公司;Agilent 1260 HPLC系统化学工作站,美国Agilent公司;色谱柱:Ace Excel 5 C18柱(250 mm×4.8 mm,5.0 µm),广州菲罗门科学仪器有限公司。
1.2 材料
TP对照品,批号21070204,质量分数99.11%,成都普菲德生物技术有限公司;单油甘油酸酯,批号ECN203-827-7,东京化成工业株式会社;泊洛沙姆407,批号GND32821B,巴斯夫股份有限公司;大豆卵磷脂,批号SY-SO-200801,艾伟拓医药科技有限公司;卡波姆940,批号C12058025,上海麦克林生化科技有限公司;泊洛沙姆P123,批号MKCL5494,西格玛奥德里奇(上海)贸易有限公司;氨基甲酸乙酯,批号RH396520,上海易恩化学技术有限公司;丙二醇,批号RH167722,上海易恩化学技术有限公司;丙三醇,批号2109072,西陇科学股份有限公司;多聚甲醛组织固定液,批号21321635,Biosharp公司;乙醇,批号2201259,体积分数95%,西陇科学有限公司;甲醇,批号DW1BH121802,色谱纯,弗顿公司;其余试剂均为分析纯。
1.3 动物
健康SPF级SD大鼠,雄性27只,雌性15只,购自江西中医药大学实验动物中心,许可证号SCXK(赣)2018-0003,体质量(200±20)g。所有动物实验遵循江西中医药大学动物实验伦理委员会有关实验动物管理和使用的规定,符合3R原则。
2 方法与结果
2.1 TP含量测定方法
2.1.1 色谱条件 色谱柱为Ace Excel 5 C18柱(250 mm×4.8 mm,5.0 µm);UV检测器、Agilent 1260 HPLC系统化学工作站,美国Agilent公司;流动相为甲醇-水(50∶50);检测波长218 nm;体积流量0.8 mL/min;柱温35 ℃;进样量20 μL。
2.1.2 对照品溶液及供试品溶液的制备
(1)对照品溶液的制备:精密称取10 mg TP对照品于50 mL量瓶中,使用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即制得200 μg/mL对照品溶液。
(2)空白LCNPs溶液的制备:取0.5 mL空白LCNPs于50 mL量瓶中,用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即得。
(3)TP@LCNPs供试品溶液的制备:取0.5 mL TP@LCNPs于50 mL量瓶中,用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即得。
(4)TP@ES供试品溶液的制备:取0.5 mL TP@ES于50 mL量瓶中,用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即得。
(5)TP@MS供试品溶液的制备:取0.5 mL TP@MS于50 mL量瓶中,用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即得。
(6)TP@GL供试品溶液的制备:取0.5 g TP@GL于50 mL量瓶中,用60%甲醇溶液溶解后,使用流动相进行定容,取1 mL过0.22 μm滤膜于进样瓶,即得。
2.1.3 专属性考察 分别取空白LCNPs溶液、TP对照品溶液、TP不同剂型供试品溶液,按照“2.1.1”项色谱条件下进行分析,记录色谱图,如图1所示。
2.1.4 线性关系考察 取“2.1.2”项下对照品溶液,并以此溶液作为母液,采用甲醇溶液将其分别稀释为2、10、20、40、80、100、160、200 μg/mL溶液,按照“2.1.1”项色谱条件下进行分析,每个样品进样3次,记录其峰面积。以质量浓度为横坐标(),峰面积为纵坐标(),对结果进行线性回归。计算所得线性方程为=45.751+26.357,2=1.000 0,RSD均小于2%,结果表明TP在2~200 μg/mL呈良好的线性关系。
2.1.5 精密度试验 分别取TP低、中、高质量浓度(2、80、200 μg/mL)的对照品溶液,按照“2.1.1”项色谱条件下进行分析,每个样品重复进样6次,记录对应的峰面积。结果表明,日内精密度分别为0.18%、0.22%、0.22%,日间精密度分别为0.74%、0.68%、0.51%,表明仪器精密度良好。
2.1.6 加样回收率试验 分别取6份1 mL已知质量浓度的TP@LCNPs供试品溶液,分别与1 mL的TP对照品溶液(200 μg/mL)混合均匀,按照“2.1.1”项色谱条件下进行分析,每个样品重复进样3次,记录对应的峰面积,计算得其平均加样回收率为103.17%,RSD值为0.59%,表明该方法的准确性良好,适用于TP的含量测定。
2.1.7 重复性试验 平行制备6份TP@LCNPs供试品溶液,按照“2.1.1”项色谱条件下进行分析,每个样品重复进样3次,记录对应的峰面积。计算TP质量浓度的RSD为0.32%,表明该方法重复性良好。
2.1.8 稳定性试验 精密量取同一份TP@LCNPs供试品溶液,分别在0、2、4、8、12、24 h按照“2.1.1”项色谱条件下进行分析,记录对应的峰面积。计算得RSD值为0.42%,表明供试品溶液稳定性良好。

图1 空白LCNPs溶液(A)、TP对照品溶液(B)、TP@ LCNPs (C)、TP@ES (D)、TP@MS (E)、TP@GL (F)的HPLC图
2.2 TP不同制剂的制备
2.2.1 TP@LCNPs的制备 精密称取72 mg单油酸甘油酯和8 mg TP溶于适量乙醇,加热搅拌溶解,作为A相,精密称量8 mg泊洛沙姆407溶于适量超纯水中,加热搅拌溶解,作为B相。将B相缓慢滴加于A相中,以300 r/min转速于45 ℃下磁力搅拌、再超声,即得。
2.2.2 TP@ES的制备 精密称取138 mg大豆卵磷脂、27.6 mg胆固醇及2.3 mL丙二醇,超声溶解,加入用5.4 mL乙醇溶解完全的16 mg TP溶液,以500 r/min转速于30 ℃下磁力搅拌混合溶解得醇相,吸取于注射器中;另取适量超纯水于烧杯中,磁力搅拌(35 ℃,600 r/min),同时将注射器中醇相缓慢滴加于水相,继续水合30 min,再冰浴超声5 min,即得[16]。
2.2.3 TP@MS的制备 精密称取124 mg泊洛沙姆407、216 mg泊洛沙姆P123、12 mg TP,加入适量无水乙醇加热溶解,50 ℃旋转蒸发,得干燥透明的药膜,加入适量超纯水,50 ℃水浴条件下,300 r/min搅拌水合1 h后将所得混悬液,过0.22 μm微孔滤膜,即得[17]。
2.2.4 TP@GL的制备 精密称取0.4 g卡波姆940于碾钵中,加入适量甘油润湿并碾磨均匀,加入适量的双蒸水碾磨,溶胀6 h后加入20 mg TP碾磨均匀即得[18]。
2.3 TP不同制剂包封率、粒径及电位的测量
2.3.1 粒径和ζ电位的测定 将TP样品用双蒸水稀释10倍,采用马尔文纳米粒度仪测量粒径和电位,平行测定3次,记录粒径、ζ电位及PDI,具体结果见表1。

表1 TP透皮制剂包封率、粒径及ζ电位测定结果(, n = 3)
“/”代表无法测量
“/” represents unmeasurable
2.3.2 包封率的测定
(1)TP@LCNPs和TP@ES包封率的测定:取0.5 mL TP@LCNPs或TP@ES于50 mL量瓶中,加入60%甲醇溶液,流动相定容至50 mL,取1 mL样品过0.22 μm微孔滤膜于进样瓶中等待进样。再取0.5 mL TP@LCNPs或TP@ES样品于超滤离心管(截留相对分子质量10 000)中,以12 000 r/min离心(离心半径6.2 cm)15 min,取离心液于进样瓶中等待进样。按照“2.1.1”项色谱条件下进行分析,通过公式计算样品包封率,具体结果见表1。
包封率=Lip/tot
Lip为药物在TP@LCNPs或TP@ES中的量,tot为游离药物和药物在TP@LCNPs或TP@ES中的总量
(2)TP@MS包封率的测定:取TP@MS样品0.5 mL于50 mL量瓶中,加入60%甲醇溶液,流动相定容至50 mL,取1 mL样品过0.22 μm微孔滤膜按照“2.1.1”项色谱条件下进行分析,测定TP含量,计算制剂中总药量a。再取过0.22 μm微孔滤膜的TP@MS样品0.5 mL于50 mL量瓶中,加入60%甲醇溶液,流动相定容至50 mL,取1 mL样品过0.22 μm微孔滤膜,按照“2.1.1”项色谱条件下进行分析,测定TP含量,计算包载药物含量b。通过公式计算样品包封率,具体结果见表1。
包封率=b/a
由上述结果可知,与LCNPs、ES、GL相比,MS的载药量更低,10~100 nm的粒径限制了其疏水核中包载的药量,因此,胶束不利于大量包载药物。ES与其他制剂相比,表现出更低的包封效率和更小的粒径,这可能是因为ES体系中高浓度的乙醇使囊泡的流动性过大,导致药物泄露,包封率降低。与其他制剂相比,GL的粒径过大,更难以穿透皮肤屏障,限制了其在经皮给药中的应用。LCNPs在具有较高的载药量与包封率的同时,电位也更小,其稳定性也更好。
2.4 体外释放度实验
2.4.1 TP透皮制剂样品含药量测定 分别精密量取TP@LCNPs、TP@ES、TP@MS样品0.5 mL和0.5 g TP@GL于50 mL量瓶中,加入60%甲醇溶液,流动相定容至50 mL。取1 mL样品过0.22 μm微孔滤膜于进样瓶中等待进样。按照“2.1.1”项色谱条件下进行分析,测量样品含药量。
2.4.2 体外释放度测定 取煮沸10 min并清洗干净的透析袋(截留相对分子质量8000~14 000),分别加入4 mL TP@LCNPs、TP@ES、TP@MS和4 g TP@GL,每组样品平行实验3次。将装有样品的透析袋同时放入200 mL的20%乙醇生理盐水的释放介质中,温度维持37 ℃,以200 r/min磁力搅拌,并在0.083、0.167、0.25、0.5、1、2、3、4、6、8 h时取样1 mL过0.22 μm微孔滤膜于进样瓶中,同时补足相应体积的释放介质。按照“2.1.1”项色谱条件,测定每个时间点下的样品中的TP质量浓度,通过公式计算累积释放率,并采用零级动力学、一级动力学、Higuchi方程对释放曲线进行拟合,并计算相关系数。结果见图2和表2、3。
累积释放率=取样时间点质量浓度/样品初始质量浓度
由上述结果可知,TP@LCNPs、TP@ES、TP@ MS、TP@GL8 h累积释放率分别为(51.40±1.19)%、(100.67±1.37)%、(89.25±4.27)%、(42.61±4.27)%,通过对TP透皮制剂累积释放率曲线进行方程拟合,发现以上4种剂型释放曲线都符合Higuchi方程,相关系数2接近1,拟合较好。然而,TP@ES在8 h累积释放率己经达到(100.67±1.37)%,在8 h内已释放完全,说明缓释效果不明显;TP@MS释放为(89.25±4.27)%,与TP@ES组无显著性差异,说明缓释效果也不明显;而TP@LCNPs和TP@GL的累积释放率为(51.40±1.19)%和(42.61±4.27)%,显著小于TP@ES组的累积释放率(<0.05),说明TP@LCNPs和TP@GL在8 h内具有明显的缓控释效果。

图2 TP透皮制剂体外释放曲线

表2 TP透皮制剂体外释放结果(, n = 3)

表3 TP透皮制剂体外释放曲线方程拟合(, n = 3)
2.5 体外经皮渗透性实验
2.5.1 大鼠皮肤处理 取健康雄性SD大鼠12只,用25%氨基甲酸乙酯麻醉,剔除大鼠腹毛,剥离出大鼠腹部皮肤,并小心清除皮下组织和脂肪,用生理盐水洗净、锡箔纸包被贮存于−20 ℃冰柜中,待用[16,19]。
2.5.2 体外透皮性实验 从冰柜中取出大鼠皮肤,在室温下自然解冻半小时,用生理盐水洗净,将角质层面朝上平铺固定于改良Franz扩散池上,加入超声脱气的20%乙醇生理盐水,使大鼠皮肤完全接触到接收液。将接收池置于(37.0±0.2)℃、350 r/min条件下平衡30 min。分别加入2 mL的TP@ES、TP@LCNPs、TP@MS和2 g TP@GL于平衡后的接收池,每组平行实验3次。将温度维持37 ℃,以200 r/min磁力搅拌,并在0.5、1、2、3、4、6、8、10、12、24 h时取样1 mL过0.22 μm微孔滤膜于进样瓶中,同时补足相应体积的释放介质。
按照“2.1.1”项色谱条件,测定每个时间点下样品中TP的质量浓度。按照公式计算单位面积累积渗透量(Q),通过公式计算单位面积累积渗透率(F),并采用零级动力学、一级动力学、Higuchi方程对释放曲线进行拟合,并计算相关系数,结果如图3和表4、5所示。

F=Q/载药量
Q表示时间内单位面积累积渗透量,V为每次取样体积,C为第个时间点测得质量浓度,为接收池体积,为有效透皮面积
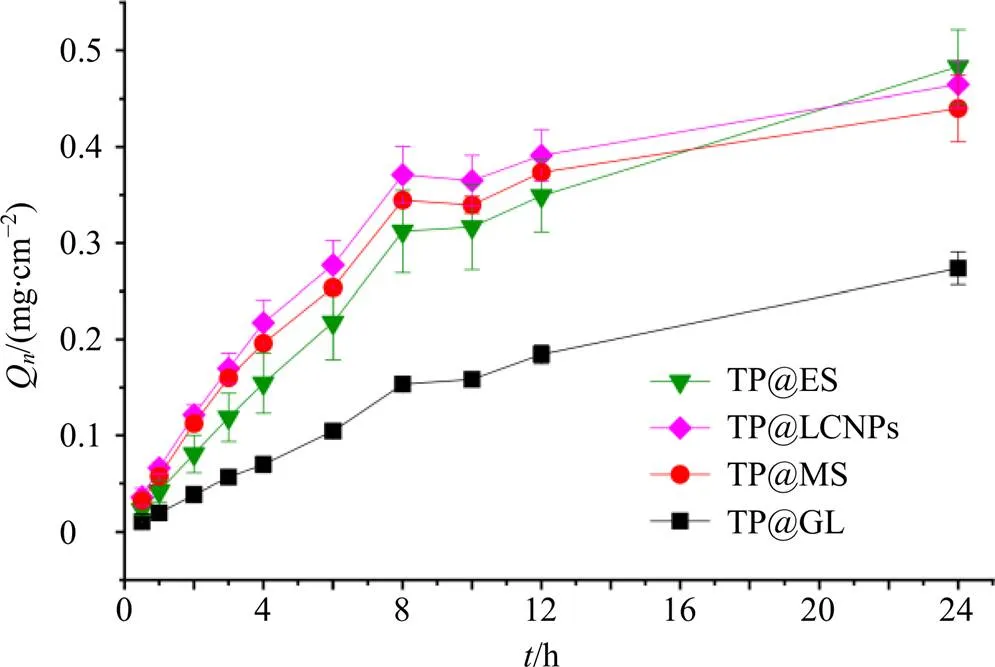
图3 TP透皮制剂累积释放量-时间曲线
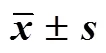
表4 TP透皮制剂渗透速率(, n = 3)
与TP@GL比较:*<0.05
*<0.05TP@GL
由上述结果可知,TP@LCNPs、TP@ES、TP@ MS、TP@GL 24 h累积渗透量(24)分别为(0.46±0.02)、(0.48±0.04)、(0.44±0.03)、(0.27±0.017)mg/cm2;累积渗透速率分别为0.018 0、0.020 0、0.017 6、0.015 4 mg/(cm2∙h),且TP@LCNPs、TP@ES和TP@MS的24和F均显著大于TP@GL(<0.05)。同时对累积释放量-时间曲线进行方程拟合,发现以上剂型释放曲线都符合Higuchi方程,表明TP@LCNPs、TP@ES、TP@MS和TP@GL均具有缓释作用。另外,根据24 h累积透过量结果可知,TP@LCNPs、TP@ES和TP@MS经皮渗透性能均显著强于TP@GL(<0.05)。
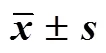
表5 TP透皮制剂累积透过量-时间拟合方程(, n = 3)
2.6 皮肤刺激性实验
2.6.1 动物分组 将健康的SD大鼠适应性饲养1周后,随机分成TP@GL组、TP@LCNPs组、TP@MS组、TP@ES组和生理盐水对照组,每组6只,雌雄各半。
2.6.2 实验方法 实验前24 h将大鼠背部的毛去除,剃毛面积为3 cm×3 cm,不得损伤皮肤。每组的给药剂量为0.4 mg/kg,连续给药7 d,每次给药6 h后用温水清洗给药部位,1 h后观察给药部位是否出现红斑、水肿,并对给药后的皮肤进行评分并根据积分平均值判定皮肤刺激性强度[20-21]。末次给药观察后,麻醉大鼠,取5 mm×5 mm大小的皮肤组织于4%多聚甲醛组织固定液中固定,制成HE染色切片,用正置微镜观察[22-23],结果见图4与表6。
皮肤刺激性评分标准:无红斑、轻度红斑、中度红斑、重度红斑和水肿性红斑分别计0、1、2、3、4分;无水肿、轻度水肿、中度水肿、重度水肿、严重水肿分别计0、1、2、3、4分。刺激分值=(红斑积分+水肿积分)/动物只数。刺激分值<0.50为无刺激性,0.50~2.99分为轻度刺激性,3.00~5.99分为中度刺激性,6.00~8.00分为强度刺激性。
由7 d刺激性感官评分结果可知,TP@LCNPs、TP@ES、TP@MS有轻度刺激性,TP@GL则具有中度刺激性。对TP@LCNPs、TP@ES、TP@MS和TP@GL的刺激性评分结果进行单因素方差分析,发现TP@LCNPs、TP@ES、TP@MS与TP@GL组之间具有显著性差异(<0.05),由此可知LCNPs、ES、MS等新型制剂都能降低TP的经皮刺激性,而GL则没有减轻TP毒副作用的效果。
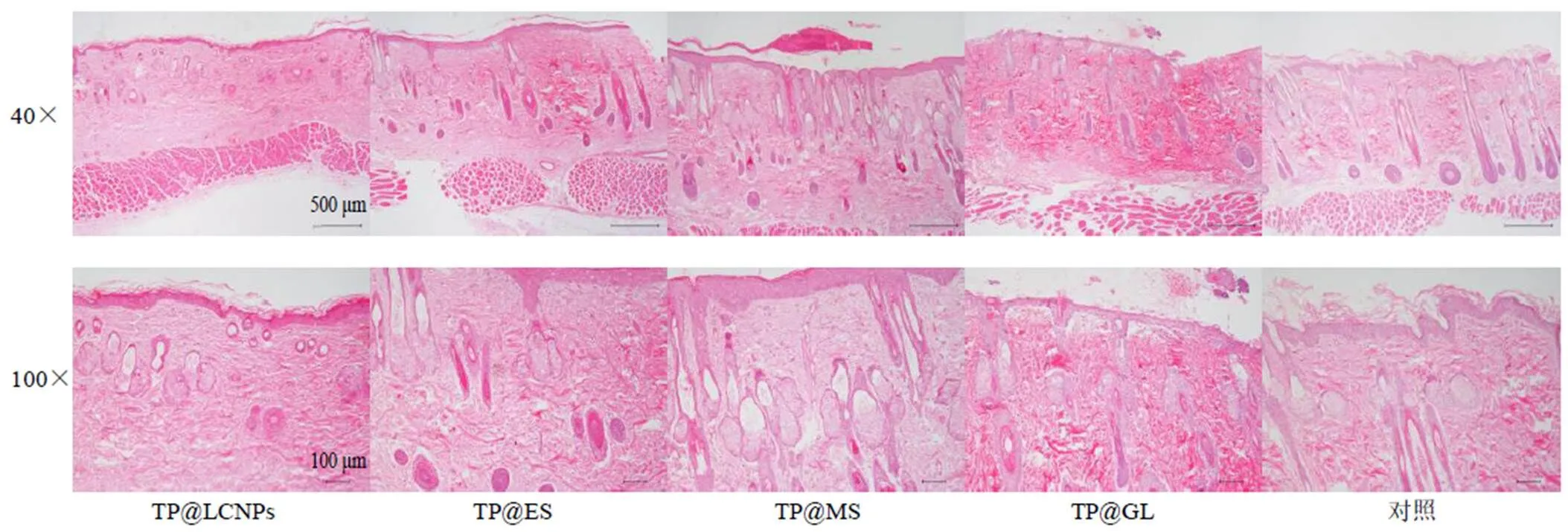
图4 TP透皮制剂HE染色切片图
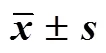
表6 TP透皮制剂皮肤刺激性评分(, n = 6)
HE染色切片镜检可见,TP@LCNPs组大鼠皮肤角质层变薄,表皮完整,皮肤附属器完整,无炎症细胞浸润。TP@ES组大鼠皮肤组织表皮完整,真皮层有少量炎症细胞浸润,皮肤附属器未见明显减少。TP@MS组大鼠皮肤鳞状上皮增厚,表面痂皮附着,皮肤附属器破坏减少,上皮下胶原大量增生,有少量炎细胞浸润。TP@GL组大鼠上皮坏死、脱落,皮肤附属器破坏减少,表皮与真皮交界处局灶出血、水肿,伴胶原增生,真皮层和平滑肌之间有淋巴细胞浸润。
综上所述,HE染色切片结果与刺激性评分结果一致,TP@LCNPs、TP@ES、TP@MS均能减轻TP的皮肤毒性。
3 讨论
由体外释放度实验结果可知,在8 h内,TP@ LCNPs、TP@ES、TP@MS、TP@GL均具有缓控释效果,释放度曲线符合Higuchi方程,相关性良好,TP@LCNPs和TP@GL的累积释放度显著小于TP@ES和TP@MS(<0.05),说明TP@LCNPs和TP@GL的缓控释效果优于TP@ES和TP@MS。
体外透皮实验结果与体外释放度实验一致,TP@LCNPs、TP@ES、TP@MS、TP@GL4种剂型均具有缓控释效果,但TP@LCNPs、TP@ES、TP@ MS的24 h累积透过量显著高于TP@GL的24 h累积透过量(<0.05),表明TP@LCNPs、TP@ES和TP@MS经皮渗透性能显著强于TP@GL。笔者认为,LCNPs较强的缓释效果与促渗作用可能与其结构和理化性质密切相关,研究表明,LCNPs包载难溶性药物时,会降低其脂质双分子层的流动性,使其固态性质更显著,从而导致药物释放更缓慢[24]。
此外,LCNPs可利用完整的包载作用及通过扰乱角质层结构的有序性使得药物透过皮肤屏障,达到良好的促渗效果[25]。而GL因其较差的流动性和较大的粒径,使药物难以从载体中迅速释放出来且难以透过皮肤屏障,故表现为较强的缓释作用和较差的渗透效果。因此,ES和MS更适用于需要药物迅速发挥疗效的临床应用,而LCNPs和GL则适用于局部给药或者缓控释给药,以达到长效缓释的作用效果。
7 d皮肤刺激性实验感官评分结果与HE染色切片镜检结果均证明LCNPs、ES、MS能显著减轻TP的皮肤刺激性(<0.05),而GL则不具有降低TP经皮刺激性的效果。综上所述,TP@LCNPs在有着良好的缓控释作用和经皮渗透效果的同时能显著降低雷公藤甲素的皮肤刺激性故本实验最终选定TP@LCNPs为TP经皮给药的最佳剂型。
为了解决TP水溶性差、生物利用度低、经皮给药具有严重的皮肤刺激性等问题[6-9],本实验制备了TP@LCNPs、TP@ES、TP@MS、TP@GL 4种制剂,并采用体外释放实验、体外透皮实验、皮肤刺激性实验对其进行了综合评估,确定了TP经皮给药系统的最佳设计剂型、最佳载药效率、体外释药特性和经皮毒性大小,为雷公藤甲素经皮给药的药物制剂开发及临床应用奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 王伯祥, 马金凯, 邓文龙, 等. 现代中药药理学 [M]. 天津: 天津科技出版社, 1995: 1222-1227.
[2] Zhou Z L, Yang Y X, Ding J,. Triptolide: Structural modifications, structure-activity relationships, bioactivities, clinical development and mechanisms [J]., 2012, 29(4): 457-475.
[3] Sabbagh F, Kim B S. Recent advances in polymeric transdermal drug delivery systems [J]., 2022, 341: 132-146.
[4] 陈鑫, 张永萍, 徐剑, 等. 雷公藤甲素的现代研究进展 [J]. 贵州中医药大学学报, 2021, 43(5): 85-89.
[5] 管咏梅, 王舒慧, 胡育森, 等. 雷公藤甲素二元醇质体凝胶的皮肤药动学研究 [J]. 中草药, 2022, 53(3): 720-725.
[6] 王贝, 江振洲, 张陆勇. 雷公藤甲素毒性及减毒的研究进展 [J]. 药物评价研究, 2012, 35(3): 211-215.
[7] Xi C, Peng S, Wu Z,. Toxicity of triptolide and the molecular mechanisms involved [J]., 2017, 90: 531-541.
[8] 严银银, 张振强, 曾华辉, 等. 雷公藤甲素的不良反应及减毒研究进展 [J]. 中华中医药学刊, 2021, 39(11): 139-143.
[9] 徐资怡, 陈佳美, 钟雪梅, 等. 甘草酸替代胆固醇构建载雷公藤甲素的脂质纳米粒的适宜性研究 [J]. 中草药, 2023, 54(3): 722-733.
[10] 管咏梅, 张建林, 刘佳, 等. 雷公藤甲素微乳凝胶对CIA大鼠T细胞相关因子调节作用研究 [J]. 世界中医药, 2019, 14(7): 1635-1638.
[11] 张建林. 基于HaCaT细胞的雷公藤甲素配伍阿魏酸减毒机制研究 [D]. 南昌: 江西中医药大学, 2019.
[12] 马宏丹, 王露, 郭东艳. 经皮给药系统与新载体的研究进展 [J]. 陕西中医, 2017, 38(9): 1319-1320.
[13] 宋基正, 刘宇灵, 林龙飞, 等. 雷公藤甲素抗肿瘤新型给药系统研究进展 [J]. 中草药, 2019, 50(5): 1269-1275.
[14] 刘丽丽, 陈谢谢, 陈家乐, 等. 脂质立方液晶纳米粒的研究进展及其在经皮给药系统中的应用 [J]. 中国药学杂志, 2017, 52(12): 1005-1010.
[15] 李恬, 黄钢, 宋少莉. 雷公藤甲素抗肿瘤机制及其新型给药系统 [J]. 中医学报, 2021, 36(7): 1452-1456.
[16] 管咏梅, 杨丽娜, 胡育森, 等. 雷公藤甲素二元醇质体的制备及评价 [J]. 中南药学, 2022, 20(2): 271-277.
[17] 张奇峰, 尹美珍. 普朗尼克F127/P123-雷公藤甲素载药胶束的逆转肿瘤耐药作用 [J]. 武汉理工大学学报, 2021, 43(2): 5-11.
[18] 杨盟. 雷公藤甲素纳米凝胶的构建及其透皮转运机制研究 [D]. 上海: 中国人民解放军海军军医大学, 2018.
[19] 单倩倩, 蒋晓静, 桂双英. 雷公藤甲素立方液晶的制备及体外评价 [J]. 中国药学杂志, 2019, 54(9): 726-733.
[20] 李燕. 雷公藤甲素外用凝胶的研制 [D]. 重庆: 重庆医科大学, 2008.
[21] 杨艳, 付昆, 徐敏, 等. 伏九贴敷疗法皮肤刺激性与抗哮喘作用相关性研究 [J]. 辽宁中医药大学学报, 2018, 20(1): 193-196.
[22] 田甜. 雷公藤甲素多肽衍生物经皮吸收及局部毒性的研究 [D]. 大连: 大连理工大学, 2020.
[23] 唐从国, 郭周庆. 如何做好一张HE染色切片 [J]. 中国组织化学与细胞化学杂志, 2012, 21(4): 428-429.
[24] 贾佳佳, 梁文迪, 代英辉, 等. 溶质液晶作为经皮给药载体的研究进展 [J]. 中国药剂学杂志: 网络版, 2022, 20(3): 96-102.
[25] 曾令军, 张灵娜, 陈旭, 等. 立方液晶载体在经皮给药系统中的促渗机制研究 [J]. 中国药师, 2021, 24(9): 1670-1675.
Screening of transdermal drug delivery preparations of triptolide
GUAN Yong-mei, LEI Fang-fang, WANG Shu-hui, ZHU Wei-feng, CHEN Li-hua, WU Xuan, CHEN Ying-chong
Key Laboratory of Modern Chinese Medicine Preparations, Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
In order to reduce the irritation and improve the transdermal permeability of triptolide, the transdermal drug delivery carrier of triptolide (TP) was screened to lay a foundation for the development of a new transdermal drug delivery system of triptolide.Triptolide lipid cubic liquid crystalline nanoparticles, ethosomes, micelles, gel and other preparations were prepared. Therelease characteristics of different formulations of triptolide were investigated by dynamic dialysis release method. The improved Franz diffusion cell method was used to investigate thepercutaneous permeability of different formulations of triptolide. The skin irritation attenuation effect of different dosage forms of triptolide was evaluated by skin irritation test.The cumulative release rates of triptolide lipid cubic liquid crystalline nanoparticles, ethosomes, micelles and gel at 8 h were (51.40 ± 1.19)%, (100.67 ± 1.37)%, (89.25 ± 4.27)% and (42.61 ± 4.27)%, respectively. The cumulative permeation amounts at 24 h were (0.46 ± 0.02), (0.48 ± 0.04), (0.44 ± 0.03) and (0.27 ± 0.02) mg/cm2, respectively. The results of skin irritation showed that triptolide lipid cubic liquid crystalline nanoparticles, ethosomes and micelles had mild irritation, while triptolide gel had moderate irritation.Different dosage forms of triptolide have different characteristics. Compared with ethosomes, micelles and gels, triptolide cubic liquid crystalline nanoparticles has good sustained and controlled release effect and percutaneous penetration effect, and can significantly reduce the skin irritation of triptolide. It is the best dosage form for transdermal administration of triptolide.
triptolide; cubic liquid crystal; ethosomes; micelles; gel;release; percutaneous permeability; skin irritation
R283.6
A
0253 - 2670(2023)10 - 3093 - 08
10.7501/j.issn.0253-2670.2023.10.006
2022-11-16
国家自然科学基金资助项目(82060722);江西省自然科学基金资助项目(20202BAB206081);2021年度江西省研究生创新专项资金资助项目(YC2021-S504)
管咏梅(1979—),博士,教授,博士研究生导师,从事中药新制剂与新技术研究。E-mail: guanym2008@163.com
吴 璇,女,讲师,主要从事药剂学及生物化学研究。E-mail: anita0725@163.com
陈颖翀,女,博士,副教授,硕士研究生导师,从事中药新剂型与新技术研究。E-mail: yc_chen1020@163.com
[责任编辑 郑礼胜]
