基于指纹图谱和UPLC-MS/MS定量测定对不同产地陈皮的质量评价研究
2023-05-20肖建才闫滨滨万修福邹隆琼吴统选康传志吕朝耕
肖建才,闫滨滨,万修福,邹隆琼,吴统选,刘 爽,康传志,吕朝耕,王 升,张 燕*,杨 健*
基于指纹图谱和UPLC-MS/MS定量测定对不同产地陈皮的质量评价研究
肖建才1,闫滨滨1,万修福1,邹隆琼2,吴统选3,刘 爽3,康传志1,吕朝耕1,王 升1,张 燕1*,杨 健1*
1. 中国中医科学院 中药资源中心 道地药材国家重点实验室培育基地,北京 100700 2. 重庆三峡云海药业股份有限公司,重庆 404500 3. 天圣制药集团股份有限公司,重庆 401120
采用HPLC指纹图谱与化学计量学相结合、UPLC-MS/MS测定多黄酮成分含量的方法,测定不同产地陈皮质量,为其鉴别和质量控制提供依据。采用HPLC-DAD指纹图谱检测并结合“中药色谱指纹图谱相似度评价系统(2012A版)”建立6个产区,49个不同批次陈皮药材(S1~S49)指纹图谱,并进行相似度评价和共有峰确认,结合聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)等化学计量学综合分析。采用UPLC-MS/MS法建立了8个黄酮类成分柚皮素、柚皮苷、木犀草苷、川陈皮素、橙皮素、橙皮苷、橘皮素和芸香柚皮苷的含量测定方法对60批7个产地陈皮药材进行评价。建立了49批不同产地陈皮药材的指纹图谱,相似度为0.864~0.999,共标定了11个共有峰,HCA分析49批陈皮明显分为4类;PCA得到5个主成分的累积方差贡献率为92.748%;OPLS-DA表明8、7、10和11号峰可能是影响陈皮药材质量的差异标志物;含量测定结果表明不同产地陈皮中黄酮类含量存在显著差异,广东新会以川陈皮素和橘皮素为主要标志成分,四川荷花池以木犀草苷为差异性成分,江西樟树以柚皮素和柚皮苷为差异性成分,广西玉林则以橙皮素、橙皮苷和芸香柚皮苷为主,重庆云阳以川陈皮素和橙皮苷为主。建立了稳定性强的不同产地陈皮HPLC指纹图谱和8个黄酮类UPLC-MS/MS定量测定方法,结合化学计量学可用于陈皮药材综合评价和质量控制。
陈皮;指纹图谱;UPLC-MS/MS;柚皮素;柚皮苷;木犀草苷;川陈皮素;橙皮素;橙皮苷;橘皮素;芸香柚皮苷;化学计量学;含量测定;质量评价
陈皮为芸香科柑橘属小乔木植物橘Blanco及其栽培变种的干燥成熟果皮[1]。药材分为“陈皮”和“广陈皮”,作为药用可以追溯至东汉时期的《神农本草经》[2],药材主要分布在广东、广西、江西、四川等地。该药具有保肝、抗呼吸系统疾病、抗氧化、抗炎、强心等药理活性作用,现代研究表明其主要含有黄酮类、挥发油、生物碱、柠檬苦素类等化学成分[3-6]。
陈皮质量研究目前主要侧重于陈皮HPLC指纹图谱或建立“一测多评”的黄酮含量方法[7-9],但对于不同产地多批次陈皮药材的HPLC图谱及UPLC-MS/MS法对陈皮黄酮多成分含量测定的综合评价尚无清晰的报道。本研究建立了不同产地陈皮的HPLC指纹图谱并进行聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)等化学计量学分析;课题组依据前期的代谢组数据分析工作,筛选出8种对评价陈皮质量相关性较高的黄酮类成分,包括黄酮和甲基黄酮类,并进行了质谱参数优化和含量测定工作。本研究前期共收集了49份陈皮样品,建立了6个主产区的指纹图谱评价体系,之后受到了国医大师金世元的启示,补充了重庆产区的11份陈皮样品进行含量测定,但受实验条件限制未对重庆产区的样品进行指纹图谱测定。本实验综合分析各产区陈皮药材的成分差异或相似原因,明确其产地差异及成分特征,为陈皮药材的质量评价研究提供一定的参考依据。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent公司);Acquity UPLCTMI-Class型超高效液相色谱系统(美国Waters公司);API-6500型四级杆-线性离子阱质谱仪(美国ABSCIEX公司,配有离子喷雾接口);Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);New Classic MS-S型电子天平(瑞士梅特勒-托利多公司);SB800DTD型超声波清洗机(宁波新芝生物科技有限公司)。
1.2 材料
对照品柚皮素(批号B21596-2019)、柚皮苷(批号B21594-2019)、木犀草苷(批号B20887-2018)、川陈皮素(批号B20199-2019)、橙皮素(批号B20184-2019)、橙皮苷(批号B20182-2019)、橘皮素(批号B20646-2019)和芸香柚皮苷(批号B21634-2019),均购自上海源叶生物科技有限公司,质量分数均大于98%;甲醇(色谱级,Sigma公司);其余试剂均为分析纯。
1.3 药材
共收集储藏时间为3年的陈皮药材60批,产区来自广西(7批)、四川(12批)、安徽(8批)、江西(6批)、河北(7批)、广东(9批)和重庆(11批)等地。所有药材经中国中医科学院中药资源中心张燕研究员鉴定为芸香科植物橘Blanco及其栽培变种的干燥成熟果皮。具体信息见表1。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A),水(0.1%乙酸)(B);梯度洗脱:0~20 min,20%~40% A;20~35 min,40%~70% A;35~55 min,70%~100% A;55~60 min,100% A;检测波长280 nm,体积流量1 mL/min,柱温25 ℃,进样体积10 μL。
2.2 供试品溶液的制备
取陈皮粉末(过二号筛)约1.0 g,精密称定。置具塞三角瓶中,精密加入70%甲醇30 mL,称定质量,超声处理45 min,放置室温,用70%甲醇补足减失的质量、摇匀,0.45mm微孔滤膜滤过,取续滤液,备用。
2.3 指纹图谱的建立及分析
2.3.1 精密度试验 精密称取陈皮药材粉末(S1)约1 g(过二号筛),按“2.2”项下方法制备供试品,按“2.1”项下色谱条件测定,连续进样6次,记录色谱图,选取其中6个峰为目标,计算得到6个共有峰的相对保留时间的RSD均小于0.10%,相对峰面积的RSD均小于1.08%,表明仪器精密度良好。
2.3.2 重复性试验 精密称取同一陈皮药材粉末(S1)约1 g(过二号筛),按“2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件测定,选取其中6个峰为目标,计算得到6个共有峰的相对保留时间的RSD均小于0.10%,相对峰面积的RSD均小于1.60%,表明方法重复性良好。
2.3.3 稳定性试验 取同一陈皮药材供试品溶液,按“2.1”项下色谱条件测定,分别在0、5、10、15、20、24 h连续进样6次分析,选取其中6个峰为目标,计算得到6个共有峰的相对保留时间的RSD均小于0.49%,相对峰面积的RSD均小于1.70%,表明供试品溶液在24 h内稳定性良好。
2.3.4 指纹图谱建立及相似度评价 精密称取49批陈皮(S1~S49)粉末各1.0 g,按照“2.2”项下方法制备供试品溶液,然后分别按照“2.1”项下色谱条件进样测定,记录色谱图。将49批陈皮样品的HPLC图谱导入《中药色谱指纹图谱相似度评价系统(2012.1版)》中,以S1号样品的色谱图为参照谱图,时间窗宽度为0.5 min中位数法生成对照图谱(R),经多点校正后进行色谱峰匹配生成样品叠加指纹图谱(图1);然后以对照指纹图谱为参照,以平均数法进行相似度计算。结果,49批陈皮样品中共标定了11个共有峰,占各批次样品总峰面积的73.47%~92.42%;各样品图谱与对照指纹图谱的相似度为0.864~0.999,说明49批陈皮样品具有很高的相似性,相似度评价结果见表2。

图1 49批陈皮药材样品的HPLC叠加指纹图谱和对照指纹图谱(R)

表2 49批陈皮药材样品HPLC指纹图谱相似度评价结果
2.4 化学计量学分析
为了进一步阐明不同产区的陈皮药材化学成分的差异,采用HCA、PCA、OPLS-DA对6个产区的陈皮进行分析。
2.4.1 HCA 系统聚类分析是一种非监督模式的分析方法,采用Hiplot Pro软件对49批样品中11个共有峰的标准化峰面积聚类分析,样品被分为4类:第1类为S8、S12~S18、S38、S49;第2类为S3、S5、S19、S41~S48、S38;第3类为S1~S2、S4、S7、S9、S35~S37、S39~S40;其余为第4类(图2)。HCA结果表明不同产区陈皮药材的质量存在一定地域差异性,可能受地理位置接近的影响,部分产地陈皮样品聚类结果存在相互交叉,如广东新会和广西玉林、安徽亳州和江西樟树等大部分陈皮药材具有一定的相似性。
2.4.2 PCA 进一步研究6个经销产区或道地产区陈皮化学成分之间的差异,将49批样品中11个共有峰的峰面积导入SPSS.24软件进行PCA,计算相关矩阵的特征值及其方差贡献率。以特征值>1为基准,得到陈皮药材指纹图谱共有峰特征值(表3),5个主成分的累积方差贡献率达到92.748%,说明5个主成分在反映6个产区陈皮样品共有成分关系中起到主导作用。其中第1~5个主成分贡献率分别为42.582%、21.788%、12.545%、9.824%和6.009%。由主成分矩阵(表4)可知各个共有峰对5个主成分不同的独立方差贡献率,第1主成分主要代表了峰5、10、11;第2主成分主要代表了峰1、2、7、9;第3主成分主要代表峰6;第4主成分主要代表了峰3;第5主成分主要代表了峰4、8。
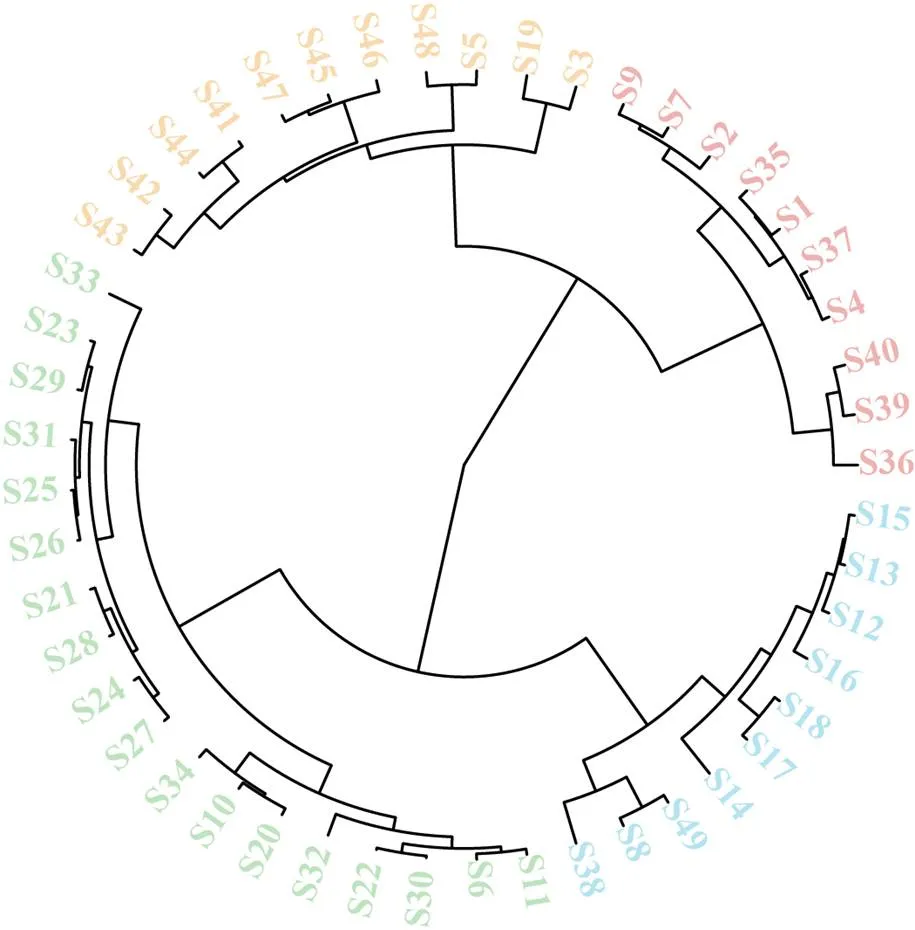
图2 49批陈皮药材指纹图谱共有峰HCA图
2.4.3 OPLS-DA 在PCA的基础上利用OPLS-DA有利于对不同产区的49份陈皮样品强化组间差异分析,筛选出对组间差异贡献率较大的成分。采用SIMCA-P14.0进行数据分析,将11个共有峰的峰面积设为变量,以49份陈皮样品Z-score标准化处理后的数据为观测值,根据样品的不同产区设置组别,进行OPLS-DA分析,在建立的模型中,累计解释能力参数2和2分别为0.981和0.503,预测能力参数(2)为0.251,提示本实验所建立的OPLS-DA模型的稳定性较好,预测能力欠佳,2−2>0.3,该模型并不理想。由OPLS-DA得分图3可知,广东新会、河北安国、广西玉林和四川荷花池等产地组间差异较明显,少部分样品与其他产地出现交集;江西樟树与安徽亳州组间出现明显交叉,这可能与两省地理环境接近或样品组内差异较大,导致组间差异不明显有关,分析结果与HCA一致。此外,VIP是筛选差异化合物的重要指标之一,选取VIP值>1的化合物作为差异性标志物,在0.95的置信区间内,OPLS-DA分析提取的变量VIP图见图4。按VIP大小顺序依次为8号峰>7号峰>10号峰>11号峰,这些成分是区分6个产区陈皮差异的主要标志性物质,值得在今后的研究中加以关注,剩余色谱峰的VIP值均小于1,对于分类贡献不高。以上结果分析表明,HPLC指纹图谱可作为评价不同产地陈皮质量研究的主要参考依据之一。
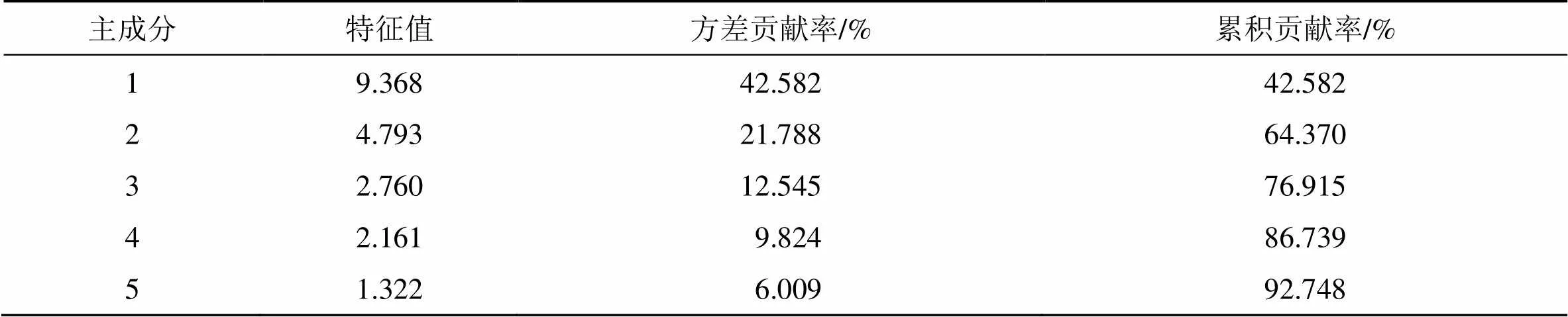
表3 49批陈皮药材样品主成分特征值及贡献率

表4 49批陈皮药材样品共有峰成分矩阵

图3 49批陈皮药材OPLS-DA得分图
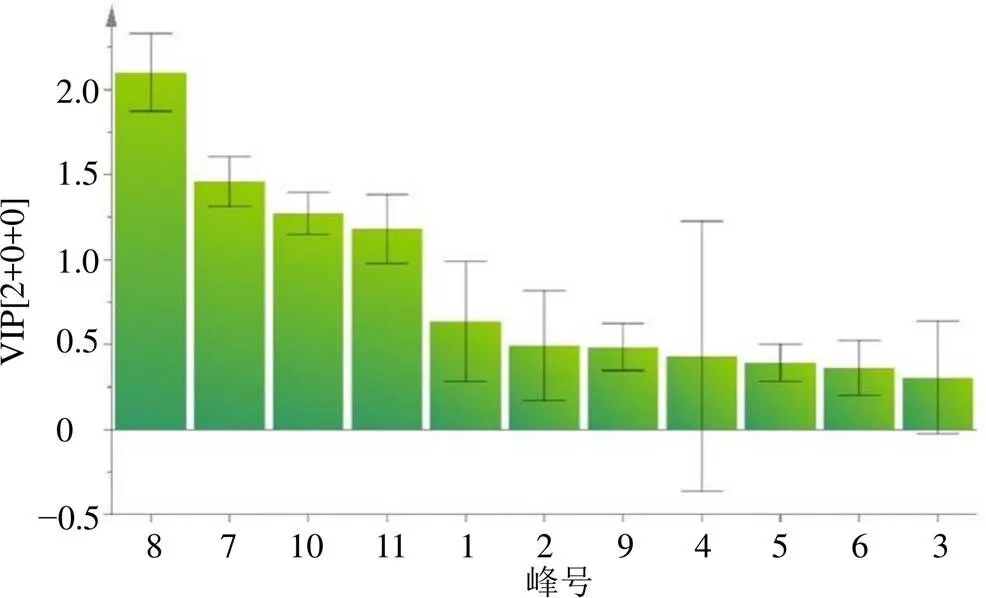
图4 49批陈皮药材11个共有峰VIP值
2.5 UPLC-MS/MS法黄酮类含量测定
2.5.1 色谱条件 Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.8 μm),以0.1%甲酸-水(A)-0.1%甲酸-乙腈(B)为流动相,梯度洗脱(0~1.0 min,5%~25% B;1.0~3.5 min,25%~40% B;3.5~4.5 min,40%~60% B),体积流量0.6 mL/min,柱温40 ℃,进样体积1 μL。
2.5.2 质谱条件 离子源:Turbo V,电离模式:ESI-,气帘气(CUR)体积流量:30 L/min,喷雾电压(IS):5500 V;雾化气(GS1)体积流量:55 L/min;加热辅助气(GS2)体积流量55 L/min;采集方式:多反应监测模式(MRM);离子化温度(TEMP):550 ℃。优化的条件参数见表5。

表5 陈皮样品中8个黄酮类成分的质谱参数
2.5.3 供试品溶液制备 取过筛陈皮样品粉末约0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理(功率:300 W;频率:40 kHz)45 min放至室温,再称定质量,用甲醇补足减失的质量,摇匀,12 000 r/min离心10 min,上清液经0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液,备用。精密量取上述供试品溶液1 mL至10 mL量瓶中,以甲醇定容,摇匀,过0.22 μm微孔滤膜,即得川陈皮素和橙皮苷供试品溶液。
2.5.4 对照品溶液制备 分别精密称取黄酮类化合物对照品适量,加甲醇制备成质量浓度为1.000 mg/mL的单一成分对照品溶液,精密量取各成分对照品溶液适量配制成3组混合对照品溶液,其中I组包括柚皮苷(0.025 mg/mL)、橙皮素(0.002 0 mg/mL)、橙皮苷(0.050 mg/mL)、橘皮素(0.025 mg/mL)和芸香柚皮苷(0.030 mg/mL),II组包括木犀草苷(0.000 20 mg/mL)和川陈皮素(0.010 mg/mL),III组包括柚皮素(0.001 0 mg/mL)。
2.5.5 线性关系考察 精密量取适量的混标溶液,稀释成多个不同浓度的混合对照品溶液,按“2.5.1”和“2.5.2”项下条件进样测定。以对照品溶液中目标化合物浓度为横坐标(),所测得的峰面积为纵坐标(),计算线性回归方程,结果见表6。
2.5.6 精密度试验 选择“2.5.4”项下中间浓度的混合对照品溶液,按“2.5.1”和“2.5.2”项下条件进样检测,重复进样7次,得到混合对照品中各成分的峰面积,计算得到各成分(柚皮素、柚皮苷、木犀草苷、川陈皮素、橙皮素、橙皮苷、橘皮素、芸香柚皮苷)峰面积的RSD值分别为2.77%、0.79%、2.41%、1.98%、2.65%、1.53%、1.71%、1.85%,表明仪器精密度良好。
2.5.7 重复性试验 精密称取同一批次陈皮样品粉末0.2 g,平行7份,按照“2.5.3”项下操作制备供试品溶液,按照“2.5.1”和“2.5.2”项下条件进样检测,得到各成分的峰面积,计算得到各成分(柚皮素、柚皮苷、木犀草苷、川陈皮素、橙皮素、橙皮苷、橘皮素、芸香柚皮苷)峰面积的RSD值分别为2.89%、2.33%、4.01%、1.93%、2.11%、1.89%、2.63%、2.95%,表明该方法重复性良好。
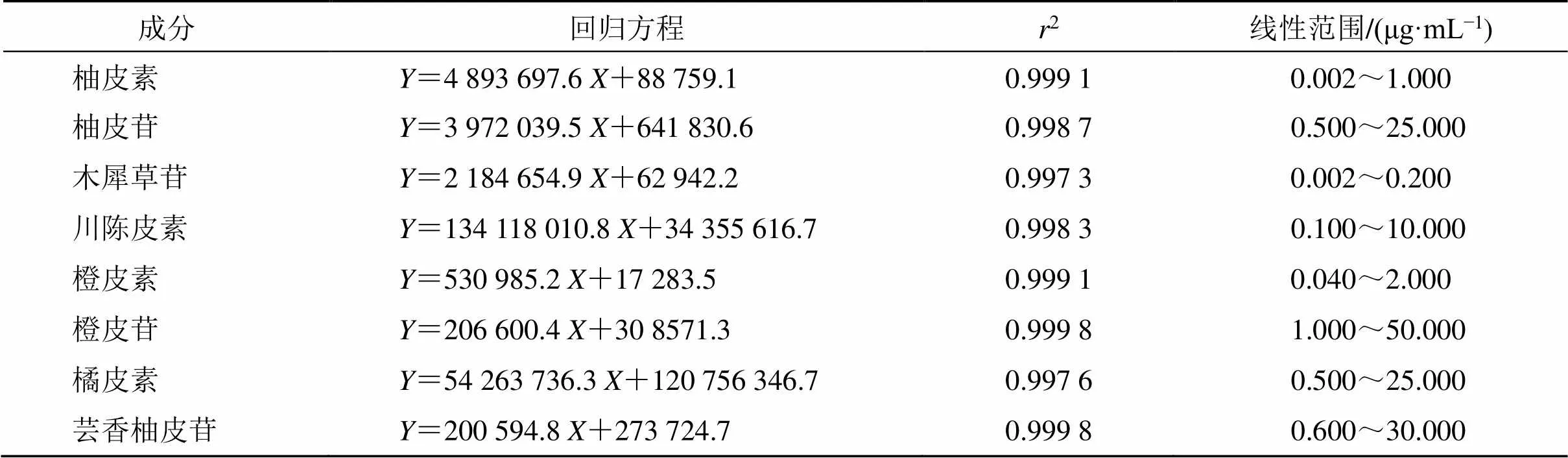
表6 陈皮样品中8种黄酮类成分的线性关系考察结果
2.5.8 稳定性试验 取同一批次供试品溶液,按“2.5.1”和“2.5.2”项下条件,分别在0、2、4、6、8、12、18、24 h进样检测,得到各成分的峰面积,计算得到各成分(柚皮素、柚皮苷、木犀草苷、川陈皮素、橙皮素、橙皮苷、橘皮素、芸香柚皮苷)在不同检测时间下峰面积的RSD值为1.39%、1.86%、2.19%、0.93%、2.22%、0.83%、1.46%、2.53%,表明陈皮样品供试品溶液中这8种黄酮类成分在24 h内稳定性良好。
2.5.9 加样回收率试验 精密称取适量已知目标成分含量的同一批次陈皮样品粉末,按“2.5.3”项下制备供试品溶液,并精密加入适量对照品溶液,按“2.5.1”和“2.5.2”项下条件进样检测,得到各成分的峰面积,计算得到各黄酮类成分(柚皮素、柚皮苷、木犀草苷、川陈皮素、橙皮素、橙皮苷、橘皮素、芸香柚皮苷)的平均加样回收率分别为96.7%、99.2%、97.7%、101.0%、97.6%、100.6%、101.5%、98.9%,其对应的RSD值分别为4.65%、3.04%、4.78%、3.91%、4.54%、1.64%、3.76%、4.12%。
2.5.10 样品含量测定 取60批陈皮样品粉末(过2号筛)约1.0 g,精密称定,分别按“2.5.3”项下方法制备样品溶液,按“2.5.1”项下色谱条件进样测定,计算8种黄酮类成分的质量分数,结果见表7,可见不同产地陈皮黄酮类化学成分含量存在显著差异。通过含量测定结果箱线图分析(图5),可有根据推测不同产地陈皮中代表性化学成分。柚皮素和柚皮苷在江西樟树(S33)收集的陈皮样品质量分数最高,分别达到95.62、2 444.23 μg/g,四川荷花池(S14)则为最低;四川荷花池以木犀草苷质量分数显著高于其他产区,最高值和平均值分别高达19.98 μg/g(S15)和8.328 μg/g;川陈皮素和橘皮素在广东新会(S44)收集的陈皮样品含量最高,分别达到10 384.44 μg/g和1 182.59 μg/g,安徽亳州(S21)则为最低;广西玉林则以橙皮素、橙皮苷和芸香柚皮苷为主,平均质量分数均显著高于其他产区;橙皮苷在安徽亳州收集的陈皮样品仅次于广西玉林,但橙皮素含量显著低于其他产区;芸香橙皮苷在江西樟树收集的样品仅次于广西玉林;重庆云阳则以川陈皮素和橘皮素为主,平均含量位于产区前列。
结果分析表明,柚皮素和柚皮苷可作为区分江西产地与其他产地陈皮的差异性成分;木犀草苷可作为区分四川产地与其他产地陈皮的差异性成分;橙皮素、橙皮苷和芸香柚皮苷可作为区分广西产地与其他产地陈皮的差异性成分;享有盛誉的重庆“橘红”药材可以“川陈皮素和橙皮苷”作为差异性成分;素有“广陈皮”之称的广东新会产地陈皮则以川陈皮素和橘皮素作为区分其他产地陈皮的差异性成分。江西樟树和安徽亳州地理位置接近,木犀草苷、川陈皮素和橙皮素的含量都整体偏低,而河北安国仅以芸香柚皮苷含量较高。根据母核有无甲基的不同将8类黄酮类成分可以分成黄酮类和甲基黄酮类2大类并进行数据统计,根据《中国药典》2020年版规定的“川陈皮素、橙皮苷和橘皮素”3类化学成分进行平均统计,统计结果见图6。结果表明,陈皮中甲基黄酮类的含量占黄酮总含量的绝大部分,黄酮类含量普遍偏低,其中江西樟树最高,达到656.59 μg/g;值得一提的是,重庆云阳的陈皮药材的“甲基黄酮类、3个黄酮类以及总黄酮”平均含量均位于所有产区之首,分别高达11 040.04、18 239.70、6 955.96 μg/g,相比“广陈皮”还要略胜一筹。

表7 陈皮样品中8个黄酮类成分的含量测定(n=3)
续表7
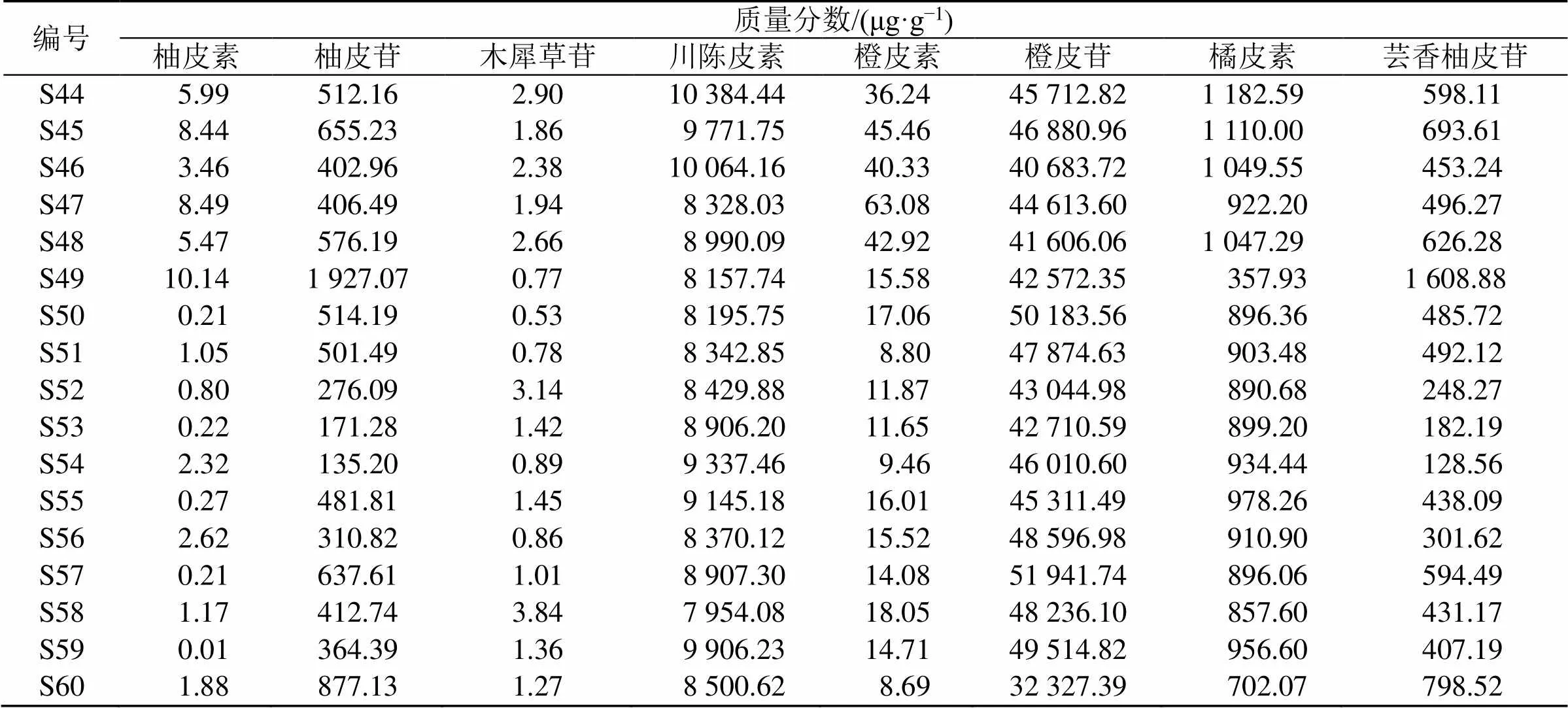
编号质量分数/(μg·g−1) 柚皮素柚皮苷木犀草苷川陈皮素橙皮素橙皮苷橘皮素芸香柚皮苷 S44 5.99512.162.9010 384.4436.2445 712.821 182.59 598.11 S45 8.44655.231.86 9 771.7545.4646 880.961 110.00 693.61 S46 3.46402.962.3810 064.1640.3340 683.721 049.55 453.24 S47 8.49406.491.94 8 328.0363.0844 613.60 922.20 496.27 S48 5.47576.192.66 8 990.0942.9241 606.061 047.29 626.28 S4910.141 927.070.77 8 157.7415.5842 572.35 357.931 608.88 S50 0.21514.190.53 8 195.7517.0650 183.56 896.36 485.72 S51 1.05501.490.78 8 342.85 8.8047 874.63 903.48 492.12 S52 0.80276.093.14 8 429.8811.8743 044.98 890.68 248.27 S53 0.22171.281.42 8 906.2011.6542 710.59 899.20 182.19 S54 2.32135.200.89 9 337.46 9.4646 010.60 934.44 128.56 S55 0.27481.811.45 9 145.1816.0145 311.49 978.26 438.09 S56 2.62310.820.86 8 370.1215.5248 596.98 910.90 301.62 S57 0.21637.611.01 8 907.3014.0851 941.74 896.06 594.49 S58 1.17412.743.84 7 954.0818.0548 236.10 857.60 431.17 S59 0.01364.391.36 9 906.2314.7149 514.82 956.60 407.19 S60 1.88877.131.27 8 500.62 8.6932 327.39 702.07 798.52
3 讨论
本研究选择广西玉林、四川荷花池、安徽亳州、江西樟树、河北安国和广东新会6个陈皮经销产区或道地产区的49批样品,以HPLC-DVD指纹图谱质量控制模式定性;结果表明49批陈皮药材指纹图谱的相似度在0.864~0.999,确定了11个共有峰,通过HCA、PCA和OPLS-DA等化学计量法分析表明49批陈皮样品明显分为4类,安徽亳州与江西樟树地理位置十分接近,二者之间明显聚类一支,5个主成分累计方差贡献率为92.748%,OPLS-DA结果显示广东新会、河北安国、广西玉林和四川荷花池等产地组间差异较明显,但少部分样品与其他产地出现交集,与HCA结果一致;通过VIP值排序发现共有峰8、7、11、10这些成分可作为区分和鉴别不同产区陈皮药材质量的主要标志性成分,但这些差异成分未做指认,本课题组后续将会继续深入研究,以期为评价不同产地陈皮药材质量提供更为全面的参考依据。后期,经国医大师金世元教授指导,加上重庆云阳产区(S50~S60)的陈皮进行定量测定,采用UPLC-MS/MS测定方法对60批样品、7个产区的8种黄酮类成分含量定量,结合化学计量学方法全面评价不同产地陈皮的质量和寻求显著性差异成分。8种黄酮类含量测定结果得到,不同产地化学成分含量存在显著差异,这种差异产生的主要原因可能是由于南北气候和地理风貌的迥异,陈皮中次生代谢物的积累长期受到了土壤微生物、光合作用、关键酶基因等因子的调控,不同产地陈皮黄酮类成分的主要合成途径发生了改变,种质资源有所区别。同时,不同产地陈皮的原植物栽培模式、加工和采收方式对黄酮类成分的积累也会构成影响。

图6 60批陈皮黄酮类平均含量统计对比图
对此做出了进一步讨论,重庆产区的陈皮原植物是大红袍红橘,为橘皮去掉里面的白瓤后的部位,称橘皮橘红。近年来,针对“大红袍(川芸皮)”的质量评价有学者做出了研究[10],金世元国医大师在著作[11]中对其也是颇有赞赏,认为重庆地处亚热带,四季分明,日照充足,极其适合红橘生长,且历史悠久,从古至今颇有声望,为道地药材。因此,在后续的研究中值得对红橘进一步细化研究。
本研究所建立的不同产地陈皮HPLC指纹图谱及UPLC-MS/MS黄酮类含量测定方法准确、可靠。结合指纹图谱和黄酮类成分的定量研究,可以为区分不同产地陈皮质量标志物和控制陈皮质量提供参考。此外,陈皮质量素有“陈久者良”之民间评价[12],储存年限长短对陈皮内在化合物的含量积累起到了至关重要的作用,这也直接关乎陈皮的质量评价[13],本课题组后续将进一步对不同产地的不同储存年限陈皮的指纹图谱和代谢物动态变化进行深入探讨以建立更为全面的质量评价体系。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 199.
[2] 清·顾观光等著. 于童蒙编译. 神农本草经 [M]. 哈尔滨: 哈尔滨出版社, 2007: 71-72.
[3] 李皓翔, 梅全喜, 赵志敏, 等. 陈皮、广陈皮及新会陈皮的化学成分、药理作用和综合利用研究概况[A] // 2020第25届广东省药师周大会论文集[C]. 广州: 广东省药师协会, 2019: 597-603.
[4] 李尚科, 李跑, 杜国荣, 等. 陈皮组成成分及检测方法研究进展 [J]. 中国果菜, 2019, 39(10): 36-39.
[5] 李皓翔, 梅全喜, 赵志敏, 等. 陈皮广陈皮及新会陈皮的化学成分药理作用和综合利用研究概况[J]. 时珍国医国药, 2019, 30(6): 1460-1463.
[6] 刘荣, 韦正, 樊丹青, 等. 不同栽培品种橘皮中主要活性成分的动态积累 [J]. 中国实验方剂学杂志, 2014, 20(15): 111-117.
[7] Jin B, Pei X, Liang H,. Establishment of HPLC fingerprint, cluster analysis and principle component analysis of citrus reticulata [J]., 2018, 10(1):69-73.
[8] 易伦朝, 谢培山, 梁逸曾, 等. 液相色谱特定(指纹) 图谱分析用于陈皮的质量考察 [J]. 药物分析杂志, 2006, 26(7): 918-922.
[9] 高喜梅, 王晓凤, 周冰倩, 等. HPLC多波长条件下陈皮指纹图谱及“一测多评”法的建立 [J]. 中药材, 2019, 42(11): 2598-2602.
[10] 王坚, 王刚. 源于重庆产大红袍红橘的陈皮挥发油成分研究 [J]. 中国药房, 2012, 23(39): 3717-3720.
[11] 黄璐琦. 道地药材“黄金”图谱精粹 [M]. 上海: 上海科学技术出版社, 2017: 54-57.
[12] 明·杜文燮著. 张向群校注. 药鉴 [M]. 北京: 中国中医药出版社, 1993: 4.
[13] 余祥英, 陈晓纯, 李玉婷, 等. 不同产地和不同贮藏年限陈皮的化学成分研究进展 [J]. 食品安全质量检测学报, 2020, 11(12): 3809-3817.
Study on quality evaluation offrom different origins by fingerprint and UPLC-MS/MS flavonoid content determination
XIAO Jian-cai1, YAN Bin-bin1, WAN Xiu-fu1, ZOU Long-qiong2, WU Tong-xuan3, LIU Shuang3, KANG Chuan-zhi1, LYU Chao-geng1, WANG Sheng1, ZHANG Yan1, YANG Jian1
1. State Key Laboratory and Breeding Base of Dao-di Herbs, Institute of Chinese Materia Medica, China Academy of Chinese Material Sciences, Beijing 100700, China 2. Sanxia Yunhai Pharmaceutical Group Co., Ltd., Chongqing 404500, China 3. Tiansheng Pharmaceutical Group Co., Ltd., Chongqing 401120, China
To determine the quality offrom different production areas by combining HPLC fingerprinting with chemometrics and UPLC-MS/MS to provide a basis for its identification and quality control.The fingerprints of 49 batches offrom six production areas (S1—S49) were established using HPLC-DAD fingerprinting combined with the “Similarity Evaluation System for Chromatographic Fingerprinting in Chinese Medicine (2012A version)”, and similarity evaluation and common peaks were confirmed. Hierarchical clustering analysis (HCA), principal component analysis (PCA) and orthogonal partial least-squares-discrimination analysis (OPLS-DA). discrimination analysis (OPLS-DA) and other chemometric syntheses. A UPLC-MS/MS method was developed for the determination of eight flavonoid components “naringenin, naringin, luteoloside, nobiletin, hesperitin, hesperidin, tangeretin, narirutin” in 60 batches offrom seven origins.The fingerprint profiles of 49 batches offrom different origins were established with similarities of 0.864—0.999. Eleven common peaks were identified, HCA analysis of 49 batches ofwas divided into four categories; PCA obtained a cumulative variance contribution of 92.748% for the five principal components; OPLA-DA indicated that peak 8, peak 7, peak 10 and peak 11 might be the differential markers affecting the quality of; and the results of content determination showed that there were significant differences in flavonoid contents infrom different origins, with nobiletin and tangeretin as the main marker components in Xinhui, Guangdong, luteoloside as the differential component in Hehuachi, Sichuan, naringenin and naringin as the differential in Zhangshu, Jiangxi, and metabolites, and Guangxi Yulin was dominated by hesperitin, hesperidin and narirutin, and Chongqing Yunyang was dominated by nobiletin and hesperidin;Stable HPLC fingerprints offrom different origins and quantitative determination of eight flavonoids by UPLC-MS/MS were established, which can be used for a comprehensive evaluation and quality control ofherbs in combination with chemometrics.
Blanco; fingerprint; UPLC-MS/MS; naringenin; naringin; luteoloside; nobiletin; hesperitin; hesperidin; tangeretin; narirutin; chemometrics; content determination; quality evaluation
R286.2
A
0253 - 2670(2023)10 - 3302 - 10
10.7501/j.issn.0253-2670.2023.10.027
2022-10-06
国家自然科学基金资助项目(81874337);国家自然科学基金资助项目(81891014);国家重点研发计划项目(2017YFC1700701);中国中医科学院重点领域(ZZ10-027)
肖建才,男,硕士研究生,研究方向为中药资源与栽培。E-mail: xjc1770557949@163.com
杨 健,男,博士,副研究员,研究方向为中药资源评价与开发利用。E-mail: yangchem2012@163.com
张 燕,女,博士,研究员,研究方向为中药资源与栽培。E-mail: zhangyan8669@126.com
[责任编辑 时圣明]
