嵌合抗原受体修饰T细胞免疫治疗食管癌的实验研究
2023-05-17丁辉谢甲贝李修岭韩双印周炳喜
丁辉,谢甲贝,李修岭,韩双印,周炳喜
(河南省人民医院 消化内科,河南 郑州 450003)
嵌合抗原受体修饰T细胞(chimeric antigen receptor-modified T cells,CAR-T)是肿瘤细胞免疫治疗新方法。经过基因改造后的T细胞获得了多种功能表型,表现出良好的肿瘤特异杀伤作用,在白血病、淋巴瘤等血液肿瘤中表现出惊人效果,这促使研究者探索其在实体瘤中的应用前景[1-2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)、癌胚抗原(carcinoembryonic antigen,CEA)、黏蛋白1(mucin 1,MUC1)等分子靶点在脑胶质瘤、肺癌、结肠癌等实体瘤中的体内外试验取得了初步的进展[3-4]。食管癌是常见的消化系统恶性肿瘤之一,严重危害大众健康,尽管近年在早期诊断、手术切除及放化疗等方面取得进步,但预后仍差。本研究基于前期研制的CAR-T[5],以食管癌为研究对象、EGFR Ⅲ型突变体(epidermal growth factor receptor variant Ⅲ,EGFRvⅢ)为分子靶点,探索其对食管癌细胞EC109的杀伤活性,旨在为食管癌细胞免疫治疗提供试验依据和研究基础。
1 材料与方法
1.1 材料限制性内切酶EcoRI及BamHⅠ购自BioLabs公司,质粒DNA提取试剂盒购自Omega公司。淋巴细胞Ficoll分离液购自TBD公司,pCDH慢病毒载体购于Novagen公司,重组人源化CD3单抗及CD28单抗购自Novoprotein公司。Alexa Fluor 647标记山羊抗小鼠IgG F(ab)2抗体购自Jackson公司。p24蛋白酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自Abcam公司,乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自Beyotime公司,干扰素γ(interferon,IFN-γ)ELISA试剂盒购自NEOBIOSCIENCE公司。细胞株EC109、EC109-EGFRvⅢ由本实验室保存。SPF级NSG小鼠购自上海南方模式生物。
1.2 pEGFRvⅢ/CAR表达载体的构建前期构建的二代CAR表达框EGFRvⅢ scFv-Hinge-TM-ICOS-CD3(1 314 bp)通过引物CAR-F(5’-GCGAATTCACCATGGGATGGAGCTGTATCAT-3’)和CAR-R(5’-CGGGATCCTTAGCGAGGGGGCAGGGCCTGCA-3’)扩增后克隆入pCDH慢病毒转移载体的MCS位点(EcoRI和BamHI,下划线为限制性内切酶位点),构建pEGFRvⅢ/CAR。质粒DNA经限制性内切酶片段分析(EcoRI/BamHI双酶切、12 g·L-1琼脂糖凝胶电泳)、核酸测序鉴定。
1.3 EGFRvⅢ/CAR-T制备健康成人外周血单个核细胞用Ficoll密度梯度法分离、提取,T淋巴细胞用自然沉降法纯化。CD3/CD28mAb包被平板(5 mg·L-1)激活T细胞,辅以白细胞介素(interleukin,IL)-2(终浓度500 U·mL-1)培养扩增。EGFRvⅢ/CAR慢病毒包装:将转移质粒(pEGFRvⅢ/CAR)、包装质粒(pCMV-dR8.9)、包膜质粒(pVSV-G)以磷酸钙法共转染包装细胞HEK293T,病毒过滤、浓缩后用p24 ELISA试剂盒检测病毒滴度,再用于转染T细胞[5]。转染24 h后,收集细胞加入荧光抗体1 μL[Alexa Fluor 647标记山羊抗小鼠IgG F(ab)2抗体],避光孵育30 min,PBS洗涤后,用流式细胞仪检测EGFRvⅢ/CAR表达。
1.4 LDH细胞毒性试验和IFN-γ水平检测以EC109-EGFRvⅢ为靶细胞,接种于96孔板(每孔1×104),效应细胞EGFRvⅢ/CAR-T按效靶比(E∶T)5∶1、10∶1、20∶1、40∶1加入,混合培养24 h(37 ℃,CO2体积分数5%)。收上清后,细胞加入150 μL LDH释放试剂孵育1 h,分别取各孔上清120 μL上机检测。设GFP慢病毒转染T细胞(GFP T)和未转染T细胞(NT T)为效应细胞对照组,设EC109(未经EGFRvⅢ稳转细胞)为靶细胞对照组。IFN-γ水平检测:效应细胞EGFRvⅢ/CAR-T与靶细胞EC109-EGFRvⅢ按 E∶T=5∶1在24孔板中混合培养24 h(37 ℃,CO2体积分数5%),用ELISA试剂盒测定培养上清IFN-γ含量。
1.5 NSG小鼠异种移植模型建立6周龄雌性NSG小鼠皮下接种5×106个EC109-EGFRvⅢ细胞,建立异种肿瘤皮下移植模型。细胞接种后10~14 d,肿瘤体积约500 mm3时,将建模成功小鼠分为3组:EGFRvⅢ/CAR-T组、未转染T细胞组(NT T)、PBS组,后2组为对照组,每组4只。效应细胞通过尾静脉注射(每100 μL 1×107个细胞)。动物实验方案通过河南省人民医院生物医学研究伦理审查。
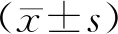
2 结果
2.1 pEGFRvⅢ/CAR载体构建EGFRvⅢ/CAR结构如图1A、B所示,信号肽引导穿膜表达,胞外区负责抗原识别结合(EGFRvⅢ scFv,Hinger),跨膜区锚定受体(TM)和胞内信号区激活T细胞(ICOS,CD3),全长942个氨基酸。重组载体EGFRvⅢ/CAR经EcoRI和BamHⅠ双酶切鉴定、12 g·L-1琼脂糖凝胶电泳,基因片段大小一致。经DNA测序和NCBI/Blast软件核酸序列同源性分析,各基因片段序列和连接无误,pEGFRvⅢ/CAR表达载体构建成功。

A为EGFRvⅢ/CAR各基因片连接示意图;B为CAR功能结构示意图;C为流式细胞术检测EGFRvⅢ/CAR-T细胞表达效率,a为设门,b为EGFRvⅢ在T细胞表达率。
2.2 EGFRvⅢ/CAR-T慢病毒包装及转染效率检测采用三质粒慢病毒包装细胞体系(pEGFRvⅢ/CAR、pVSV-G、pCMV-dR8.9),磷酸钙沉淀法共转染包装细胞HEK293T,病毒滴度为(4~9)×106TU·mL-1。慢病毒感染后,流式细胞术检测EGFRvⅢ/CAR表达率约为82%(图1C),转染效率可。
2.3 EGFRvⅢ/CAR-T靶向杀伤活性效应细胞与靶细胞混合培养,设效靶比(E∶T)为5∶1、10∶1、20∶1、40∶1,混合培养24 h后,LDH检测结果显示:随着效靶比的不断增加,EGFRvⅢ/CAR-T细胞杀伤EC109-EGFRvⅢ的作用逐渐提高,E∶T为5∶1时,靶细胞裂解死亡,差异有统计学意义(P<0.05),而效应细胞对照组(GFP T,NT T)和靶细胞对照组(EC109)差异无统计学意义(P>0.05)。见图2A、2B。ELISA法检测混合培养上清中细胞因子IFN-γ水平,结果显示:EGFRvⅢ/CAR-T组(E∶T为5∶1,24 h)IFN-γ为(2 100.6±85)ng·L-1,高于对照组(GFP T,NT T),而对照组细胞差异无统计学意义(P>0.05)。见图2C。
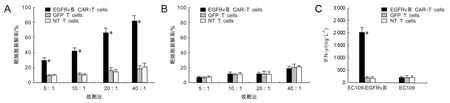
A为EGFRvⅢ/CAR-T细胞对EC109-EGFRvⅢ细胞杀伤活性;B为对照组EC109细胞;C为IFN-γ释放情况,GFP T和NT T为效应细胞对照组,EC109为靶细胞对照组;*P<0.05。
2.4 NSG小鼠移植瘤模型肿瘤抑制实验NSG小鼠肿瘤模型分3组,EGFRvⅢ/CAR-T组小鼠在细胞注射3周后肿瘤生长得到抑制,而对照组(NT T,PBS)肿瘤继续生长。遵循动物伦理要求,小鼠肿瘤体积超过1 500 mm3时终止观察,安乐处死。肿瘤生长曲线显示,EGFRvⅢ/CAR-T组与对照组相比差异有统计学意义(P<0.01)。见图3。
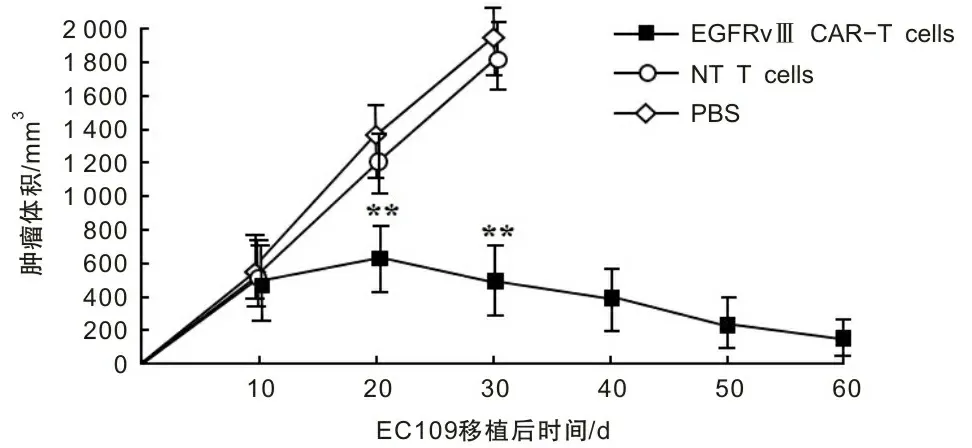
注:实验组为EGFRvⅢ/CAR-T细胞;对照组为未转染T细胞(NT T)和PBS;**P<0.01。
3 讨论
近年,肿瘤免疫治疗取得了可喜的进步,从免疫检测点抑制剂(例如细胞程序化死亡受体-1/programmed death-1,PD-1)到CAR-T,都展示出良好的抗肿瘤作用,免疫治疗进入了快速发展的时代[6]。CAR将单链抗体、T细胞激活基因片段和共刺激分子嵌合于一体,发挥抗体的特异识别结合和T细胞的细胞毒性作用,通过基因转导/转染方法导入T细胞(CAR-T),使其获得肿瘤杀伤活性[7-8]。然而,实体瘤的CAR-T细胞免疫治疗面临诸多挑战,特异靶点缺乏、分子异质性、抗原递呈不足、免疫抑制微环境等因素影响其抗肿瘤作用[9]。食管癌是我国常见的消化系统恶性肿瘤,发病率高,预后差,CAR-T免疫治疗食管癌仍在实验室和临床探索中[10],所选分子靶点有EGFR、肝配蛋白A型受体2(ephrin type-A receptor 2,EphA2)、CD276等。
EGFRvⅢ是为数不多的肿瘤特异性抗原之一,在多种人类恶性肿瘤中有高表达率,其作为肿瘤靶向治疗、免疫治疗的分子靶点广受关注。靶向EGFRvⅢ的各种策略在积极探索中,包括治疗性抗体、疫苗、小分子药物、CAR-T等[11-13]。CliniTrial网站显示多个EGFRvⅢ CAR-T在国内外进入到临床试验阶段,初步的结果显示其有良好的治疗作用[14-15]。本研究前期通过抗体工程技术获得EGFRvⅢ单链抗体(scFv),基于此研制了重组抗体及嵌合抗原受体[5,16]。本试验验证了EGFRvⅢ CAR-T细胞(EGFRvⅢ scFv-Hinge-TM-ICOS-CD3)对表达EGFRvⅢ食管癌细胞的抗肿瘤作用。效应细胞与靶细胞共培养,在效靶比5∶1时即表现出良好的杀伤作用,而对照组细胞没有裂解死亡,说明了EGFRvⅢ CAR-T细胞的特异性杀伤作用。
CAR有多种结构组合,胞内T细胞活化区有CD28、CD134、CD137、ICOS等共刺激分子和T细胞活化基序(CD3),新一代CAR嵌入有调控、迁移、持久等功能的分子[17]。本研究所用CAR以ICOS(inducible costimulator,ICOS)为共刺激分子,制备慢病毒转染T细胞,以EC109-EGFRvⅢ为靶细胞(人食管鳞癌细胞株EC109稳转EGFRvⅢ)进行体外试验,无论是LDH释放试验或IFN-γ分泌检测,效应细胞EGFRvⅢ/CAR-T都表现出对靶细胞的特异杀伤作用,且随着效靶比的增加,细胞毒性作用提高,而对照组细胞(效应细胞对照组和靶细胞对照组)无细胞裂解或死亡变化。NSG异种移植小鼠模型EGFRvIII/CAR-T输注后,实验组肿瘤得到有效抑制,而对照组小鼠多数由于肿瘤负荷过重而处死。
CAR-T细胞免疫治疗的问世揭开了肿瘤免疫治疗的新篇章,已有8款CAR-T细胞获得美国FDA批准进入临床应用,我国也有2款细胞获得批准,更多的临床试验正在进行中。本研究为食管癌的CAR-T细胞免疫治疗提供了实验依据和研究基础,旨在为消化道肿瘤免疫治疗探索新方法。然而,体外试验和动物模型与人类肿瘤的体内环境存在差别,研究结果还需要临床研究进一步验证。随着研究的不断深入,新的分子靶点、完善的嵌合结构、安全的细胞、有效的治疗方案会进入人们的视线,必将为广大肿瘤患者带来益处[18-19]。
