伏立康唑TDM在艾滋病合并马尔尼菲蓝状菌感染患者中的临床干预研究
2023-05-16冯艳兰洪秋烟王槐远吴水发陈婷婷
冯艳兰,洪秋烟,王槐远,吴水发,陈婷婷*
(1.永春县医院药剂科,福建 永春 362600;2.福建医科大学附属泉州市第一医院药剂科,福建 泉州 362000)
马尔尼菲蓝状菌感染是艾滋病患者常见的机会性感染,患者应接受诱导治疗及维持治疗,首选诱导治疗药物为两性霉素B,维持治疗药物为伊曲康唑,伏立康唑为可选替代治疗方案。伏立康唑体内代谢呈非线性药动学特点,且治疗窗窄,在使用伏立康唑过程中进行TDM尤为重要。本文通过对8例HIV伴马尔尼菲青霉菌感染患者使用伏立康唑并TDM的临床情况进行分析,讨论伏立康唑TDM在艾滋病患者的临床应用价值。
1 资料与方法
1.1 研究对象
选取泉州市第一医院2018年1月至2019年1月住院的艾滋病合并马尔尼菲蓝状菌感染的患者,对其中使用伏立康唑并进行TDM的8例患者进行分析。
1.2 方法
取样:在伏立康唑第5剂给药前半小时抽静脉血2~3mL。
血药浓度测定方法:采用HPLC测定患者血清伏立康唑浓度。
疗效判断 ①治愈:治疗后患者的临床症状、体征消失,实验室检查(影像学等)和病原学(细菌、真菌培养及药敏结果等)恢复正常;②好转:临床症状和/或体征有所好转,实验室检查(影像学等)和病原学(细菌、真菌培养及药敏结果等)指标未完全恢复正常;③无效:病情无明显好转或加重的情况。
不良反应 重点监护伏立康唑致视觉障碍、肝功能异常、皮疹等常见不良反应。
2 结果
2.1 基本资料
研究共纳入8例患者,均为男性,发病年龄在9~59岁之间,18岁以下1例,18~40岁5例,40岁以上2例,平均 34 岁。体重18~65kg,住院时间8~27d。8例患者入院时均伴有发热,其中伴淋巴结肿大1例,咳嗽咳痰2例,气促2例,肺炎2例,纳差、乏力、腹胀1例。见表1
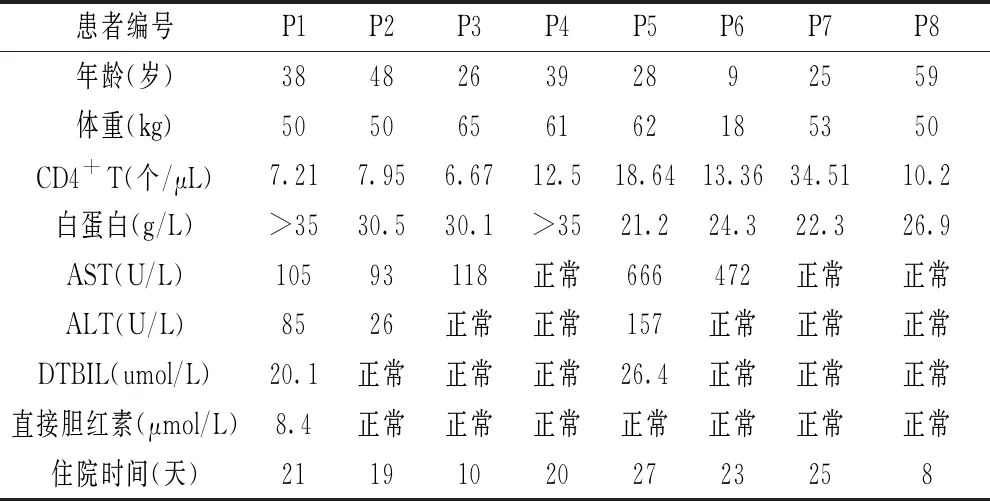
表1 患者一般情况及临床特征
2.2 伏立康唑TDM结果
7例患者给予首日负荷剂量6mg/kg,q12h,ivgtt,维持剂量4mg/kg,q12h,ivgtt,1例患者给予负荷剂量4mg/kg,q12h,ivgtt,维持剂量2mg/kg,q12h,ivgtt。8例患者均在第5剂给药前半小时测定伏立康唑的谷浓度。4例患者血药浓度偏高,占比50%,对其中2例患者进行剂量调整,调整剂量后第五次给药前复测血药浓度,降至正常范围内;1例改用两性霉素B,1例改用伊曲康唑。3例患者血药浓度在正常范围内,占比37.5%;1例患者血药浓度偏低,占比12.5%,未对该患者进行剂量调整。最终8例患者均好转出院。监测结果见表2。

表2 伏立康唑TDM及剂量调整
2.3 伏立康唑ADR监测
8例患者中,5例出现药品不良反应,占比65.5%。4例患者出现视觉器官功能障碍,占比80%,均发生在血药浓度偏高的患者中,且均在用药三天内发生。其中3例患者出现幻视,1例出现视物模糊、畏光,经更换药物或更改剂量后,视觉上的不良反应均消失。3例患者用药前后肝功能均正常,使用伏立康唑后,其中1例出现肝功能异常,经减量及保肝治疗后,好转。5例患者在使用伏立康唑前已存在肝功能异常,使用伏立康唑后,其中4例肝功能没有进一步损伤,1例出现急性肝损伤。见表3。
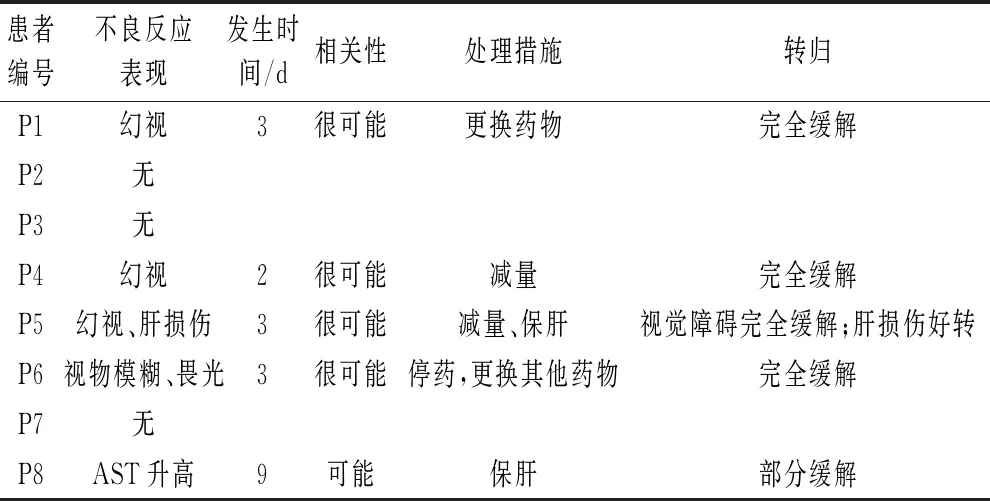
表3 伏立康唑ADR监测情况
3 讨论
3.1 影响伏立康唑血药浓度的因素
3.1.1 低蛋白血症
8名患者中2例白蛋白水平在正常范围内,6例低蛋白血症(<35 g / L)。伏立康唑血浆蛋白结合率与血浆白蛋白浓度成反比,白蛋白血药浓度下降,游离的伏立康唑血药浓度反而增加,当胆红素浓度升高,两者的相关性更加明显(P=0.05)[1]。低蛋白血症可引起伏立康唑游离的血药浓度异常增高,即使其监测的血药浓度在正常范围之内,游离的血药浓度偏高也可能引起相关的不良反应。
3.1.2 炎症指标
8例患者CRP、PCT水平均偏高,Veringa等[2]前瞻性研究表明在感染或炎症期间,肝脏中的几种药物代谢酶减少,包括细胞色素P450同工酶。由于伏立康唑被细胞色素P450同工酶广泛代谢,因此炎症期间通过降低药物清除率可导致伏立康唑谷浓度升高。Van Wanrooy MJP等[3]对128名伴有炎症的患者进行分析发现严重炎症患者,谷浓度为6.2mg/L,中度炎症时为3.4 mg/L,轻度或无炎症时为1.6 mg/L,伏立康唑CRP和浓度之间显著相关(P <0.001),每增加1mg/L CRP浓度,伏立康唑谷浓度增加0.015mg/L。因此,在炎症期间应密切监测伏立康唑的血药浓度,并根据监测结果调整剂量。
3.2 伏立康唑的血药浓度与不良反应
3.2.1 视觉器官障碍
伏立康唑的临床疗效、不良反应与血药浓度具有明显的相关性[4]。Pascual A等[5]研究表明,药物有效性在血药谷浓度<1.0 mg/L时明显降低;视神经毒性等不良反应在血药谷浓度>5.5 mg/L时,其发生率明显升高。伏立康唑所致的视神经毒性反应多数比较轻微,一般不会破坏眼的本质结构,且停药后1周可渐渐恢复[6]。伏立康唑可导致猴子视锥和视杆细胞ON型双极细胞功能障碍,该功能障碍具有可逆性,伏立康唑所致的视神经损害的作用机理尚不清楚[7]。因此,临床使用伏立康唑时,应对血药浓度、视觉功能进行监测,若出现视力模糊、幻视等视觉障碍时,应结合伏立康唑血药浓度监测结果及时调整用药方案,必要时予以停用伏立康唑。
3.2.2 肝功异常
伏立康唑通过肝脏细胞色素P450同工酶、CYP2C19等代谢,肝功能损伤直接影响药物的清除率,使其明显下降,排泄减慢,导致血药浓度升高[8]。5例肝损伤患者在使用伏立康唑之前,肝功能child-pugh评分均为A级。排除药物相互作用等原因,根据伏立康唑说明书,给予该5例患者伏立康唑负荷剂量6mg/kg,q12h,ivgtt(首日),维持剂量虽有减量,但未根据药品说明书将剂量减半。经伏立康唑治疗后,其中4例患者肝功能没有进一步损伤,1例患者出现急性肝损伤。该名急性肝损伤患者在用药第三天测得伏立康唑Cmin偏高(8.7μg/mL)。《中国伏立康唑个体化用药指南推荐意见》指出,伏立康唑稳态血药谷浓度位于5.5μg/mL~10μg/mL之间,并且未发生2级或2级以上不良事件时,建议将维持剂量减量20%,然后再根据患者的血药浓度监测结果调整剂量[9]。临床药师建议伏立康唑剂量减少20%~50%,医师予以减量20%。临床药师建议调整剂量后第五次给药前半小时再次监测血药谷浓度,并根据监测结果调整剂量。该患者同时联合使用可导致肝损伤的药物克林霉素0.9g,qd,ivgtt,减量使用第五次给药前半小时未进行血药浓度监测,于减量后第四天出现肝功能损伤急性加重(谷丙转氨酶 226 U/L,谷草转氨酶 837 U/L,总蛋白 57.1 g/L,总胆红素 241.4 μmol/L,肝功能评分(Child-Pugh C)。《中国伏立康唑个体化用药指南推荐意见》指出,重度肝损伤不推荐使用伏立康唑,在充分权衡风险与收益后,伏立康唑可在严密监测患者的肝功能、血药浓度的情况下使用[9]。停用肝损伤药物伏立康唑和克林霉素,同时进行保肝治疗。停药后第10天患者肝功能评分(Child-Pugh A),重新给予伏立康唑200mg,qd,ivgtt,调整剂量后第五次给药前再次监测血药浓度1.6μg/mL,患者肝功能进一步好转,考虑肝代谢能力增强,将伏立康唑剂量调整为200mg q12h 口服序贯治疗,监测血药浓度在正常范围内(3.4μg /mL)。经治疗后患者病情好转,肝功能评分(Child-Pugh A),出院带药(伏立康唑,200mg,qd,po)继续抗真菌治疗。
3.3 伏立康唑TDM干预的意义
此项研究测定的病例虽然少,但仍可以看出伏立康唑在常规的给药剂量下,血药浓度达标率并不高。本研究中达标率<50%,8例患者中仅有3例血药浓度在正常范围内,4例血药浓度偏高,1例血药浓度偏低。在伏立康唑TDM下进行个体化用药监护,患者最终均好转出院并且逆转了由血药浓度偏高所致的不良反应。
4 结论
HIV伴马尔尼菲青霉菌感染患者常伴有肝功能异常及低蛋白血症等,患者的年龄、性别、基因多态性、肾功能不全等均可影响伏立康唑血药浓度,常规固定剂量并不适用于该类人群,临床药师应充分利用伏立康唑TDM为患者提供个体化指导,做到精准给药,减少药物不良反应的发生,提高临床疗效,提升临床合理用药水平。
