乙酰化修饰在嗜肺军团菌致病过程中的作用*
2023-05-16钟文红陈涛涛欧阳松应
钟文红 陈涛涛 欧阳松应**
(1)福建师范大学生命科学学院,福州 350117;2)福建师范大学南方生物医学研究中心,福州 350117)
蛋白质翻译后修饰 (post-translation modification,PTM)是调节蛋白质功能的有效途径,目前常见的PTM包括甲基化、磷酸化、ADP-核糖化、泛素化及糖基化等。蛋白质乙酰化修饰是一种可逆的翻译后修饰,通过乙酰基转移酶将乙酰辅酶A(acetyl-CoA)上的乙酰基团共价结合在特定的氨基酸残基上[1]。乙酰化修饰参与生理和疾病相关的多种关键细胞过程,如基因转录和表达、DNA 损伤修复、细胞信号转导、蛋白质折叠和自噬。近年来,蛋白质乙酰化在病原体致病过程中的作用研究取得了一系列的进展,由病原体介导的乙酰化修饰对其在宿主细胞内的生存复制具有重要作用。本文主要从嗜肺军团菌的致病机制、乙酰化修饰概述、嗜肺军团菌效应蛋白介导的乙酰化修饰及其在嗜肺军团菌致病过程中的作用等方面进行综述。
1 嗜肺军团菌及其致病性
嗜肺军团菌 (Legionella pneumophila,L. pneumophila)是一种革兰氏阴性致病菌,广泛分布于水生环境中。人们在吸入被军团菌污染的气溶胶后,军团菌能够感染人类肺部细胞,引起非典型肺炎,即军团病。1976 年,在美国费城举行的退伍军人大会中首次爆发了军团病,一年后临床分离出了军团病的病原菌,并以该疾病及其受害者的名字将病原菌命名为嗜肺军团菌[2]。
为了能够入侵宿主并在宿主细胞内进行复制,嗜肺军团菌编码了一种高度保守的IVB 分泌系统(Legionella pneumophilaDot/Icm type IVB secretion system,T4BSS),称为Dot/ICM,跨越细菌生物膜,附着于宿主细胞后,将330多种嗜肺军团菌效应蛋白(基因图谱详见NCBI 网站:https://www.ncbi.nlm.nih.gov/genome/tree/416?)通过Dot/ICM易位到宿主细胞中[3](图1)。嗜肺军团菌效应因子能够促进含军团菌的液泡(Legionellacontaining vacuole,LCV)的形成与成熟。LCV 是一种内质网衍生的隔室,作为嗜肺军团菌在宿主细胞内复制生存的场所,可以协助嗜肺军团菌逃避溶酶体的降解并从宿主细胞中获得营养物质[4-5]。

Fig. 1 Infection pathway of Legionella pneumophila in host图1 嗜肺军团菌在宿主细胞中的侵染途径
1.1 对宿主细胞的识别
嗜肺军团菌通过气溶胶传播后会进入人体的肺部,感染人类肺泡巨噬细胞,经历了最初的附着和吞噬之后,嗜肺军团菌进入到宿主细胞内进行复制。嗜肺军团菌的几种细菌毒力因子如RtxA(repeat in toxin A)、LadC(L.pneumophila-specific adenylate cyclase)、enhC(enhanced entry protein)、MOMP (major outer membrane protein) 以 及Lcl(L. pneumophilacollagen-like protein)可以促进嗜肺军团菌的黏附性并协助其附着于宿主细胞内。嗜肺军团菌主要外膜蛋白MOMP 是一种成孔蛋白,MOMP 与宿主细胞表面的补体受体(complement receptors)CR1和CR3结合后,会启动宿主细胞的内化作用。嗜肺军团菌胶原样蛋白Lcl与细胞黏附有关,Lcl1 会与补体受体ClqR 结合。最终,嗜肺军团菌通过传统的吞噬作用或特殊的卷曲吞噬过程进入宿主细胞内[6]。
1.2 LCV的形成
嗜肺军团菌利用多种机制逃避宿主的溶酶体降解途径,其中最重要的就是其LCV 的形成。嗜肺军团菌进入宿主细胞后,一方面通过抑制宿主溶酶体的酸化[7],另一方面通过招募宿主内质网来源的囊泡将原始吞噬体转化为具有宿主内质网膜特征的LCV,抑制LCV 与宿主溶酶体的融合,以防止其降解(图2)[8]。这一过程与宿主细胞的小GTPase 蛋白功能密切相关,包括附着在病原体囊泡上的Rab1。由COPII(Coat protein II)复合体形成的囊泡将蛋白质和脂类从内质网(ER)运输到高尔基体顺式表面(cis-Golgi),COPI (coat protein I)复合体介导了COPII 中的组分从高尔基体回到内质网的循环[9]。嗜肺军团菌劫持了来自内质网(ER)出口部位的囊泡运输,以形成ER衍生的LCV,确保有足够的军团菌复制环境。进入细胞后,嗜肺军团菌通过其分泌的效应蛋白SidM及Ralf 分别将宿主Rab1 和ADP-核糖基化因子1(ADP-ribosylation factor 1,Arf1)募集至LCV 表面[10-11]。嗜肺军团菌效应蛋白SidM 作为高度特异性的Rab1鸟嘌呤核苷酸交换因子(GEF),通过腺苷化激活Rab1,激活的Rab1 则刺激SEC22b(vesicle trafficking protein,SEC22 homolog B)与突触融合蛋白(synaxin)的结合[12]。另外,效应蛋白LidA 能够协同SidM 募集Rab1 至LCV 表面。而SidM 对Rab1 的腺苷化修饰则能被去腺苷化酶SidD 所逆转,使GTP·Rab1 可与GTP 酶激活蛋白LepB 结合,从而完成Rab1 的激活循环[13]。Arf1的活性受Ralf的调节,Ralf是一种细菌鸟嘌呤核苷酸交换因子,能够将宿主小GTP 酶招募至LCV。嗜肺军团菌效应蛋白AnkX利用其磷脂酰胆碱酶活性共价修饰Rab1,这一修饰被Lem3 逆转。AnkX还通过磷酸胆碱化修饰使参与内体运输的Rab35失活,从而调节宿主细胞胞内和胞外途径的膜运输,避免LCV被宿主溶酶体酸化降解[14]。
1.3 嗜肺军团菌IV型分泌系统
嗜肺军团菌的致病性与其特有的IV 型分泌系统(T4BSS)密切相关。T4BSS 由27 种蛋白质组成,跨越两种细菌细胞膜,将效应蛋白直接转移到宿主细胞胞浆中。T4SS 介导的分泌过程包括效应蛋白的识别及转位到宿主细胞[7]。T4SS 由两个主要复合体组成:核心跨膜复合体(the core transmembrane complex,CTMC) 和Dot/ICM 型IVB 偶联复合体(the Dot/Icm type IVB coupling complex,T4CC)。CTMC 形成效应蛋白转位的孔道,由DotC、DotD、DotF、DotG、DotH 和DotK组成。T4CC 的功能是识别和招募效应蛋白,由DotL (IcmO)、 DotM、 DotN (IcmJ)、 IcmS、IcmW、LvgA、DotY 和DotZ 组成。效应蛋白可以通过与DotL-IcmSW 或DotL-IcmSW-LvgA 复合体的相互作用发生易位,另外也可以通过DotM介导的对C端分泌信号的识别而发生易位,这类效应蛋白C 端约25 个氨基酸富含谷氨酸残基(E-block motif)[15]。
嗜肺军团菌利用T4BSS向宿主细胞分泌了330多种效应蛋白,这些效应蛋白介导了多种蛋白质翻译后修饰,如磷酸化[16]、泛素化[17]、去泛素化[18]、腺苷酸化[19]、ADP-核糖基化[20]及糖基化[21]等,参与调控宿主细胞的细胞进程。例如:SidE 家族的效应蛋白包括SidE、SdeA、SdeB以及SdeC,催化不依赖于ATP 的非经典泛素化修饰来调节细菌感染[22](图3)。SidE 家族的mART(momo-ADP-ribosyltransferace)结构域利用β-烟酰胺腺嘌呤二核苷酸(NAD+)对泛素(ubiquitin,Ub) 的第42 位精氨酸进行ADP-核糖化修饰(ADPr),产生ADPr-Ub。随后,ADPr-Ub 被其具有磷酸二酯酶活性的PDE(phoshopdiesterase)结构域切割,释放ADP并将Pr-Ub转移到底物上进行泛素化修饰。该过程是可逆的,嗜肺军团菌效应蛋白DupA和DupB在其中发挥关键作用[23]。在结构上,DUPs 类似于SdeA 的PDE 结构域,但与PDE相比,它们与Pr-Ub具有更高的结合亲和力,这使得它们能够从底物的丝氨酸残基中识别切割Pr-Ub,产生Pr-Ub 分子。此外,DUPs 也可以将ADPR-Ub转化为Pr-Ub。SidJ作为一个CaM依赖的谷氨酸化酶会调节SidEs的活性,能够谷氨酰化修饰SidEs 抑制其泛素化酶活性[24],而SdjA 会逆转SdeA上的谷氨酰化来调节SidJ的活性[25]。

Fig. 3 Summary diagram of the regulation of SidE activity图3 SidE家族活性调节的示意图
2 乙酰化修饰
2.1 蛋白质乙酰化修饰及乙酰基转移酶
根据受体氨基酸的不同,乙酰化修饰主要分为N型和O型乙酰化修饰,其中N型主要发生在赖氨酸或蛋白质N端氨基酸的氨基,O型则发生在丝氨酸或苏氨酸的羟基。经典的乙酰化修饰主要为N型乙酰化修饰,其根据氨基酸乙酰化的位置主要分为Nα-乙酰化和Nε-乙酰化类型。Nα-乙酰化修饰发生在底物蛋白N端氨基酸的α氨基上,通常是不可逆的,其由N 端乙酰基转移酶家族(NAT)所介导[26]。NAT具有不同的底物特异性,如NatA倾向于N端具有丝氨酸、丙氨酸、甘氨酸和苏氨酸的蛋白质,而NatB 作用于具有Met-Glu、Met-Asp、Met-Asn 末端的蛋白质,NatC 则作用于Met-Ile、Met-Leu、Met-Trp和Met-Phe末端[27]。
Nε-乙酰化修饰则发生在底物蛋白赖氨酸的ε氨基,通常是可逆的,其受乙酰基转移酶和去乙酰化酶的调节。介导赖氨酸Nε 乙酰化修饰的酶也称赖氨酸乙酰基转移酶(lysine acetyltransferases,KAT)。Nε-乙酰化修饰广泛存在于真核和原核生物中,影响蛋白质的多种功能,包括酶活性、蛋白质和DNA的相互作用、稳定性及亚细胞分布等[28]。
目前已经鉴定出了20 多种KAT,根据它们同源性区域及乙酰化相关基序的相似性,可归为GNAT 家 族 (GCN5-related N-acetyltransferases family)、MYST 家族和CBP/p300 家族[29](表1)。GNAT 家族主要包括GCN5(KAT2A)、p300/CBP相关因子(PCAF,KAT2B)、延伸乙酰转移酶复合亚基3 (elongator acetyltransferase complex subunit 3, ELP3)及组蛋白乙酰转移酶1(HAT1),是目前赖氨酸乙酰基转移酶中最典型的家族。MYST 家族主要包括Moz(KAT6A)、组蛋白乙酰基转移酶Ybf2/SAS3、组蛋白乙酰基转移酶SAS2、Tip60(KAT5)及MOF(KAT8),该家族具有高度保守的MYST结构域:由一个乙酰辅酶A结合基序和一个锌指组成。CBP/p300 家族(KAT3A/KAT3B)由环磷酸腺苷反应元件结合蛋白(CBP/CREB)及高度同源的HAT 腺病毒E1A相关的300 ku蛋白组成,该家族具有4个独立的反式激活结构域,包括两个富含半胱氨酸的区域、激酶诱导的CREB相互作用结构域及核受体辅激活物结合结构域。不同类型的KAT 在细胞中扮演不同的角色,各种KAT 的稳定表达对维持细胞的生理活动都至关重要。
O-乙酰化修饰首次在2006 年被报道,主要由病原菌分泌的一类称为YopJ 家族的效应蛋白所介导,调控宿主细胞的免疫反应。如在耶尔森氏菌中,YopJ 可以作为一种乙酰基转移酶修饰哺乳动物宿主细胞中的丝氨酸和苏氨酸,从而破坏宿主免疫[30],来自植物病原菌丁香假单胞菌的YopJ 家族成员HopZ3 可以乙酰化植物蛋白上的丝氨酸、苏氨酸和组氨酸残基[31]。到目前为止,已经有7 个YopJ 家族的效应蛋白被证明能够乙酰化其相应的宿主靶标(表2)。有趣的是,YopJ 乙酰基转移酶家族与已知的乙酰基转移酶,如组蛋白乙酰基转移酶(HATS)和N 端乙酰基转移酶(NAT)之间没有序列上的相似性,这表明YopJ 乙酰基转移酶是独立进化的[32]。YopJ 家族使用了一种独特的催化机制,YopJ 家族效应蛋白的中心区域包含一个与半胱氨酸蛋白酶C55家族相同的催化三联体,主要由His/Glu/Cys 组成,使它们能够作为乙酰基转移酶发挥作用 。另外,IP6 (inositol hexakisphosphate)是一种激活YopJ 家族乙酰基转移酶活性的特异性真核辅因子,会诱导该家族整体构象发生变化,从而在催化三联体附近形成稳定的乙酰辅酶A 结合位点[33]。一直以来,YopJ 家族乙酰基转移酶表现出与KATS或NAT没有观察到的独特性质,例如,YopJ 家族可对不同氨基酸残基如Ser/Thr/Lys 进行修饰,YopJ 家族乙酰转移酶是唯一一类选择性修饰底物蛋白丝氨酸和苏氨酸残基的乙酰基转移酶,其选择性修饰与底物蛋白氨基酸在多肽中的位置无关。
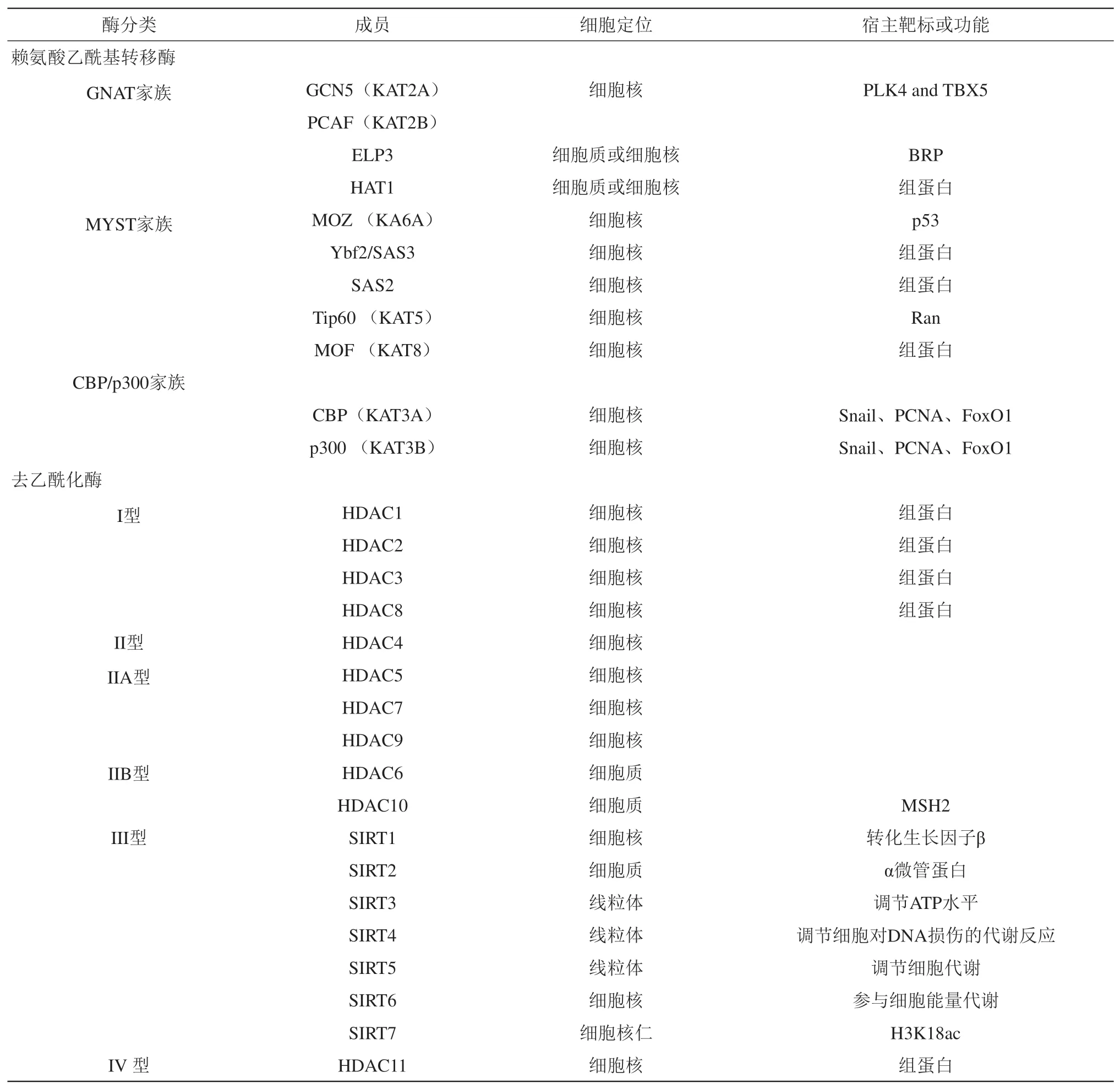
Table 1 Protein lysine acetyltransferase and deacetylase表1 蛋白质赖氨酸乙酰基转移酶及去乙酰化酶
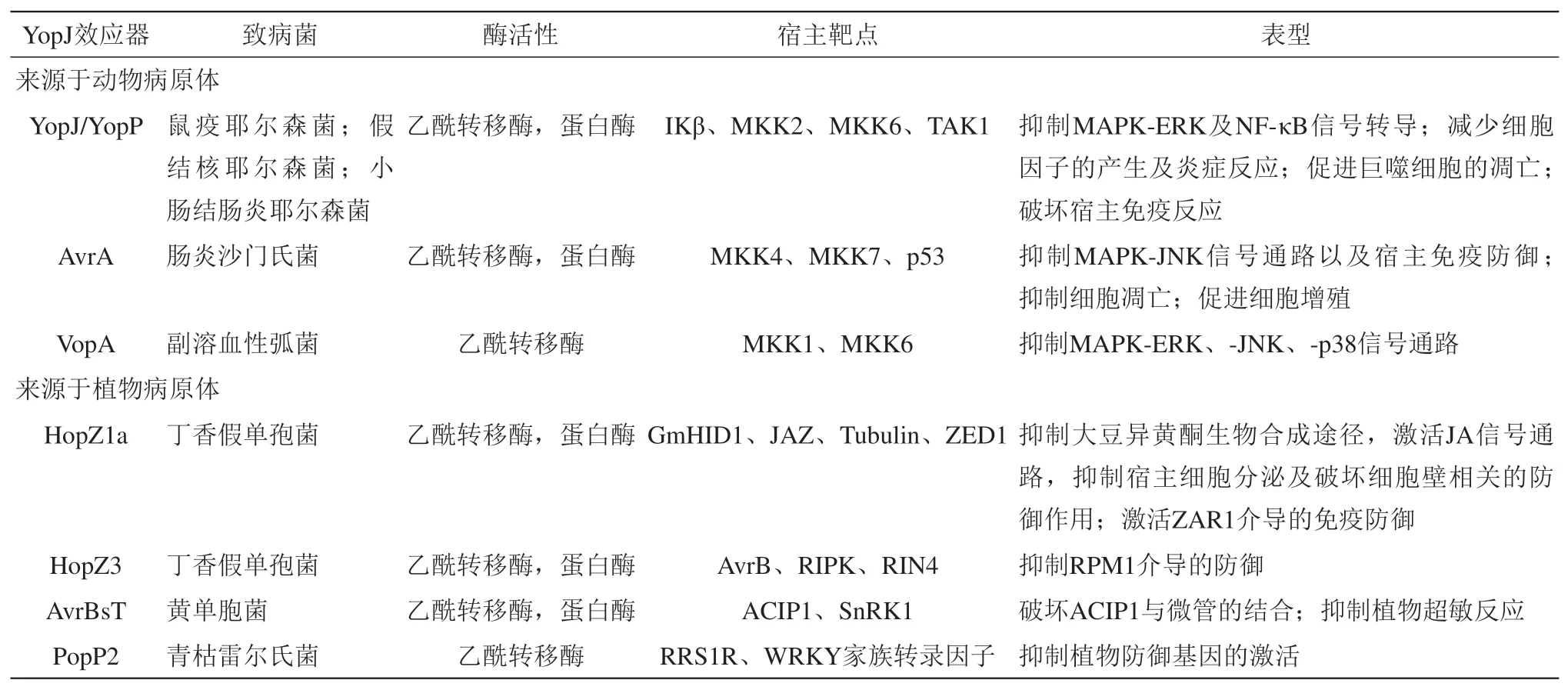
Table 2 YopJ family effectors and their targets表2 YopJ家族效应器及其毒力靶点
2.2 蛋白质去乙酰化酶
先前的研究表明,蛋白质去乙酰化酶主要分为4 类(表1)。第一类主要包括HDAC1、HDAC2、HDAC3和HDAC8,该类去乙酰化酶主要定位于细胞核中。第二类根据催化位点的不同可进一步细分为IIA 类和IIB 类。IIA 类包括HDAC4、HDAC5、HDAC7和HDAC9,该类去乙酰化酶具有一个催化位点,主要定位于细胞核中。IIB 类包括HDAC6和HDAC10,有两个催化位点,它们主要定位于细胞质中。I类和II类都是锌离子依赖的去乙酰化酶,将乙酰基从赖氨酸中分解出来,释放出醋酸酯。第三类包括Sirtuin 1~7(SIRT1~7)是NAD+依赖的去乙酰化酶[34],Sirtuins 通过罗斯曼折叠结构域(Rossmann fold)与NAD+结合,将乙酰化的赖氨酸残基上的乙酰基去除,产生脱乙酰赖氨酸及释放烟酰胺(NAM) 和O- 乙 酰-ADP 核 糖(O-AADPR)[35],该类酶的亚细胞定位范围广泛。第四类只含HDAC11,是一种锌离子依赖性的去乙酰化酶,介导核心组蛋白N 端赖氨酸的去乙酰化修饰。
3 嗜肺军团菌效应蛋白介导的蛋白质乙酰化修饰
蛋白质乙酰基转移酶和去乙酰化酶共同调节蛋白质乙酰化修饰,病原菌在入侵宿主的过程中会分泌乙酰基转移酶调控宿主中不同底物的细胞功能,在嗜肺军团菌中也存在一部分效应蛋白介导了乙酰化修饰,这些效应蛋白对嗜肺军团菌入侵宿主细胞后的复制生存具有重要作用。
3.1 GNAT家族乙酰基转移酶
VipF作为嗜肺军团菌中保守的核心效应因子,是军团菌在宿主细胞内生长所必需的,VipF 与已知的乙酰转移酶的序列和结构比对中显示出两个结构域内有潜在的乙酰辅酶A 结合基序,并且VipF显示出具有氯霉素乙酰转移酶的活性[36]。最新的研究发现,VipF的两个GCN5结构域通过两条β链连接成两个翅膀形状,形成U 形(图4)。这两个结构域都与乙酰辅酶A或辅酶A结合,但只有在C端结构域中,分子才延伸到乙酰转移酶活性反应所需的U形槽的底部,N端结构域中的分子会折叠回来。有趣的是,当氯霉素作为底物结合在靠近N端结构域中央U 形槽的口袋中时,VipF 保持开放的构象。此外,中央U 形槽的突变包括Glu129和Asp251,极大地削弱了VipF的乙酰转移酶活性,这些都表明嗜肺军团菌效应器VipF 具有独特的酶机制[37]。经生物信息学分析发现,嗜肺军团菌中还有一些效应蛋白也属于GNAT 家族(表3),介导了乙酰化修饰,但是它们在宿主中的靶标还未被研究发现。
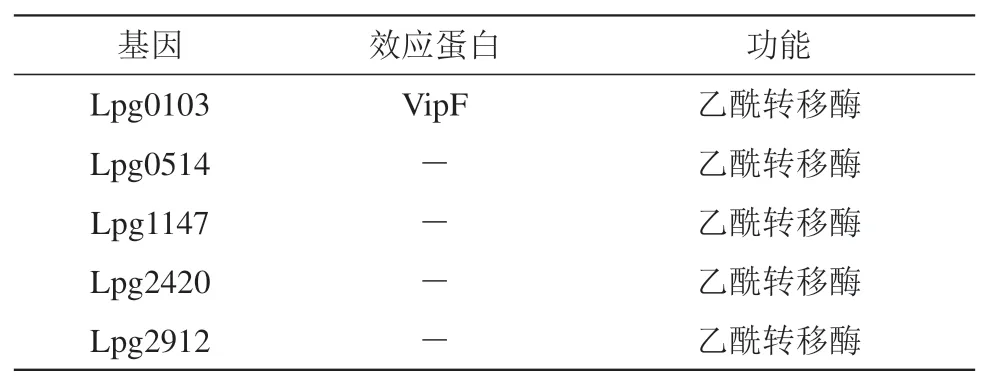
Table 3 GNAT family of L. pneumophila表3 嗜肺军团菌中的GNAT家族
3.2 YopJ家族乙酰基转移酶
嗜肺军团菌效应蛋白Lem17(Lpg1949)是CE家族(CE clan proteases)的一个成员,CE 家族包括去泛素化酶(deubiquitinating enzymes,DUBs)和乙酰转移酶,两种酶会使用相同的氨基酸残基作为活性部位。另一个CE 家族成员ChlaDUB1 是来自衣原体中的效应蛋白,具有乙酰基转移酶和去泛素酶的双重活性,并且这两种活性使用相同的活性部位。与ChlaDUB1不同,Lem17是一个乙酰转移酶,并且与乙酰基转移酶家族YopJ 和效应蛋白LegCE 的亲缘关系很近[38]。通过生物信息学分析LegCE和Lpg2538类似于Lem17在嗜肺军团菌致病过程中参与了对宿主靶标的乙酰化修饰(图5),它们都具有YopJ 乙酰转移酶家族中发挥乙酰转移酶功能保守的催化三联体。它们所介导的乙酰化修饰反应开始于催化半胱氨酸硫醇基团上的去质子化,催化三元化合物中的组氨酸作为质子基团受体。然后,去质子化的半胱氨酸作为亲核剂攻击乙酰辅酶A 的羰基,导致乙酰基-酶中间体的形成及CoA 会作为副产物被释放。最后,乙酰基-酶中间体会攻击底物(宿主中的目标蛋白),并将乙酰基团转移至特定的Ser/Thr/Lys残基上。

Fig. 5 Sequence alignment of YopJ acetyltransferase family图5 YopJ乙酰转移酶家族序列比对
3.3 去乙酰化酶
嗜肺军团菌在感染宿主过程中会进化出多种策略以抵御宿主的免疫系统,使其能够在宿主细胞复制增殖。嗜肺军团菌编码的效应蛋白LphD具有组蛋白去乙酰化酶活性,在嗜肺军团菌感染过程中LphD 会靶向宿主细胞核介导H3K14 去乙酰化修饰[39]。LphD对H3K14乙酰基团的去除协助了嗜肺军团菌中的另一个效应蛋白RomA对相同的赖氨酸残基进行甲基化修饰。效应蛋白RomA含有SET结构域(SETD),并通过宿主组蛋白的甲基化抑制宿主基因表达。LphD 和RomA 不仅针对同一宿主蛋白,而且RomA的活性依赖于LphD。在LphD基因敲除的条件下,感染期间RomA 对H3K14 的甲基化水平会明显降低,可见LphD 和RomA 是两个高度依赖的效应蛋白,一个效应器的活性缺乏会降低另一个效应器的活性。并且研究发现,LphD 和RomA 都会以内源性染色质结合复合物KAT7 为靶标,协同操纵宿主细胞染色质以抑制基因表达。总之,LphD 的去乙酰化修饰能够协同RomA 影响嗜肺军团菌对宿主细胞的侵染,促进了细菌在宿主体内进行复制。
4 乙酰化修饰在病原体致病过程中的作用
病原体通过分泌毒力因子调控宿主特定的细胞功能,以实现在宿主内的复制增殖。其中,病原体毒力因子介导的乙酰化修饰作用在病原体侵染及其宿主内的复制生存起着重要的作用。病原体分泌的乙酰转移酶针对其宿主中的不同底物进行乙酰化修饰,影响其功能如阻止磷酸化修饰,促进蛋白酶体依赖的蛋白质降解,改变亚细胞定位等。此外,乙酰化与其他翻译后修饰,如甲基化、磷酸化和泛素化有广泛的交叉联系,不同PTM 的组合可以丰富各种细胞过程的调节[40]。
4.1 乙酰化修饰阻止宿主信号传导,破坏宿主免疫防御
在耶尔森氏菌感染后,宿主会迅速激活丝裂原活化蛋白激酶(MAPK)通路,将吞噬细胞招募到感染部位以吞噬并清除病原体。耶尔森氏菌通过其三型分泌系统(T3SS) 分泌的毒力因子YopJ(Yersiniaouter protein J)阻断MAPK 通路的激活。YopJ 能够直接与MAPKKs(MAPK kinases)包括MAPKK1/2/3/4/5/6 特异性互作, 并对MKK6(MAP kinase kinase 6) 中 氨基酸Ser207、Lys210和Thr211以及MKK2 中的Ser222和Thr226进行乙酰化修饰,进而抑制MAPKK 的磷酸化激活[30]。另外,YopJ 还会对 IκB 激酶β(IκB kinase β,IKKβ)的Thr180残基进行乙酰化修饰,抑制其激酶活性,最终导 致NF-κB 信号被阻断[41]。伤寒沙门氏菌(Salmonella typhimurium)分泌的效应蛋白AvrA具有乙酰转移酶活性,通过乙酰化宿主MKK4 和MKK7 激酶抑制宿主细胞的MAPK-JNK 途径,进而抑制细胞凋亡[42]。与耶尔森氏菌不同,沙门氏菌是一种胞内致病菌,抑制感染细胞的凋亡则有利于其在宿主体内的生存。此外,AvrA 也靶向并乙酰化细胞周期的中央调节因子p53,促进p53 的转录活性,导致细胞周期阻滞,抑制细胞凋亡[43]。来自副溶血性弧菌的毒力因子VopA 是由分泌的毒力因子能够乙酰化MKK6、MKK1 及黏着斑激酶(FAK),抑制其激酶活性及活化,有效抑制细胞迁移和细胞凋亡[44]。
由植物病原菌产生的YopJ 效应因子也具有不同的宿主靶标,破坏宿主的免疫防御进而促进病程。HopZ1是由引起细菌性斑点病的植物病原菌丁香假单胞菌(P. syringae)所分泌的效应因子,在病原菌感染期间, HopZ1a 会乙酰化Jaz(Jasmonate ZIM domain proteins) 激 活JA/ET(Jasmonate/Ethylene) 信号,进而抑制水杨酸(salicylic acid,SA)所介导的植物防御[45-46]。丁香假单胞菌所分泌的另一个效应因子HopZ3 则对RPM1 免疫复合物中的多个组分进行乙酰化修饰,阻断RPM1 免疫复合物的磷酸化修饰,从而抑制RPM1依赖的植物免疫防御。由青枯雷尔氏菌所分泌的效应因子PopP2 能够乙酰化宿主WRKY 转录因子,抑制防御基因的转录激活[47]。
4.2 乙酰化修饰影响宿主蛋白的亚细胞定位及稳定性
到目前为止,已经有多项研究证明乙酰化修饰控制了许多非组蛋白的定位。 黄单胞菌(Xanthomonas euvesicatoria)的效应物AvrBsT具有乙酰化转移酶的活性,能乙酰化拟南芥中的微管结合蛋白ACIP1(乙酰化相互作用蛋白1),破坏ACIP1 与微管的结合,导致ACIP1 聚集体的累积;AvrBsT(K282R)突变体则无法对ACIP1 进行乙酰化修饰,同时也抑制了ACIP1聚集物的形成[48]。乙酰化修饰也与蛋白质的稳定性有关,赖氨酸多泛素化修饰通常是依赖于蛋白酶体的蛋白质降解机制。由于经典的乙酰化修饰作用于赖氨酸残基上,进而可以阻止蛋白质的多泛素化修饰,最终抑制蛋白酶体依赖的蛋白质降解,所以蛋白质乙酰化修饰可以与其他PTMs组合共同调节蛋白质稳定性。此外,来自小麦赤霉菌的乙酰化转移酶GCN5乙酰化修饰自噬相关蛋白Atg8,促进其的自噬降解[49]。
4.3 乙酰化修饰调控病原体毒力
乙酰化修饰可以提高或者抑制酶的活性,进而调控致病菌的毒力。PhoP/PhoQ双组分系统在细菌中高度保守,并在哺乳动物宿主内调节毒力以响应各种环境胁迫。沙门氏菌PhoP 的乙酰化对其毒力至关重要,前面的研究发现,PhoP 的两个赖氨酸残基K201 和K102 可以分别被乙酰基转移酶Pat 和AcP 乙酰化,参与了PhoP 活性的调节,K201Q 突变会抑制巨噬细胞的生长及导致小鼠模型的毒力减弱。此外,PhoP 的另一个高度保守的赖氨酸残基K88 乙酰化修饰则削弱了PhoP 的二聚体形成[50],抑制其与DNA 的结合能力,导致鼠伤寒沙门氏菌的毒力减弱。大多数致病菌的临床感染是以生物膜为基础的,这是因为生物膜为致病菌提供了保护,使其不受宿主免疫反应和抗生素的影响。LuxS 是群体感应分子产生的关键酶,参与嗜水气单胞菌生物膜的形成,LuxS 缺失的突变体在小鼠模型中表现为生物膜形成能力增强。LuxS K165位点的乙酰化修饰会抑制该酶的活性,增强生物膜的形成,进而增强毒力[29]。LuxS乙酰化机制的鉴定可能代表了一个新的药物靶标,以调节基于生物膜的病原体感染。
5 展 望
到目前为止,乙酰化修饰作为一种常见的蛋白质翻译后修饰,参与许多重要的生物学过程的调节。最初乙酰化修饰研究的重点主要集中在细胞转录、翻译和代谢过程,近年来研究者发现乙酰化修饰在病原体致病性也具有重要作用,如胞内病原菌嗜肺军团菌分泌有多个具有乙酰化活性的效应蛋白至宿主细胞中。嗜肺军团菌分泌的效应蛋白中尽管有多个蛋白质被预测介导了乙酰化修饰,但是到目前为止还未报道过这些效应蛋白在嗜肺军团菌致病过程中的调控机制,它们是否会影响嗜肺军团菌对宿主细胞的识别、LCV 的形成及嗜肺军团菌在宿主体内的生长复制?它们是否会阻止宿主信号传导,破坏免疫防御,协助嗜肺军团菌侵染宿主及逃逸?以上问题还有待探究。大规模的乙酰化组学分析揭示更多病原体毒力蛋白的乙酰化作用及其靶标,有助于理解乙酰化修饰如何调节毒力因子在病原体致病过程中的影响。更多地了解乙酰化修饰在致病菌发病机制中的作用,可以为新的治疗方法奠定基础。
