不同剂量阿帕替尼联合卡瑞利珠单抗对肝癌患者晚期治疗的疗效及安全性观察
2023-05-15朱加作赵吉光程志原
朱加作 赵吉光 程志原
肝细胞癌的发病率高且预后生存较差[1-2]。卡瑞利珠单抗是2019年5月在国内获批上市的新型生物靶向抗肿瘤制剂,可抑制程序性死亡受体1(PD-1),具有提高机体免疫T细胞活性的作用,增强T细胞对肿瘤细胞的免疫监视[3-4]。肝细胞癌作为典型的富血管肿瘤,其多个病理阶段均与新生血管的生成密不可分,阿帕替尼是2014年10月经国家食品药品监督管理局批准上市的生物靶向药,目前国内应用逐渐成熟,可抑制血管内皮生长因子受体2(VEGFR-2)活性[5-6]。然而阿帕替尼虽能够抑制肿瘤新生血管生成,随着给药剂量的提高是否会增加手足综合征、皮肤瘙痒、肾性蛋白尿等不良反应发生风险仍无统一定论[7-8]。鉴于此,为进一步明确阿帕替尼在晚期肝细胞癌治疗中的安全性区间,现选取68例晚期肝细胞癌患者进行前瞻性研究,为后续临床实践的安全用药提供参考。
资料与方法
一、研究对象
2017年10月至2020年10月宣城市中心医院收治的晚期肝细胞癌患者68例,该研究经院内医学伦理院委会讨论通过,患者家属签署知情同意书。随机分为高、低剂量组,各34例。低剂量组女13例,男21例;年龄48~80岁,平均(64.34±7.02)岁;肝功能Child-Pugh分级:B级24例、A级10例;BCLC分期:C期34例;合并乙型肝炎28例;合并糖尿病12例;合并高血压16例。高剂量组年龄49~80岁,平均(64.51±6.93)岁;女15例,男19例;肝功能Child-Pugh分级:B级22例,A级12例;BCLC分期:C期34例;合并乙型肝炎30例;合并糖尿病13例;合并高血压16例。2组一般资料比较差异无统计学意义。纳入标准:①病理检测证实为肝细胞癌[9];②年龄>18岁;③预计生存期>6个月;④健康状况评分>65分。排除标准:①治疗积极性差;②入组前接受PD-1抑制剂、VEGFR-2酪氨酸激酶抑制剂治疗;③自身免疫性疾病;④严重感染或皮肤大面积过敏;⑤经化疗、放疗等常规抗肿瘤治疗后出现四级以上药物毒性反应者;⑥合并其他癌症。剔除标准:个人原因转院或放弃治疗者。
二、治疗方法
两组均予以卡瑞利珠单抗注射液(国药准字:S20190027)静脉滴注治疗,200 mg/次,1次/21 d。低剂量组和高剂量组分别口服甲磺酸阿帕替尼片(国药准字:S20140103)250 mg/d、500 mg/d。所有患者均维持给药至无法耐受或病情进展。药物厂家:本研究药物均购自江苏恒瑞医药股份有限公司。
三、观察指标
(一)疗效 治疗1个月后,复查CT影像并参考实体瘤免疫修饰反应评估标准(imRECIST)[10]对2组患者的短期疗效进行评估。分为部分缓解(PR)、完全缓解(CR)、疾病进展(PD)、疾病稳定(SD),整体评估疾病控制率(SD+CR+PR)和客观缓解率(CR+PR)。
(二)不良反应 参考不良事件标准术语(CTCAE)[11]评估不良反应,包括高血压、手足综合征、皮疹、肾性蛋白尿、胃肠道反应、血小板降低、转氨酶升高。
(三)预后随访 所有受试者自首次服药始,均随访24个月,记录患者无进展生存期(PFS)、总生存期(OS),末次随访日期2022年10月30日,所有失访患者均纳入删失。
四、统计学方法

结 果
一、临床疗效比较
高剂量组和低剂量组的疾病控制率和客观缓解率分别为79.41%、64.71%和67.65%、41.18%。高剂量组客观缓解率高于低剂量组(P<0.05)。见表1。
二、不良反应发生率比较
高剂量组手足综合征、肾性蛋白尿发生率均高于低剂量组(P<0.05)。见表2。
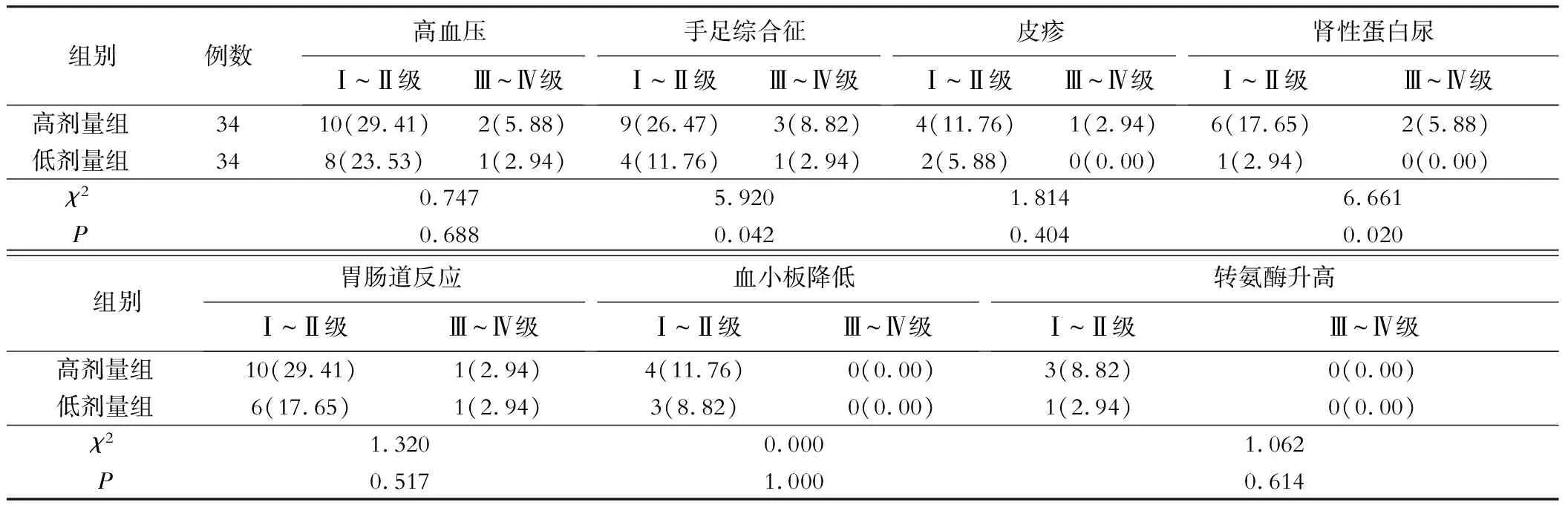
表2 两组不良反应发生率比较[n(%)]
三、生存预后比较
截止随访结束,共计失访3例,其中高剂量组1例,低剂量组2例,总随访率91.17%。高剂量组中位PFS为9个月,中位OS为17个月,死亡18例,2年总生存率为45.45%;低剂量组中位PFS为8个月,中位OS为13个月,死亡22例,2年总生存率为31.25%。2组PFS曲线比较差异有统计学意义(log=4.498,P<0.05,图1);2组OS曲线比较差异无统计学意义(log=1.721,P>0.05,图2)。
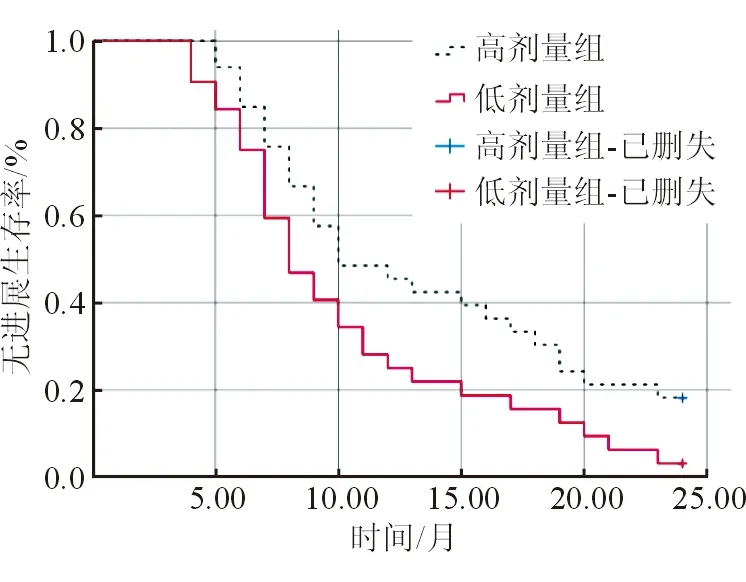
图1 2组PFS曲线比较
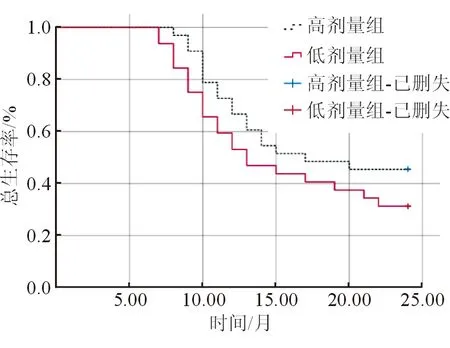
图2 2组OS曲线比较
讨 论
肝细胞癌占原发性肝癌的90%,根据2020年全球癌症发病率、死亡率和患病率报道,肝细胞癌在癌症相关死亡中位居第三,且发病率在全球范围内呈上升趋势[12]。肝细胞癌患者预后仍然不佳的原因一般归结于该病在早期阶段无症状,导致诊断较晚,并且对常规化学疗法和放射疗法具有显著抵抗力。外科手术是肝细胞癌的首选治疗方法,而早期研究报道显示,多数患者确诊时已错失手术切除时期,介入治疗、消融、调强放疗等局部治疗方案在晚期肝细胞癌治疗中同样应用广泛,且均经FDA批准,有助于延长患者的生存期,但复发率、转移率较高,往往无法达到临床预期[13]。大约50%的肝细胞癌患者接受全身治疗,传统上索拉非尼或乐伐替尼用于一线治疗,瑞戈非尼、卡博替尼或雷莫芦单抗用于二线治疗,然而近几年研究中免疫检查点抑制剂的出现彻底改变了原发性肝癌的管理,与索拉非尼相比,atezolizumab 和贝伐珠单抗的组合已被证明可以改善总生存期,并被FDA批准治疗晚期肝细胞癌。然而上述研究中针对晚期肝细胞癌的治疗主要为抑制肿瘤血管生成和调节机体免疫反应,结合我国国民经济现状,进口药品的价格远超国民及国家财政在医疗补助中的承受能力,因此国内临床实际治疗中生物靶向药物的使用仍以具有相同作用机制的国产药物为主,卡瑞利珠单抗是第三个获准发售的国内PD-1癌症免疫疗法药,对PD-1受体活性具有抑制作用,同时可解除肿瘤PD-1配体上调后对活化免疫T细胞功能的抑制作用,减少免疫逃逸,有助于提高抗肿瘤效果[14]。刘金等[15]对23例中晚期肝细胞癌应用卡瑞利珠单抗治疗1个月后缓解率接近50%;杨秋雨等[16]研究报道,53例中晚期肝细胞癌患者采用卡瑞利珠单抗联合肝动脉化疗栓塞治疗1个月后,客观缓解率为45.2%,但仍具提升空间。
细胞与分子学研究发现[17-18],肝细胞癌的发生、转移、凋亡、复发等多个病理阶段均依赖于肝脏丰富的供血系统,而肿瘤新生血管的形成与VEGF/VEGFR的信号传导密切相关,VEGF成功结合胞外区VEGFR后可过度激活磷脂酰肌醇-3激酶等多个血管生成信号传导途径,促进内皮细胞的活化、增殖,诱导肿瘤细胞的转移。阿帕替尼是具有小分子抗血管生成的单药,可拮抗VEGFR-2无法有效结合酪氨酸激酶ATP,导致酪氨酸激酶活性丧失,成功阻断VEGF/VEGFR传导信号,导致肿瘤新生血管减少或完全阻断[19]。本研究在既往研究基础上对卡瑞利珠单抗联合不同剂量阿帕替尼治疗晚期肝癌的疗效及安全性进行研究和验证,结果显示,高剂量组客观缓解率高于低剂量组,表明晚期肝细胞癌应用高剂量阿帕替尼治疗,有助于提升客观缓解率,疗效更佳。相关研究提出[20],随着阿帕替尼给药剂量的增加,皮肤组织中药物残留量随之增加,可能导致真皮血管损伤及修复失衡,引起皮肤黏膜和血管黏膜损伤,诱发瘙痒和手足综合征。此外,阿帕替尼可增加血管通透性,提高肾小球滤过膜的透过率,导致肾小球滤过液中蛋白质占比增加,增大了给药后肾性蛋白尿的发生风险。本研究中高剂量组手足综合征、肾性蛋白尿的发生率更高,提示提高阿帕替尼给药剂量,可能增加患者的手足综合征、肾性蛋白尿发生风险。本研究预后随访显示,高剂量组和低剂量组中位PFS分别为9个月、8个月,2组PFS曲线比较差异有统计学意义,表明相对于低剂量阿帕替尼治疗方案,采用高剂量阿帕替尼给药方案更有助于延长患者的无进展生存期。本研究中高剂量组和低剂量组中位OS分别为17个月、13个月,2年总生存率分别为45.45%、31.25%,2组OS曲线比较虽未表现出统计学差异,但高剂量组2年总生存率高出低剂量组14.20%(45.45%~31.25%),随着样本量的增加可能会表现出统计学差异。
因本研究采用单中心小样本研究所得结果可能与临床实际存在些许偏差,仍需进行大样本研究论证,共同完善阿帕替尼的安全性用药区间及晚期肝细胞癌的生存预后分析。而近几年国际研究针对肝细胞癌的治疗尽管取得了各项重大进展,但控制免疫反应和逃避的分子基础仍不清楚,且已经确定了不同的病因依赖性免疫特征及发炎和非发炎的肝细胞癌和基因组特征与对免疫检查点抑制剂的反应有关,但可指导临床决策的生物标志物仍待验证。因此后续研究中根据晚期肝细胞癌患者所表现出的病因学依赖性的反应机制,而制定个体化的基因靶点相关性的免疫疗法可能会在不久的将来改变这种疾病的管理。
利益冲突声明:所有作者均声明不存在利益冲突。
