以肝占位发现的直肠神经内分泌肿瘤1例
2023-05-15周喆聿王凯刘劲松尹胤
周喆聿 王凯 刘劲松 尹胤
患者,男性,67岁,主因“体检发现肝占位4d”于2021年10月19入本院。既往有高血压病史20年,体格检查未及明显阳性体征。实验室检查:粪便隐血试验阳性,红细胞3.88×1012/L↓,血红蛋白111 g/L↓。其余包括甲胎蛋白和肝癌异常凝血酶原在内的各项指标均在参考范围之内。上腹部平扫+增强CT示(图1):肝右叶占位(大小约为15.6 cm×8.8 cm,增强扫描轻度强化),肝癌可能,伴肝内多发转移性病灶(增强后动脉期边缘环形强化)。于10月22日行彩超引导肝脏穿刺。考虑到患者CT所见、年龄及粪便隐血试验阳性结果,完善无痛电子胃肠镜检查(图2):直肠距肛门8 cm见不规则隆起样病灶,约占管腔1/2,组织活检质硬易出血。肝脏穿刺病理:免疫组化:Ki-67(约10%+)、CD56(+++)、突触素(synaptophysin, Syn)(+++)、嗜铬粒蛋白(chromogranin A, CgA)(个别+)、CK19(+++);符合神经内分泌肿瘤,G2,请结合临床排除肿瘤起源部位。直肠活检病理:免疫组化:Ki-67(约15%+)、CD56(+++)、Syn(+++)、CgA(-)、CK(+++)、p53(部分++)、SSTR2a(+++);符合神经内分泌肿瘤,G2。分子诊断病理:未检测到基因KRAS、NRAS、BRAF V600E位点突变;微卫星稳定(MSS)。最终诊断:直肠NEN伴肝转移。患者于10月30日就诊于肿瘤内科,于11月2日行第一次FOIFIRI(伊利替康+亚叶酸钙+5-氟尿嘧啶)化疗。后于11月15日行第二次化疗,于12月1日、12月13日和2022年1月5日行FOLFIRI化疗联合西妥昔单抗的方案。2021年12月28日复查全腹部平扫+增强CT示(图3):肝右叶占位(大小约16.5 cm×11.3 cm)伴肝内转移,较前部分稍增大;直肠中段管壁占位较前大致相仿。后患者因个人原因未在本院进一步治疗。
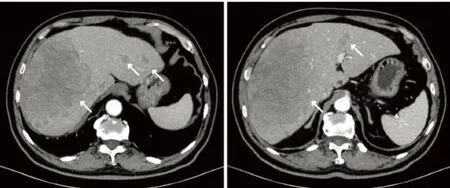
图1 腹部增强CT表现
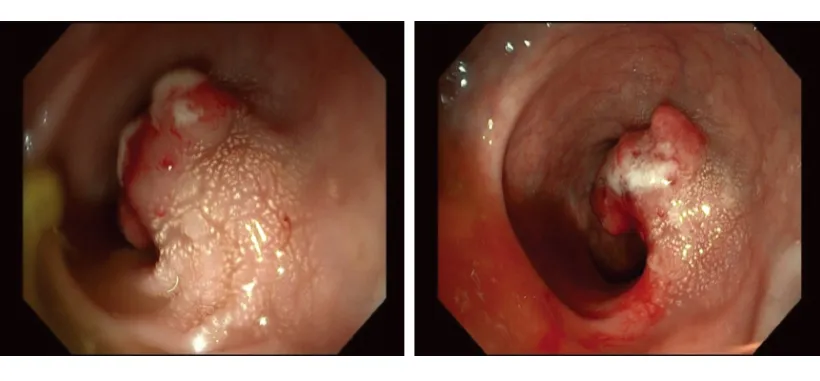
图2 肠镜下表现
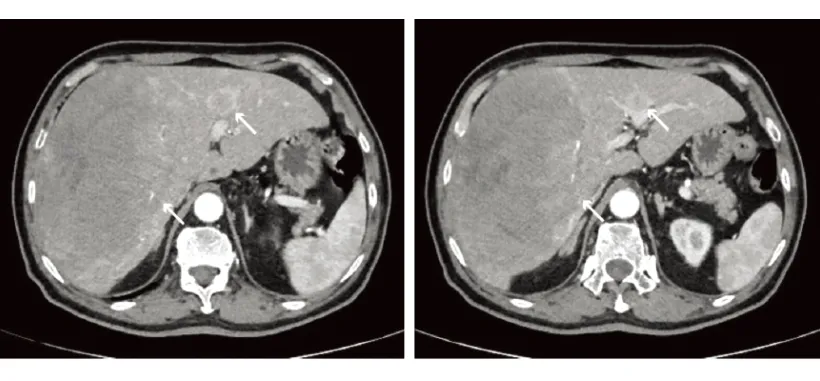
图3 第一次化疗8周后复查腹部增强CT表现
讨论起源于全身神经内分泌细胞的神经内分泌肿瘤(neuroendocrine neoplasm, NEN)为少见肿瘤,胃肠胰NEN约占所有NEN的2/3。结直肠癌血行转移最主要的靶器官是肝脏,肝转移是NEN患者生存的一个负面预测因素[2]。
根据美国监测、流行病学与最终结果数据库的数据,直肠NEN发病率为1.04/10万[1]。NEN分为有功能性和无功能性肿瘤,大多数为无功能性的[3],本例患者也是在健康体检时被偶然发现。有功能性NEN可分泌不同的激素,出现心悸、出汗、皮肤潮红、腹痛、腹泻等临床症状。分化良好的NEN根据Ki-67指数和核分裂象计数分为G1、G2(Ki-67:3%~20%;核分裂象2~20个/mm2)和G3级[3]。病理诊断NEN必做的免疫组化项目包括Syn、CgA以及上皮标记;选做的项目包括SSTR2、CD56以及p53等[3]。
Mayo等[4]报道无功能激素状态是导致较差生存率的独立危险因素之一。Morgan等[5]通过多因素回归分析评估NEN进展的预测因素,仅发现≥5 cm的肝转移肿瘤具有显著性差异(P=0.003)。NEN的临床表现多样,取决于原发肿瘤的分泌活性和肝转移肿瘤的负荷程度[2]。肝转移是仅次于NEN分级的预后不良因素[6],因此,NEN肝转移的管理是NEN患者治疗的关键组成部分。
结直肠癌患者最主要的死亡原因是肝转移,肝转移肿瘤可以达到无疾病证据(no evidence of disease, NED)状态或完全切除可以提高患者的中位生存期和5年生存率[7]。根据我国结直肠癌肝转移诊断和综合治疗指南,积极的综合治疗意义重大,具有较高转化切除率的FOLFIRI化疗方案应作为首选的化疗方案,同时联合分子靶向治疗可以进一步提高转化率[8]。检测KRAS、NRAS、BRAF V600E突变具有评估预后以及预测分子靶向药物有效性的意义[7]。对于RAS野生型患者可以采用西妥昔单抗联合化疗治疗[9-10],早期肝转移肿瘤缩小(第8周影像学上肿瘤大小缩小)与患者的生存和无进展生存期相关[10]。对于BRAF V600E突变的患者,预后大多较差[8]。本例患者行第一次化疗8周后肝转移肿瘤快速进展,表明患者对此治疗方案敏感性低以及NEN的高度异质性。
根据我国胃肠胰NEN诊治专家共识[3],依维莫司被推荐用于明确进展的无功能性直肠NEN;抗血管生成的索凡替尼也可用于进展期G2级(Ki-67≥10%)直肠NEN;对于G2或G3级直肠NEN,CAPTEM(替莫唑胺+卡培他滨)和FOLFOX(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)是可采用的化疗方案。专家共识并无明确推荐NEN肝转移的转化治疗方案,主要原因在于目前无论化疗、靶向治疗或生长抑素类似物的总体客观缓解率均不高[11]。此外,减瘤术、经肝动脉介入治疗和射频消融等是对于肝转移肿瘤可选的治疗手段。研究显示,对于功能性NEN,减瘤比例>70%与R0切除术有相当的生存结局[2]。介入治疗的客观反应率为80%以上[8],以小粒径固体栓塞剂为佳[12]。本例患者肝转移肿瘤为III型(转移瘤双叶分布,弥散),功能性残肝体积<30%,不推荐外科手术[11]。Ⅱ型(通常累及双叶,孤立转移灶伴较小转移灶)和I型(单发病灶,任何大小)肝转移肿瘤通过手术或联合消融治疗(最大径≤5 cm,5个病灶以内是消融指征)可切除[3, 11]。患者最终选择FOLFIRI化疗联合西妥昔单抗的方案,短期内进展。
通过本例以及文献复习,笔者认为,增强CT呈“牛眼征”表现(肿瘤边缘环状强化,而中央坏死区无强化)需警惕肝转移肿瘤,病理诊断是金标准。NEN肝转移的治疗仍然存在争议,尚未达成共识。目前尚无大型随机对照研究比较内科和外科治疗的生存获益。多学科团队治疗模式对NEN肝转移患者进行全面病情评估,制定个性化治疗方案有重大意义。
利益冲突声明:所有作者均声明不存在利益冲突。
