茶树TLP家族基因鉴定及其对高温干旱和炭疽菌侵染的响应
2023-05-13郭菥蓥连玲丽魏日凤
郭菥蓥, 陈 强, 连玲丽, 魏日凤, 刘 伟
(1.福建农林大学园艺学院,福建 福州 350002;2.福建农林大学生命科学学院,福建 福州 350002;3.宁德师范学院生命科学学院,福建 宁德 352000)
茶[Camelliasinensis(L.)O.Kuntze]是一种多年生常绿经济作物,在我国主要分布在长江中下游、西南、华南等地区.茶树在生长过程中常受高温、干旱等极端天气的影响,茶树中活性成分儿茶素、茶氨酸、咖啡因含量的减少导致茶叶品质下降,造成重大经济损失,这对茶树育种和逆境响应机制研究提出了新要求[1].植物病程相关蛋白(PR)是植物在病理或病理相关的环境下诱导的一类蛋白,主要分布在植物液泡和细胞间隙中.类甜蛋白(thaumatin-like protein, TLP)属于PR-5家族,是逆境环境下产生的一类蛋白,主要通过改变细胞膜的通透性来调节植物对逆境胁迫的防御反应[2-3].
目前多种植物TLP已被证实具有抗真菌活性、诱导细胞程序性死亡、提高植株耐受性等作用[4].如:Yan et al[5]研究表明,葡萄TLP29基因的过表达可上调水杨酸和茉莉酸甲酯信号,增强了对白粉病和丁香假单胞菌番茄致病变种DC3000的抗性;Li et al[6]研究表明,番茄TLFP8基因能通过核内复制调控气孔的密度和大小,从而影响水分利用效率,提高植物抗旱性;陈兵等[7]从西瓜基因组中鉴定得到28个TLP家族基因,这些基因主要在根部表达,可受枯萎病菌诱导,可能在抵御病原菌侵染过程中发挥重要作用;Sun et al[8]研究表明,杨树TLP基因的过表达能增强对斑点病的抗性能力,同时从过表达植株中提取的总蛋白也在体外对病原真菌具有明显的抑制作用.
以往研究表明,茶树TLP基因在响应逆境胁迫中起重要作用.如:Muoki et al[9-10]研究表明,在干旱胁迫下茶树耐旱品种‘UPASI-9 ’TLP基因表达上调,同时,在干旱胁迫下转TLP基因的拟南芥传递膜稳定性增强、耐旱性显著提高;Wang et al[11]研究表明,miRn211-thaumatin-like蛋白可正向调控抑制茶树灰霉病;Acharya et al[12]研究表明,茶树TLP基因过表达植株中PAL和LOX基因的表达量显著增加,增强了对菜豆壳球孢病菌(Macrophominaphaseolina)的抗性.尽管这些研究已证实TLP与茶树抗逆性密切相关,但目前仍缺乏对TLP的系统认识.据此,本研究从全基因组水平对茶树TLP家族基因进行鉴定,并对家族基因的进化关系、保守基序和顺式作用元件等进行分析,旨在为进一步研究该家族基因在响应逆境胁迫中的功能提供依据.
1 材料与方法
1.1 材料处理
茶树品种‘舒茶早’全基因组和蛋白数据下载自TPIA数据库(https://www.tpdb.shengxin.ren)[13];拟南芥(Arabidopsisthaliana)蛋白序列来自TAIR数据库(https://www.arabidopsis.org/);水稻(Oryzasativa)蛋白序列来自国家水稻数据中心(https://www.ricedata.cn/);炭疽菌侵染和高温干旱胁迫的转录组数据均下载自NCBI-SRA数据库(https://www.ncbi.nlm.nih.gov/sra).
选取茶树品种‘龙井43’一年生扦插苗,采摘标准为大小一致、无病害的第2叶;茶树炭疽菌(Colletotrichumgloeosporioides)由宁德师范学院分子生物研究室提供.在高温干旱处理试验中,将(24±2)℃下生长的植株转移至含150 g·L-1PEG-6000的水培溶液中,于(38±2)℃下生长,收集处理0、6、12、24 h的第2叶;在炭疽菌处理试验中,将叶片做十字切割后接种炭疽菌块,置于光照培养箱中的培养皿上进行保湿培养(25 ℃、光照时间12 h),分别于处理0、24、48 h时取样.每个处理设3次重复.提取的样品用液氮速冻后保存于-80 ℃中用于RNA的提取.
1.2 茶树TLP家族基因鉴定及理化性质分析
从Pfam数据库(http://pfam.xfam.org/)获取茶树TLP家族基因的结构域信息(PF00134).使用Hmmsearch程序预测茶树全基因组中的TLP基因[14-15].通过CDD在线分析工具(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)确认结构域.使用PortParam在线分析工具(https://web.expasy.org/protparam/)分析TLP蛋白序列的理化性质.使用WolfSport在线分析工具(https://wolfpsort.hgc.jp/)预测TLP蛋白的亚细胞定位信息.
1.3 茶树TLP家族基因系统进化树构建、染色体定位和启动子顺式作用元件预测
从茶树基因组注释文件中提取染色体位置信息,并使用TBtools软件[16]对定位信息进行可视化.将拟南芥、水稻与茶树TLP氨基酸序列进行多重序列联配,联配结果用MEGA 7.0软件采用邻近法构建系统进化树,Bootstrap值设置为1 000,其他为默认值[17].从基因组中提取茶树TLP家族基因转录起始位置上游2 000 bp处的序列用于查找启动子顺式作用元件,通过网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行顺式作用元件预测[18].
1.4 茶树TLP家族基因结构、保守基序和蛋白网络互作预测
从TPIA数据库下载茶树外显子和内含子分布信息,使用TBtools软件对TLP家族基因进行基因结构分析,并绘制基因结构示意图.将茶树TLP蛋白序列提交到MEME程序预测其保守基序,保守基序数量设置为10,其余参数默认设置[19].利用String蛋白互作数据库(http://string-db.org/)中的蛋白互作记录预测茶树TLP蛋白之间的相互作用,物种参数选择拟南芥[20].
1.5 基于转录组数据分析茶树TLP家族基因在逆境胁迫下表达水平
从NCBI-SRA数据库中下载茶树在高温干旱胁迫[21](登录号:SRP199821)和炭疽菌侵染胁迫[22](登录号:SRP116367)下的转录组数据,经去除低质量序列、比对和计算等处理得到表达量数值,并从中提取TLP家族基因的FPKM(fragments per kilobase of transcript per million mapped)值,去掉未表达的基因,使用TBtools软件绘制表达热图.
1.6 茶树TLP家族基因在逆境胁迫下表达水平的qRT-PCR验证
利用Primer-Blast在线工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast)对目标基因进行引物设计(附件表Ⅰ,扫OSID码可见).使用RNAprep Pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取茶树叶片总RNA,使用Nano Drop 2000超微量分光光度计(赛默飞世尔科技公司)检测RNA的浓度和纯度,使用TransScript All-in-one First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒(北京全式金生物技术有限公司)合成cDNA用于qRT-PCR验证,每个样品均设置3次生物学重复.分别以高温干旱处理和炭疽菌侵染处理的样品cDNA为模板,利用CFX96 Touch荧光定量PCR仪(Bio-Rad公司)进行qRT-PCR验证.qRT-PCR程序设置为:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,40个循环.反应体系按TransStart®Tip Green qPCR SuperMix试剂盒(北京全式金生物技术有限公司)说明书的方法配制.反应结束后分析荧光值变化曲线和熔解曲线,所有数据均采用 SPSS 19软件进行处理,采用Duncant测验检验数据的差异显著性,P<0.05表明有统计学意义.选用茶树GAPDH(登录号:GE651107)作为内参基因,采用2-ΔΔCT方法计算各时间段茶树TLP家族基因的表达量,最后利用Prism 9软件将数据图表化.
2 结果与分析
2.1 茶树TLP家族基因的鉴定及理化性质
利用结构域信息对茶树全基因组进行搜索,通过CDD在线分析工具验证出31个TLP家族基因均含有索玛甜功能结构域,依据染色体位置依次命名为CsTLP1~CsTLP31.蛋白质理化性质分析(附件表Ⅱ,扫OSID码可见)显示,茶树TLP编码144~637个氨基酸,其中,蛋白质序列最短的基因为CsTLP16,最长的基因为CsTLP11.TLP蛋白等电点为4.53~9.08.CsTLP3、CsTLP7、CsTLP8、CsTLP25、CsTLP11、CsTLP15、CsTLP21、CsTLP29、CsTLP30编码的蛋白为碱性蛋白,其余为酸性蛋白.亚细胞定位预测显示,TLP蛋白在细胞内外均有分布,主要定位在细胞外基质和叶绿体上(均为12个),其余家族基因定位在内质网、高尔基体、细胞核上.
2.2 茶树TLP家族基因系统进化关系、染色体定位及启动子顺式作用元件预测结果
为了进一步了解茶树TLP家族基因的进化关系,根据Shatters et al[23]对TLP家族基因的分类原则,选取拟南芥和水稻10个TLP蛋白(10个聚类组中每组选取1个作为代表)与茶树TLP蛋白构建系统进化树(图1).基于拟南芥10个TLP蛋白将茶树31个TLP蛋白分别聚成10个类群;类群3不含茶树TLP蛋白;类群7不含水稻TLP蛋白;类群5的成员最多,共有10个茶树TLP蛋白.从基因染色体定位结果(附件图Ⅰ,扫OSID码可见)可知:CsTLP30和CsTLP31未定位到具体染色体上;6、7、15号染色体上分布1个TLP基因;8、9、10、12号染色体上分布2个TLP基因;1、2、3号染色体上分布3个TLP基因;分布在13、14号染色体上的TLP基因数量分别为4和5个.分布在13、14号染色体上的TLP基因出现成簇聚集现象,主要为类群5家族基因,推测它们可能具有相似的功能;4、5、11号染色体上没有茶树TLP家族基因分布.

●表示拟南芥;▲表示茶树;★表示水稻.
为了研究茶树TLP家族基因顺式作用元件的功能,在转录起始位置上游2 000 bp处的序列中查找各类顺式作用元件,除启动子增强顺式作用元件(TATA-box、CAAT-box)外,共预测出4类顺式作用元件,分别为光响应元件、胁迫响应元件、激素响应元件和生长发育相关元件(附件图Ⅱ,扫OSID码可见).其中,光响应元件有22种,包括Box4、G-box和GT1-motif等,尤其是Box4分布在90%的TLP家族基因中;胁迫响应元件有7种,包括低温响应元件(LTR)和干旱响应元件(MBS)等,其中,ARE分布在90%的TLP家族基因中;激素响应元件有9种,包括脱落酸响应元件(ABRE)、水杨酸响应元件(TCA-element)和赤霉素响应元件(P-box、GARE-motif、TATC-element)等,其中,ABRE广泛分布于71%的TLP家族基因中;生长发育相关元件包括调控分生表达组织元件(CAT-box)和调控玉米醇溶蛋白代谢元件(O2-site)等.这些元件预示了TLP家族基因可能在茶树生长发育及响应光照、激素和胁迫中发挥作用.
2.3 茶树TLP家族基因结构、保守基序及蛋白网络互作预测结果
为了解茶树TLP家族基因的结构,根据其系统进化关系,利用TBtools软件绘制TLP家族基因结构图,比较TLP家族基因的内含子和外显子.结果(附件图Ⅲ,扫OSID码可见)显示,茶树TLP家族基因外显子数量存在一定差异,外显子个数为1~10,内含子个数为0~9.其中,11个成员仅含有1个外显子,9个成员含有2个外显子,7个成员含有3个外显子,2个成员含有4个外显子,1个成员含有8个外显子,1个成员含有10个外显子.同一分支基因的外显子数量和分布差异较小,同一个类群成员的基因结构较相似.利用在线程序MEME对茶树TLP家族基因保守基序进行了分析,查找TLP蛋白的10个保守基序.结果(附件图Ⅲ,扫OSID码可见)显示,茶树TLP家族基因的保守基序有5~17个,且大多数家族基因具有相同的模体组织模式,均为基序4、10、3、9、7、1、6、5、2、8.然而在部分类群内部存在着个别基因保守基序丢失的现象,如类群7家族基因中的CsTLP11丢失基序7、8、9,CsTLP14丢失基序4、10、3、9、7.类群5家族基因中除了CsTLP26均含有两个保守结构域,其余家族基因均丢失基序10,这些都暗示着TLP家族基因在类群间以及类群内部可能具有功能的特异性.
为了深入了解茶树TLP家族基因所编码蛋白的相互作用,以拟南芥为模板对其进行蛋白网络互作预测.结果(附件图Ⅳ,扫OSID码可见)显示:29个茶树TLP基因对应11个拟南芥已知基因,其中,CsTLP29与CsTLP5、CsTLP12、CsTLP30之间存在相互作用;CsTLP2、CsTLP5、CsTLP7、CsTLP9、CsTLP10、CsTLP12、CsTLP13、CsTLP17、CsTLP19、CsTLP29、CsTLP30与拟南芥RBP45B均存在互作,剩余的18个基因之间不存在相互作用,它们大都独立发挥调控作用.
2.4 基于转录组数据分析茶树TLP家族基因在不同胁迫处理下的表达水平
为了研究茶树TLP家族基因在逆境胁迫过程中的表达水平,从NCBI-SRA数据库中下载茶树在炭疽菌侵染和高温干旱胁迫下的转录组数据.结果(图2A)显示,在炭疽菌侵染下,CsTLP1、CsTLP20、CsTLP21、CsTLP23、CsTLP27、CsTLP29的表达量存在差异,这些基因主要归属于类群5,其他基因的表达量差异不显著.图2B显示,在高温干旱胁迫下,CsTLP7、CsTLP15、CsTLP16、CsTLP17、CsTLP18、CsTLP20、CsTLP21、CsTLP22、CsTLP23、CsTLP26、CsTLP27、CsTLP28的表达量存在差异,其他基因的表达量差异不显著.在炭疽菌侵染和高温干旱胁迫下差异表达的基因主要来自类群5和类群6.

A:绿色表示低表达,红色表示高表达;TA-0 h、TA-24 h分别表示茶树在炭疽菌侵染0和24 h的log2FPKM值;CK为不处理的对照.B:蓝色表示低表达,红色表示高表达;HD-96 h、HT-96 h分别表示茶树在高温干旱和干旱胁迫96 h的log2FPKM值;CK为不处理的对照.
2.5 基于qRT-PCR验证不同胁迫处理对茶树TLP家族基因表达水平的影响
为了进一步确认茶树TLP家族基因在逆境下的表达水平,对上述转录组分析中呈现差异表达的14个TLP基因进行qRT-PCR验证.结果(图3)显示:茶树TLP家族基因在炭疽菌侵染后,以0 h处理下的基因表达量为对照,CsTLP20、CsTLP21、CsTLP23、CsTLP27在所有时间点的表达量显著上调;处理48 h时,CsTLP20的表达量上调近157倍,CsTLP21的表达量上调近26倍,CsTLP23的表达量上调近329倍;CsTLP27的表达量上调近39倍.分析发现,炭疽菌侵染后没有诱导CsTLP1、CsTLP29的表达.
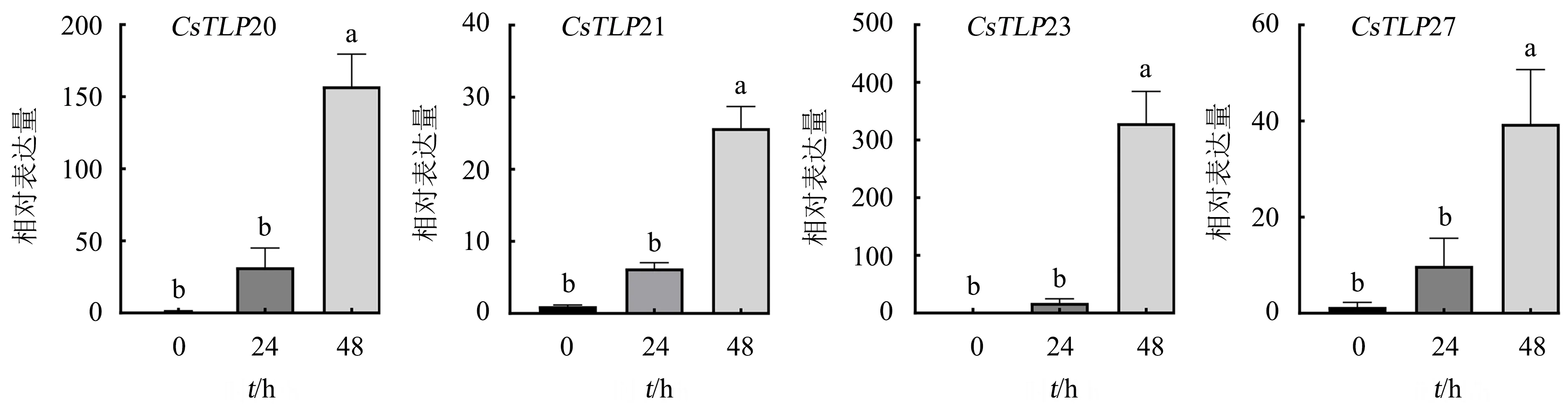
不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05).
图4显示:茶树TLP家族基因在高温干旱处理下,以0 h处理下的基因表达量为对照,CsTLP20、CsTLP21、CsTLP22、CsTLP23、CsTLP28在所有时间点的表达量均显著上调;处理24 h时,CsTLP28的表达量上调近5倍,CsTLP20的表达量上调近51倍,CsTLP21的表达量上调近38倍;处理12 h时,CsTLP23的表达量上调近13倍;CsTLP7、CsTLP16、CsTLP27在所有时间点的表达量均显著下调;CsTLP26在处理12 h时的表达量显著上调,其余时间点均显著下调;CsTLP15在处理24 h时的表达量显著上调,其余时间点均显著下调.分析发现,高温干旱处理后没有诱导CsTLP17、CsTLP18的表达.

不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05).
结合转录组数据发现,CsTLP20、CsTLP21、CsTLP23、CsTLP27的表达量在高温干旱和炭疽菌侵染处理下均存在差异且表达量较高.其中,CsTLP20、CsTLP21、CsTLP23在高温干旱和炭疽菌侵染处理下均显著上调,这3个基因表达量的qRT-PCR验证结果与转录组数据一致;而CsTLP27的表达量经qRT-PCR验证,其在炭疽菌侵染下显著上调且在高温干旱下显著下调,该基因在高温干旱下的qRT-PCR验证结果与转录组数据不一致.
3 讨论
近年来随着对TLP家族基因研究的深入,发现其在植物逆境胁迫响应中发挥着重要作用[24].本研究基于茶树基因组数据,对基因组中的TLP家族基因进行筛选和验证,共鉴定出31个TLP基因,并对基因的分布和表达进行了分析.TLP家族基因在植物中广泛存在,本研究共鉴定出31个茶树TLP基因,数量低于陆地棉(88个)[25]和水稻(37个)[26],高于西瓜(28个)[7]和甘蓝型油菜(29个)[27].亚细胞定位预测显示,茶树TLP家族基因主要分布在细胞外基质和叶绿体上,其中,类群5家族基因主要分布在细胞外基质,表明TLP蛋白特异表达具有多样性,可能参与多个器官功能进程.系统聚类分析显示:茶树TLP家族基因主要分为10个聚类组,其中,类群3不含有TLP家族基因,这与桑树TLP家族基因[28]类似;而陆地棉TLP家族基因在10个类群中均有分布[25],推测其可能在与拟南芥物种分化之后,该聚类组中的基因发生了丢失现象.染色体定位分析显示,茶树TLP家族基因多个成员在染色体上存在聚集现象,这些同一聚类组的基因多数来源于同一染色体,少数来自不同染色体,其中,聚类组5中的基因主要来自13、14号染色体,预测可能发生了基因染色体内或染色体间的复制.同一聚类组内各基因结构和蛋白序列保守基序组织模式相似,这也说明系统进化树的可靠性.对基因启动子区顺式作用元件分析发现,茶树TLP家族基因具有多个与激素、胁迫响应相关的顺式作用元件,这预示着其可能通过各种激素信号转导途径参与胁迫响应过程.蛋白网络互作分析发现:CsTLP29与CsTLP5、CsTLP12、CsTLP30之间存在相互作用;11个TLP基因与拟南芥RBP45B存在互作.研究表明,拟南芥RBP45B是一种含有3个RNA识别基序(RRM)的RNA结合蛋白,在植物处于逆境条件下,该蛋白在保持mRNA稳定性和翻译起始相关方面发挥着重要作用[29].大部分类群5基因编码的蛋白序列与拟南芥OSM34蛋白序列高度相似,而OSM34是一种渗透蛋白,能够调节ABA诱导脯氨酸合成[30],预测该类群成员可能参与响应植物逆境胁迫.如:张华崇等[25]研究表明,陆地棉TLP类群5中有6个家族基因在黄萎病菌侵染胁迫下的表达量显著上调;陈兵等[7]研究表明,西瓜TLP类群5中的家族基因在枯萎病菌侵染胁迫下的表达量显著上调.本研究中,经过高温干旱和炭疽菌侵染胁迫处理后,多个茶树TLP基因的表达量与无胁迫处理的对照相比均存在显著差异,除CsTLP24、CsTLP25和CsTLP31外,其余类群5家族基因的表达量均有差异,但表达倍数有所不同,暗示茶树不同TLP基因在应对逆境胁迫时发挥的响应功能也有所差别,与前人[10,31]的研究结果相似,预示TLP类群5家族基因可能对茶树逆境胁迫的响应中发挥了重要作用.
综上所述,茶树TLP类群5家族基因大多数成员可能直接或间接参与逆境胁迫的响应,可作为植物抗逆性育种的候选基因.本研究利用生物信息学方法对茶树TLP家族基因进行分析和预测,并通过qRT-PCR验证了其在炭疽菌侵染和高温干旱胁迫处理下的表达水平,旨在为进一步研究茶树TLP家族基因在逆境胁迫响应中的生物学功能提供参考.
