鸡毒支原体PstS蛋白的原核表达及其定位
2023-05-13单春兰王开功程振涛
宋 春, 杨 美, 岳 筠, 单春兰, 王开功,3, 程振涛,3
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病预防控制中心,贵州 贵阳 5500083;贵州大学贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
鸡毒支原体(Mycoplasmagallisepticum, MG)是鸡慢性呼吸道疾病的重要病原,导致鸡呼吸困难甚至发生肺炎,阻碍鸡的生长发育,降低产蛋量,也会引起死胚率升高[1-2].养禽业集约化养殖模式和管理不善等多种原因导致鸡毒支原体、传染性喉气管炎等呼吸道疾病普遍发生,多种病原混合感染并长期存在,严重危害禽业经济[3-4].目前,控制MG感染的疫苗主要有灭活疫苗和弱毒疫苗.在一定程度上,灭活疫苗可以控制感染,减少发病鸡的数量,降低产蛋量损失,但无法抵抗强毒株的攻击[5].有研究表明,弱毒疫苗F株、6/85和ts-11可有效控制MG在鸡体内传播[6-8].但是弱毒疫苗免疫鸡群必须为健康鸡群,且蛋鸡在产蛋期不宜接种,这限制了弱毒疫苗的使用[9].
鸡毒支原体缺乏细胞壁结构,脂质相关膜蛋白在其膜表面大量存在,可介导支原体黏附、侵入宿主细胞等过程,决定了支原体致病性强弱[10].所以MG膜蛋白筛选及其黏附特性研究是解析MG致病机理和亚单位疫苗靶标的关键.如TM-1蛋白、PvpA蛋白、烯醇化酶、醛缩酶、pMGA蛋白等MG外膜蛋白均有研究报道[11-12].本试验基于MG F株基因组,分析磷酸盐ABC转运蛋白底物结合蛋白(phosphate ABC transporter substrate-binding protein, PstS)具有跨膜结构和良好的B细胞抗原表位,可能是MG的膜蛋白.早期研究表明,PstS是结核分支杆菌的膜蛋白,将其免疫小鼠后,可刺激细胞产生高水平的特异性抗体和Th1型细胞因子IL-2、IFN-γ,具有较强的保护效率[13].PstS抗原是结核分支杆菌血清学诊断的最佳单抗原[14].有研究表明,PstS蛋白参与癌症、细菌和病毒感染等许多致病性相关的过程[15-16].但关于PstS蛋白在MG中的生物功能相关研究未见报道,本试验通过原核表达重组蛋白PstS制备多克隆抗体,并应用Western blot对PstS蛋白在MG内的分布进行定位分析,为进一步研究MG PstS蛋白的生物功能提供依据.
1 材料与方法
1.1 菌株
MG F菌株购自中国兽医监察所;感受态DH5α购自宝生物工程(大连)有限公司;BL21(DE3)购自江苏科晶生物科技有限公司.
1.2 主要试剂
改良Frey氏培养基购自中海生物科技有限公司;pMD-19T载体、pColdⅠ表达载体由贵州大学动物科学学院提供.PfuDNA Polymerase、限制性内切酶SalⅠ、BamHⅠ购自宝生物工程(大连)有限公司;His标签蛋白纯化试剂盒购自NOVAGEN公司;BCA蛋白定量试剂盒、过硫酸铵、5×SDS蛋白上样缓冲液、预染蛋白Marker、SDS-PAGE凝胶快速配制试剂盒、DAB显色液均购自上海碧云天生物技术有限公司;膜蛋白提取试剂盒购自上海贝博生物公司;弗氏佐剂、羊抗兔标记抗体(HRP-IgG)均购自SIGMA公司.
1.3 PstS蛋白的生物信息学分析
选择15株鸡毒支原体NC06、NC08、NC95、NC96、VA94、S6、NY01、Str.F、Str.R(high)、Str.R(low)、F、f99lab、NCTC、W101、CA06参考菌株序列, 应用相关软件[17]分析MG F株PstS基因(AHB99366.1)的保守性、色氨酸密码子(TGA),PstS蛋白序列的理化性质、亲/疏水区、跨膜区、信号肽、B细胞表位.
1.4 PstS基因的SOE-PCR扩增与克隆
MG使用改良Frey氏培养基进行培养,提取其基因组为模板.PstS基因在210和1 017 bp处存在2个TGA密码子,在大肠杆菌中表达为终止密码子,本试验利用SOE-PCR将2个TGA点突变改变为编码色氨酸的TGG.根据GenBank上已发表的鸡毒支原体Str.F(CP001873.1)中PstS基因信息,设计特异引物(表1),利用PstSp1/p2扩增PstS的基因片段231 bp,PstSp3/p4扩增849 bp,将2个TGA突变成TGG,按照条件94 ℃ 3 min、94 ℃ 30 s、60 ℃ 30 s、72 ℃ 2 min、30个循环、72 ℃延伸5 min进行PCR反应.经凝胶电泳并回收2个片段为模板,PstSp1/p4引物扩增PstS基因1 065 bp.按照条件94 ℃ 3 min、94 ℃ 30 s、58 ℃ 1 min、72 ℃ 20 s、30个循环、72 ℃延伸7 min进行PCR扩增.扩增PstS基因全长后回收并克隆至pMD-19T载体,构建正确的克隆质粒pMD-PstS.

表1 PstS基因引物序列1)
1.5 pCold-PstS原核表达载体的构建
将pMD-PstS、pColdⅠ表达载体用BamHⅠ、SalⅠ进行双酶切后,经1.0%琼脂糖凝胶电泳鉴定并胶回收PstS基因和pColdⅠ载体大片段,然后进行连接、转化至BL21(DE3)感受态细胞,于LB固体平板(Amp+)培养,挑单菌落于LB液体(Amp+)培养,提取重组质粒经PCR、双酶切鉴定后送生工生物工程(上海)股份有限公司测序,构建正确的pCold-PstS表达载体.
1.6 PstS蛋白的表达与纯化
将pCold-PstS转化至BL21(DE3)感受态细胞,摇床培养至D600 nm为0.6~0.8,加入异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)诱导,将诱导菌液高速离心,收集沉淀,用磷酸盐缓冲液(phosphate buffer solution, PBS)洗涤菌体沉淀并重悬,取4体积菌液和1体积SDS上样缓冲液混匀并置于沸水中10 min,12%(体积分数)SDS-PAGE电泳检测PstS蛋白表达.超声裂解诱导菌体,高速离心后采用SDS-PAGE检测,分离上清与沉淀.采用亲和层析柱法纯化PstS蛋白后进行12% SDS-PAGE电泳,然后转印于聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上,采用QuickBlockTMWestern液封闭1 h,TBST(Tris-HCl, NaCl, Tween20)漂洗3~5次,以His-tag抗体(稀释比例1∶1 000)为1抗于4 ℃孵育过夜,漂洗后以辣根过氧化物酶(horseradish peroxidase, HRP)标羊抗小鼠IgG(稀释比例1∶5 000)为2抗于37 ℃孵育1 h,漂洗后采用DAB显色液进行显色,利用Odyssey®红外扫描仪进行扫描以验证PstS蛋白的表达.
1.7 PstS蛋白抗血清制备及效价测定
将纯化后的PstS蛋白经过弗氏完全(不完全)佐剂等比乳化,通过皮下多点注射免疫约2 kg的新西兰大白兔,每只每次400 μg.每隔14 d再次免疫,第4次免疫后的第3天采集心脏血,收集兔抗PstS血清后采用ELISA测效价.
1.8 Western blot鉴定PstS蛋白的定位
取40 mL 108CCU(color change unit,颜色变化单位)的MG液体培养物,4 ℃、12 000 r·min-1离心30 min,弃上清.沉淀中加1 mL Western及IP细胞裂解液,混匀后冰上裂解2~10 min,离心得到上清为MG总蛋白.再取40 mL MG液体培养物,参考膜蛋白提取试剂盒说明书对MG膜蛋白、胞浆蛋白进行提取.将3种蛋白用BCA蛋白定量试剂盒测定后进行SDS-PAGE电泳、转膜,PVDF膜用QuickBlockTMWestern液封闭1 h,TBST漂洗3~5次,加1∶800稀释的PstS兔抗血清37 ℃孵育2 h,漂洗,再用HRP-山羊抗兔IgG(1∶5 000)孵育1 h,漂洗,于DAB显色液中显色后利用Odyssey®红外扫描仪进行扫描.
2 结果与分析
2.1 PstS蛋白的生物信息学分析
对GenBank中15株MGPstS基因核苷酸序列进行分析,PstS基因同源性为97.5%~100%,PstS基因在210和1 017 bp处存在TGA密码子,需要人工突变为色氨酸同义密码子TGG.经预测,其蛋白分子式为C1919H3001N499O583S7,pI=5.11,分子质量42.6 ku,为亲水性蛋白.9~31区域有跨膜区,1~28区域有信号肽.在83~89、95~105、121~127、194~201、297~303、319~328、352~358具有丰富的B细胞表位,很可能是鸡毒支原体的优势抗原表位区域.
2.2 PstS基因的SOE-PCR扩增及克隆
以MG F株的DNA为模板,用突变引物PCR扩增出231和849 bpPstS基因片段,后经SOE-PCR扩增PstS基因全长1 065 bp,均得到符合预期的目的片段(图1).将PstS基因全长胶回收后克隆至pMD19-T中,构建正确的pMD-PstS.
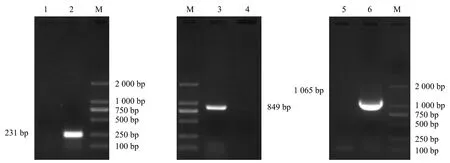
M:DL 2 000 Marker;1:阴性对照;2:PstS基因片段1扩增产物;3:PstS基因片段2扩增产物;4~5:阴性对照;6:PstS基因全长扩增产物.
2.3 重组表达载体pCold-PstS的构建
重组表达载体pCold-PstS经PCR和BamHⅠ/SalⅠ双酶切鉴定,获得1 065 bp的目的基因条带,与预期相符(图2).重组质粒测序结果表明,已将PstS基因成功亚克隆至表达载体pColdⅠ.
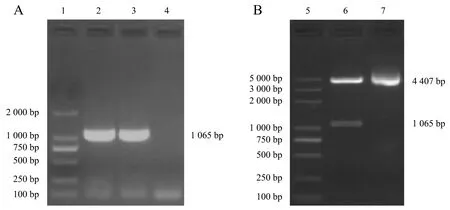
1:DL 2 000 Marker;2-3:pCold-PstS重组质粒;4:阴性对照;5:DL 5 000 Marker;6:pCold-PstS重组质粒;7:pColdⅠ空载体.
2.4 PstS蛋白的诱导表达与纯化
pCold-PstS的阳性克隆菌经过IPTG诱导,对表达产物进行SDS-PAGE电泳,利用考马斯亮蓝染色并脱色后,凝胶上呈现出43 ku的目的蛋白条带(图3A),诱导菌液超声裂解后,对上清和沉淀进行SDS-PAGE电泳,可见融合蛋白PstS在上清中高效表达(图3B),主要为可溶性表达.融合蛋白PstS纯化后,采用Western blot检测,在43 ku处有显色条带(图3C),说明纯化的融合蛋白PstS能与His标签单抗发生特异性反应.
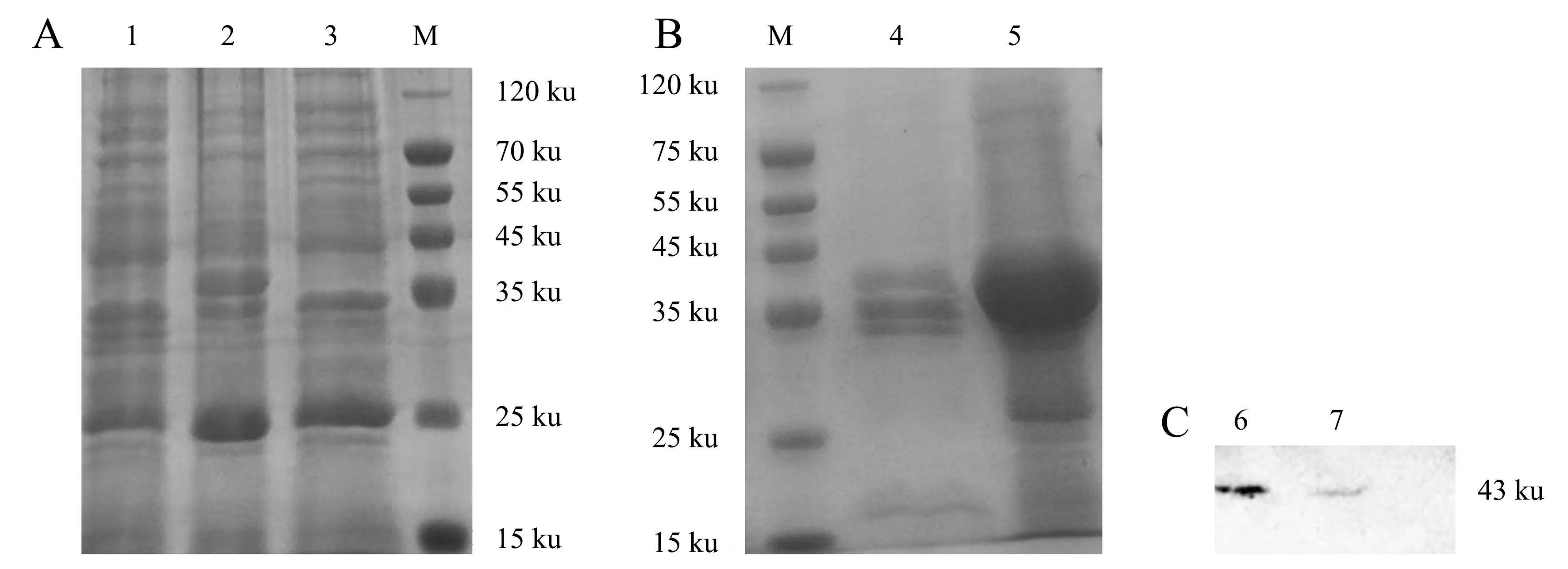
M:Marker;1:空载体诱导;2:重组菌诱导;3:重组菌未诱导;4:重组菌诱导沉淀;5:重组菌诱导上清;6~7:纯化蛋白.
2.5 兔抗PstS血清效价测定
ELISA方法测得制备的兔抗PstS血清效价为1∶25 600(图4).制备的兔抗血清与免疫原呈现阳性反应,且效价较高,说明融合PstS蛋白具有较好的免疫原性.

图4 PstS抗血清的效价测定
2.6 MG总蛋白、胞浆蛋白和膜蛋白的提取
提取MG总蛋白、胞浆蛋白和膜蛋白进行浓度测定及SDS-PAGE电泳(图5)检测,在约43 ku的位置处均可见目的蛋白条带,且膜蛋白在总蛋白中的占比较低.
2.7 PstS融合蛋白在鸡毒支原体中的亚细胞定位
将MG总蛋白、胞浆蛋白和膜蛋白进行SDS-PAGE电泳,分别用兔抗PstS血清孵育,通过Western blot检测均可呈现出43 ku的免疫印迹条带(图6).说明PstS存在于细胞膜组分和胞浆组分中,是鸡毒支原体的膜蛋白,也是MG的胞浆蛋白.

M:Marker;1:膜蛋白;2:胞浆蛋白;3:总蛋白.
3 讨论
磷以磷酸盐的形式存在于生物体中,在菌体组成结构、能量代谢、信号传递等方面发挥重要作用.磷酸盐特殊转运(phosphate specific transport, Pst)系统是细菌中磷酸盐吸收转运的关键系统,PstS蛋白在Pst系统中主要负责外界磷酸盐的摄取,是ABC磷酸盐摄取机制中的结合元件[18-19].有研究表明,在膜表面,具有表达PstS蛋白的细胞,其捕获磷酸盐的能力更强[20].而大肠杆菌过表达溶磷菌PstS蛋白后,对磷酸盐的吸收也显著增加[21].Zaborina et al[22]从肠上皮组织分离出富含PstS蛋白的高毒力铜绿假单胞菌,证明了PstS蛋白参与肠上皮细胞的黏附过程并破坏细胞完整性.此外,PstS蛋白还通过影响细菌生物被膜的形成,介导细菌耐药[23].有研究表明,PstS蛋白可以增强细菌对青霉素、氟喹诺酮类等抗生素的耐药性[24-25].因此,膜表面的PstS蛋白在原核生物中具有重要的生物学意义.
支原体缺乏细胞壁,其表面膜蛋白与致病过程和免疫应答密切相关[26].跨膜区是膜受体蛋白、离子通道蛋白或膜锚定蛋白的重要特征,常用来预测是否为膜蛋白[27-28].Western blot是进行膜定位的常用方法[29-31],本试验采用Western blot对鸡毒支原体PstS蛋白进行亚细胞定位分析,结果表明,PstS蛋白既存在于细胞膜上,也存在于胞浆中.这种多分布、多功能特性在支原体膜蛋白定位研究中均有报道[32-33],可能是因为支原体作为最小的原核微生物,其基因组有限的编码能力决定了支原体系统中蛋白的多功能兼职性[34],所以相同蛋白在胞浆中发挥生理功能的同时也会分泌到膜表面参与病原菌黏附、入侵等过程.而PstS蛋白作为磷酸转运系统中的关键成员,其生理作用决定了其同时存在于膜蛋白和胞浆蛋白中.
4 结论
本试验通过生物信息学分析揭示MG PstS蛋白具有跨膜结构和良好的抗原表位特征,并在原核表达系统中成功表达了MG PstS蛋白(约43 ku).通过Western blot证实PstS蛋白同时存在于MG膜组分和胞浆组分中,属于鸡毒支原体的膜蛋白,为后续MG致病机理、耐药性机制和基因工程疫苗研究提供了依据.
