马口鱼源鮰爱德华氏菌的分离鉴定及耐药性
2023-05-13吴斌
吴 斌
(福建省淡水水产研究所,福建 福州 350002)
马口鱼(Opsariichthysbidens)俗称花杈鱼、桃花鱼、宽口等,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)马口鱼属(Opsariichthys),广泛分布于我国的江河干、支流和湖泊中,是一种小型杂食偏肉鱼类[1-2].马口鱼较易捕捞,其肉质鲜美,营养价值高,颇受消费者青睐,并且在南方1冬龄即性成熟,人工养殖潜力巨大[3].目前,马口鱼的研究主要集中在规模化人工繁殖技术[4-6]、细胞遗传[7-8]、亲缘地理[9]、营养成分[10]、食性[11]等方面,对于养成过程中的病害防控研究还未见报道.
2021年,福建省南平市某淡水鱼养殖场养殖的马口鱼出现摄食能力减弱现象,患病鱼头部、鳍条根部、口腔内部黏膜存在出血症状,解剖发现肝脏为土黄色,脾脏肿大,出现血样腹水,个别鱼出现一侧或两侧眼球凸起,有身体异常弯曲和打转的症状.1~2龄亲鱼的死亡率小于10%,2~3 cm小苗的死亡率高达80%.本试验从患病鱼的肝、肾、脾、脑组织中均可分离到菌落特征相同的优势菌株,选择脑中分离的菌株,对其进行生理生化特征研究以及耐药性分析,再利用形态学观察与分子技术构建系统进化树,以期为该病的防治提供依据.
1 材料与方法
1.1 材料
1.1.1 样本 回归感染用健康马口鱼,体质量25~30 g,体长12~14 cm,均来自顺昌县兆兴鱼种养殖有限公司.
1.1.2 培养基与试剂 脑心浸液培养基、脑心浸液琼脂、革兰氏染色液均购自北京陆桥技术有限责任公司;药敏纸片和细菌微量生化反应管均购于杭州微生物试剂有限公司;Taq PCR Master Mix(2×, blue dye)购自BBI生命科学有限公司;细菌基因组DNA提取试剂盒、DNA Marker DL2000、Nucleic Acid Dye购自天根生化科技(北京)有限公司;16S rDNA通用引物(27F和1492R)合成、测序均由上海生物工程技术有限公司完成.
1.2 方法
1.2.1 病原菌的分离纯化与保存 取患病马口鱼,观察、记录发病环境、临床症状和解剖症状,选择具有典型发病症状的病鱼脑组织进行细菌分离,脑心浸液琼脂平板划线分离细菌,28 ℃恒温箱中培养24 h后,挑取形态大小、颜色等特征基本一致的优势菌落重复纯化2次,然后接种于脑心浸液培养基,在28 ℃、200 r·min-1摇床中培养12 h,加入无菌甘油,使菌液和甘油的比例为7∶3(体积比),混匀后分装于无菌冻存管中,先放置在-20 ℃冰箱2 h,后转移至-80 ℃冰箱内长期保存.
1.2.2 回归感染试验 取体质量约25 g健康马口鱼暂养于150 L玻璃缸中,连续曝气,水温25~27 ℃,每日投喂2次,投喂30 min后换水,每次换全水体的30%,暂养7 d使其稳定,试验前停食24 h后用于回归感染试验.
将-80 ℃条件下保存的菌株接种于脑心浸液琼脂平板,28 ℃恒温箱中培养12 h,无菌生理盐水冲洗平板获得细菌悬液,根据预试验结果,采用无菌生理盐水10倍稀释法,将细菌悬液稀释成5个合适的浓度备用.回归感染试验分为肌肉注射法和腹腔注射法.肌肉注射法:随机捞取健康马口鱼60尾,分6组,每组10尾,背部肌肉注射,试验组每尾注射细菌悬液0.1 mL,对照组注射0.1 mL无菌生理盐水.腹腔注射法:随机捞取健康马口鱼72尾,每组12尾,注射部位为腹腔,其他步骤同肌肉注射法.暂养期间连续曝气,不投饵,水温26~28 ℃,每日换水1次,每次换水30%.观察记录各组发病情况,及时捞除死亡马口鱼,连续观察10 d,对濒临死亡、症状显著的马口鱼进行细菌的再次分离、纯化和保种.
1.2.3 菌株鉴定
1.2.3.1 形态特征观察 将分离纯化得到的菌株接种于普通脑心浸液琼脂平板上,28 ℃培养14~16 h,观察菌落形态特征,挑取单菌落,革兰氏染色,在光学显微镜下观察菌体形态特征.
1.2.3.2 分子生物学鉴定 将保存菌株接种于脑心浸液培养基中,200 r·min-1摇床(28 ℃)中培养12 h后,12 000 r·min-1离心10 min后收集菌体,使用天根细菌基因组DNA提取试剂盒提取细菌全基因组DNA.16S rDNA引物序列:上游引物(27F)为5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物(1492R)为5′-ACGGCTACCTTGTTACGACTT-3′.PCR反应体系50 μL,其中,Taq PCR Master Mix(2×blue dye)25 μL,上下游引物各2 μL(10 μmol·L-1),DNA模板1 μL,ddH2O 20 μL.反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min.PCR反应产物在琼脂糖凝胶(质量分数为1.0%)中电泳(120 V)25 min,采用凝胶成像系统观察电泳结果并送上海生物工程技术有限公司测序,获得的测序序列采用NCBI中的nucleotide blast进行序列同源性分析,利用MEGA 7.0软件构建系统进化树.
1.2.3.3 生化鉴定 取分离保存的菌株接种于脑心浸液琼脂平板上,28 ℃培养48 h备用,分别按照各细菌微量生化管试剂盒说明书进行后续试验,系统地鉴定该菌株的生化特性和生物学特性.
1.2.3.4 药物敏感性试验 将首次分离保存的菌株接种于脑心浸液培养基,200 r·min-1摇床(28 ℃)中培养12 h,调整菌液浓度至108cfu·mL-1.取100 μL调整后的细菌悬液,均匀涂布于脑心浸液琼脂平板上,适度干燥后用无菌镊子将药敏纸片贴于培养基表面,28 ℃培养24 h后分别测量各种抗生素纸片抑菌圈的直径,根据产品说明书判别结果.
1.2.3.5 组织病理观察 迅速解剖健康对照组、自然发病组和病原菌回归感染120 h后的马口鱼做组织病理切片,取其鳃、肝、脾、肾、肠、脑、心组织块,用体积分数4%的中性甲醛溶液固定24 h后,保存于4 ℃冰箱.按照常规方法制作石蜡切片,H-E染色,中性树胶封片,Olympus CX41型显微镜观察并照相.
2 结果与分析
2.1 病原菌的回归感染
从自然患病鱼脑部分离纯化获得1株细菌,命名为ObB210709B1,分别采用腹腔注射和肌肉注射的方法感染健康的鱼(表1、表2).两种回归方法中高浓度组死亡均集中在前3 d,低浓度组死亡集中在4~7 d,所有试验组的鱼最终均死亡,表明这株菌的毒力很强;回归鱼均能表现出鳍条根部、头部、口腔黏膜出血,脾脏肿大,血样腹水等自然发病症状;回归鱼无眼睛凸起、打转的症状,但该症状在自然发病中也只有个别鱼存在.综上可知,该菌为马口鱼的致病菌.
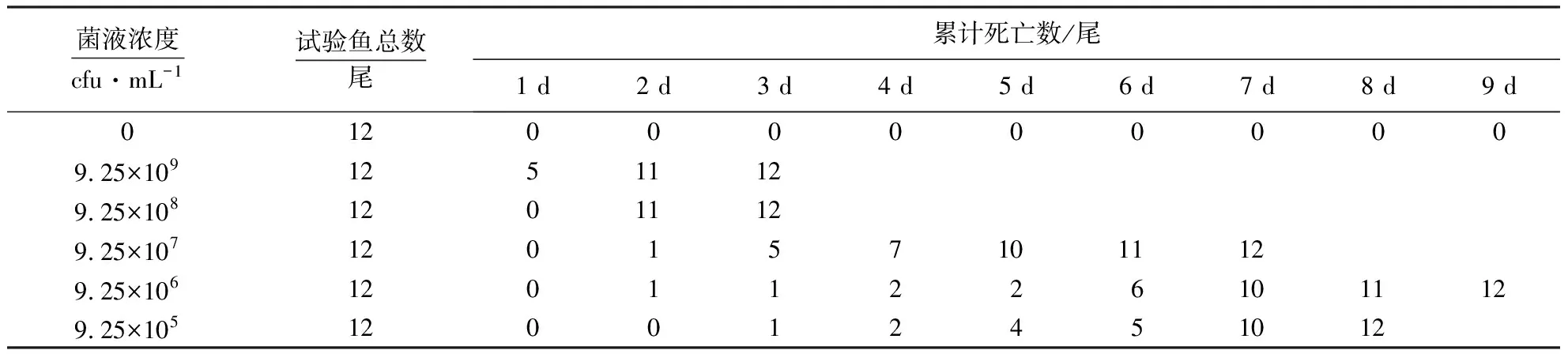
表1 ObB210709B1腹腔注射回归感染试验

表2 ObB210709B1肌肉注射回归感染试验
2.2 细菌的形态学特征
分离菌最适培养基为脑心浸液培养基,但在脑心浸液琼脂平板上生长速度仍然较慢,菌落小,28 ℃条件下生长4 d直径为2~4 mm,菌落形态相似,圆形,黄白色半透明,表面光滑湿润,边缘整齐(图1A).菌体革兰氏染色阴性,两端钝圆,短杆状,菌体大小(0.5~1.0)μm×(1.0~3.0)μm,无芽胞(图1B).

A:菌落;B:革兰氏染色
2.3 生化鉴定
通过细菌微量生化管对ObB210709B1进行生化鉴定(表3).分离菌生化活性较弱,只能利用葡萄糖、麦芽糖、果糖,不能分解其他糖类,且其他生化试验结果也多为阴性,参考《伯杰氏系统细菌学手册》[12],发现分离菌的生化特性与鮰爱德华氏菌最相似,初步确定该菌为鮰爱德华氏菌.

表3 分离菌株ObB210709B1生理生化特征1)
2.4 16S rDNA序列分析
PCR扩增ObB210709B1菌株的16S rDNA基因并测序,获得序列采用MEGA软件构建系统进化树.PCR扩增产物约为1 500 bp的特异性条带,经测序获得基因片段序列,与GenBank中已有的核酸序列进行BLAST分析,结果表明,该序列与EdwardsiellaictaluriMs12(GeneBank登录号KC112992.1)的16S rDNA基因序列同源性为99.50%.系统进化树分析表明,分离菌株与鮰爱德华氏菌属同一分支(图2).结合形态学和生理生化特征,将所分离菌株鉴定为鮰爱德华氏菌.

图2 菌株ObB210709B1的系统进化树
2.5 药物敏感性
菌株ObB210709B1对24种药物的敏感性试验(表4)结果表明:该菌株对参与试验的氨基糖苷类药物、喹诺酮类药物、四环素类药物、氯霉素药物、多粘菌素类药物及β-内酰胺类的氨苄西林、羧苄西林、阿莫西林均高度敏感;对β-内酰胺类的青霉素、苯唑西林,大环内脂类的红霉素,糖肽类的万古霉素,磺胺类的复方新诺明均耐受.综上可知,该菌的耐药性低,临床治疗药物的选择种类较多.

表4 菌株ObB210709B1的药物敏感性1)
2.6 组织病理
2.6.1 临床症状 患病马口鱼鱼体充血、出血,腹部膨胀,鳍条根部出血严重,肛门红肿,腹部及尾部坏死形成溃烂(图3A);眼球出血、突出(图3B);解剖腹腔内充满大量血腹水(图3C);肝脏血管扩张淤血,肿大,呈土黄色;脾脏肿胀,淤血呈暗红色(图4F).

A:鱼体状态;B:眼部;C:腹腔;D:肝脾部.“←”指病变位置.
2.6.2 病理变化 健康对照组的鳃、肝、脾、肾、肠、脑、心的组织切片见图4a1-4a7.自然发病组和病原菌回归感染120 h后组织病理学变化主要表现为鳃增生粘连,最后鳃丝崩解(图4b1、图4c1);肝细胞细胞核消失,空泡变性严重,灶性坏死,淋巴细胞、巨噬细胞浸润(图4b2、图4c2);脾淋巴细胞减少,灶性坏死,脾血窦淤血(图4b3、图4c3);肾小球血管内皮细胞肿胀,肾小囊内大量蛋白渗出染成红色,肾小球上皮细胞变性、坏死(图4b4、图4c4);肠道黏膜上皮坏死,脱落,固有膜内大量炎症细胞浸润,有大量细菌团块(图4b5、图4c5);脑外膜脱落,出血、炎性细胞浸润(图4b6、图4c6);肌间隙增宽、水肿,心肌纤维变性、坏死,有细菌团块(图4b7、图4c7).感染组的组织病变情况要比自然发病组严重.

a(对照组):a1:鳃;a2:肝;a3:脾;a4:肾;a5:肠;a6:脑;a7:心肌;b(自然发病组):b1:鳃增生粘连;b2:肝细胞空泡变性,灶性坏死;b3:脾淋巴细胞减少,灶性坏死,脾血窦淤血;b4:肾小球血管内皮细胞肿胀,肾小管内大量蛋白渗出;b5:肠道黏膜上皮坏死,脱落,固有膜内有大量细菌团块;b6:脑出血,白细胞浸润;b7:心肌纤维间隙增宽、水肿;c(回归感染组):c1:鳃丝崩解;c2:肝细胞细胞核消失,空泡变性严重,坏死,淋巴细胞、巨噬细胞浸润;c3:脾淋巴细胞减少,淤血;c4:肾小球血管内皮细胞肿胀、出血、坏死,肾小管上皮细胞破坏;c5:肠道黏膜上皮粘连,有大量细菌团块,固有膜内大量炎症细胞浸润;c6:脑外膜脱落,出血、炎性细胞浸润; c7:心肌纤维水肿、变性、坏死,肌间隙增宽,有细菌团块.“←”指病变位置.
3 讨论
爱德华氏菌是水产养殖中较常见的条件致病菌,由其所引起的鱼类疾病,通常称为鱼类的爱德华氏菌病.鱼类致病性爱德华氏菌共有3种,即迟钝爱德华氏菌(Edwardsiellatarda)、鮰爱德华氏菌和保科爱德华氏菌(E.hoshinae),其中,前两种在鱼类病害中最常见[12].鮰爱德华氏菌通常感染鲶形目的一些鱼类,例如,斑点叉尾鮰(Parasilirusasotus)[13]、黄颡鱼(yellow catfish)[14]、白鲶鱼(white catfish)[15]、蟾胡子鲶(walking catfish)[16]、鲑鳟(Oncorhynchusmykiss)[17]、云斑鮰(brown bullhead)[18]等.其中,E.ictaluri最易感染斑点叉尾鮰并形成斑点叉尾鮰肠型败血症,具有感染速度快、发病率和死亡率高等特点,对斑点叉尾鮰的养殖具有严重影响[19].此外,E.ictaluri也可感染非鲶形目的一些鱼类,如蓝色弓背鱼(green knife fish)、斑马鱼(bengal danio)、日本鳗鲡(Japanese eel)[20-21].此外,E.ictaluri也可引起大鲵发病[22].本试验从福建自然发病的马口鱼体内分离到E.ictaluri,并通过人工感染试验证实其是病原菌,E.ictaluri在自然状态下也能感染马口鱼致病,提示其感染宿主的范围进一步扩大,也为防控马口鱼养殖可能发生的疾病提供依据.进化树分析表明,该菌与其他来源的鮰爱德华氏菌有一定的遗传距离,可能由于感染不同宿主,即使是同一种病原菌,在感染力、毒力上也会存在差异,这种差异造成菌株之间的遗传距离.这种遗传距离的存在提示应该根据分离菌株的宿主、分离时间与区域等信息,继续进一步分析该菌种的种群进化关系,以揭示该菌种的分子流行病学特征.
本试验发现鮰爱德华氏菌感染马口鱼的组织病理损伤主要表现为肝空泡坏死,脾出血、坏死,肾小球出血与肾小管破裂,多组织器官均有细菌团块的聚集,肠道尤为严重,与吴中明等[22]的研究结果一致.鮰爱德华氏菌可在马口鱼体内多组织、多器官定殖,引起病理损伤,甚至导致死亡,该菌对机体的损伤与炎症反应,尤其是肝、脾、肾和肠的病理损伤最为严重.马口鱼在临床上出现明显的腹水与全身性出血等临床特征,肝、肾的结构损伤较严重,从而引起蛋白合成障碍、肾小球滤过性增强、肾小管重吸收能力降低等,导致血管内外液体交换及球-管失衡,钠、水在体内潴留出现水肿[23].
养殖鱼暴发疾病后应尽快进行药敏试验,选择合适的敏感药物进行治疗.此次分离的E.ictaluri对恩诺沙星、氟苯尼考等高度敏感,耐药程度较低.该菌株是第1次从养殖发病的马口鱼分离获得,且该养殖场养殖的马口鱼亲鱼均来源于野生捕捞并由养殖场人工繁育子一代或子二代,因此,推测该病原菌株的耐药性较低,可能是因为菌株还未受到疾病治疗过程中相关药物的影响,仍未形成广泛耐药性.药敏试验结果与国内外相关研究结果[24-27]基本一致,为临床治疗中提供可参考使用药物.E.ictaluri对磺胺类药物复方新诺明表现强耐药,提示需科学合理使用抗生素药物,避免单一、超剂量和长期用药而导致耐药性.此外,中草药是一种天然环保的药物,具有安全、有效、残留少、价格低廉等优点,已有研究表明,连翘、大黄、蒲公英、金银花、黄柏等中草药制剂对E.ictaluri均有抑菌作用,抑菌圈平均直径大于20 mm[28],也为鮰爱德华氏菌病的防治提供了一种途径.
