氟氯氰菊酯通过cGAS-STING 信号通路诱导肺损伤
2023-05-10宋亚男倪文思朱玲勤孙祎平杨惠芳
宋亚男,倪文思,朱玲勤,王 瑞,孙祎平,杨惠芳
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏医科大学环境因素与慢性病控制重点实验室,银川 750004)
拟除虫菊酯杀虫剂在全世界范围内普遍用于虫害控制,包括农业、林业甚至家庭,且使用量逐年增加[1]。氟氯氰菊酯是最重要的第二类拟除虫菊酯[2]。氟氯氰菊酯可在动物的大脑、肝脏和其他组织中蓄积,从而对机体造成损伤[2-7]。还有研究[3,8]表明,氯氰菊酯可通过损伤肺泡上皮细胞和血管内皮细胞,引起肺水肿、肺泡炎、肺纤维化等肺损伤,但其具体机制尚不明确。
肺损伤通常与氧化应激有关,而氧化应激又会导致线粒体损伤[9]。环状GMP-AMP 合成酶(cGAS)-干扰素刺激基因(STING)信号通路的激活在肺炎的发生发展中起着重要作用[10]。线粒体损伤可激活cGAS-STING 通路,从而激活核因子κB(NFκB)释放促炎因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等,导致炎性反应,进而引起肺损伤[11-12]。TNF-α 和IL-6 作为重要的促炎因子,过表达可引起肺水肿、充血、纤维化等肺损伤[13-16]。因此,本研究通过建立氟氯氰菊酯致大鼠肺损伤的动物模型,探究氧化应激及cGAS-STING 炎症通路在氟氯氰菊酯致大鼠肺损伤中的作用机制。
1 材料与方法
1.1 实验试剂
氟氯氰菊酯(德国Dr.Ehrenstorfer 公司);金龙鱼牌玉米油;丙二醛(MDA)试剂盒(北京索莱宝科技有限公司);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);BCA 蛋白检测试剂盒(江苏凯基公司);全蛋白提取试剂盒(上海碧云天公司);PAGE 凝胶快速制备试剂盒(上海雅酶生物公司);GAPDH、STING 一抗(美国Abcam 公司);ALDH2 一抗(美国Abbkine 公司);cGAS 一抗(美国ABclonal 公司);NFκB 一抗、p-NFκB 一抗、IL-6 一抗、TNF-α 一抗、Goat Anti-Rabbit IgG(中国Affinity 公司);蛋白Marker(美国Thermo Fisher 公司);FastKing 一步法除基因组cDNA 第一链合成预混试剂(北京天根生化科技公司);探针法定量PCR 预混液(美国Promega 公司);TRIzol(美国Invitrogen 公司)。
1.2 实验动物与分组
成年SD 大鼠40 只,雌雄各半,体质量360~550 g,购自宁夏医科大学实验动物中心。大鼠适应性饲养1 周,给予充足的水和食物,在特定的无病原体环境中饲养[12 h 光照/12 h 黑暗;温度(25±2)℃;湿度(55±5)%]。将大鼠随机分为4组,每组10 只,即对照组(玉米油等比例灌胃组)、低剂量组(6.3 mg·kg-1灌胃氟氯氰菊酯)、中剂量组(12.7 mg·kg-1灌胃氟氯氰菊酯)、高剂量组(25.3 mg·kg-1灌胃氟氯氰菊酯)。连续染毒4 周。本研究项目获得宁夏医科大学伦理委员会批准(IACUC-NYLAC-2021-101)。
1.3 检测方法
1.3.1 HE 染色 处死大鼠后冰排上取全肺,4%PFA 固定后肺脱水,石蜡包埋,并制备4 μm 厚的切片,用苏木精和伊红(HE)染色。包埋、切片、染色后,在显微镜下(20 ×)观察肺组织病理结构变化。
1.3.2 透射电子显微镜 取1 m3新鲜右上肺组织,立即加入4%的丙二醛进行第一次固定。其他处理步骤包括1%渗透酸二次固定,梯度脱水,环氧树脂包埋,超薄切片,醋酸铀酰和柠檬酸铅双染色,最后用H-7650 透射电镜观察。
1.3.3 MDA 检测 称取100 mg 组织,加入1 mL提取液进行冰浴匀浆;8 000×g 4 ℃离心10 min,取上清,置于冰上待测。按照该试剂盒说明加样,分别测定各样在532 nm 和600 nm 处的吸光度值,按照公式MDA 含量(nmol·g-1)=537.63×(ΔA532-ΔA600)计算,以上实验均重复至少3 次。
1.3.4 SOD 检测 准确称取0.1 g 组织于EP 管中,并加入0.9 mL 生理盐水,剪碎组织,冰浴制备匀浆,3 000 r·min-1,离心10 min,取上清即10%匀浆上清液待测。用BCA 试剂盒测定蛋白浓度。根据SOD 试剂盒说明进行操作,测定各个样本在450 nm 处的OD 值。SOD 抑制率=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%,SOD 活力(U·mg prot-1)=SOD 抑制率(%)×24/待测样本蛋白浓度(mg prot·mL-1),以上实验均重复至少3 次。
1.3.5 qPCR 检测 取出冷冻肺组织置于冰上,根据TRIzol 法提取总RNA,逆转录合成cDNA。扩增条件为:95 ℃预变性2 min、95 °C 变性3 s、60 ℃退火30 s、60 ℃延长30 s,45 个循环。反应结束后,根据扩增曲线数据,每个样品重复实验3 次。分析扩增曲线后,用2-ΔΔCt对qPCR 结果进行定量分析。美国国家生物技术信息中心(NCBI)设计的引物序列如表1 所示。引物序列由上海生工生物技术公司合成。

表1 用于qPCR 基因表达分析的引物
1.3.6 Western blot 检测 根据蛋白提取试剂盒提取各组大鼠肺组织全蛋白,并采用BCA 法测定蛋白浓度,变性后上样进行SDS-PAGE 凝胶电泳,随后转膜,3%BSA 封闭1 h,一抗孵育过夜,1×TBST 漂洗3 次后,二抗室温孵育1 h,1×TBST漂洗3 次,按比例配制ECL 发光液对目的条带进行曝光,利用Image J 软件对条带的灰度值进行分析。
1.4 统计学方法
采用GraphPad Prism 8.0 软件进行数据分析,计量资料以均数±标准差()表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Bonferroni 多重比较检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 氟氯氰菊酯致大鼠肺损伤的一般指标
从染毒开始到染毒结束,高剂量组的体质量随着暴露时间的延长逐渐降低(图1A)。与对照组相比,高剂量组平均体质量低于对照组(P<0.05)(图1B)。与对照组相比,中、高剂量组肺脏器系数升高(P 均<0.01)(图1C)。

图1 氟氯氰菊酯暴露28 d 后体质量和肺脏器系数的改变情况
2.2 氟氯氰菊酯对大鼠肺病理改变的影响
HE 染色结果显示,对照组肺泡结构完整清晰,肺泡壁薄,肺泡间质未增宽充血,无炎性细胞浸润及出血。随着染毒剂量的增加,肺泡间质明显增宽,肺泡壁增厚,肺组织充血,出现泡沫细胞,纤维化程度增加。高剂量组血管壁明显增厚(图2A)。
透射电镜结果显示,对照组Ⅱ型肺泡上皮细胞结构完整,线粒体结构清晰,基底膜清晰,肺泡腔内未见巨噬细胞。随着剂量的增加,Ⅱ型肺泡上皮细胞线粒体嵴模糊,双层膜结构消失,特别是高剂量组(图2B)。随着染毒剂量的增加,基底膜逐渐模糊,高剂量组基底膜发生扩张(图2C)。中、高剂量组肺泡腔内均可见巨噬细胞,中剂量组巨噬细胞结构更为清晰(图2D)。高剂量组在一个血管腔中出现3 个内皮细胞,怀疑为内皮细胞增生(图2E)。
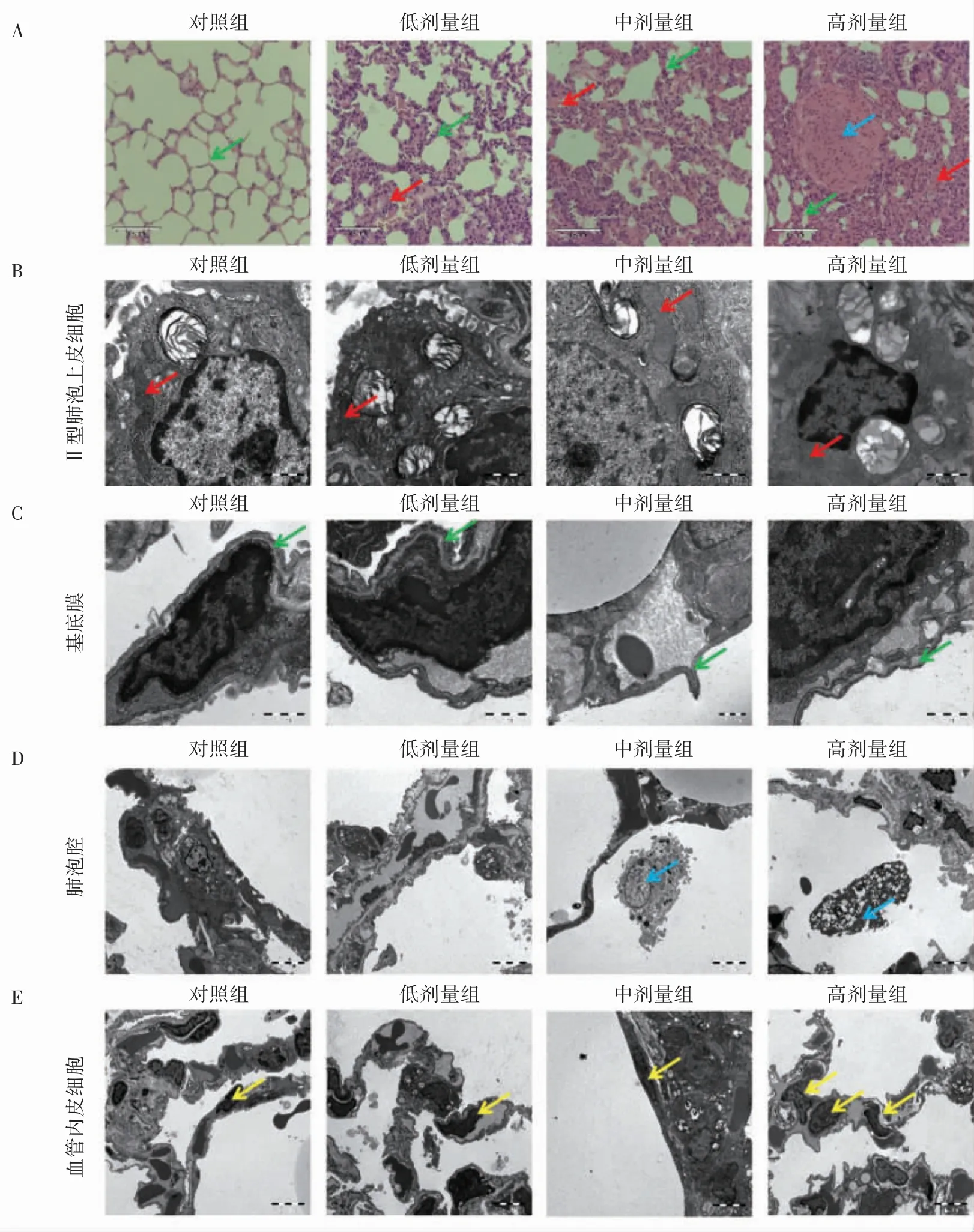
图2 氟氯氰菊酯致大鼠肺组织病理及超微结构变化图
2.3 氟氯氰菊酯致大鼠肺氧化应激相关指标检测
与对照组相比,MDA 含量随染毒剂量的增加而升高,说明肺组织内已发生氧化损伤,且低、中、高剂量组MDA 含量均高于对照组(P 均<0.01)(图3A)。与对照组相比,SOD 含量随染毒剂量的增加而降低,说明抗氧化能力减弱,且对照组SOD 含量均高于低、中、高剂量组(P 均<0.01)(图3B)。与对照组相比,ALDH2 蛋白和mRNA表达量均随染毒剂量的增加而降低,说明抗氧化能力减弱,且对照组与低、中、高剂量组差异均有统计学意义(P 均<0.01)(图3C~图3E)。氧化应激相关指标表明氟氯氰菊酯可引起肺氧化损伤,且损伤程度随着染毒剂量的增加而加重。
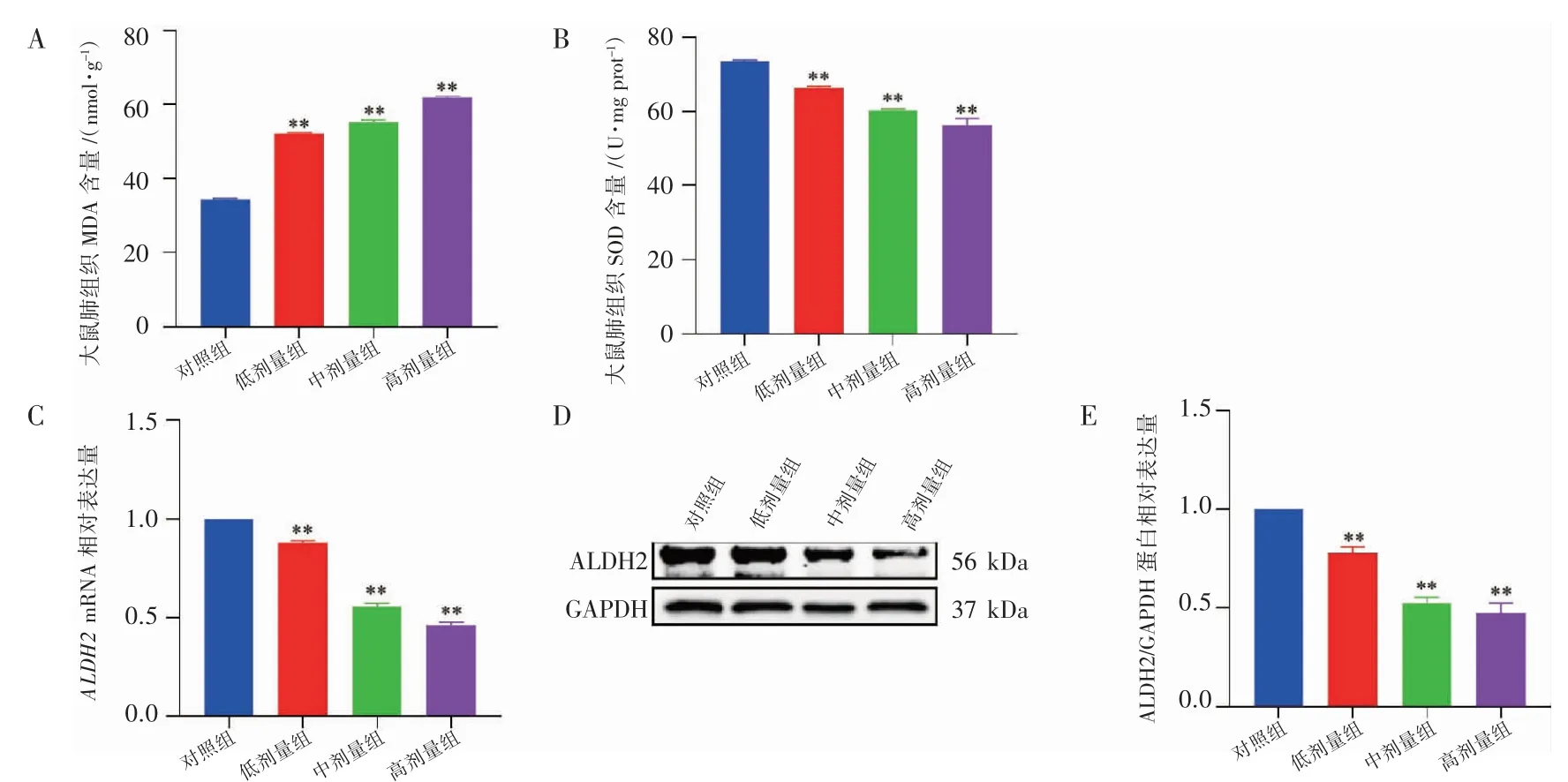
图3 氧化应激水平测定
2.4 氟氯氰菊酯诱导大鼠体内促炎因子的表达
与对照组相比,IL-6、TNF-α mRNA 和蛋白表达水平均随染毒剂量的增加逐渐升高,且对照组与低、中、高剂量组相比差异均有统计学意义(P 均<0.05),见图4A。
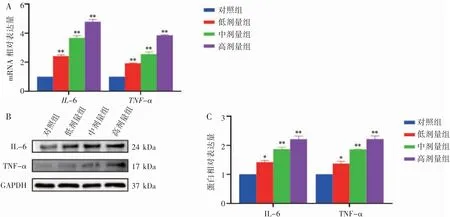
图4 Western blot 及RT-qPCR 检测氟氯氰菊酯诱导大鼠体内促炎因子的表达情况
2.5 氟氯氰菊酯诱导大鼠炎症通路相关因子的表达
与对照组相比,随着染毒剂量的增加,cGAS、NFκB 蛋白和mRNA 表达逐渐增加,且对照组与中、高剂量组相比差异均有统计学意义(P 均<0.05)。与对照组相比,STING 蛋白表达随着染毒剂量的增加而逐渐增加,且对照组与低、中、高剂量组相比差异均有统计学意义(P 均<0.05),见图5。
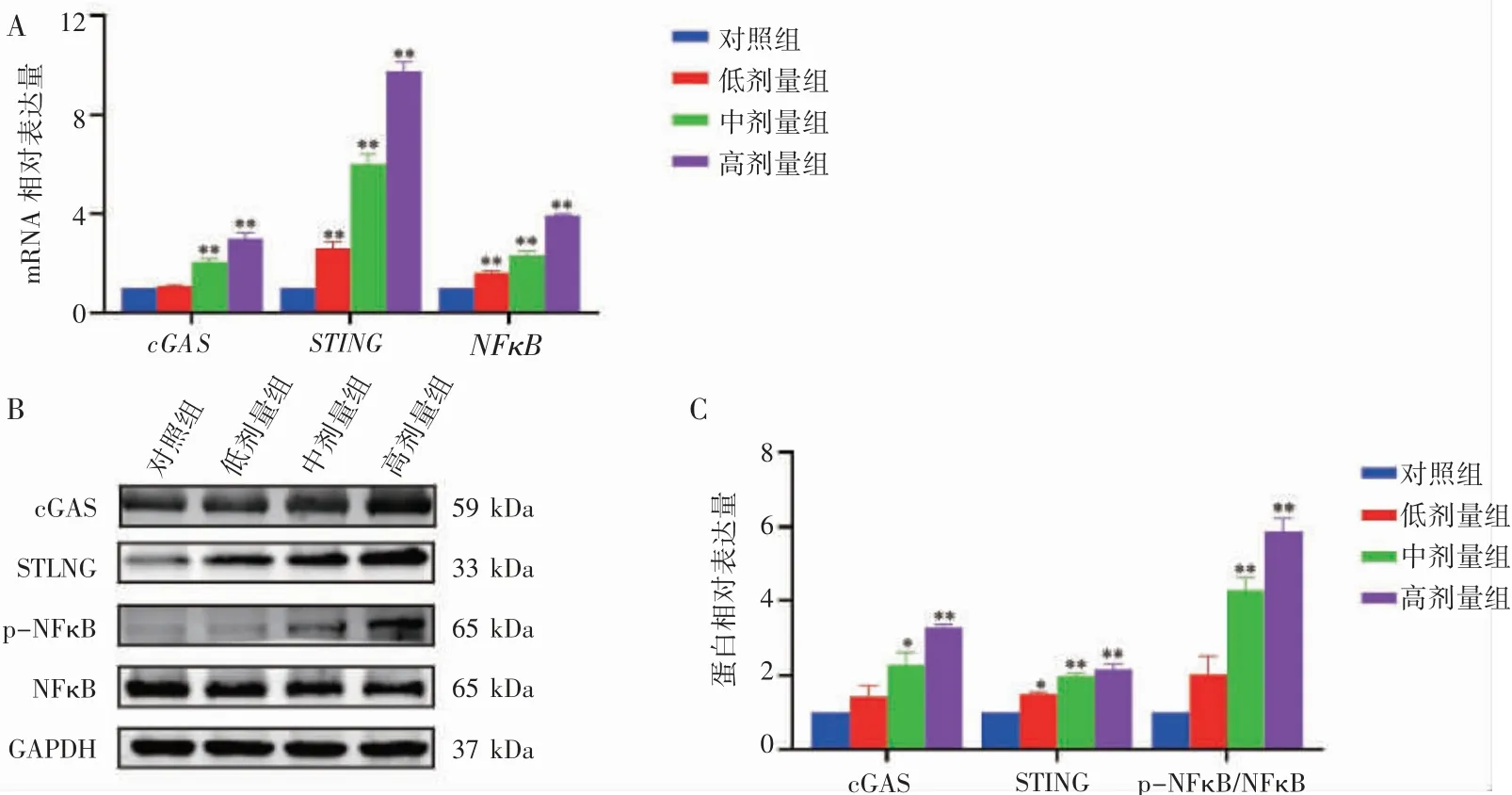
图5 Western blot 及RT-qPCR 检测氟氯氰菊酯诱导大鼠肺组织cGAS/STING 相关因子表达情况
3 讨论
近年来,随着拟除虫菊酯使用量的加剧,其对人体的潜在危害尤其是呼吸系统的损害逐渐引起关注[7]。本课题组前期研究[17]显示,银川市郊蔬菜大棚土壤样本中拟除虫菊酯类农药残留率最高的为氟氯氰菊酯。
通常肺损伤与氧化应激有关,拟除虫菊酯类农药可通过降低抗氧化能力和加重氧化损伤来提高活性氧水平,导致氧化应激。本研究检测了氧化应激的氧化和抗氧化相关标记物,即MDA和SOD 的含量以及ALDH2 的mRNA 和蛋白质表达量。其中MDA 含量因暴露于氟氯氰菊酯而升高,而SOD 含量和ALDH2 的mRNA 和蛋白质表达量则随暴露剂量的增加而降低,这与有关研究[15-16]结果一致。本研究设置了低、中、高剂量的剂量梯度,证明了氟氯氰菊酯暴露与氧化应激水平之间存在剂量依赖关系,即氟氯氰菊酯浓度增加,氧化应激水平随之升高。
长期氧化应激是线粒体功能障碍的主要原因,然而线粒体功能障碍会驱动炎症和免疫反应的损伤相关分子模式(DAMPs)[18-20]。一些DAMPs可以被细胞质cGAS 蛋白识别,激活STING 依赖性先天免疫通路[12]。STING 活化导致NFκB 的活化磷酸化,促进促炎细胞因子TNF-α 和IL-6 的表达[21]。本研究在透射电镜下观察到染毒组线粒体模糊、嵴消失,线粒体双分子层膜结构被破坏。此外,本研究的qPCR 结果显示,cGAS、STING、NFκB、IL-6、TNF-α mRNA 表达水 平均升高。Western blot 结果显示,cGAS、STING、p-NFκB、IL-6、TNF-α 蛋白表达水平均升高。mRNA 和蛋白表达量随染毒剂量的增加而增加。IL-6 和TNF-α 的过表达可导致肺纤维化[13],与电镜观察结果一致,且随着暴露剂量的增加,纤维化程度加重。特别是TNF-α 与肺水肿和肺充血相关,已被证实会损害肺内皮细胞和上皮细胞[14]。肺脏器系数是肺水肿的重要指标。本研究结果表明,高剂量组肺脏器系数增加。同时,电镜下染毒组表现为肺充血、血管壁增厚,气血屏障基底膜模糊、扩张,电镜下Ⅱ型肺泡上皮细胞损伤、内皮细胞增生。
综上所述,氟氯氰菊酯引起肺组织氧化应激,进而激活大鼠的cGAS-STING 通路诱导炎性反应,最终导致肺损伤。激活ALDH2 或抑制STING 活性可能是干预氟氯氰菊酯损伤的潜在靶点,在后续细胞模型研究中将继续对其进行深入分析。
