m6A 甲基化对邻苯二甲酸单(2-乙基己基)酯诱导小鼠睾丸间质细胞自噬的作用
2023-05-10马慧颖郭晓英德小明李丽萍闫凤梅
马慧颖,李 玲,2,3,郭晓英,德小明,2,3,李丽萍,2,3,郝 羽,闫凤梅
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.生育力保持教育部重点实验室,银川 750004)
邻苯二甲酸酯类化合物(phthalic acid esters,PAEs)作为增塑剂,常被用在儿童玩具、食品外包装和医疗器械等产品的生产过程中[1]。在对中国23 个城市水源中邻苯二甲酸酯类物质浓度进行检测时发现,邻苯二甲酸二(2-乙基己基)酯[di-(2-ethylhexyl)phthalate,DEHP]的检出率高达87.9%[2]。在生物体内,DEHP 经过一系列酶促反应形成活性代谢产物邻苯二甲酸单(2-乙基己基)酯(mono-2-ethylhexyl phthalate,MEHP),MEHP具有生殖和发育毒性等[3],其在生物组织中蓄积时间长达6 个月,因此MEHP 的毒性评估不容忽视[4]。在哺乳动物细胞中,自噬是一种非常保守的机制,自噬可介导受损的细胞成分向溶酶体传递以维持体内平衡[5]。本课题组前期研究发现,MEHP染毒能够诱导胞质内产生自噬体[6]。N6-甲基腺嘌呤(m6A)是真核细胞中最丰富的RNA 甲基化形式,研究[7]表明,m6A 甲基化在精子发生和胚胎发育中起到了重要的调控作用,m6A 去甲基化酶可影响小鼠睾丸精子的生成[8],m6A 甲基化酶缺失导致精子发生相关基因的改变,从而使精原细胞分化等功能无法正常进行[9]。本实验通过加入甲基化抑制剂3-脱氮腺苷(3-deoxyioden osine,DAA)观察m6A 甲基化在MEHP 致小鼠睾丸间质细胞自噬中的作用,为进一步研究m6A 甲基化在PAEs中致雄性生殖毒性的作用提供理论依据和研究基础。
1 材料与方法
1.1 细胞株、主要仪器与试剂
1.1.1 细胞株 小鼠睾丸间质细胞株(TM-3)(中国科学院细胞库)。
1.1.2 主要仪器 CO2培养箱、发光成像系统、超微量紫外分光光度计(美国Thermo Fisher Scientific 公司),净化工作台(苏州安泰空气技术有限公司),康宁细胞计数仪(上海康宁管理有限公司),细胞成像系统倒置生物显微镜(深圳爱可机械有限公司),高速冷冻离心机(上海力申科学仪器有限公司),多功能酶标仪(美国珀金埃尔默股份有限公司)。
1.1.3 试剂 MEHP、DMSO溶剂(美国Sigma 公司),DAA(美国Cayman Chemical 公司),DMEM、双抗、磷酸盐缓冲液(PBS)、胎牛血清(上海逍鹏生物科技有限公司),胰蛋白酶(北京索莱宝科技有限公司),CCK-8 细胞增殖检测试剂盒(上海贝博生物科技有限公司),总RNA 提取试剂盒(大连宝生物工程有限公司),m6A RNA 甲基化定量检测试剂盒(艾美捷科技有限公司),全蛋白提取试剂盒、BCA 蛋白检测试剂盒、自噬检测试剂盒、化学发光检测试剂盒(江苏凯基生物技术股份有限公司),LC3 和Beclin-1 抗体(Abcam 公司)。
1.2 TM-3 细胞培养、染毒液配制及分组
复苏TM-3 细胞,每瓶加入含有10%胎牛血清、1%双抗的DMEM 培养基至4 mL,放置于37 ℃、100%相对湿度、5%CO2的细胞培养箱中,培养24~48 h 至细胞铺满培养瓶底80%,传代2~3次,在生长至对数生长期时收集TM-3 细胞,进行后续相关实验。
MEHP 染毒液配制:称取100 mg MEHP 标准品,加入1 mL DMSO 将其稀释成浓度为359.27 mmol·L-1的MEHP 溶液,其中DMSO 终浓度为0.1%,分装储存于-20 ℃条件下,依照课题组前期实验剂量[6],加入无菌培养基,梯度稀释成对照组(0 μmol·L-1)、MEHP 低剂量组(200 μmol·L-1)、中剂量组(400 μmol·L-1)、高剂量组(800 μmol·L-1)的染毒液,现用现配。
DAA 组给予终浓度为40 μmol·L-1的DAA,DAA+MEHP 组给予40 μmol·L-1DAA+400 μmol·L-1MEHP。
1.3 CCK-8 法检测不同浓度甲基化抑制剂对细胞活力的影响
将TM-3 细胞制成单细胞悬液并进行计数,调整细胞浓度后将细胞接种到96 孔板中(每孔1×104个细胞),在37 ℃、5%CO2和100%相对湿度的CO2培养箱中培养6~8 h,待细胞贴壁后,加入浓度梯度为0(DAA 对照组)、5、10、20、40、80 μmol·L-1的DAA 继续培养24 h,避光加入适量的检测液,多功能酶标仪中37 ℃孵育0.5~1 h,检测其吸光度值,计算细胞活力[10]。
1.4 光学显微镜下观察TM-3 细胞形态、CCK-8法检测其存活率
将制成单细胞悬液的TM-3 细胞,按每孔2×105个细胞接种到6 孔板中,待细胞铺满孔底70%~80%,分别加入0、200、400、800 μmol·L-1的MEHP,40 μmol·L-1DAA 和40 μmol·L-1DAA+400 μmol·L-1MEHP 干预24 h,于光学显微镜下进行观察。加入CCK-8 检测液在450 nm波长处检测吸光度值,计算TM-3 细胞存活率。
1.5 提取TM-3 细胞总RNA 并检测不同组别染毒对m6A 甲基化水平的影响
将处于对数生长期的TM-3 细胞按每孔2×105个细胞接种到6 孔板中,待细胞铺满孔板底部70%~80%,每孔加入2 mL 不同组别的染毒液,继续培养24 h,按照总RNA 提取试剂盒说明书操作,提取TM-3 细胞的总RNA,随后准备相应数量的8 联管,使用高效RNA 结合液将TM-3细胞总RNA 结合到孔板上,利用捕捉和检测抗体在多功能酶标仪下检测450 nm 处的吸光值,并计算m6A 甲基化水平。m6A(%)=[(ODsample-ODNC)÷S]/[(ODPC-ODNC)÷P]×100%,其中S 为样本RNA 的质量,P 为阳性对照组RNA 的质量。
1.6 丹酰尸胺(MDC)染色检测自噬
将TM-3 细胞以每孔2×104个细胞的浓度接种到24 孔板中,待细胞铺满孔板底部80%左右,加入不同组别的染毒液放入培养箱中培养24 h。洗涤缓冲液洗2 次,每孔加入100 μL 配制好的MDC 染色液,避光在室温下孵育20~30 min,洗涤缓冲液洗3 次,荧光显微镜下观察,并对每个组别进行随机拍照,用Image J 软件分析各组的荧光信号强度。
1.7 Westernblot检测TM-3细胞相关蛋白表达情况
TM-3 细胞经过不同组别染毒24 h,加入蛋白裂解液超声裂解20 min,12 000 r·min-1离心5 min,收集上清为TM-3 细胞的全蛋白,用BCA试剂盒和多功能酶标仪检测蛋白浓度,配制合适的蛋白上样体系。根据蛋白分子质量进行配胶、电泳、转膜、脱脂奶粉封闭,1×PBST 清洗后,加入相应的一抗稀释液(LC3 为1∶2 000;Beclin-1 为1∶5 000)放在4 ℃冰箱孵育过夜,使用洗膜液清洗3 次,在室温下孵育二抗1~2 h,洗膜30 min后配制ECL 发光液对目的条带进行曝光。应用Image J 软件对目的蛋白进行灰度值分析。
1.8 统计学方法
采用GraphPad Prism 9 和SPSS 26.0 软件对实验数据进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 不同浓度甲基化抑制剂对TM-3 细胞活力的影响
随着DAA 浓度的增加,TM-3 细胞活力先增加后降低,当DAA 浓度为5、10、20、40 μmol·L-1时,细胞活性分别为(104.36±14.01)%、(101.26±11.04)%、(99.24±8.70)%、(97.43±7.49)%,与DAA 对照组相比均无明显变化(P>0.05);当DAA浓度为80 μmol·L-1时,细胞活性为(84.94±5.95)%,较DAA 对照组降低(P<0.01),见图1。
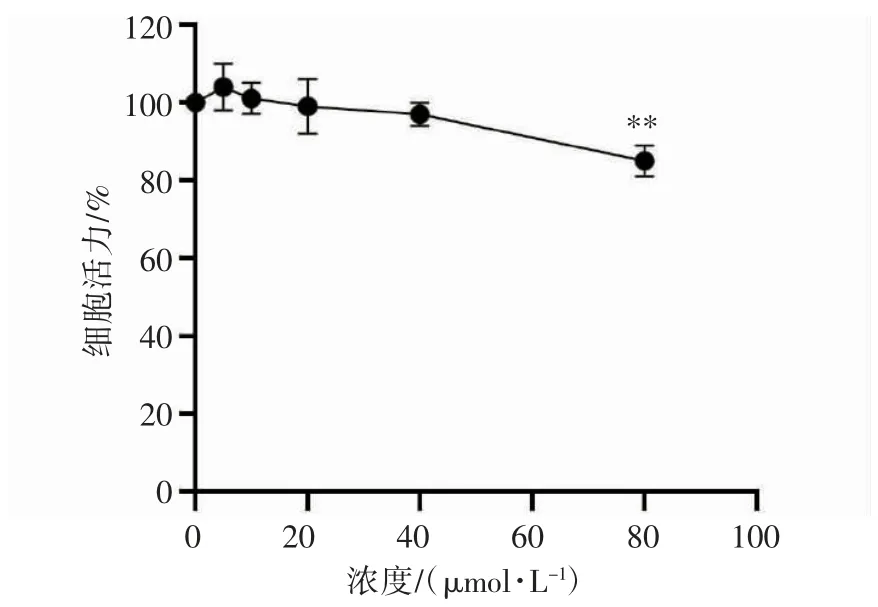
图1 不同浓度DAA 对TM-3 细胞活力的影响
2.2 不同染毒方式对TM-3 细胞形态的影响
MEHP 对照组TM-3 细胞大多为梭形和多边形,细胞间排列较密集,MEHP 染毒组随着剂量加大,各细胞间的空隙变大,圆形细胞变多,贴壁细胞的数量明显减少,DAA+MEHP 组与中剂量MEHP 组相比,细胞发生皱缩,细胞间隔稍有增大,见图2。
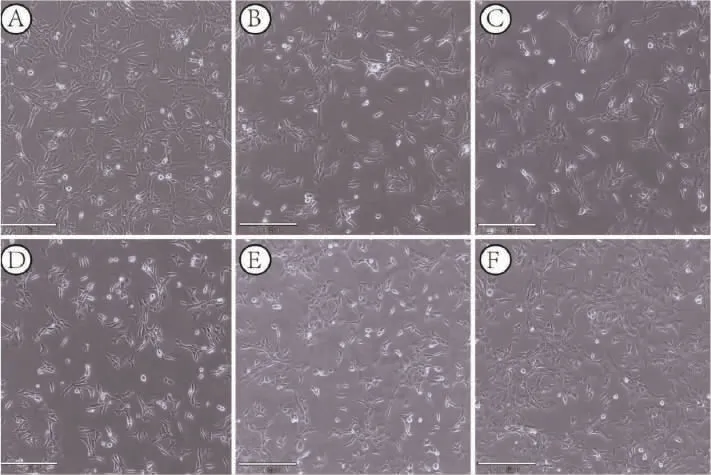
图2 不同组别对TM-3 细胞形态的影响(×100,标尺为270 μm 处)
2.3 不同组别染毒对TM-3 细胞活力的影响
不同组别染毒24 h 测定其吸光度值,结果显示,与MEHP 对照组相比,MEHP 低、中、高剂量组和DAA+MEHP 组TM-3 细胞活力均下降(P均<0.01),与MEHP 中剂量组相比,MEHP+DAA组细胞活力下降(P<0.01),见表1。
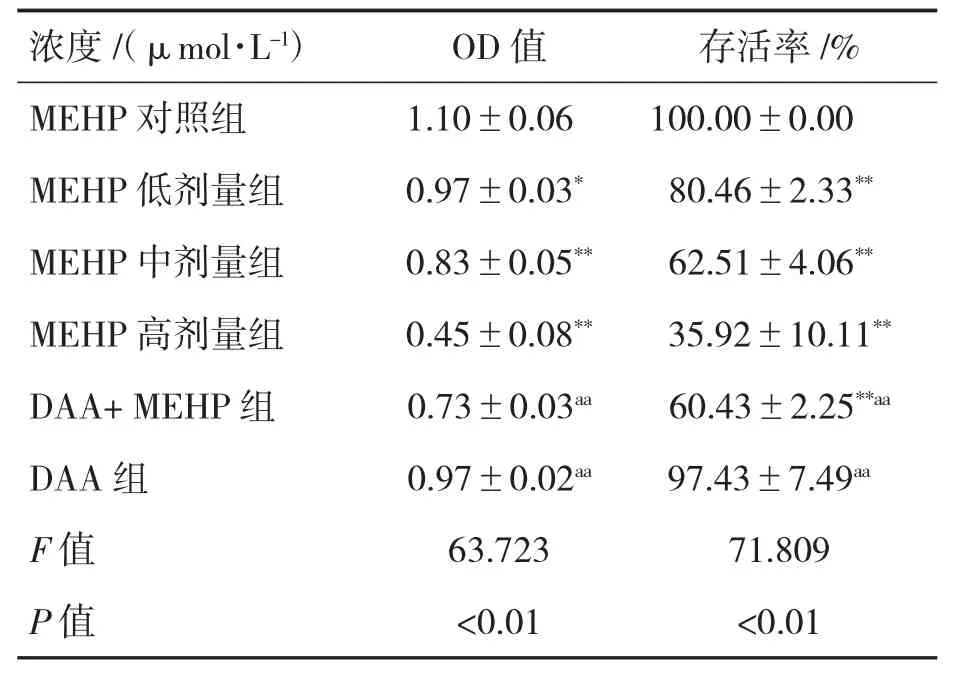
表1 不同组别染毒对TM-3 细胞活力的影响
2.4 不同浓度MEHP 对TM-3 细胞RNA 甲基化m6A 修饰的影响
TM-3 细胞经过不同浓度MEHP 处理24 h,MEHP 组对照,低、中、高剂量总体m6A 甲基化水平依次为(0.070 7±0.001 4)%、(0.055 3±0.000 5)%、(0.042 97±0.001 8)%和(0.039 5±0.001 0)%,与MEHP 对照组相比,各组m6A 修饰水平均降低(P 均<0.01),见图3。
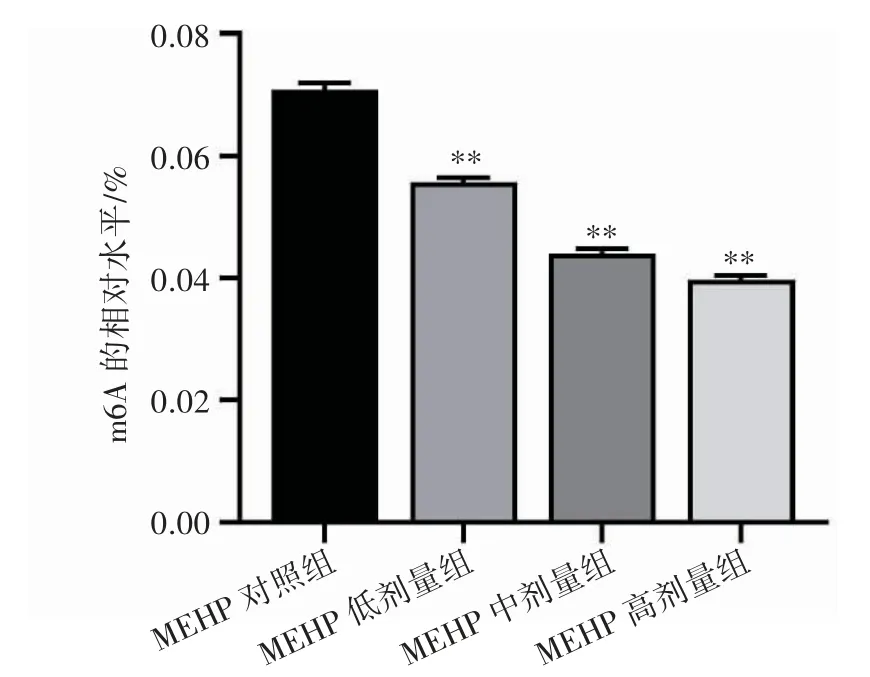
图3 不同浓度MEHP 对TM-3 细胞m6A 修饰水平的影响
2.5 甲基化抑制剂对TM-3 细胞RNA 甲基化m6A 修饰的影响
DAA 组m6A 修饰水平为(0.038 5±0.002 2)%,与MEHP 对照组相比下降(P<0.01);DAA+MEHP组m6A 修饰水平为(0.024 1±0.001 6)%,与MEHP中剂量组相比降低(P <0.01),如图4。由于40 μmol·L-1DAA 在明显降低TM-3 细胞的m6A修饰水平的同时对细胞损伤较小,因此后续DAA 的干预剂量为40 μmol·L-1。
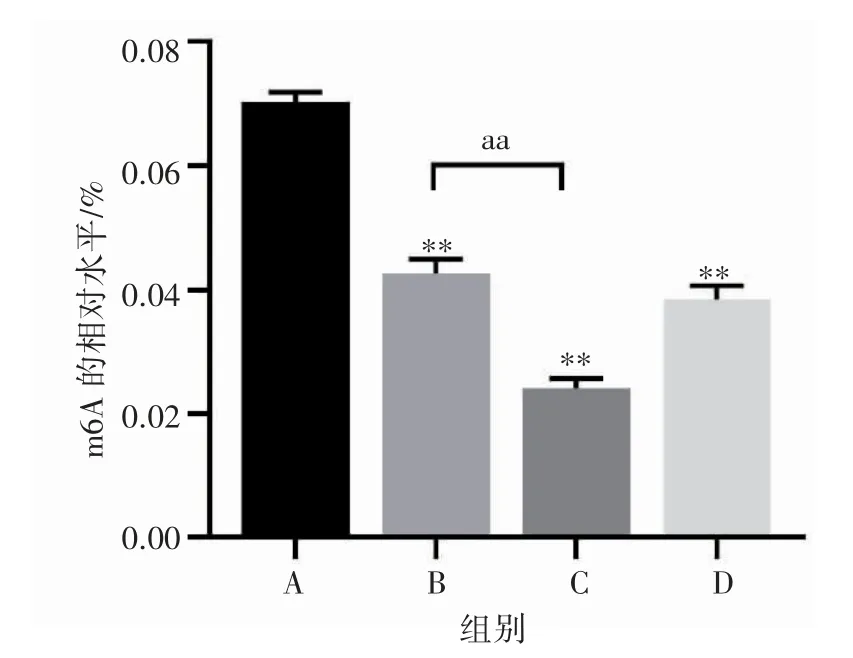
图4 甲基化抑制剂对TM-3 细胞m6A 修饰水平的影响
2.6 不同浓度MEHP 及甲基化抑制剂对TM-3细胞自噬发生的影响
MDC 荧光染色结果显示,与对照组相比,MEHP低剂量组荧光信号强度为(26.07±8.35),两者比较差异无统计学意义(P>0.05);MEHP 中、高剂量组和DAA 组荧光信号强度分别为(77.96±8.79)、(127.56±4.65)和(77.79±43.95),与对照组相比增强(P<0.01);DAA+MEHP 组荧光信号强度为(112.03±2.45),较MEHP 中剂量组增强(P<0.05),见图5。
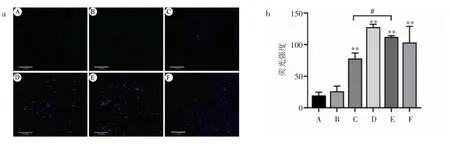
图5 不同处理条件下TM-3 细胞MDC 的荧光强度
2.7 不同浓度MEHP 对TM-3 细胞自噬相关蛋白表达量的影响
与对照组相比,MEHP 各染毒组LC3-Ⅱ的表达量均升高(P<0.05),伴随着染毒剂量增大,呈逐渐上升的趋势,MEHP 低剂量组LC3-Ⅱ/LC3-Ⅰ无明显改变(P>0.05),MEHP 中、高剂量组LC3-Ⅱ/ LC3-Ⅰ的比例升高(P<0.01)。MEHP低剂量组Beclin-1 的表达量与对照组相比差异无统计学意义(P>0.05),MEHP 中、高剂量组Beclin-1 的表达量较对照组升高(P<0.01),见图6。
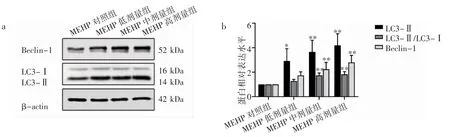
图6 不同浓度MEHP 对TM-3 细胞自噬相关蛋白表达量的影响
2.8 甲基化抑制剂对TM-3 细胞自噬相关蛋白表达情况的影响
不同处理条件Western blot 结果及定量分析结果显示,与对照组相比,DAA+MEHP 组和DAA组LC3-Ⅱ的表达水平均升高(P 均<0.01),DAA组LC3-Ⅱ/ LC3-Ⅰ无明显变化(P>0.05),DAA+MEHP 组LC3-Ⅱ/ LC3-Ⅰ升高(P<0.01)。DAA+MEHP 组和DAA 组Beclin-1 的表达水平较对照组均上升(P 均<0.01),见图7。
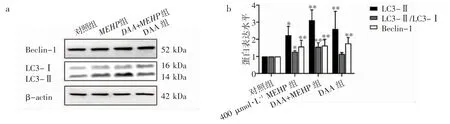
图7 甲基化抑制剂对TM-3 细胞自噬相关蛋白表达量的影响
3 讨论
表观遗传学在内分泌干扰物致人类健康损害中起着重要的作用[11],其中RNA 甲基化在转录后水平调节基因表达,其作用不容忽视。m6A修饰主要分布在3’非翻译区域、近终止密码子和长外显子区域[12],能够调控RNA 稳定性、选择性剪接、翻译及核转运等。相关研究[13]发现,机体暴露于环境污染物后,其DNA 甲基化水平、DNA羟甲基胞嘧啶、RNA 甲基化水平以及相关调节基因均发生改变。另有研究[14]表明,在睾丸间质干细胞分化的过程中观察到了METTL14 降低和ALKBH5 增加,导致睾丸间质细胞中m6A 甲基化水平降低,自噬增加。
自噬是一种将自噬体与溶酶体融合进行降解的分解、代谢过程,以满足细胞本身的代谢需要和某些细胞器的更新[15]。自噬相关基因,在调节自噬过程中发挥重要作用[16],其中LC3 包括LC3-Ⅰ和LC3-Ⅱ两种,两者之间可以互相转换,LC3-Ⅱ定位于自噬体膜,常用来判断细胞的自噬水平[17]。在哺乳动物中,Beclin-1 是酵母Atg6 的同源物,其促进形成自噬体膜从而对自噬进行调控[18]。本实验通过CCK-8 法检测不同组别染毒24 h 后TM-3 细胞的存活率,结果显示,随着染毒剂量的增加,TM-3 细胞存活率不断下降,DAA+MEHP组细胞存活率较MEHP 中剂量组降低。光学显微镜下观察细胞形态,结果显示,对照组TM-3 细胞大多为梭形和多边形,细胞间排列较紧密,随着MEHP 染毒剂量的加大,细胞间的空隙变大,圆形细胞变多,贴壁细胞的数量减少,DAA+MEHP组TM-3 细胞发生皱缩,细胞间隔较MEHP 中剂量组稍有增大。使用m6A RNA 甲基化定量检测试剂盒检测不同处理条件下TM-3 细胞m6A 修饰的水平,结果提示,随着MEHP 染毒剂量的增加,m6A 修饰水平降低,并且呈现出剂量依赖性趋势;DAA+MEHP 组m6A 修饰水平与MEHP 中剂量组相比降低;DAA 组m6A 修饰水平较对照组下降。既往研究[19]报道,RNA 甲基化的主要功能是促进mRNA 代谢以维持细胞自我更新,m6A水平降低与癌症进展和低存活率密切相关,这与本研究结果相互验证。MDC 是一种嗜酸性染色剂,通常用来检测自噬体形成,自噬小体可被染成蓝色[20]。本实验利用MDC 染色法在荧光显微镜下观察自噬小体形成,结果显示:对照组荧光信号强度最弱,说明正常的TM-3 细胞中只有极少数的自噬小体,MEHP 低剂量组与对照组相比,荧光信号强度无明显变化,而MEHP 中、高剂量组荧光信号强度明显增强;DAA+MEHP 组荧光信号强度较中剂量MEHP 组呈上升趋势;DAA 组荧光信号强度与对照组相比增强。本课题组前期研究[6,21]发现,一定剂量MEHP 染毒可通过PTEN/AKT 信号通路正向调节小鼠睾丸间质细胞自噬。Liu 等[22]研究发现,邻苯二甲酸单(2-乙基己基)酯依赖ROS 通过Akt1 途径诱导人血管内皮细胞自噬。另有研究[23]表明,MEHP 的原型DEHP 导致小鼠睾丸间质细胞自噬和凋亡,并且自噬在DEHP 诱导的细胞凋亡中发挥了重要的毒性作用。本研究也发现,MEHP 各剂量组LC3-Ⅱ的表达水平与对照组相比均升高;与对照组相比,MEHP 低剂量组LC3-Ⅱ/LC3-Ⅰ和Beclin-1 的表达水平无明显变化,而中、高剂量MEHP 组LC3-Ⅱ/LC3-Ⅰ和Beclin-1 的表达水平均升高。DAA+MEHP 组和DAA 组LC3-Ⅱ和Beclin-1 的表达水平均升高,DAA+MEHP 组LC3-Ⅱ/LC3-Ⅰ的比例也升高。说明一定浓度的MEHP 能引起TM-3 细胞中自噬小体的积累;DAA 作为甲基化抑制剂,能够降低整体m6A 修饰的水平,进而导致自噬小体的累积。Wang 等[24]研究发现,硫酸吲哚氧基通过调节RNA 中的肥胖相关蛋白(FTO)和m6A 甲基化来激活自噬通量,3-脱氮腺苷抑制m6A 甲基化后可以阻断硫酸吲哚氧基对细胞自噬激活的影响,上述发现与本研究结果相似。有研究显示,敲除m6A 去甲基化酶FTO 后,降低了Atg5 和Atg7 的表达水平,导致自噬体形成减少,最终自噬被抑制[25]。
综上所述,MEHP 可能通过降低RNA 甲基化m6A 修饰的水平来诱导TM-3 细胞发生自噬,这些发现揭示了m6A 甲基化在MEHP 致TM-3 细胞自噬中的重要作用,为邻苯二甲酸酯类与雄性生殖毒性的相关性研究提供研究基础,但关于PAEs 的雄性生殖毒性的作用机制还有待进一步探索与研究。
