氟氯氰菊酯通过GADD45B 介导JNK/p38MAPK通路对大鼠肾脏损伤的影响
2023-05-10孙祎平李晓玉谢永鑫宋亚男杨惠芳
孙祎平,李晓玉,谢永鑫,赵 吉,孙 健,王 瑞,宋亚男,杨惠芳
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏环境因素与慢性病控制重点实验室,银川 750004)
农药的广泛使用可以提高农作物的产量,但在环境中的农药残留会对人和动物的身体健康造成很大的影响。拟除虫菊酯因具有高效、易降解、低毒等特点,在全球范围内都有着广泛的应用[1]。课题组前期研究[2]发现,在银川市近郊蔬菜大棚内农药残留中,氟氯氰菊酯的残留量最多。氟氯氰菊酯作为重要的Ⅱ型拟除虫菊酯类农药,广泛应用于卫生害虫防治[3]。有研究[4]显示,拟除虫菊酯可引起肾脏形态结构异常改变、肾功能障碍,而氟氯氰菊酯对肾脏的毒性机制尚不清楚。生长停滞和DNA 损伤诱导β(growth arrest and DNA damage-inducible 45β,GADD45B)是一种应激蛋白,与细胞周期停滞、细胞凋亡和致癌应激的反应等密切相关[5]。抑制GADD45B 可以防止蛋白尿以及减轻足细胞的损伤,从而保护肾小球[6]。在肾脏损伤过程中,MAPK 作为一条关键的信号通路,其中的关键因子p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)明显上调[7]。GADD45B 介导JNK/p38MAPK通路在氟氯氰菊酯所致大鼠肾脏损伤中的关系尚不明确,因此,本研究旨在探讨在氟氯氰菊酯诱导大鼠肾脏损伤中MAPK 通路的作用,为进一步阐明毒性机制,建立早期预防策略提供理论依据和方法。
1 资料与方法
1.1 实验动物
选择40 只Wistar 雄性大鼠,SPF 级,体质量260~280 g,购自辽宁昌盛生物技术有限公司[动物合格证号:SCXK(Liao)2015-0001]。所有大鼠饲养于标准动物房,饲料喂养,自由饮水,饲养环境温度(22±2)℃,相对湿度60%~70%,保持12 h光照(8:30~20:30)和12 h 黑暗(20:30 至次日8:30)交替循环。大鼠适应性喂养1 周后,设置对照组(玉米油),氟氯氰菊酯低剂量组(6.25 mg·kg-1)、中剂量组(12.50 mg·kg-1)和剂量组(25.00 mg·kg-1),每组10 只。对大鼠进行隔天称重,根据前一天称取的体质量配制染毒药物。采用等浓度法进行灌胃染毒,对照组大鼠灌胃等量玉米油,隔天染毒,持续28 d,随后麻醉处死大鼠,在无菌条件下收集肾脏组织,各动物处理方法均严格遵守中华人民共和国实验动物操作的相关规定,本研究项目获得宁夏医科大学伦理委员会(IACUC-NYLAC-2021-101)批准。
1.2 主要试剂与仪器
氟氯氰菊酯(德国Dr.Ehrenstorfer 公司);丙二醛(malondialde hyde,MDA)试剂盒(北京索莱宝公司)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物工程研究所);BCA蛋白检测试剂盒(江苏凯基公司);全蛋白提取试剂盒、SDS-PAGE 凝胶配制试剂盒(上海碧云天公司);GAPDH、GADD45B、p-p38MAPK、p-JNK、p38MAPK、JNK 抗体(中国Affinity 公司)。蛋白Marker(美国Thermo Fisher 公司);Trizol(美国Invitrogen 公司);引物由上海生工公司合成。
1.3 观察指标
1.3.1 HE 染色 取出切割好的肾脏组织和对应的标签放入脱水箱,分别在75%、85%、90%和95%的乙醇梯度中脱水1 h,在无水乙醇Ⅰ和无水乙醇Ⅱ中分别脱水30 min,接着放置于二甲苯Ⅰ和二甲苯Ⅱ中分别脱水5 min。经过包埋、切片、染色,用显微镜(×40)观察肾脏组织的形态结构变化。
1.3.2 透射电镜 取3 mm×1 mm×1 mm 的新鲜肾脏组织,放入4 ℃固定液中2~4 h,然后放入1%渗透压0.1 mol·L-1磷酸盐缓冲液(pH 7.4)中固定2 h。经过50%→70%→80%→90%→95%→100%→100%乙醇→100%丙酮脱水,每次15 min;环氧树脂包埋样本;超薄切片机切60~80 nm 超薄切片;醋酸铀染色30 min,待切片室温干燥后,在透射电子显微镜下观察,采集图像分析。
1.3.3 MDA 检测 使用MDA 试剂盒检测其含量,取0.1 g 肾脏组织,加入1 mL 提取液进行冰浴匀浆;8 000×g 4 °C 离心10 min,取上清,置冰上待测。根据说明书将样本加入96 孔板中,测定各样本在532 nm 和600 nm 处的吸光度,计算MDA 含量,实验重复3 次。
1.3.4 SOD 检测 称取50 mg 组织,加入0.45 mL生理盐水,剪碎组织,冰水浴制备匀浆,3 000 r·min-1,离心10 min,取10%匀浆上清液冰上待测。样本准备好后用BCA 试剂盒测定蛋白浓度。根据说明书将样本加入96 孔板中,测定各样本在450 nm处的吸光度。SOD 抑制率(%)=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%,SOD活力(U·mg prot-1)=SOD 抑制率(%)/50%×12/待测样本蛋白浓度(mg prot·mL-1),实验重复3 次。
1.3.5 qPCR 检测 取出肾脏组织放置于冰上,使用Trizol 法提取总RNA,逆转录合成cDNA。引物序列见表1,扩增条件为:95 ℃预变性5 min,95 ℃变性10 s、60 ℃退火30 s、60 ℃延长30 s,45 个循环。根据扩增曲线数据,分析扩增曲线后计算2-ΔΔCt,分析相关因子的mRNA 表达水平,每个样品重复试验3 次。

表1 引物序列
1.3.6 Western blot 检测 取50 mg 肾脏组织,加入0.5 mL 的组织裂解液进行冰浴匀浆研磨,12 000 r·min-1,4 ℃离心10 min,提取肾脏组织全蛋白,采用BCA 法测定蛋白浓度,配制SDSPAGE 凝胶,80 V 稳定电压电泳后转模,3%BSA封闭1 h,于1∶1 000 稀释的一抗中4 ℃孵育过夜,经TBST 清洗3 次,10 min/次,再于1∶1 000稀释的二抗室温孵育1 h,用TBST 清洗3 次,10 min/次,使用ECL 发光液于避光条件下进行曝光。应用Image J 软件计算各条带的灰度值。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料以均数±标准差()表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Dunnett-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 氟氯氰菊酯对大鼠体质量的影响
经过氟氯氰菊酯染毒,各组大鼠体质量差异无统计学意义,染毒前与染毒14 d、28 d 相比,差异无统计学意义(P 均>0.05),见表2。
表2 氟氯氰菊酯对大鼠体质量的影响(,g)
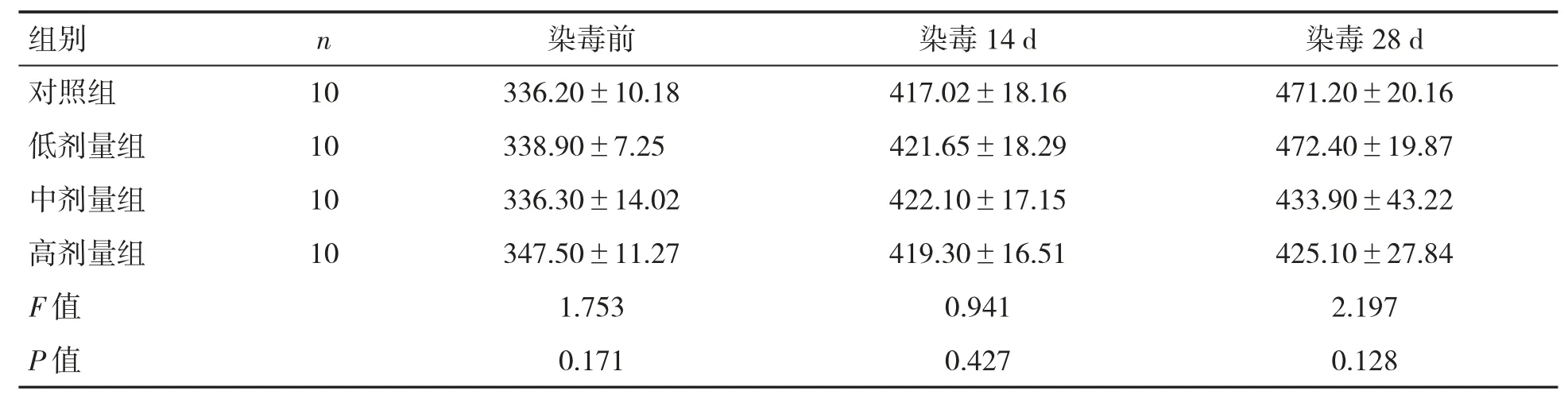
表2 氟氯氰菊酯对大鼠体质量的影响(,g)
2.2 氟氯氰菊酯对大鼠肾脏质量及脏器系数的影响
经过氟氯氰菊酯染毒各组大鼠肾脏质量和脏器系数差异均无统计学意义(P 均>0.05),见表3。
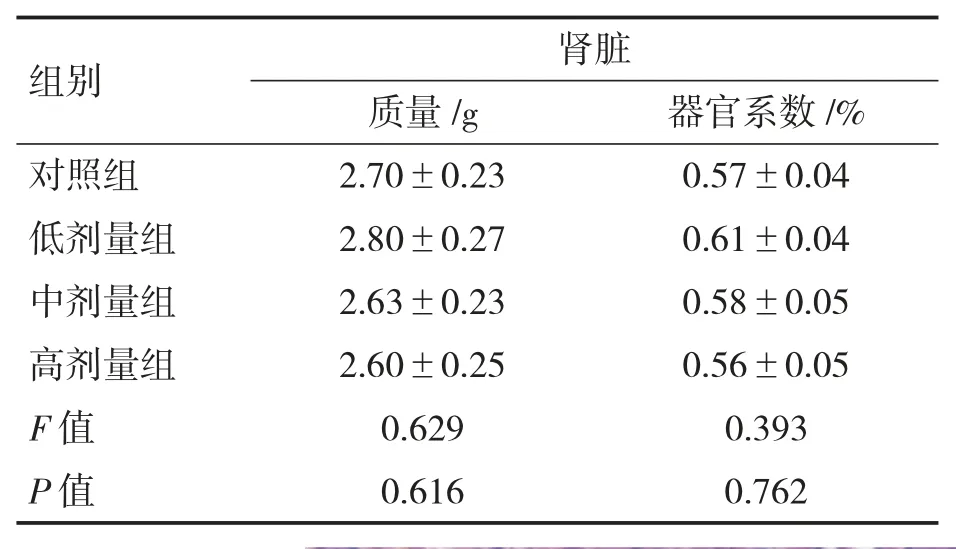
表3 氟氯氰菊酯对大鼠肾脏质量及器官系数的影响
2.3 氟氯氰菊酯染毒对大鼠肾脏组织结构的影响
2.3.1 光镜下HE 染色病理切片观察大鼠肾脏形态结构变化 对照组显示,肾小球和肾小管形态和结构清晰,未见明显异常,肾小球系膜细胞、内皮细胞等结构均正常,毛细血管腔未见异常扩张;氟氯氰菊酯染毒组显示肾小管水肿,肾小管上皮细胞脱落,肾小球萎缩,且随染毒剂量增加损伤越明显,见图1。
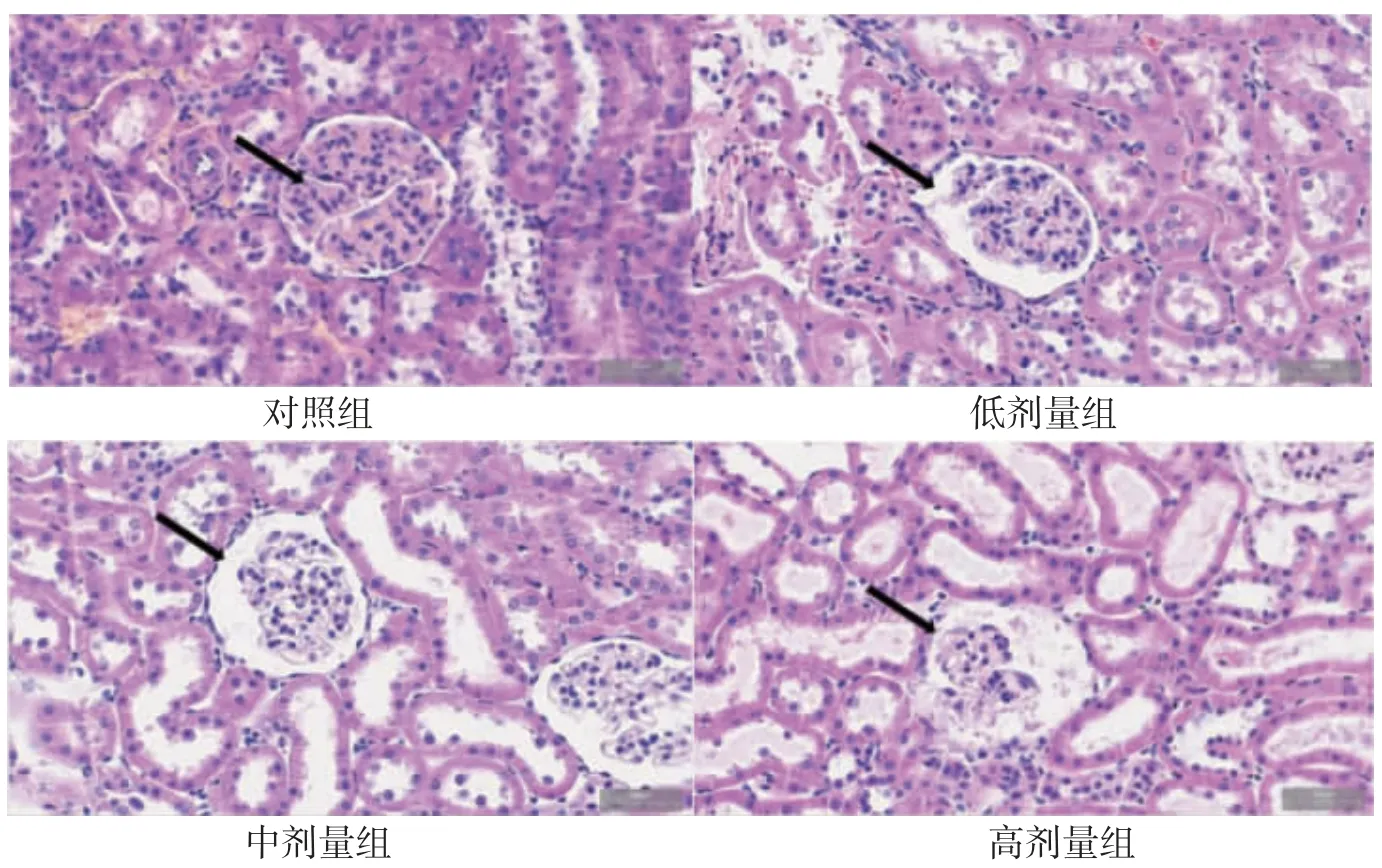
图1 各组大鼠肾脏形态病理切片(HE×40,↑:肾小球)
2.3.2 透射电镜观察大鼠肾脏超微结构变化 电镜下对照组可见肾小管上皮细胞排列规则,线粒体、内质网结构正常。氟氯氰菊酯染毒组显示肾脏小管细胞基底膜逐渐增厚,线粒体出现肿胀,在高剂量组中出现了空泡样病变,见图2。
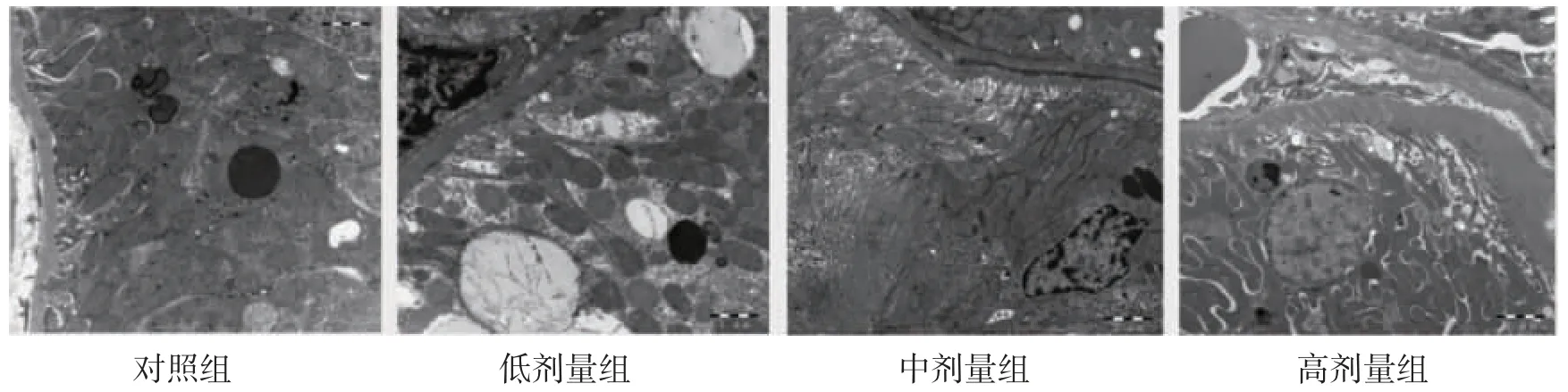
图2 透射电镜观察氟氯氰菊酯暴露对大鼠肾脏细胞影响(标尺=1 μm)
2.4 氟氯氰菊酯染毒对大鼠肾脏组织氧化应激指标SOD、MDA 水平的影响
与对照组相比,随着氟氯氰菊酯染毒剂量的升高,SOD 活力呈现降低趋势,MDA 含量呈现升高趋势(P 均<0.05),见图3。
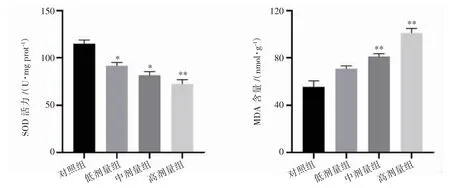
图3 氟氯氰菊酯染毒后大鼠肾脏中SOD 及MDA 的变化
2.5 氟氯氰菊酯染毒对大鼠肾脏组织中GADD45B、JNK 和p38MAPK、p-JNK 和p-p38MAPK表达的影响
qPCR 与Western blot 结果均显示,与对照组相比,中、高剂量组GADD45B 的mRNA 和蛋白表达水平均随染毒剂量的增高而上调(P 均<0.05),JNK 和p38MAPK 的蛋白和mRNA 表达水平均随染毒剂量的增高而下降(P 均<0.05),p-JNK 和pp38MAPK 的蛋白表达水平均随染毒剂量的增高而上调(P 均<0.05),见图4~图6。
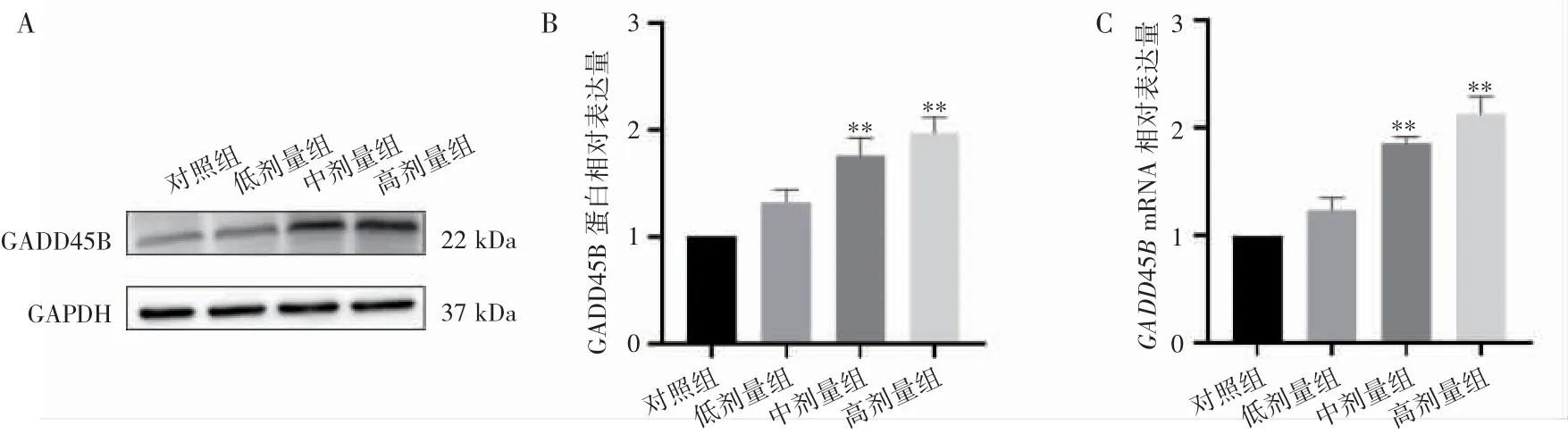
图4 氟氯氰菊酯染毒后大鼠肾脏中GADD45B 的表达变化
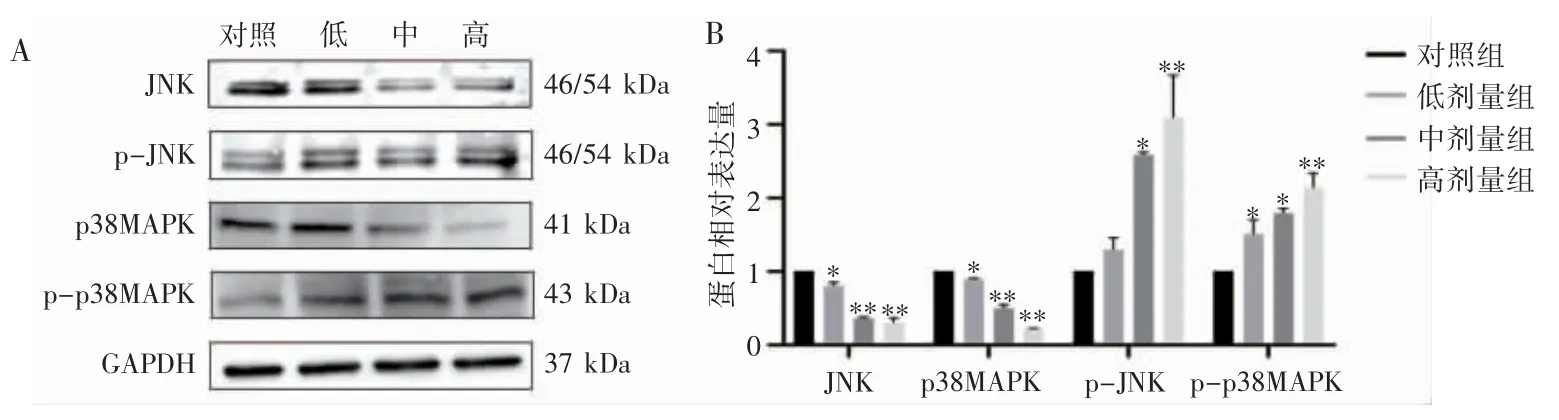
图5 氟氯氰菊酯染毒后大鼠肾脏中MAPK 通路相关因子的蛋白表达变化
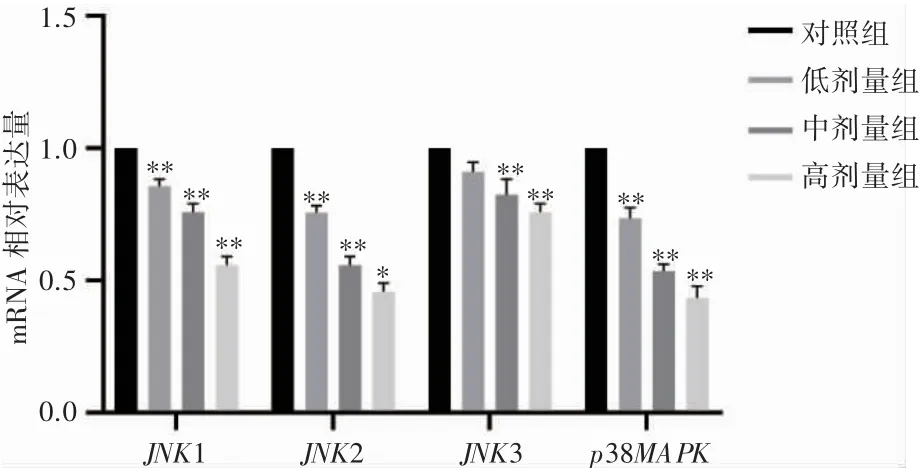
图6 氟氯氰菊酯染毒后大鼠肾脏中MAPK 通路相关因子的mRNA 表达变化
3 讨论
拟除虫菊酯对人类和哺乳动物具有不同程度的毒性,包括神经系统毒性、生殖毒性、肝脏毒性和肾脏毒性[8]。研究[9]显示,拟除虫菊酯的蓄积可通过多种机制导致肾脏损害,如氧化应激、细胞凋亡、炎症等。高效氯氟氰菊酯和溴氰菊酯对鹌鹑肾脏的损伤体现在肾小管和肾小球组织结构的破坏[10-11]。本研究通过HE 染色显微镜下观察发现,随着染毒剂量的增加,肾小管浑浊肿胀,肾小球萎缩,肾小管上皮细胞逐渐坏死脱落,伴有炎性细胞浸润,与Deng 等[12]的研究结果一致。研究[13]发现,溴氰菊酯可导致大鼠肾脏中核染色质浓缩,细胞核浓缩分裂,线粒体肿胀,嵴断裂或消失,说明氟氯氰菊酯可对大鼠肾脏超微结构造成损伤,与本实验结果一致。
研究[14]表明,拟除虫菊酯会打破体内氧化-抗氧化平衡状态,导致过量的ROS 产生,从而影响肾脏结构、代谢功能,进而对机体造成危害。ROS是导致肾脏损伤发生和发展的关键因素[15]。ROS可以使机体产生脂质过氧化反应,从而引发链式反应,最终将损伤放大。而MDA 作为脂质过氧化反应的标志性产物,能够间接地反映机体氧化损伤的程度[16]。SOD 是一种抗氧化酶,在体内能够清除氧自由基,促进氧自由基分解,使其处于生成与消除的平衡状态,降低自由基对细胞膜的损伤[17]。本研究显示,随着染毒剂量的增加,SOD 活力下降,MDA 含量增加,说明氟氯氰菊酯染毒使大鼠肾脏组织氧化应激水平增加,最终导致氧化损伤的发生。
GADD45B 是一种普遍表达的蛋白质,是GADD45 基因家族的成员,参与介导细胞周期停滞、DNA 损伤修复和细胞凋亡等[18]。在肾脏疾病中,GADD45B 可激活MAPK 通路导致疾病进一步发展,通过调控MAPK 级联反应,使p38MAPK 磷酸化从而诱导足细胞凋亡[19]。有报道[7]称,Heymann肾炎大鼠和足细胞特异性缺失小鼠中GADD45B表达上调,表明其参与对肾脏的损伤。有研究[20]观察到,斑马鱼肾小球足细胞损伤中,GADD45B过表达会促进足细胞的凋亡和蛋白尿,同时抑制GADD45B 的表达可以缓解足细胞损伤并减少蛋白尿,ROS 可介导GADD45B 的上调,同时GADD45B 过表达可激活p38MAPK 通路,使其诱导足细胞损伤。在本研究中,GADD45B、p-JNK、p-p38MAPK 表达水平均随染毒剂量的升高而升高,JNK、p38MAPK 表达水平均随染毒剂量的升高而降低,提示氟氯氰菊酯暴露可引起GADD45B表达异常,进而诱导JNK 和p38MAPK 信号通路的磷酸化导致肾脏损伤。
综上所述,氟氯氰菊酯具有一定的肾脏毒性,可使大鼠肾脏氧化应激水平增加,GADD45B可能通过调控JNK/p38MAPK 促使大鼠肾脏损伤,后续还将构建细胞模型进一步证明及研究。
