FGF21 过表达抑制胰腺癌细胞增殖、迁移和侵袭并促进细胞凋亡
2023-05-10马世玲黄李雅
马世玲,黄李雅
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院,银川 750004)
胰腺癌是一种致命的恶性肿瘤,主要起源于胰腺导管上皮,是导致癌症相关死亡的原因之一[1]。胰腺癌起病隐匿,约80%的患者在明确诊断时已经失去手术机会。晚期患者行化疗、放射治疗或其他综合治疗效果有限,即使近年来兴起的肿瘤免疫疗法,也因肿瘤细胞表面缺乏免疫原性及其独特的肿瘤微环境存在很大的挑战和窘境[2]。
成纤维细胞生长因子(fibroblase growth factors,FGFs)由23 个成员组成,人类FGF 信号转导涉及发育、肿瘤、代谢和神经疾病[3]。成纤维细胞生长因子21(FGF21)被认为是一种重要的内分泌代谢调节因子,主要在肝脏、胰腺和脂肪中表达,此外,在肾脏中也有所表达[4]。研究[5]表明,FGF21 在肿瘤发生发展中也具有潜在调节作用。目前,FGF21 在胰腺癌的发生和发展中的具体作用机制尚不清楚。为探究FGF21 对胰腺癌细胞表型的影响,本研究将FGF21 过表达技术应用于胰腺癌细胞PANC-1,观察FGF21 对胰腺癌细胞增殖、迁移、侵袭和细胞凋亡的影响,以阐释FGF21 抑制胰腺癌细胞发展机制,以期为胰腺癌寻找新的有效靶向治疗位点提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株及重组慢病毒载体 人胰腺癌细胞株PANC-1 购自中国科学院(上海)细胞库。在宁夏医科大学总医院干细胞实验室培养。含过表达FGF21 基因序列的重组慢病毒载体HBLVh-FGF21-3xflag-ZsGreen-PURO 及慢病毒空载体HBLV-ZsGreen-PURO 购自汉恒生物科技(上海)有限公司。
1.1.2 主要试剂 DMEM 高糖培养液和胎牛血清购自美国Gibco 公司;兔抗人FGF21 单克隆抗体、兔抗人Cleaved-caspase3 单克隆抗体、兔抗人Caspase3 单克隆抗体、兔抗人Caspase9 单克隆抗体均购自美国Abcam 公司;GAPDH、Tublin 购自美国Proteintech 公司;ECL 试剂盒购自江苏凯基生物技术有限公司;引物购自上海生工生物工程有限公司;RNA 反转录试剂盒、荧光定量PCR 试剂盒和CCK-8 试剂盒购自北京全式金生物技术有限公司;流式凋亡试剂盒购自上海伟进生物科技有限公司;吉西他滨购自上海源叶生物科技有限公司。
1.2 方法
1.2.1 细胞培养及重组慢病毒感染 人胰腺癌细胞株PANC-1 用含10%胎牛血清的DMEM 培养液,置于37 ℃、5%CO2的培养箱中进行培养。取对数生长期的PANC-1 细胞,以1.5×105个/孔接种于6 孔培养板中,细胞融合度达到70% 时,依据病毒的感染复数(multiplicity of infection,MOI)为5,分别加入重组慢病毒载体HBLV-h-FGF21-3xflag-ZsGreen-PURO 和空载体HBLV-ZsGreen-PURO 进行病毒感染。72 h 后用荧光显微镜(放大倍数为100)观察病毒感染效率,用含嘌呤霉素抗性的培养液筛选获得FGF21 过表达的稳定感染细胞株,命名为PANC-1/FGF21 OE 细胞(OE 组);感染空病毒载体HBLV-ZsGreen-PURO的PANC-1 细胞命名为PANC-1/FGF21 OC 细胞(OC 组)和空白细胞组。
1.2.2 Western blot 检测FGF21 过表达PANC-1细胞中FGF21 及凋亡相关蛋白的表达 分别收集病毒感染、培养72 h 后的空白细胞组、OC 组和OE 组细胞培养液,用冷丙酮沉淀,离心(14 000×g)10 min,PBS 重悬,Loading Buffer 加热(100 ℃)变性5 min。蛋白经还原SDS-PAGE 处理,转移至PVDF 膜上,用含5% 脱脂奶粉的封闭液室温封闭2 h;加入一抗(兔单克隆抗体FGF21 1∶1 000 稀释)4 ℃过夜;TBST 洗膜3 次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000),室温反应1 h;TBST 洗膜3次,每次15 min,用ECL 试剂盒曝光显影。以OE组与OC 组蛋白条带的灰度值之比,以及OE 组与空白细胞组蛋白条带的灰度值之比表示OE组蛋白的相对表达水平。
分别收集病毒感染72 h 后的OE 和OC 组以及空白细胞组细胞,用全蛋白提取试剂盒分别提取各组细胞的总蛋白,Loading Buffer 加热变性(5 min 100 ℃),取蛋白质20 μg/ 孔,经还原SDS-PAGE 处理,转移至PVDF 膜上,用含5%脱脂奶粉的封闭液室温封闭2 h;加入一抗(兔单克隆抗体Caspase3 1∶5 000 稀释;兔单克隆抗体Cleaved-caspase3 1∶1 000 稀释;兔单克隆抗体Caspase9 1∶1 000);GAPDH 1∶1 000 稀释;Tublin(1∶1 000)4 ℃过夜;TBST 洗膜3 次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000),室温反应1 h;TBST 洗膜3 次,每次15 min,用ECL 试剂盒曝光显影。以目的蛋白与内参蛋白条带的灰度值之比表示目的蛋白的相对表达水平。
1.2.3 RT-qPCR 检测FGF21 过表达PANC-1 细胞中FGF21、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的mRNA 表达 应用TRIzol 提取细胞总RNA 后,从总RNA 中反转录cDNA,利用PrimeScript RT Master Mix Perfect Real -Time 试剂盒从总RNA 中反转录cDNA。mRNA 表达用SYBRTMGreen PCR Master Mix 和7300 Real-Time PCR 系统,反应容积20 μL,热循环程序为:95 ℃1 min;95 ℃15 s,60 ℃30 s,72 ℃30 s 进行40个循环。定量mRNA 的相对表达量。获取Ct 值,以β-actin 作为内参对照,应用2-ΔΔCt值计算FGF21、TNF-α、IL-6 的mRNA 相对表达量[Ct=(过表达组样品的目的基因的Ct 平均值-内参基因的Ct 平均值)-(对照组样品的目的基因的Ct平均值-内参基因的Ct 平均值)]。PCR 引物由上海生物工程有限公司合成。
FGF21正义引物5’-GAAGCCGGGAGTTATTCA AATC-3’;
FGF21 反义引物5’-ACATTGTATCCGTCCTCAAGAA-3’;
TNF-α 正义引物5’-AGCCCTGGTATGAGCCCATCTATC-3’;
TNF-α 反义引物5’-TCCCAAAGTAGACCTGCCCAGAC-3’;
IL-6 正义引物5’-CACTGGTCTTTTGGAGTTTG AG-3’;
IL-6 反义引物5’-GGACTTTTGTACTCATCTGCAC-3’。
1.2.4 CCK-8 法检测转染后胰腺癌细胞株PANC-1 细胞增殖能力 各组细胞接种于96 孔板中(5×103个/孔),待细胞贴壁生长后,分别于0、24、48、72 h 加入10 μL CCK-8 溶液,37 ℃培养箱内孵育2 h,检测450 nm 波长处各孔的 光密度(OD)值。分别进行3 次独立实验,计算各组细胞增殖率(%)=(24、48、72 h 时增殖OD 值-0 h时增殖OD 值)/(0 h 时增殖OD 值)×100%。
1.2.5 划痕愈合实验和Transwell 小室实验检测FGF21 过表达PANC-1 细胞的迁移和侵袭能力 将各组PANC-1 细胞接种于6 孔板中(1.0×106个/孔),细胞生长至融合度近100%时,用无菌的200 μL 移液器枪头在细胞层均匀划线,低血清培养液继续培养。分别于划痕的0 h和48 h,光学显微镜(放大倍数为40)下拍照、测定划痕面积。划痕愈合率(%)=(0 h 划痕面积-48 h 划痕面积)/0 h 划痕面积×100%。
24 孔Transwell 小室(孔径为8 μm)的上室中铺入90 μL 基质胶(体积稀释比例为1∶2),37 ℃培养箱内过夜使之凝固。将各组PANC-1 细胞用无血清培养液重悬后,接种于上室中(1×105个/孔),下室中加入含20%胎牛血清的培养液;24 h 后取出上室,PBS 清洗2 次,用4% 多聚甲醛溶液固定细胞30 min,甲醇通透细胞20 min,结晶紫染色25 min,PBS 清洗后,用棉签擦拭各小室内没有迁移的细胞,光学显微镜下随机取3个视野(放大倍数为200),观察每个小室的穿膜细胞并计数。
1.2.6 流式细胞仪检测FGF21 对吉西他滨诱导胰腺癌细胞株PANC-1 凋亡的影响 各组细胞接种于12 孔板中(1×106个/孔),待细胞贴壁生长后分别给予空白细胞组、OC 组和OE 组最终浓度为80 μg·mL-1的吉西他滨,实验设置3 个平行对照组(空白组、PE 组、7 AAD 组),培养48 h 后,收集1×105个细胞,加入5 μL PE 和7 AAD避光染色15 min 后上流式细胞仪检测,分析凋亡率。
1.3 统计学方法
采用SPSS 20.0 统计学软件进行数据分析。所有实验均独立进行3 次重复,计量资料以均数±标准差()表示,组间比较采用t 检验或方差分析(ANOVA)。P≤0.05 为差异有统计学意义。
2 结果
2.1 FGF21 重组慢病毒成功感染人胰腺癌PANC-1 细胞
PANC-1 细胞经FGF21 重组慢病毒感染72 h后,重组病毒感染的OE 组和OC 组细胞中,80%以上可见绿色荧光蛋白表达。Western blot 检测慢病毒感染后PANC-1 细胞中FGF21 蛋白的表达水平结果显示,OE 组细胞中FGF21 蛋白表达水平高于OC 组细胞(P 均<0.05),见图1,提示重组慢病毒感染成功。
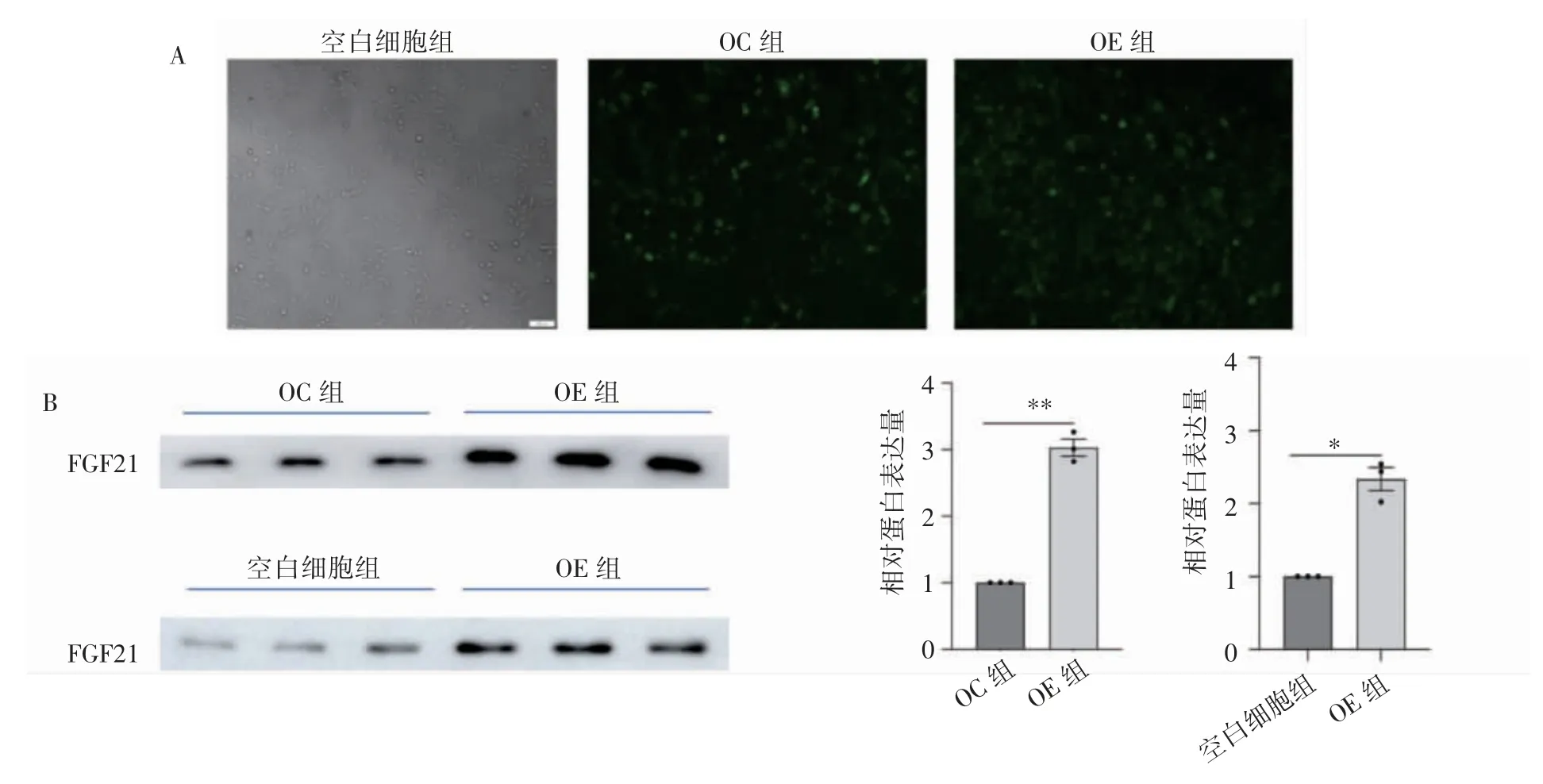
图1 FGF21 重组慢病毒感染人胰腺癌PANC-1 细胞情况
2.2 FGF21 过表达PANC-1 中FGF21、TNF-α、IL-6 的mRNA 表达情况
RT-qPCR 检测FGF21 重组慢病毒感染后PANC-1 细胞中FGF21、TNF-α 和IL-6 的mRNA 表达水平结果显示,OE 组细胞中FGF21 mRNA 表达水平高于OC 胞和空白细胞组细胞;TNFα 和IL-6 的mRNA 表达水平均低于OC 细胞组和空白细胞组(P 均<0.01),见图2。
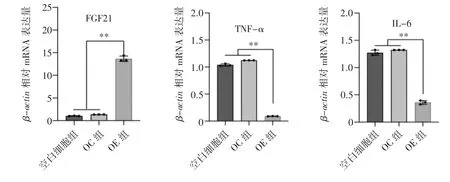
图2 RT-qPCR 检测FGF21 过表达PANC-1 细胞中FGF21、TNF-α 和IL-6 的mRNA 表达
2.3 FGF21 抑制PANC-1 细胞的增殖
空白细胞组、OC 组和OE 组的不同时间点(0 h,24 h,48 h 和72 h)CCK-8 测定结果显示,FGF21 过表达抑制了PANC-1 的增殖能力,培养24 h、48 h、72 h,各时间点OE 组细胞增殖均低于空白细胞组与OC 组(P 均<0.05),见图3。
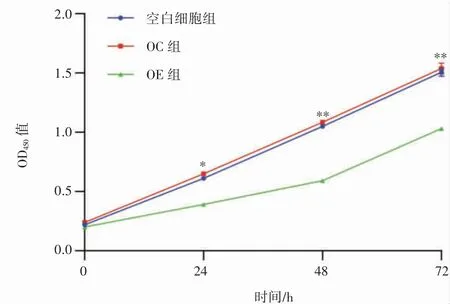
图3 CCK-8 试验检测FGF21 过表达对PANC-1 细胞增殖的影响
2.4 FGF21 抑制PANC-1 细胞的迁移和侵袭能力
细胞划痕愈合实验结果显示,FGF21 过表达抑制了PANC-1 的迁移能力,各组培养48 h,OE组愈合率低于空白细胞组与OC 组(P 均<0.01),见图4A。Transwell 小室实验结果显示,分别与空白细胞组和OC 组相比,OE 组侵袭细胞数目均减少(P 均<0.01),见图4B。
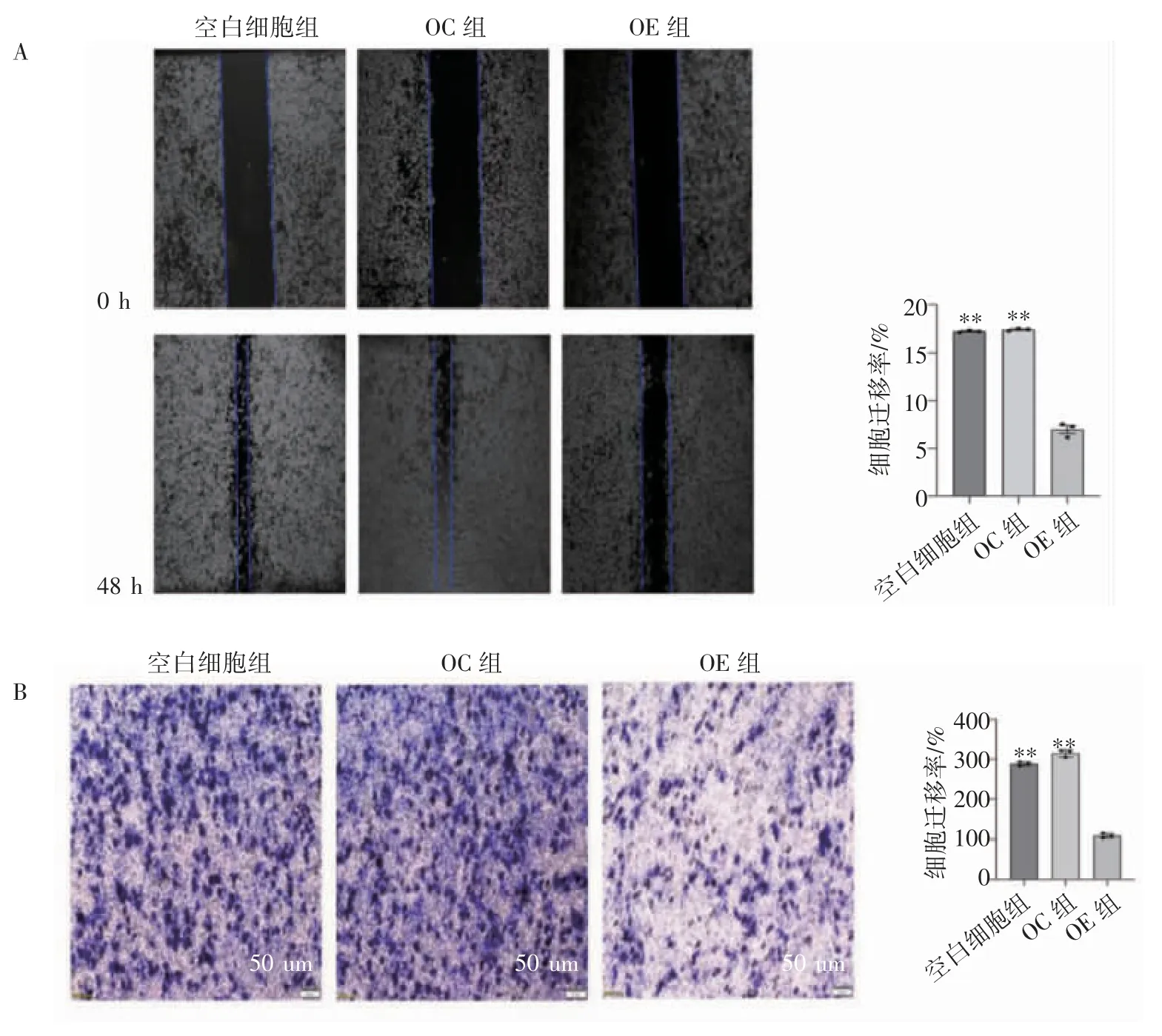
图4 FGF21 过表达对PANC-1 细胞迁移和侵袭的影响
2.5 FGF21 促进吉西他滨诱导的胰腺癌细胞株PANC-1 凋亡
流式细胞仪检测FGF21 对吉西他滨诱导PANC-1 细胞凋亡的影响结果显示,FGF21 过表达OE 组凋亡率均高于空白细胞组和OC 组(P均<0.01),见图5。
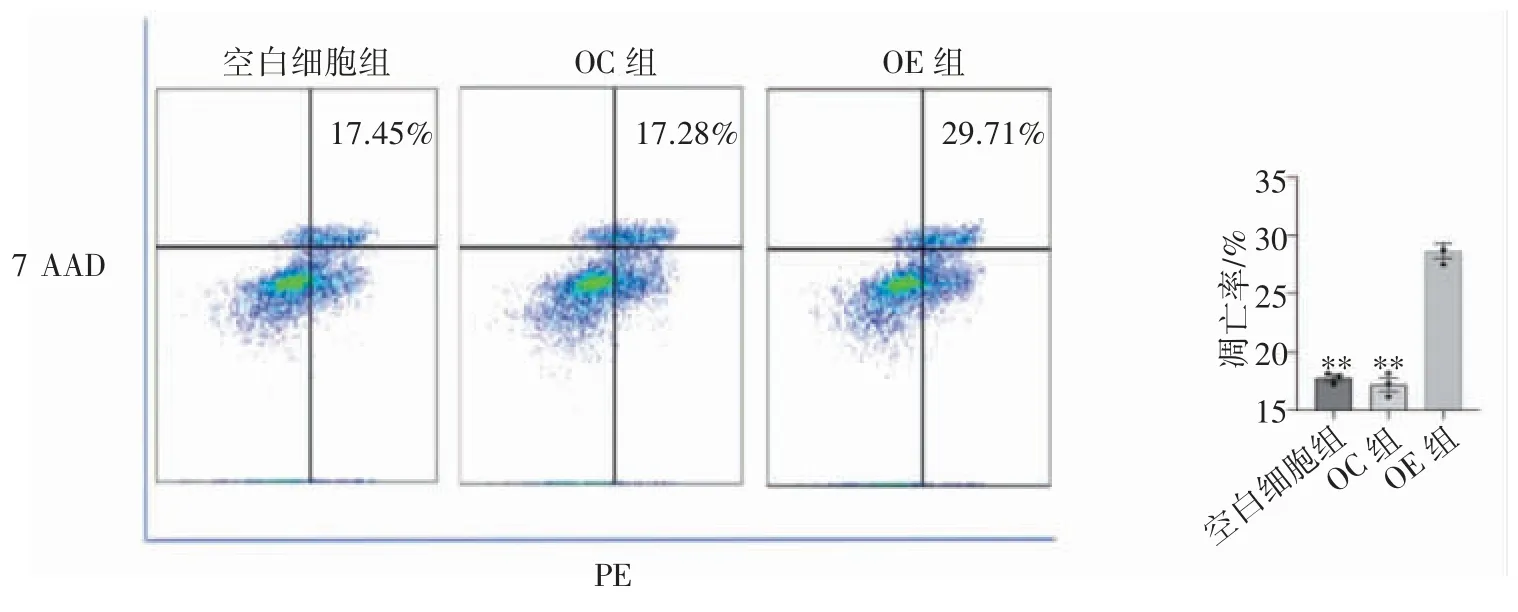
图5 流式细胞仪检测FGF21 过表达对吉西他滨诱导PANC-1 细胞凋亡的影响
2.6 FGF21 可促进PANC-1 细胞中凋亡相关蛋白表达
Western blot 法检测FGF21 重组慢病毒感染后PANC-1 细胞中Caspase3、Cleaved-caspase3、Caspase9 蛋白的表达水平结果显示,OE 组细胞中Caspase3、Cleaved-caspase3、Caspase9 蛋 白 表达水平均高于空白细胞组和OC 组(P 均<0.05),见图6。
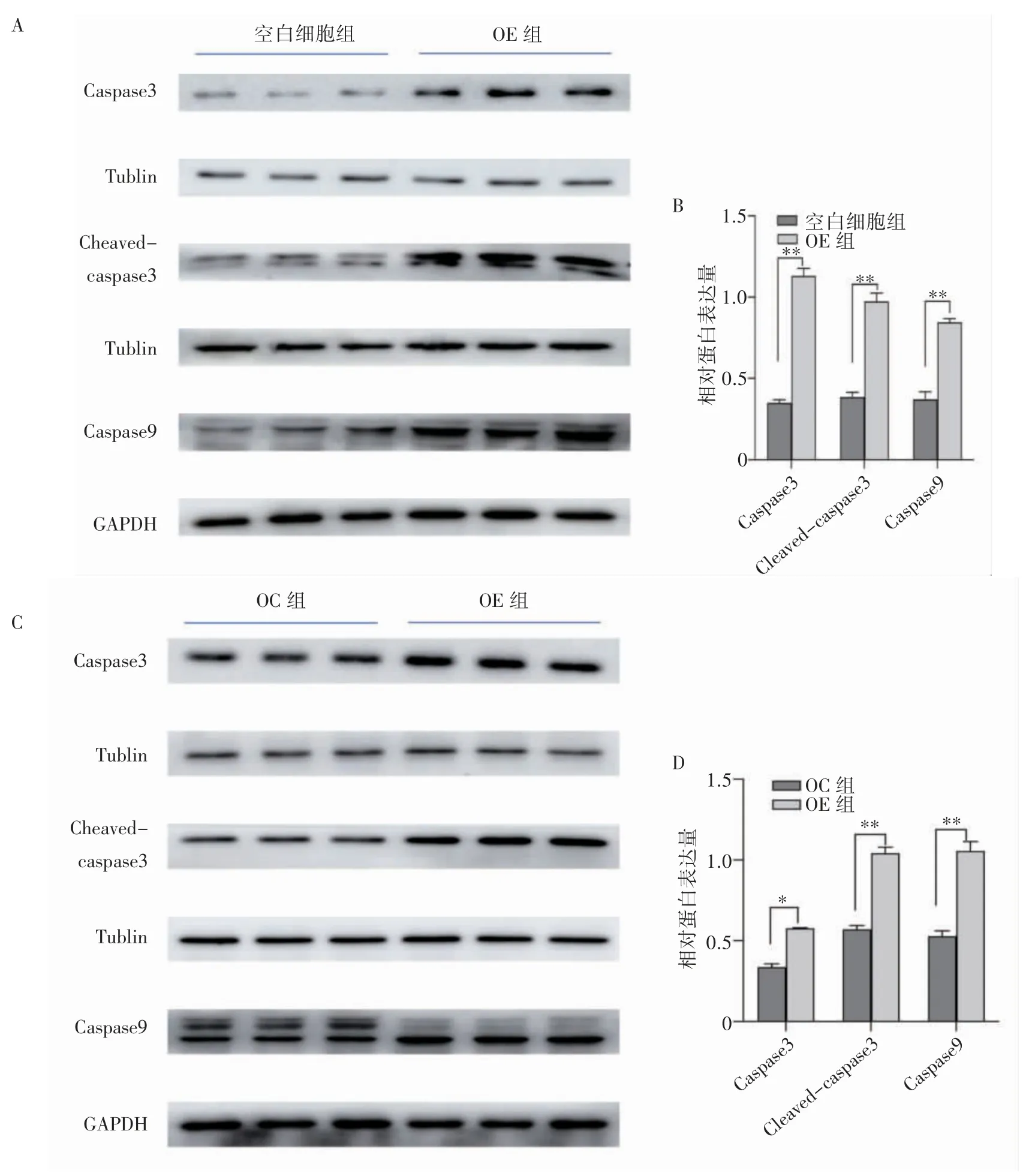
图6 Western blot 检测凋亡蛋白相关蛋白的表达
3 讨论
胰腺癌由于起病隐匿,早期诊断困难,5 年生存率仅为7.2%[6]。目前尚缺乏有效的治疗手段。因此,为胰腺癌寻找有效的靶向治疗位点意义重大。
FGF21 是FGF 基因家族中的一员,属于FGF19 亚族,与传统的FGF 亚家族显著不同,FGF19 亚族缺少肝素结合区域,且需要与专性共受体β-Klotho(KLB)蛋白结合成共同复合体从而激活FGF 受体(fibroblast growth factor receptors,FGFRs)的信号[7]。FGF21 基因位于19 号染色体上(19q13.33),编码一个含209 个氨基酸的蛋白体,其中N 末端含有一个由28 个氨基酸组成的信号肽与FGFR 反应,C 端与KLB 结合,需保证C 端与N 端的完整性才能保证其发挥正常功能[8]。FGF21 可能代表了一种有效的预防或治疗方法,通过预防脂肪肝疾病,从而阻止随后发展为肝癌[9],并且与心血管疾病和肝脏疾病的演变有明显相关性[10-11]。FGF21 被认为是一种外分泌胰腺分泌物,外分泌胰腺中的腺泡细胞比其他类型细胞合成和分泌的FGF21 都多,缺乏FGF21 的小鼠经高脂饮食诱导肥胖后,会出现明显的胰岛增生和导管周围淋巴细胞炎症[12]。FGF21 能够对机体糖脂代谢产生重要影响[13],由于肿瘤细胞代谢增强,易受营养饥饿的影响[14],FGF21 可能会影响其表型。最近的研究[15]表明,在前列腺癌中,FGF21 促进了前列腺癌细胞的凋亡,并抑制其增殖。细胞凋亡是一种进化保守的程序性细胞死亡形式,是肿瘤发展的关键一步,由Bcl-2 家族和Caspase 家族蛋白质进行调节[16]。它可以通过与细胞外因子的相互作用和内在(细胞内)事件触发。Caspases 负责启动凋亡降解阶段的特征,Caspase3 是半胱氨酸-脂肪蛋白酶家族的成员,介导特定靶蛋白分裂,最初都是由非活性酶原体产生的,然后通过各种特定的内部和或外部信号激活,激活的Caspase3 会切割各种下游底物,导致细胞凋亡[17]。Caspase9 引发的凋亡被认为反映了癌细胞对化疗药物的易感性,是调控凋亡过程的关键信号元件[18]。
本研究表明,FGF21 过表达抑制了胰腺癌细胞的增殖、迁移和侵袭,并促进了细胞的凋亡。此外,Western blot 结果表明,这一过程依赖于Caspase3、Cleaved-caspase3 和Caspase9 的激活,进一步证明了FGF21 促进凋亡的作用是通过调节凋亡相关基因来实现的。
本研究发现,FGF21 过表达可促进吉西他滨诱导PANC-1 细胞凋亡,并抑制PANC-1 细胞增殖、迁移和侵袭的能力。有研究[19-20]发现,血清FGF21 水平因透明细胞肾癌、肝细胞癌和乳头状甲状腺癌而增加,介导了癌细胞的增殖、迁移和凋亡,与本研究结果一致。
综上所述,FGF21 与胰腺癌的发生、发展密切相关,其具体的作用机制还需深入研究,并进一步探索FGF21 涉及的细胞信号通路,从而更全面地评估FGF21 对胰腺癌的影响,以期为寻找胰腺癌治疗潜在靶点提供更多的理论和实验依据。
