氧化苦参碱调控CTLA-4和PD-1缓解小鼠类风湿关节炎的作用
2023-05-10岳晓琪牛腾耀詹静慧张艳丽
岳晓琪,牛腾耀,詹静慧,高 强,张艳丽
(宁夏医科大学基础医学院病原生物学与免疫学系,银川 750004)
类风湿关节炎(rheumatoid arthritis,RA)是一种以滑膜增生为特征的慢性炎性自身免疫病。调节性T 细胞(regulatory T cell,Tregs)发挥免疫抑制作用,属于CD4+T 细胞亚群,可诱导免疫耐受,预防自身免疫性疾病发生。其关键性表型特征在于表达叉头样转录因子3(forkhead box protein 3,Foxp3)。Foxp3 在CD4+调节性T 细胞的分化、发育和功能稳定的过程中发挥着重要功能。研究发现,T 淋巴细胞数目减少或功能缺陷可能与RA发病相关,特别是滤泡辅助性T 细胞(follicular helper T cells,Tfh)和Treg 细胞失衡造成免疫功能的紊乱[1-2]。由调节性T 细胞分化而来的滤泡调节性T 细胞(follicular T regulatory cell,Tfr)表达Treg 细胞标记物细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)和Foxp3。Tfr 细胞产生白细胞介素(interlenkin,IL)-1R2 和IL-1Ra 抑制Tfh 活化,并通过CTLA-4 抑制B7-1 和B7-2 在生发中心(germinal center,GC)B 细胞的表达,具有抑制GC 形成和B 细胞发育的功能[3-4]。滤泡辅助性T 细胞对于B 细胞的激活、抗体类别转换和GC 的形成至关重要。Tfh 细胞的特征在于高度表达程序性死亡受体-1(programmed death receptor-1,PD-1)分子,主要抑制T 细胞抗原受体(T cell receptor,TCR)和CD28 共刺激。研究[5]发现,Tfh 细胞对同源B细胞呈递的抗原敏感,Tfh 细胞PD-1 的高表达反映了抗原刺激的经历,尤其是在GC 内[6]。CTLA-4(CD152)是T 细胞上的一种跨膜受体,可以与CD28 竞争性结合B7 分子配体诱导T 细胞无反应性,参与免疫反应的负性调节[7]。
氧化苦参碱(oxymatrine,OMT)是从宁夏道地药材苦参中提取的单体生物碱[8]。本团队前期研究[9-10]发现,OMT 可纠正胶原诱导性关节炎炎(collagen-induced arthritis,CIA)小鼠脾Tfr 细胞和Tfh 细胞的数量失衡,降低自身抗体的产生,从而缓解小鼠的RA,但未涉及T 细胞负向免疫调控机制的研究。本研究拟通过建立CIA 小鼠模型,探讨OMT 是否可调节T 细胞CTLA-4 和PD-1 的表达而缓解RA。
1 材料与方法
1.1 材料
1.1.1 动物模型建立 从北京维通利华实验动物技术有限公司购买36 只SPF 级、6~7 周龄、体质量18~22 g/只的雄性DBA/1J 小鼠SCXK(京2016-0011),饲养于宁夏医科大学实验动物中心。
1.1.2 药物 地塞米松磷酸钠注射液(产品批号:兽070011145)[5 mg/(2 mL/支)]购自吉林省华牧动物保健品有限公司;OMT(产品批号:20200102)购自宁夏紫荆花药业股份有限公司,纯度99%。
1.1.3 试剂 牛源性Ⅱ型胶原(产品批号:20022)、不完全弗氏佐剂(批号:7002)及完全弗氏佐剂(批号:7001)购于Chondrex 公司;实时荧光定量试剂盒(批号:RR820A)、逆转录试剂盒(批号:RR036A)均购于TaKaRa 公司;HRP 标记的山羊抗鼠IgG(批号:RS0001)、HRP 标记的山羊抗兔IgG(批号:RS0002)、兔抗Foxp3 多克隆抗体(批号:YT6169)、兔抗CTLA-4 多克隆抗体(批号:YT5933)、小鼠抗β-actin 多克隆抗体(批号:YM3128)均购于ImmunoWay 公司;小鼠抗PD-1 多克隆抗体(批号:ab52587)购于Abcam 公司。
1.1.4 实验仪器 RT-qPCR 仪(上海枫岭生物技术有限公司,型号:FTC-3000H);酶标仪(Thermo Fisher 飞公司,型号:1510);凝胶成像仪(GE,型号:AI600 images);电泳仪(美国Bio-Rad 公司,型号:Universal Power Supply);乳化仪(上海昂尼仪器仪表有限公司,型号:AD145S-P)。
1.2 方法
1.2.1 构建CIA 小鼠模型 将DBA/1J 小鼠随机分为正常组、模型组、OMT 组和地塞米松组,每组9 只。将体积比1∶1 完全乳化后的牛源性Ⅱ型胶原与等体积完全弗氏佐剂皮下多点注射于除正常组以外的各组小鼠背部以及尾部,0.1 mL/只,正常组注射等体积生理盐水,21 d 后改用不完全弗氏佐剂同样的方式加强免疫。造模后第15 天,地塞米松组采取药物干预措施,持续7 d,腹腔注射地塞米松2.8 mg·kg-1,7 d 后以1.4 mg·kg-1剂量维持;OMT 组依据Wang 等[11]和本课题组前期研究,本次实验OMT 的浓度为180 mg·kg-1;每次0.1 mL/只,每日给药1 次,直至造模结束;正常组和模型组注射等体积生理盐水。治疗30 d 后根据相关动物伦理规定处死全部小鼠。
1.2.2 观测和评估CIA 小鼠的关节炎指数(arthritis index,AI)和关节肿胀度 由同一个检测人员每隔3 d 对小鼠关节肿胀程度进行AI 分级评分,评分标准见表1,小鼠足红肿程度评为0~4 分,最高为16 分,AI 评分≥1 分为造模成功[12]。在评分的过程中使用游标卡尺测量并计算CIA 小鼠关节肿胀度[关节肿胀度=踝关节厚度×爪关节厚度],连续记录至第45 天。

表1 AI 评分标准
1.2.3 苏木精-伊红染色法(hematoxylin-eosin staining,HE)观察关节滑膜组织的异位GC 将关节和脾脏切片提前置于68 ℃烘箱中2 h 以上,进行固定和脱水处理后,苏木精染色10 min,1%盐酸乙醇溶液处理10 s,氨水返蓝20 s,超纯水冲洗1 min,1%伊红染色1 min,完成后续步骤以后滴加中性树胶封片观察。
1.2.4 免疫组化法检测小鼠踝关节滑膜中Foxp3、CTLA-4 和PD-1 的表达 无菌取小鼠踝关节滑膜并脱钙处理,对脱钙后的小鼠踝关节进行固定、脱水、透明、浸蜡、包埋及切片和脱蜡处理。分别将兔抗Foxp3 多克隆抗体、兔抗CTLA-4 多克隆抗体和小鼠抗PD-1 多克隆抗体1∶1 000 稀释后室温孵育3 h。滴加适量的HRP 标记的山羊抗鼠或兔IgG 抗体,室温孵育30 min,用PBS 冲洗3 次。滴加现配DBA 显色液并不断地观察颜色变化情况,8 min 后终止显色反应。封片,干燥后在显微镜下进行观察并记录。
1.2.5 小鼠脾脏淋巴细胞的制备 无菌条件下取脱颈处死小鼠的新鲜脾脏,充分研磨脾脏;在15 mL 离心管中加入4 mL 小鼠淋巴细胞分离液,800×g 离心30 min;吸取云雾状白膜层,用PBS 补齐至5 mL,再250×g 离心10 min,弃上清并收集脾脏淋巴细胞沉淀。
1.2.6 小鼠脾脏淋巴细胞中总RNA 提取及qPCR 检测 将上述得到的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)根据试剂盒说明书进行总RNA 提取,收集总RNA 反转录合成cDNA,引物序列见表2。反应条件:95 ℃的条件下变性5 s,60 ℃的条件下退火10 s,72 ℃的条件下延伸5 s,循环40 次;通过2-ΔΔct计算mRNA 的相对表达量。
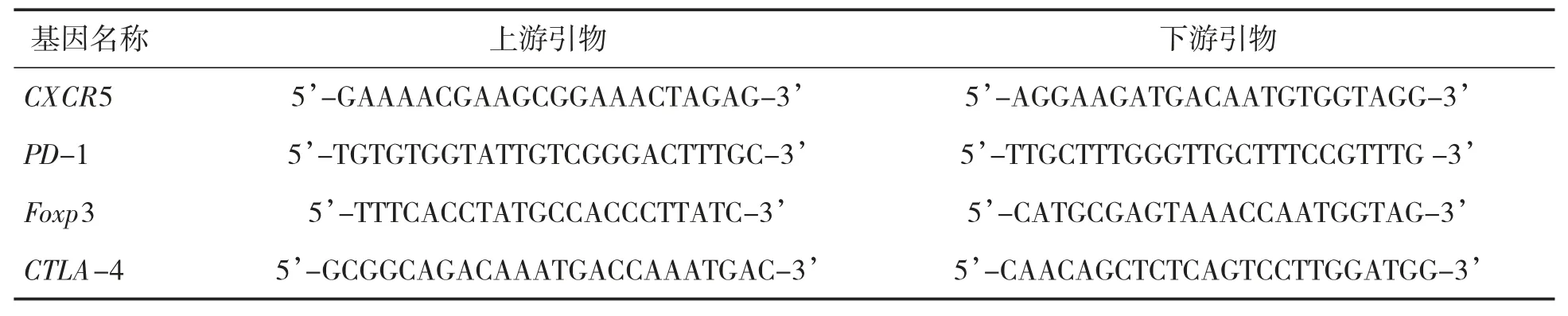
表2 引物序列
1.2.7 Western blot 检测Foxp3、CTLA-4 和PD-1蛋白的表达水平 将收集好的小鼠脾细胞于冰上裂解25 min 后4 ℃12 000×g 离心5 min,提取上清即为全蛋白。使用BCA 蛋白定量法检测提取蛋白的总量,经8%的SDS-PAGE 凝胶电泳,转膜后使用5%的脱脂奶粉封闭2 h。将兔抗Foxp3 多克隆抗体(1∶1 000)、兔抗CTLA-4 多克隆抗体(1∶1 000)、兔抗PD-1 多克隆抗体(1∶500)滴加于目的条带,4 ℃孵育过夜。随后二抗室温孵育2 h,PBS 洗涤后滴加ECL 发光液曝光,随后采用Image J 软件对条带进行分析。
1.3 统计学方法
采用SPSS 17.0 统计学软件进行数据分析,计量资料以均数±标准差()表示。多组间比较采用one-way ANOVA 分析,两两比较采用LSD-t 检验。P≤0.05 为差异具有统计学意义。
2 结果
2.1 OMT 缓解CIA 小鼠关节肿胀度并降低关节评分
从初次免疫后开始计算到第15 天,模型组、地塞米松组、OMT 组的小鼠关节与正常组相比差异无明显变化。第15 天以后,相比正常组,模型组、地塞米松组、OMT 组的小鼠关节肿胀度和评分开始升高。在初次免疫18 d 后,相比于模型组,OMT 组与地塞米松组关节肿胀度和关节评分的升高较为缓慢,并且随着给药时间的延长,其肿胀程度逐渐缓解,关节评分亦降低(P 均<0.05),见图1A。HE 结果显示,正常组的小鼠关节腔内几乎不存在炎性细胞的浸润,模型组小鼠炎性细胞呈大面积浸润,OMT 组炎性细胞浸润程度有所改善,见图1B。
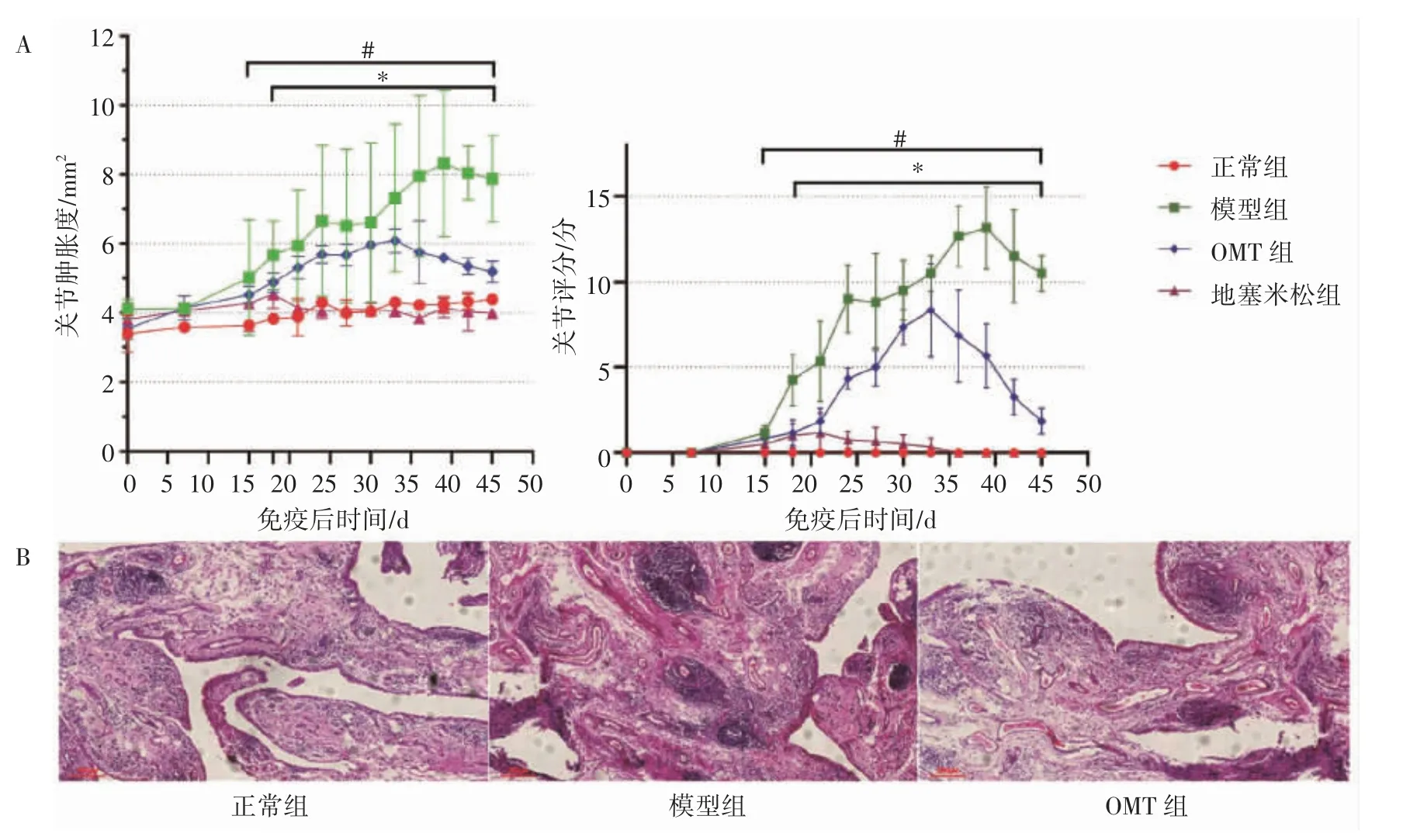
图1 OMT 对CIA 小鼠关节的影响
2.2 OMT 处理增加CIA 小鼠脾脏淋巴细胞Foxp3、CTLA-4 表达并降低PD-1 表达
通过RT-qPCR 和Western blot 检测位于脾脏淋巴细胞的Foxp3、CTLA-4 和PD-1 的mRNA 和蛋白表达水平。采用免疫组化法检测小鼠后肢踝关节滑膜中Foxp3、CTLA-4 和PD-1 的表达情况,结果显示,与正常组相比,模型组的脾脏淋巴细胞CTLA-4 和Foxp3 的mRNA 和蛋白表达量降低,PD-1 的mRNA 和蛋白表达量升高(P 均<0.05)。与模型组相比较,OMT 组、地塞米松组的脾脏淋巴细胞PD-1 mRNA 和蛋白表达量降低,CTLA-4 和Foxp3 的mRNA 和蛋白表达量升高(P 均<0.05),见图2A、图2B。小鼠踝关节滑膜中免疫组化检测结果与脾脏淋巴细胞中的结果相一致,见图2C。
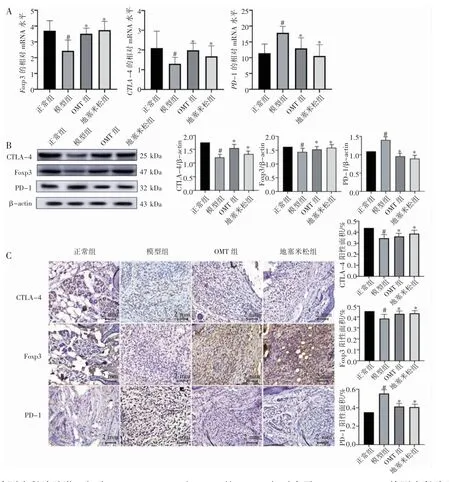
图2 OMT 对CIA 小鼠脾脏淋巴细胞Foxp3、CTLA-4、PD-1 表达的影响
3 讨论
RA 是一种滑膜和关节结构的炎症变化、间充质组织中广泛纤维蛋白样变性以及骨结构的萎缩和稀疏的慢性全身性疾病,自身抗体的异常产生是其发病的主要机制之一[13-15]。CIA 动物模型在临床特征和免疫学改变等方面与人类RA相似,在RA 的研究中被广泛应用[16-18]。本课题组前期研究[19]发现,OMT 可下调CIA 小鼠脾滤泡辅助性T 细胞和B 细胞数量,抑制小鼠血清IL-21表达,缓解关节炎症,但对免疫负调控的分子机制未做探讨。
RA 的发展与淋巴细胞免疫紊乱和异常活化的淋巴细胞亚群密切相关,特别是在CD4+T 细胞相关的亚群中[20-22]。IL-21 通过诱导CD4+T 分化为Tfh 细胞,与GC B 细胞表面的IL-21 受体结合,促进B 细胞向浆细胞分化并最终产生大量抗体,从而导致关节滑膜损伤[23-24]。在CD4+T 细胞分化为负性免疫调控细胞Treg 的过程中,IL-21和转化生长因子(TGF-β)起着重要的作用,Treg细胞诱导免疫耐受从而发挥免疫抑制作用,预防自身免疫性相关疾病的发生。Tfr 细胞由Treg 细胞分化而来,它与Treg 细胞具有某些共同的特征,高表达Foxp3 和CTLA4 还可促进机体分泌细胞炎性因子IL-10 和TGF-β,具有抑制GC 形成、Tfh 细胞和自身反应性B 细胞发育的功能[25]。协同刺激分子PD-1 与PD-L1、PD-L2 结合可以抑制T、B 细胞的活化与相关细胞因子的产生,在维持机体免疫耐受的过程中具有重要作用。
研究[5]显示,当Tfh 细胞的PD-1 与组成表达PD-1 配体1(PD-L1)的B 细胞结合时,PD-1 进一步限制了Tfh 细胞CXCR3 的上调,使这些细胞向GC 聚集,因此,PD-1 以共刺激非依赖和依赖的方式工作,控制Tfh 细胞的组织定位和功能[26-27]。Tan 等[28]研究发现,PD-1/PD-L1 缺陷小鼠的血液和淋巴结中调节性T 细胞(Foxp3+)增加,从而增强了抑制能力,并在体内有效地抑制了Tfh 细胞。Foxp3+需要CD28 和ICOS 信号,但被PD-1/PD-L1 抑制,因此,PD-1 亦会抑制Tfr细胞的免疫负调控作用,调节进入外周血的Tfr细胞数量。CTLA-4 通过与T 淋巴细胞表面的CD28 竞争性结合B7 分子配体参与了免疫反应进程中的负性调节[7]。本实验结果显示,OMT 可降低CIA 小鼠关节评分并缓解CIA 小鼠关节肿胀度,增加脾淋巴细胞Foxp3 及CTLA-4 的表达,降低PD-1 的表达。推测OMT 可能通过降低PD-1 的表达、增加CTLA-4 的表达调控Foxp3+T细胞的数量和功能,从而缓解RA,但详尽的负向免疫学调控机制还需后续深入研究。
