线粒体泛素连接酶1 对大鼠心肌细胞H9C2 缺氧损伤的实验研究
2023-05-10徐方晶范玉成孙美琪
徐方晶,王 洁,范玉成,张 瑜,孙美琪,何 静,何 军
(1.宁夏医科大学临床医学院,银川 750004;2.宁夏医科大学总医院,银川 750004;3.宁夏医科大学附属石嘴山市第一人民医院病理科,石嘴山 753600)
缺血性心脏病(ischemic heart disease,IHD)是目前世界范围内导致死亡的主要原因之一,给个人和社会带来了巨大的经济负担[1-2]。心肌缺血时,心肌细胞线粒体有氧呼吸减弱、三磷酸腺苷(ATP)合成减少,致使心肌细胞能量供应不足,无法维持正常的生理功能,最终导致心肌细胞凋亡或坏死。心脏是富含线粒体的器官,线粒体占心肌细胞体积的1/3,心脏收缩所需能量的90%以上由线粒体生成和提供[3]。因此,线粒体结构与功能的稳态对维持正常的心脏功能十分重要。
线粒体泛素连接酶1(mitochondrial ubiquitin ligase 1,Mul1)是一种线粒体外膜锚定蛋白,也被称为线粒体锚定蛋白连接酶(mitochondrial-anchored protein ligase,MAPL)或生长抑制及死亡E3连接酶(growth inhibition and death E3 ligase,GIDE),在心、脑、肝、肾、脾、骨骼肌、小肠、肺及外周血白细胞等组织与细胞中表达。Mul1 分子的N 端和C 端均含有跨膜结构域,其位于C 端的环指结构域具备E3 连接酶活性,发挥蛋白质泛素化或类泛素化(small ubiquitin-like modifier,SUMO)修饰功能[4-6],通过调控核因子κB(nuclear factor-KappaB,NF-κB)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)、p53 蛋白和蛋白激酶B(protein kinase B,PKB/Akt)等信号分子[7-10],直接或间接参与细胞生长、线粒体动力学及炎症与免疫反应。本课题组的前期研究[11]发现,Mul1 在急性缺血心肌组织中呈特异性高表达,由此推测Mul1 参与调控缺氧心肌的病理生理变化。本研究利用缺氧大鼠心肌细胞模型,通过对Mul1 过表达和沉默干预,观察Mul1 对大鼠缺氧心肌细胞存活率和结构的影响,探讨Mul1 对缺氧心肌细胞损伤的影响。
1 材料与方法
1.1 主要材料、试剂与仪器
大鼠心肌细胞H9C2(上海中科院细胞库);Mul1 过表达慢病毒载体LV-Mul1 和Mul1 敲减慢病毒载体LV-Mul1-RNAi 及其相关空载体(上海吉凯基因公司);HitransG P 感染增强液(上海吉凯基因公司);RNA 提取试剂盒(天根生化公司);HiScript ⅡQ RT SuperMix for qPCR(诺唯赞公司);QuantiNovaTMGreen PCR Kit(凯杰企业管理有限公司);无糖DMEM 培养基和胎牛血清(Gibco 公司);高糖DMEM 培养基和青链霉素双抗(BI 公司);全蛋白提取试剂盒、BCA 蛋白含量检测试剂盒和SDS-PAGE 快速凝胶配制试剂盒(凯基生物公司);Mul1 抗体(兔多克隆抗体,16133-1-AP,Proteintech 公司);GAPDH(兔多克隆抗体,bs-2188R,博奥森公司);辣根过氧化物酶标记的山羊抗兔IgG(ZB-2301,中杉金桥公司);Hoechst 33342 染色液(索莱宝公司);三气培养箱(Steri-Cycle i250,美国Thermo Fisher 公司);荧光定量PCR 仪(ABI 7500,美国Thermo Fisher 公司);CBM 智能细胞检测平台(Cytation 5,美国BioTek 公司);透射电子显微镜(HT-7800,日本Hitachi 公司)。
1.2 实验方法
1.2.1 大鼠心肌细胞H9C2 常规培养 以含10%胎牛血清、1%青链霉素双抗的DMEM 高糖培养基培养,置于5%CO2、37 ℃、饱和湿度培养箱中,细胞密度达80%~90%时进行实验。
1.2.2 慢病毒转染及分组命名 分别构建Mul1过表达、过表达空质粒、Mul1 敲减质粒和敲减空质粒,进行慢病毒包装后用于实验。将H9C2 细胞接种至6 孔板内(2×104/孔),置于37 ℃、5%CO2培养箱培养。待细胞汇合至20%~30%时,以复感染指数(MOI)=10 加入病毒以及HitransG P感染增强液40 μL/孔。感染18 h 后更换完全培养基,继续培养72 h 后,倒置荧光显微镜观察绿色荧光蛋白表达。将各组H9C2 细胞分别命名为阴性对照组(NC)、Mul1 过表达组(LV-Mul1)、Mul1敲减组(LV-Mul1-RNAi)、Mul1 过表达空载体组(LV-Vector)、Mul1 敲减空载体组(LV-RNAi-Vector),其中LV-Mul1-RNAi 的干扰靶序列为5’-GGAGCTAAGAAGATTCATTTG-3’。
1.2.3 嘌呤霉素筛选稳定株 慢病毒感染H9C2细胞72 h 后(80%~90%细胞汇合),将细胞继续培养于含4 μg·mL-1嘌呤霉素的培养基中进行药筛,筛选48 h 后,未感染病毒的对照组细胞全部死亡,而感染病毒组未再出现细胞死亡时,调整嘌呤霉素至维持浓度2 μg·mL-1,继续对感染后的细胞进行筛选,同时收集细胞进行后续实验。
1.2.4 RT-qPCR 检测Mul1 表达载体mRNA 水平 使用RNA 提取试剂盒提取各转染组细胞RNA,HiScript ⅡQ RT SuperMix for qPCR 试剂盒逆转录成cDNA。加入Mul1 基因引物进行PCR 反应。Mul1 上游引物:5’-GGAGCATAAGATGGTGTGGAA-3’,下 游 引 物:5’-GTGTTAGTCCTCTGGTGAAT-3’。并使用QuantiNovaTMGreen PCR Kit 在荧光定量PCR 仪上进行RT-qPCR。以GAPDH 为内参基因,使用2-ΔΔCt方法计算Mul1 mRNA 的相对表达水平。
1.2.5 Western blot 检测Mul1 表达载体的蛋白水平 将各组细胞置于细胞裂解液中,匀浆振荡裂解静置30 min 后,4 ℃、17 000×g 离心10 min,收集上清后BCA 法测定蛋白浓度。采用聚丙烯酰胺凝胶电泳法,每个泳道加样蛋白量为30 μg,并转于聚偏二氟乙烯膜上,10%脱脂牛奶封闭2 h,加入一抗(Mul1 1∶1 000;GAPDH 1∶5 000),4 ℃孵育过夜。复温后洗膜3 次,加入二抗(山羊抗兔,稀释比为1∶5 000)室温孵育1 h,洗膜3 次后化学发光法检测目的蛋白的相对表达量,并用Image J 软件进行定量分析。
1.2.6 观察缺氧培养下细胞的形态变化 常规培养各组细胞至细胞融合度约90%时,更换培养基为含10%胎牛血清的无糖DMEM,置于含5%CO2、94%N2、1%O2的三气培养箱培养12 h。同时,另将各组细胞进行常氧培养作为对照。倒置显微镜下观察各组细胞形态的变化。
1.2.7 检测缺氧培养下细胞的存活率 将各组细胞以PBS 清洗后加入Hoechst 33342(1∶1 000)染液、室温孵育30 min,再以PBS 洗涤,经CBM智能细胞检测平台动态观察同一视野并采集图片进行定量分析。
1.2.8 透射电镜观察缺氧培养下细胞的超微结构 收集上述各组正常培养和缺氧培养的H9C2细胞,室温、700×g 离心5 min,4 ℃、戊二醛固定2 h,然后进行常规电镜样品固定、脱水、渗透、包埋,超薄切片,经透射电子显微镜观察并摄片。
1.3 统计学方法
采用GraphPad Prism 8.0.2 软件进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,两组比较采用LSD-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 Mul1 慢病毒表达载体转染H9C2 细胞后绿色荧光蛋白表达情况
各组H9C2 细胞生长状态均良好;阴性对照组H9C2 细胞中无绿色荧光表达,Mul1 过表达组及Mul1 过表达空载体组阳性率均为60%~70%;Mul1 敲减组及Mul1 敲减空载体组绿色荧光表达丰度高,阳性率均为70%~80%,见图1。
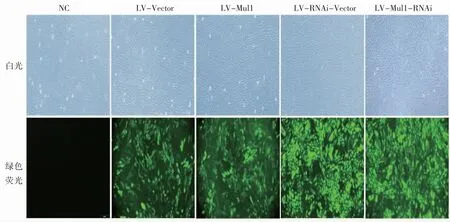
图1 Mul1 慢病毒表达载体转染H9C2 细胞后绿色荧光蛋白表达情况(×100)
2.2 Mul1 慢病毒表达载体干扰H9C2 细胞Mul1 mRNA 表达效率鉴定
RT-qPCR 检测结果显示,Mul1 过表达组Mul1 mRNA 水平高于阴性对照组和Mul1 过表达空载体组(P 均<0.05);Mul1 敲减组Mul1 mRNA表达水平低于阴性对照组和Mul1 敲减空载体组(P 均<0.05),见图2。
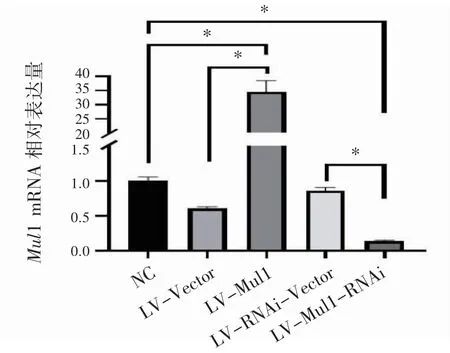
图2 Mul1 慢病毒表达载体干扰H9C2 细胞Mul1 mRNA 表达效率鉴定
2.3 Mul1 慢病毒表达载体干扰H9C2 细胞Mul1蛋白表达效率鉴定
Western blot 检测结果显示,与阴性对照组和Mul1 过表达空载体组相比,Mul1 过表达组Mul1 蛋白表达水平升高(P 均<0.05);与阴性对照组和Mul1 敲减空载体组相比,Mul1 敲减组Mul1 蛋白表达水平降低(P 均<0.05),见图3。该结果表明,Mul1 过表达载体和敲减载体以及相应对照载体均构建成功,并且获得了Mul1 过表达细胞株、Mul1 敲减细胞株以及相关空载体细胞株。
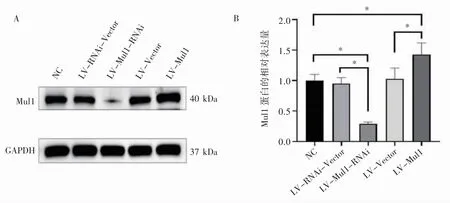
图3 Mul1 慢病毒表达载体干扰H9C2 细胞Mul1 蛋白表达效率鉴定
2.4 Mul1 对缺氧培养的H9C2 细胞形态的影响
采用倒置显微镜观察各组细胞生长状态,常规培养下的各组H9C2 细胞全部贴壁生长,为梭形或多角形,伸出伪足,形成不规则的星形并形成放射状排列的细胞簇,细胞核突出明显。缺氧12 h 后各组H9C2 细胞形态均发生不同程度的变化,细胞簇周围有部分脱落的细胞,细胞皱缩。与阴性对照组和Mul1 过表达空载体组相比,Mul1 过表达组细胞质出现空泡和粗大颗粒样物质,大片细胞皱缩、脱落;与阴性对照组和Mul1 敲减空载体组相比,Mul1 敲减组细胞绝大部分细胞形态较好,偶见死亡细胞,透光性强,见图4。
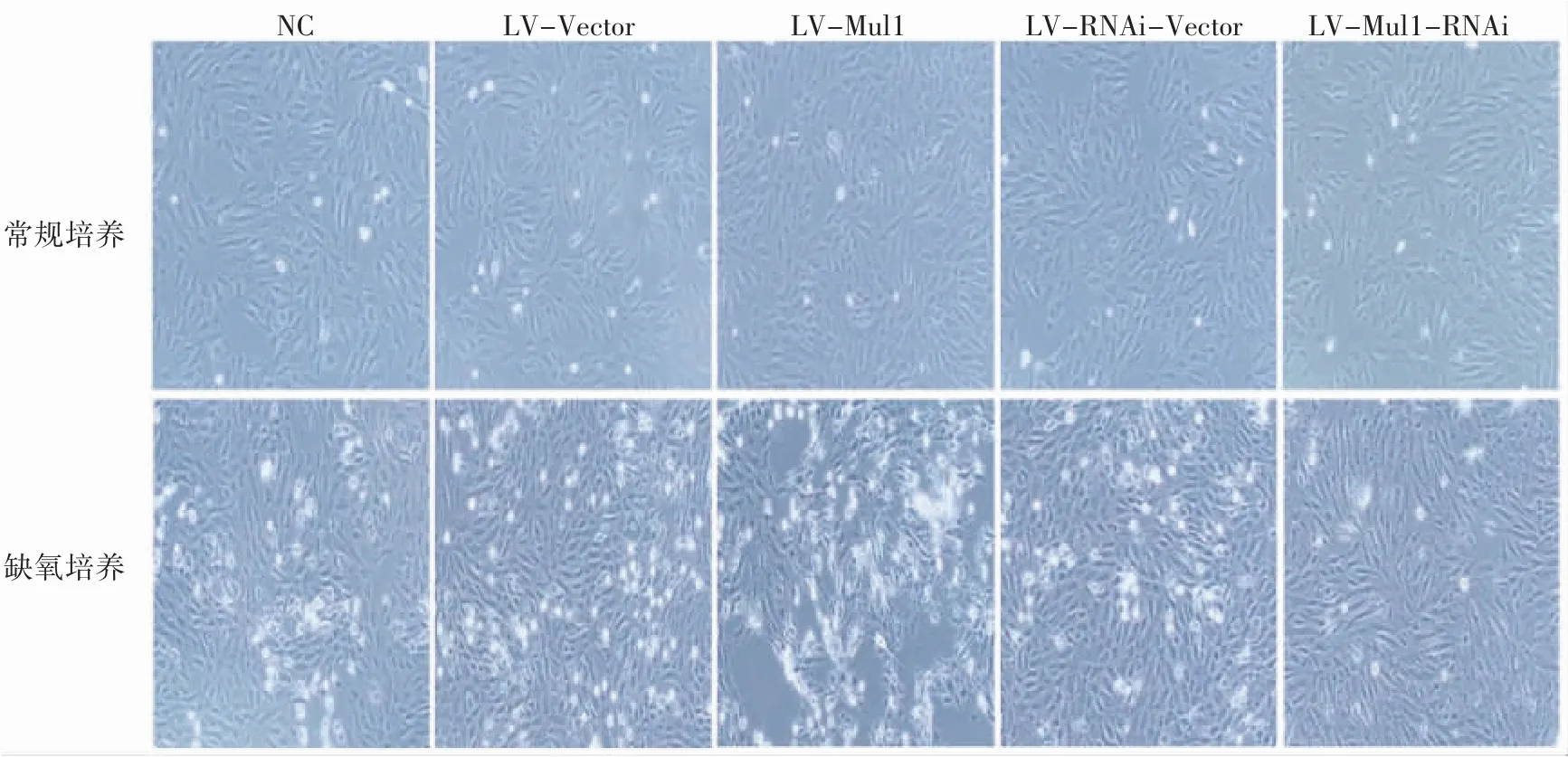
图4 Mul1 对缺氧培养的H9C2 细胞形态的影响(×100)
2.5 Mul1 对缺氧培养的H9C2 细胞存活率的影响
将各组H9C2 细胞置于CBM 智能细胞检测平台中持续缺氧24 h,在同一视野下持续进行细胞计数。结果显示,阴性对照组、Mul1 过表达空载体组、Mul1 敲减空载体组、Mul1 过表达组和Mul1 敲减组在缺氧24 h 时,细胞存活率分别为(91.38±0.98)%、(88.43±1.07)%、(90.17±1.13)%、(65.42±2.60)%和(95.50±1.44)%,缺氧培养24 h时,Mul1 过表达组细胞存活率低于阴性对照组及Mul1 过表达空载体组(P 均<0.05),Mul1 敲减组细胞存活率高于阴性对照组和Mul1 敲减空载体组(P 均<0.05),见图5。
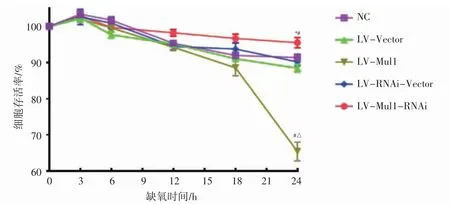
图5 Mul1 对缺氧培养的H9C2 细胞存活率的影响
2.6 Mul1 对缺氧培养的H9C2 细胞超微结构的影响
正常含氧培养条件下各组H9C2 细胞结构正常,细胞核膜边界清晰完整,染色质均匀,细胞质内容物丰富,线粒体结构清晰。缺氧12 h 后,阴性对照组和阳性对照组(LV-Vector、LV-RNAi-Vector)H9C2 细胞线粒体排列紊乱、肿胀,出现局灶型空化现象,细胞核膜尚完整,染色质及细胞质内容物无异常改变;Mul1 过表达组H9C2 细胞线粒体肿胀明显、嵴断裂、溶解呈空泡状,胞质内容物减少;Mul1 敲减组H9C2 细胞大部分线粒体结构正常,偶见线粒体嵴断裂现象,见图6。
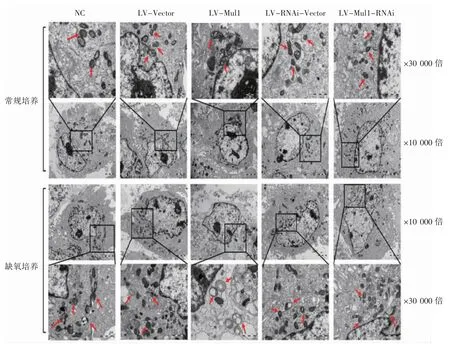
图6 Mul1 对缺氧培养的H9C2 细胞超微结构的影响
3 讨论
心脏收缩和舒张的功能活动需要心肌细胞获取足够的氧气,并且心肌细胞较其他类型细胞对缺氧更为敏感[12]。缺氧可造成心肌细胞生长减慢、活力降低,细胞形态及内部结构受损,尤其造成线粒体明显损伤,细胞色素C 释放增加,活性氧升高,ATP 合成受阻,引起心肌细胞能量代谢紊乱、氧化应激和炎性反应以及细胞凋亡等[13]。因此,寻找能够调控缺氧诱导的心肌细胞损伤的基因对研究缺血性心脏病的发生发展十分重要。
目前研究[4,6,14]发现,Mul1 作为一种多功能的线粒体泛素连接酶可诱导细胞凋亡并减缓生长。但在心肌细胞中,尤其在缺氧培养下,Mul1 对心肌细胞损伤的影响报道甚少。为探讨Mul1 是否调控缺氧心肌细胞的病理生理功能,本研究利用慢病毒转染技术成功实现外源性Mul1 在H9C2心肌细胞中过表达和低表达,在缺氧条件下培养Mul1 对H9C2 细胞的影响结果显示,常规培养时各组细胞株之间的细胞形态结构及死亡率无明显变化,而缺氧培养时过表达Mul1 可以加重细胞损伤程度,提高细胞的死亡率;敲减Mul1 后上述现象则相反;进一步观察细胞超微结构提示,缺氧培养下Mul1 可以进一步加重线粒体损伤,表现为线粒体严重肿胀、局灶性空化、嵴断裂及内膜消失。由此认为,Mul1 引起的心肌细胞损伤与线粒体损伤密切相关。线粒体是细胞内能量代谢的中枢,因此维持线粒体结构与功能的完整性对细胞状态的维持至关重要。Mul1 能够参与调节与线粒体功能障碍相关的蛋白质的水平和功能,其中线粒体动力学变化引起的线粒体代谢紊乱与心血管疾病的发生发展相关[6]。线粒体作为一种处于动态平衡状态的细胞器,当细胞受到代谢或环境压力时,通过融合、分裂来维持其形状、分布和大小。为了维持线粒体分裂和融合之间的平衡,需要4 个进化上保守的GTP 水解酶,包括线粒体融合蛋白1(mitofusion 1,Mfn1)、线粒体融合蛋白2(mitofusion 2,Mfn2)和视神经萎缩1(optic atrophy 1,OPA1)以及动力相关蛋白1(dynamic related protein 1,Drp1),其中Drp1 被认为是分裂的“主调节器”[14-15]。Mul1 作为泛素或SUMO连接酶发挥作用,具有泛素化或SUMO 化底物的潜力。当Mul1 表达上调时,Mul1 通过SUMO 化介导Drp1 稳定和泛素化介导的Mfn2 降解都会增强,这会阻碍线粒体融合,同时促进线粒体分裂,扰乱线粒体动态平衡稳定状态,引起线粒体网状结构崩解、片段化增强以及膜电位损失,最终导致细胞死亡[16-17]。另外,Mul1 独特的拓扑结构使其能够在膜间“感知”线粒体应激,并通过特定底物的泛素化传递这些信号。其中Mul1 连接酶失活导致UBX 结构域蛋白7(UBX domain protein 7,UBXN7)的积累,伴随缺氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)蛋白表达水平升高,氧化磷酸化减少和糖酵解增加以维持缺氧细胞的内环境稳定,以适应缺氧[18]。Wang 等[19]的研究也表明,在缺血再灌注损伤的大鼠心肌中,Mul1通过SUMO 化稳定并激活p53,导致p53 介导的线粒体功能障碍和细胞死亡。在本研究中,Mul1可增加缺氧培养下大鼠心肌细胞的损伤程度,加重以线粒体为主的细胞结构损伤,并增加细胞死亡率,原因可能为Mul1 通过扰乱线粒体动力学变化以及对下游信号分子的相互作用进而调控线粒体功能参与缺氧心肌细胞损伤及死亡。
