卤水-氨法反向沉淀对氢氧化镁结晶生长的影响
2023-05-08刘辉罗才贵邹来禧宋学文柳殷罗仙平
刘辉 , 罗才贵 , 邹来禧 , 宋学文 , 柳殷 , 罗仙平 *,
(1.江西理工大学资源与环境工程学院,江西 赣州 341000; 2.西安建筑科技大学,西安 710055)
我国盐湖资源丰富, 从大兴安岭-阴山山脉-太行山-祁连山脉、秦岭以北区域至我国西南地区均有分布[1], 仅以青海察尔汗盐湖为例,每年因盐湖资源开发产生的含卤废液达4 800~6 000 万吨,其氯化镁含量高,经天然析出即形成水氯镁石(MgCl2·6H2O)晶体,且杂质含量低[2],具有较好品质。 当前,水氯镁石是盐湖镁基材料开发的主要原料之一, 平均每生产1 吨钾盐会副产8~9 吨水氯镁石, 长期堆放的水氯镁石不仅形成“镁害”,威胁当地生态安全,而且造成资源浪费[3]。 废弃水氯镁石广泛用于制备金属镁、氢氧化镁、氧化镁、无水氯化镁、相变储能材料等[4-6]。通过盐湖水氯镁石制备氢氧化镁的方法主要为液相化学法;沉淀剂主要有石灰乳、氢氧化钠、氨水(气)、碳酸钠等[7],沉淀方式主要有直接沉淀法、均匀沉淀法、反向沉淀法[8]。 另外,通过热解-水合法、电沉积法、超声微波辅助制备氢氧化镁的文献也有报道[9-11]。 氢氧化镁具有无毒、无污染、耐高温、耐腐蚀等优点,可作为抗菌剂[12],废水、废气和酸性水污染物处理剂[13]以及新一代的阻燃剂[14],广泛应用于卫生、环保和消防等多个领域。 因此,利用青海盐湖水氯镁石制备氢氧化镁功能材料, 不仅能够消纳大量水氯镁石, 对于盐湖资源的高效开发和高值化利用具有重要意义。
氢氧化镁属于CdI2型晶体, 即6 个OH-离子组成八面体,Mg2+位于八面体中心, 形成八面体结构单元;晶体形貌通常为六方片状。此外,氢氧化镁的不同暴露面具有不同极性,(001) 晶面属于非极性面,是Mg-OH 离子键构成的生长基元在面上的延伸;而(101)晶面则是极性较强的面,是生长基元层与层之间的叠加,主要是弱氢键相连[15](见图 1)。 促进(001)晶面的生长,有利于得到分散性良好、表面极性小的六角片状氢氧化镁[16],提高其与高分子聚合物的相容性,得到优质的绿色阻燃型材料[17-18]。 因此,通过I001/I101峰强比分析氢氧化镁晶体的生长情况[19-21]具有重要意义。张婧[22]通过调控晶体反应条件实现了氢氧化镁的晶面选择性生长,发现不同晶面极性的氢氧化镁对刚果红的吸附性能存在差异。 高雪焘[23]通过化学包覆、接枝聚合方法制备六角片状氢氧化镁,在复合阻燃橡胶的力学性能和阻燃性能上表现优异。 吴易梅等[24]通过结晶-水热法制备分散性良好的六角片状氢氧化镁产品。 ZHU 等[25]通过对柠檬酸用量和水热条件的调控,可控合成具有高比表面积(159 m2/g)和高孔容(0.75 cm3/g)的氢氧化镁,对 Pb(Ⅱ)和 Cd(Ⅱ)吸附效果显著。综上可知,氢氧化镁的可控合成,不仅有助于改善其理化性质, 而且能够拓宽其应用领域,具有重要意义。
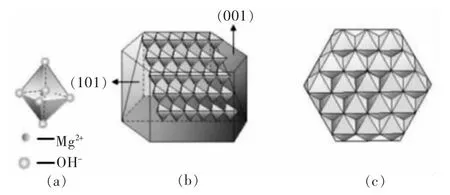
图1 氢氧化镁生长基元及其在(001) 面及(101) 面的排列方式[15]Fig. 1 Schematic diagram of Mg(OH)2 growth unit and its arrangement in (001) and (101) plane[15]
传统制备氢氧化镁的方法中, 通常以NaOH 为沉淀剂,在强碱作用下,氢氧化镁的结晶、生长过程会瞬时完成,难以控制其形貌,产物常呈胶体状,容易发生团聚,包覆溶液中的Na+、Cl-,在烘干后形成NaCl晶体,进而导致其粒径大和纯度低[26]。基于此,相关学者提出以氨水为沉淀剂制备氢氧化镁。 氨水属于弱碱,其水解过程(提供OH-离子)相对缓慢,能减缓氢氧化镁晶体的成核、生长过程,有利于调控氢氧化镁的形貌[27]。 此外,上述反应过程中生成的副产品氯化铵,也可通过回收实现循环利用。粒径分布方面,在不考虑孔隙率的情况下,氢氧化镁的粒度越细,比表面积越大[28]。易求实等考察滴加方式对制备氢氧化镁的影响,发现通过反向滴加(镁源加入到碱液中)方式,反应体系的pH 值始终在碱性范围内, 生成的Mg(OH)2颗粒带相同的电荷,有利于减少二次团聚,得到粒径分布窄的氢氧化镁晶体[29-31]。 在氯根含量方面,宋磊等[32]采用盐湖卤水制备出了工业级Mg(OH)2和MgO,发现产品中的杂质氯的主要存在形式为结合态和游离态。杨喜云等[33]在通过水氯镁石和氨水为原料制备氢氧化镁过程中,发现Mg2+离子浓度<3 mol/L 时,所得产品为氢氧化镁,而当Mg2+离子浓度≥3 mol/L 时,则出现碱式氯化镁(BMC)相;反应温度大于50 ℃,碱式氯化镁向氢氧化镁转变,进而改变氢氧化镁纯度。 综上可知,通过控制反应参数,能够对氢氧化镁的成核结晶、形貌粒径、Cl-含量进行调控。
本研究以盐湖废弃的水氯镁石 (MgCl2·6H2O)为原料, 通过过滤除杂、 重结晶等工艺制备精制卤水,通过反向沉淀方式,与氨水反应;通过调控反应过程中的Mg2+离子浓度、反应温度、进料速度和陈化时间等,探究反应条件对氢氧化镁成核结晶、粒径和Cl-含量的影响规律, 为研究盐湖水氯镁石制备氢氧化镁晶面生长调控的优化奠定基础,为利用盐湖资源制备高纯、高附加值的氢氧化镁功能材料提供借鉴。
1 实验材料和实验方法
1.1 实验药剂与仪器
化学试剂(均为分析纯):镁源为青海盐湖水氯镁石(MgCl2·6H2O)重结晶后的精制卤水、氨水(西陇科学股份有限公司,简称为西陇科学,下同)、乙二胺四乙酸二钠(简称为EDTA,西陇科学)、铬黑指示剂(上海麦克林公司)、钙-羧酸指示剂(上海麦克林公司)、硝酸(西陇科学)、铬酸钾(以达科技),实验用水均为去离子水。
主要仪器:集热式磁力搅拌器(DF-101S,常州金坛友仪器有限公司)、蠕动泵(YZ15,保定雷弗流体科技有限公司)、真空干燥箱(ADP310C,重庆雅马拓科技有限公司)、离心机(YINGTAI-TD5B,长沙英泰仪器有限公司)、电热恒温水浴锅(DK-2000-IIIL,黄骅菲斯福实验仪器有限公司)、X 射线衍射仪(Empyrean 型,荷兰)、扫描电镜(FEI-MLA650,美国)、激光粒度测试仪(LT3600,珠海真理光学仪器有限公司)。
1.2 盐湖卤水-氨法-反向沉淀制备氢氧化镁
1.2.1 盐湖卤水-氨法-反向沉淀制备氢氧化镁
预处理:将盐湖废弃水氯镁石(青海西部镁业有限公司)通过过滤除杂、重结晶等工艺制备成精制卤水,并通过EDTA 测定Mg2+离子浓度。 氢氧化镁制备工艺见图2。

图2 卤水-氨法-反向沉淀制备氢氧化镁的工艺流程Fig. 2 Process flow chart of preparation of magnesium hydroxide by brine-ammonia-reverse precipitation
反向沉淀法: 将500 mL 三口玻璃烧杯置于集热式恒温磁力搅拌器装置中,倒入一定量氨水,匀速(一定速率)滴入 MgCl2溶液,搅拌 30 min(600 r/min),在水浴锅中恒温陈化一定时间。 此后,将氢氧化镁悬浊液转移至离心瓶中离心(2 000 r/min,10 min),洗涤(去离子水法3 次、无水乙醇法2 次),每次加入200 mL 洗液,搅拌 5 min,而后转移至烘箱中烘干(105 ℃,12 h),得到氢氧化镁样品,待测。
1.2.2 氢氧化镁中Cl-含量的测量
称取1 g 样品, 精确至0.000 1 g, 用过量硝酸溶解,加蒸馏水,用少量NaOH 调节溶液pH 值至7~8,容量瓶定容至100 mL 后摇匀。 准确移取25 mL 试液于250 mL 锥形瓶中,加 2~3 滴 5% K2CrO4,以 AgNO3标定溶液滴至溶液呈砖红色,记下所用体积V,重复3 次。
Cl-含量:
式(1)中:ω(Cl-)为 Cl-含量占氢氧化镁样品的质量分数,%;c 为硝酸银标准溶液浓度,mol/L;V 为硝酸银标准溶液的平均体积,mL;m 为称取样品的质量,g。
2 结果与讨论
2.1 镁离子浓度的影响
考察不同 Mg2+离子浓度 (0.5、1.0、1.5、2.0 mol/L,100 mL)对氢氧化镁结晶度、粒径和 Cl-含量的影响。 对所制备的氢氧化镁样品进行XRD 分析(见图 3(a)),发现其 XRD 衍射峰位置与氢氧化镁标准卡片(PDF#83-0114) 的特征衍射峰位置匹配,且(001)晶面、(101)晶面和(110)晶面特征峰尖锐, 表明所制备的样品为氢氧化镁, 有较高的结晶度。 进一步通过 XRD 特征参数分析(见表 1),发现随着Mg2+离子浓度的增大,I001/I101峰强比由0.70 逐渐增大到 0.86,表明氢氧化镁(001)晶面得到生长,导致样品的极性降低,且团聚减少。 这是由于随着Mg2+离子浓度的增大,氢氧化镁生成速率增大, 各个晶面的生长速率均会提高, 但由于(001)晶面的表面能最低[34],为使整个晶体能量最低, 氢氧化镁 (001) 晶面生长速度会高于(101)晶面。

表1 不同镁离子浓度制备的氢氧化镁晶体特征参数(T=45 ℃,V=5 mL/min, t=0.5 h)Table 1 The crystal characterization parameters of magnesium hydroxide prepared with different concentrations of magnesium ions (T=45 ℃, V =5 mL/min, t=0.5 h)
对所得氢氧化镁样品进行粒径分析 (见图3(b)),发现随着Mg2+离子浓度的增大, 氢氧化镁的粒径趋于变小,且粒径分布较窄,表明所得氢氧化镁样品均一性较好。 对上述样品进行氯根测定分析,发现随着Mg2+离子浓度的增大, 氢氧化镁固体中的Cl-含量整体呈上升趋势(见图3(c)),而Cl-含量偏大可能影响氢氧化镁样品的性能[35]。 综合考虑氢氧化镁结晶度好、粒径均匀性、Cl-含量低等要求,宜选择Mg2+离子浓度为1.5 mol/L。
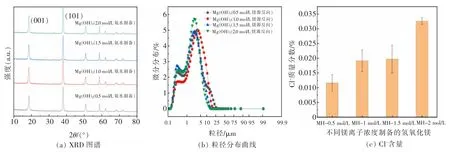
图3 不同镁离子浓度制备的氢氧化镁(T=45 ℃,V 进料=5 mL/min,t=0.5 h)Fig. 3 Magnesium hydroxide prepared by different concentrations of magnesium ions(T=45 ℃, Vfeed=5 mL/min, t=0.5 h)
2.2 反应温度的影响
保持 Mg2+离子浓度(1 mol/L,100 mL)、氨水浓度过量 (2 mol/L,110 mL), 改变反应温度(35、45、55、65、75 ℃),考察不同反应温度对制备氢氧化镁的结晶度、粒径和Cl-含量的影响(其他制备步骤见1.2.1)。 结合氢氧化镁的特征参数(见表2),发现随着温度的上升,峰强比I001/I101呈现增大的趋势,表明温度的上升有利于其(001)晶面的生长[36], 原因在于氢氧化镁(001)面的总能量较低,存在热力学稳定性,在氢氧化镁晶体生长过程中,其生长基元不容易与之结合,最终(001)面成为较显著的暴露晶面,在温度较高时,晶体生长是在非受迫的情况下进行的,晶体的生长驱动力主要为表面能的减少及扩散效应,所以晶体可以自由生长,晶体各面族的生长习性可以得到充分的显露,随着温度升高,这种趋势更加明显,见图 4(a)。

图4 不同反应温度制备的氢氧化镁 (C(Mg2+)=1 mol/L,V =5 mL/min,t=0.5 h)Fig. 4 Magnesium hydroxide prepared at different reaction temperatures(C(Mg2+)=1 mol/L, V =5 mL/min, t=0.5 h)
此外,随着温度的上升,制得的氢氧化镁粒径增大(见图 4(b)和表 2)。 有研究表明,氢氧化镁的合成属于放热反应, 温度升高使得氢氧化镁的溶解度增大,进而易发生溶解再结晶,使氢氧化镁晶体小颗粒继续结晶生长成大颗粒,导致其粒径增大[37-38]。 在总Cl-含量方面,随着反应温度的上升,氢氧化镁的总Cl-含量显著下降(见图4(c)),原因在于,温度上升加剧溶液中的分子运动,导致氢氧化镁生成过程中碱式单核配合物形成多核配合物受到影响,降低夹杂在链与链之间的氯离子含量[39-40],从而获得低Cl-的氢氧化镁。 综合考虑氢氧化镁结晶度好、粒径均匀性、Cl-含量低以及节能等要求,宜选择反应温度为65 ℃。

表2 不同反应温度制备的氢氧化镁晶体特征参数(C(Mg2+)=1 mol/L、V=5 mL/min、t=0.5 h)Table 2 The crystal characteristic parameters of magnesium hydroxide prepared at different reaction temperatures (C(Mg2+)=1 mol/L, V=5 mL/min, t=0.5 h)
2.3 进料速度的影响
保持 Mg2+离子浓度(1 mol/L,100 mL)、氨水浓度过量(2 mol/L,110 mL), 改变进料速度(2.5、5.0、7.5、10.0 mL/min,75 ℃), 考察不同进料速度对制备氢氧化镁结晶度、粒径和Cl-含量的影响(其他制备步骤见1.2.1 章节)。 随着进料速度的增大,氢氧化镁的粒径变化比较明显(见图 5(b)),粒径 D50和 D90随着进料速度的增大而呈下降的趋势(见表3),粒径分布变窄;而(001)晶面尺寸变化不大,以 15.2 nm 为主,峰强比I001/I101由0.72 逐步上升到0.78,极性成减弱的趋势。
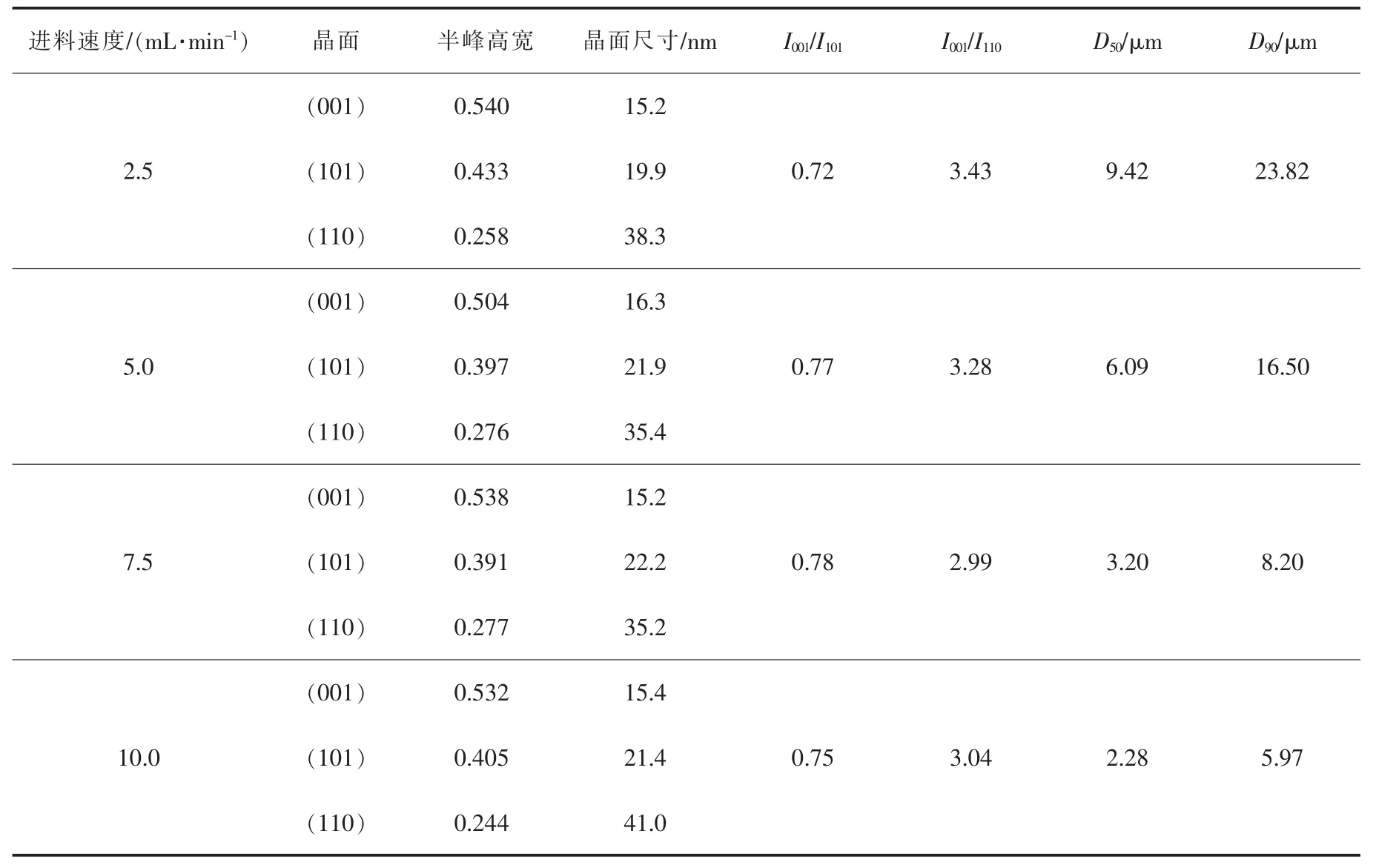
表3 不同进料速度制备的氢氧化镁晶体特征参数(C(Mg2+)=1 mol/L,T=45 ℃,t=0.5 h)Table 3 Crystal characteristic parameters of magnesium hydroxide crystal surface prepared at different feeding rates(C(Mg2+)=1 mol/L, T=45 ℃, t=0.5 h)
分析认为,进料速度的增大,使单位时间内镁离子增量上升,反应速率增快,有利于小颗粒的生成,且没有生长完全,结晶度较差,故粒度较小。 氢氧化镁的Cl-含量, 随着进料速度的增加有降低的趋势(见图5(c)),分析认为是氯离子与氢氧化镁的水解架桥受到影响[41],进而降低Cl-含量。综合氢氧化镁结晶度好、粒径均匀性、Cl-含量低的要求,宜选择进料速度为5.0 mL/min。
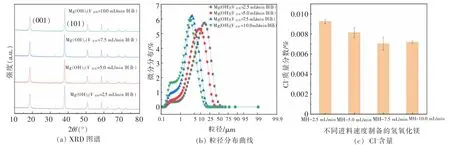
图5 不同进料速度制备的氢氧化镁 (C(Mg2+)=1 mol/L,T=45 ℃,t=0.5 h)Fig. 5 Magnesium hydroxide prepared at different feeding rates (C(Mg2+)=1 mol/L, T=45 ℃, t=0.5 h)
2.4 陈化时间的影响
保持 Mg2+离子浓度(1 mol/L,100 mL)、氨水过量(2 mol/L,110 mL),改变陈化时间(0、1、3、6、12 h),考察不同陈化时间对制备氢氧化镁结晶度、粒径和Cl-含量的影响。 随着陈化时间延长, 氢氧化镁的Cl-含量呈增大的趋势(见图6),结合晶体特征参数相关信息 (见表4), 发现氢氧化镁的粒径D50变化不大, 但粒径D90随着陈化时间的延长而逐渐变小,大颗粒受到影响,观察(001)晶体尺寸,由16.8 nm生长至19.4 nm;峰强比I001/I101变化不大。 进一步分析可知,在陈化时间开始时,晶体在原位进行生长,进而增大了粒径,随着陈化时间的延长,氯化铵溶液与氢氧化镁进行反应, 氢氧化镁大颗粒被溶解,晶体的角顶和棱被溶解,晶体成近似球状,颗粒的均匀性也更好;而随着反应的进行,陈化时间的延长, 氢氧化镁与氯化镁通过水解架桥反应导致碱式氯化镁晶体(xMg3(OH)5Cl·4H2O)增多[42],使得氢氧化镁产品中Cl-含量增加。 综合结晶度好、粒径均匀性、Cl-含量低的要求, 宜选择陈化时间为1 h。
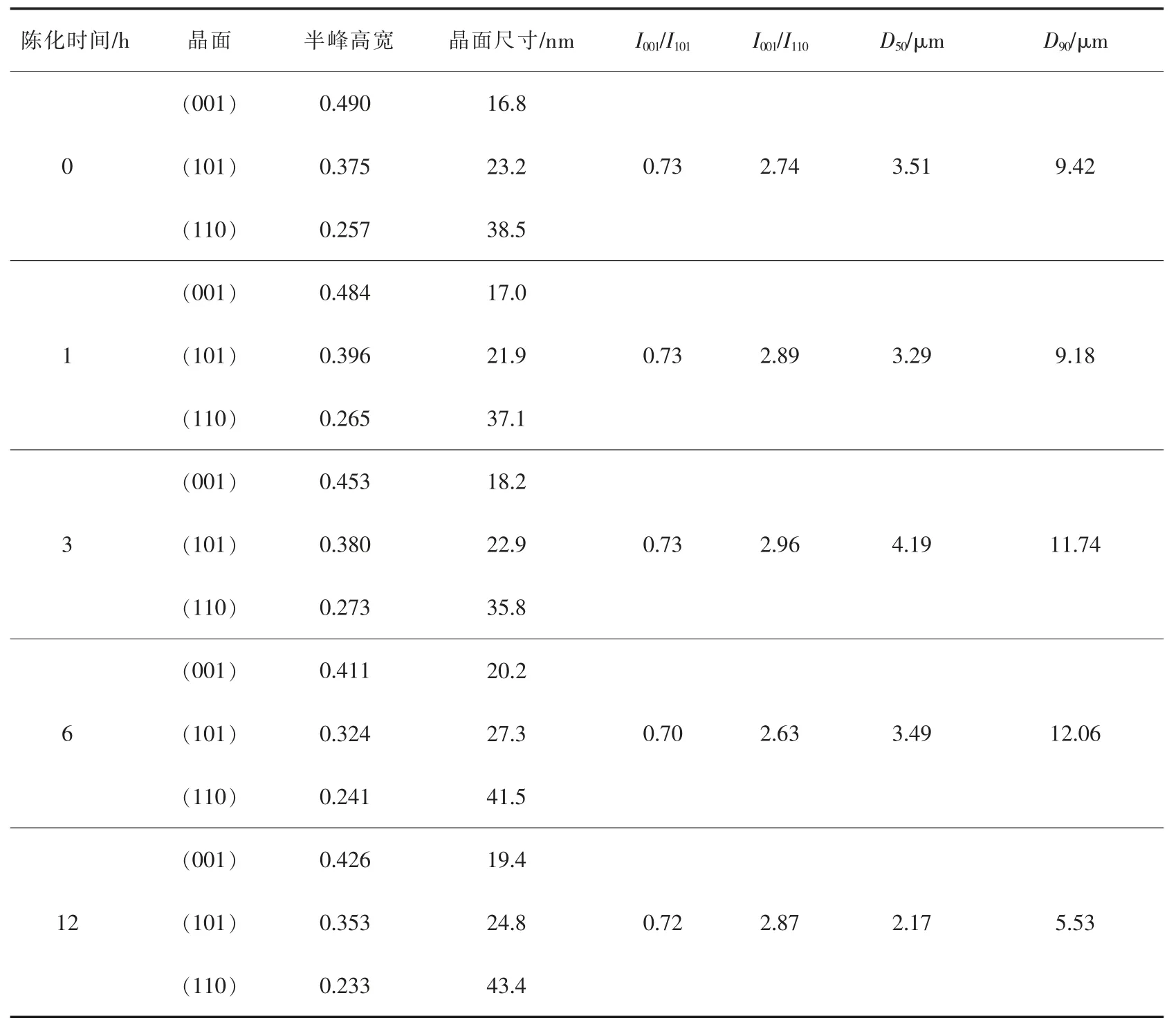
表4 不同陈化时间制备的氢氧化镁晶体特征参数(C(mg2+)=1 mol/L,T=45 ℃,V=5 mL/min)Table 4 Crystal characteristic parameters of magnesium hydroxide crystal surface prepared by different aging time(C(mg2+)=1 mol/L, T=45 ℃, V=5 mL/min)

图6 不同陈化时间制备的氢氧化镁(C(Mg2+)=1 mol/L,T=45 ℃,V=5 mL/min)Fig. 6 Magnesium hydroxide prepared at different aging time(C(Mg2+)=1 mol/L, T=45 ℃,V=5 mL/min)
2.5 优化条件的分析
综合上述反应条件对氢氧化镁结晶度、 粒径和Cl-含量的影响规律可知,在镁离子浓度为1.5 mol/L,反应温度为65 ℃,进料速度为5 mL/min,陈化时间为1 h 的条件下,制备氢氧化镁,为优化组。 同时在镁离子浓度为1.5 mol/L,反应温度为65 ℃,陈化时间为1 h 的条件下,将氨水和镁液直接混合,制备氢氧化镁,为空白组。 对制备的氢氧化镁样品进行相关表征,发现优化组所得氢氧化镁的XRD 衍射峰与标准卡片(PDF#83-0114)衍射峰基本一致(见图7)。结合SEM 可知,直接混合生成的氢氧化镁成不规则状,团聚严重(见图8(a));生成的优化组氢氧化镁为六角片状(见图 8(b)), 结合能谱图(见图 8(c))可知,生成的产品主要为氢氧化镁,含有少量钙离子、氯离子等杂质。 优化组的(001)面晶粒尺寸为13.1 nm,峰强比 I001/I101为 0.83,Cl-含量为 0.026 8%,粒度 D50=3.955 μm,D90=8.318 μm, 粒径分布均匀(见表 5)。

表5 氢氧化镁晶体特征参数(C(Mg2+)=1.5 mol/L、T=65 ℃、V=5 mL/min、t=1 h)Table 5 Crystal characteristic parameters of magnesium hydroxide crystal surface(C(Mg2+)=1.5 mol/L, T=65 ℃, V=5 mL/min, t=1 h)

图7 氢氧化镁优化组的XRD 图谱(C(Mg2+)=1.5 mol/L,T=65 ℃,V=5 mL/min,t=1 h)Fig. 7 XRD pattern of magnesium hydroxide optimized group(C(Mg2+)=1.5 mol/L, T=65 ℃,V=5 mL/min, t=1 h)

图8 氢氧化镁的 SEM 及能谱图示(空白组:C(Mg2+)=1.5 mol/L,T=65 ℃,t=1 h;优化组:C(Mg2+)=1.5 mol/L,T=65 ℃,V=5 mL/min,t=1 h)Fig. 8 SEM and energy spectrum image of magnesium hydroxide (Blank Group:C(Mg2+)=1.5 mol/L,T=65 ℃,t=1 h;Optimized Group:C(Mg2+)=1.5 mol/L,T=65 ℃,V=5 mL/min,t=1 h)
3 结 论
通过研究合成条件(Mg2+浓度、反应温度、进料速度和陈化时间)对合成氢氧化镁结晶度、粒径和氯根含量的影响,探究了盐湖卤水-氨法反向沉淀制备氢氧化镁的晶面生长规律。 主要结果如下:
1) 随着 Mg2+浓度和反应温度的提高, 有利于氢氧化镁(001)晶面的生长。 Mg2+浓度的增大、陈化时间的延长使得产物氢氧化镁中Cl-含量增大,影响纯度。
2) 氢氧化镁的粒径受反应条件及晶面生长、极性影响较大。 通过盐湖卤水-氨法反向沉淀能够制备得到 (001) 晶面尺寸为 13.1~19.4 nm、 粒径 D50为1.64~9.32 μm,Cl-含量<0.1%的六角片状氢氧化镁。
上述结果可为调控盐湖水氯镁石制备氢氧化镁晶面生长提供科学依据, 并为利用盐湖资源制备高纯、高附加值的氢氧化镁功能材料提供有益借鉴。
