阿帕替尼治疗多线治疗失败的晚期乳腺癌临床效果观察
2023-05-06曹莉莉
曹莉莉
(南通大学第二附属医院/南通市第一人民医院肿瘤科,江苏 226001)
乳腺癌是严重威胁女性健康最常见的恶性肿瘤之一[1],近年来全球乳腺癌发病率逐年升高,以每年3.1%速度增长[2-3]。3%~10%乳腺癌患者初诊时即有远处转移,超过30%早期乳腺癌患者在接受根治手术及术后辅助治疗后仍会发生远处转移,晚期乳腺癌总体中位生存时间为2~3年[4]。目前晚期乳腺癌尚无法治愈,多采用化疗、靶向、内分泌治疗为主的综合治疗,但部分患者经多线治疗后病情仍会进展,因此,寻找新的治疗靶点、研发新型治疗药物十分有必要。血管生成是恶性肿瘤细胞增殖、迁移的关键步骤,近年来抗血管生成靶向药物成为研究的热点之一。甲磺酸阿帕替尼是一种新型小分子血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)酪氨酸激酶抑制剂(TKI),通过抑制VEGFR-2 与VEGF 结合,阻止其下游通路的激活,从而抑制内皮细胞增殖,抑制肿瘤组织新生血管的生成[5]。阿帕替尼已被国家食品药品监督管理总局批准用于晚期胃癌的三线治疗和晚期肝细胞肝癌的二线治疗[6-7],在乳腺癌、肺癌、结直肠癌等实体肿瘤中也开展了临床研究,并显示显著疗效[8-10]。本文回顾性分析我院2017年1月—2020年6月收治的经多线治疗失败的晚期乳腺癌患者46 例临床资料,总结阿帕替尼临床疗效及不良反应。
1 资料与方法
1.1 一般资料 晚期乳腺癌患者46 例,均为经三线及以上化疗或内分泌治疗失败后且不能耐受化疗的患者,中位年龄52 岁(31~72 岁),年龄<50 岁22例,≥50 岁24 例;病理类型均为浸润性导管癌,ER阳性32 例,阴性14 例,PR 阳性29 例,阴性17 例;Ki-67<30% 22 例,≥30% 24 例;转移部位<3 个26例,≥3 个20 例;既往行手术治疗30 例,使用过蒽环类药物28 例;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1 分25 例,2 分21 例。根据是否发生阿帕替尼治疗相关性高血压将患者分为继发高血压组16 例和无继发高血压组30 例。纳入标准:(1)女性,年龄≥18 岁;(2)经病理组织或细胞学确诊为晚期乳腺癌;(3)ECOG 评分0~2 分;(4)预计生存时间≥2 个月;(5)有可测量的靶病灶;(6)既往无高血压;(7)患者签署治疗知情同意书。排除标准:(1)临床资料不完善及失访者;(2)合并其他肿瘤及不可控制的基础性疾病。
1.2 治疗方案 患者均接受甲磺酸阿帕替尼片治疗,餐后半小时口服,初始剂量500 mg/次,1 次/天,直至病情进展或不能耐受。当治疗过程中出现3 级及以上或无法耐受的任何不良事件时,暂停用药至不良事件好转(降至1 级非血液学毒性和2 级及以下血液学毒性)后下调剂量为250 mg/次,1 次/天。若减量后患者再次出现3 级及以上不良反应,则予停药。治疗期间不进行其他抗肿瘤治疗。通过门诊、住院复查和电话进行随访,随访截止日期为2021年4月10 日。
1.3 疗效与不良反应评估 (1)疗效评价:根据实体瘤疗效评价标准(response evaluation criteria in solid tumours 1.1,RECIST 1.1),通过影像学检查评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),客观缓解率(ORR)=(CR 例数+PR 例数)/总例数×100%;疾病控制率(DCR)=(CR 例数+PR 例数+SD 例数)/总例数×100%。(2)无进展生存期(PFS):为开始治疗至疾病进展或任何原因造成死亡的时间。(3)不良反应:非血液学不良反应包括高血压、蛋白尿、手足综合征、乏力纳差、腹泻和声音嘶哑,血液学不良反应包括白细胞、粒细胞、血小板计数减少、血红蛋白浓度降低,按照美国国立癌症研究院通用不良反应标准NCI-CTCAE 4.0 进行评价。
1.4 统计学处理 应用SPSS 26.0 统计学软件进行数据分析。计数资料以频数和百分比表示,组间比较采用卡方检验或Fisher 确切概率法;Kaplan-Meier法绘制生存曲线,生存率比较采用Log-rank 法。采用Cox 回归分析影响晚期乳腺癌患者预后的因素。以P<0.05 为差异有统计学意义。
2 结 果
2.1 近期疗效 全组患者治疗4 周后PR 12 例,SD 25 例,PD 9 例,ORR 为26.1%,DCR 为80.4%。继发高血压组和无继发高血压组ORR 分别为43.8%(7/16)和16.7%(5/30),差异无统计学意义(P=0.101),DCR 分别为87.5%(14/16)和76.7%(23/30),差异无统计学意义(P=0.623)。
2.2 无进展生存期 全组患者中位PFS 为4.2 个月,继发高血压组中位PFS 为6 个月,长于无继发高血压组的4 个月,差异有统计学意义(P=0.014)。见图1、图2。
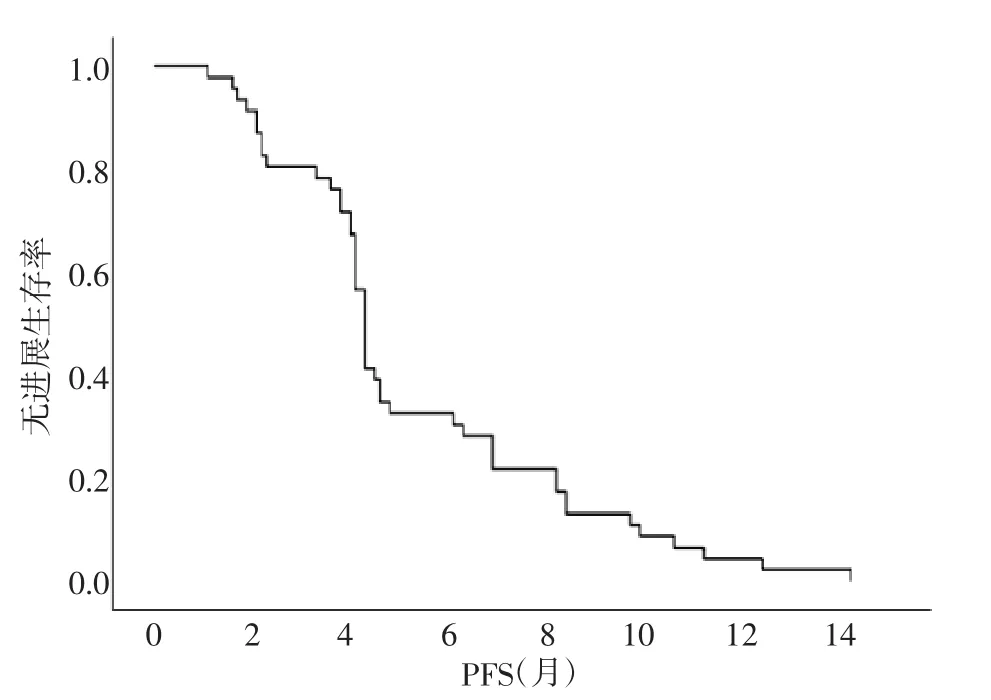
图1 全组患者PFS 曲线
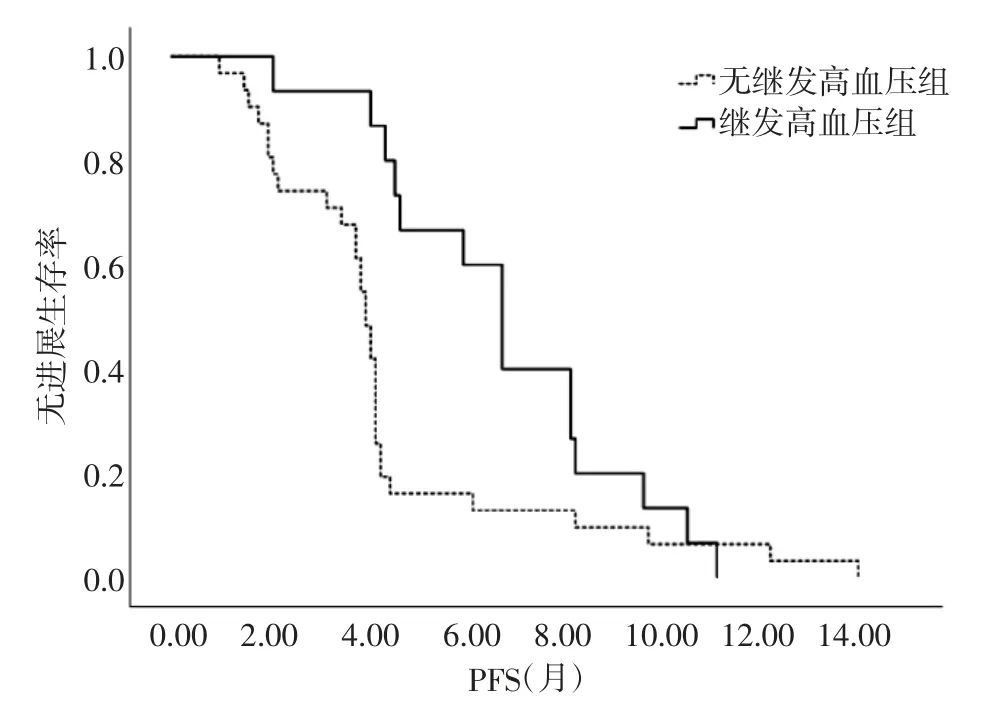
图2 继发高血压组与无继发高血压组PFS 比较
2.3 PFS 影响因素 单因素分析显示,患者年龄、激素受体状态、Ki-67 表达、转移部位数、蒽环类药物治疗史、手术史、放疗史、ECOG 评分均与PFS 无关(P>0.05),而治疗相关性高血压与PFS 有关(P=0.014)。Cox 回归多因素分析显示,治疗相关性高血压是延长晚期乳腺癌患者PFS 的保护性因素(OR=2.722,95%CI:1.272~5.825,P=0.010)。见表1、表2。
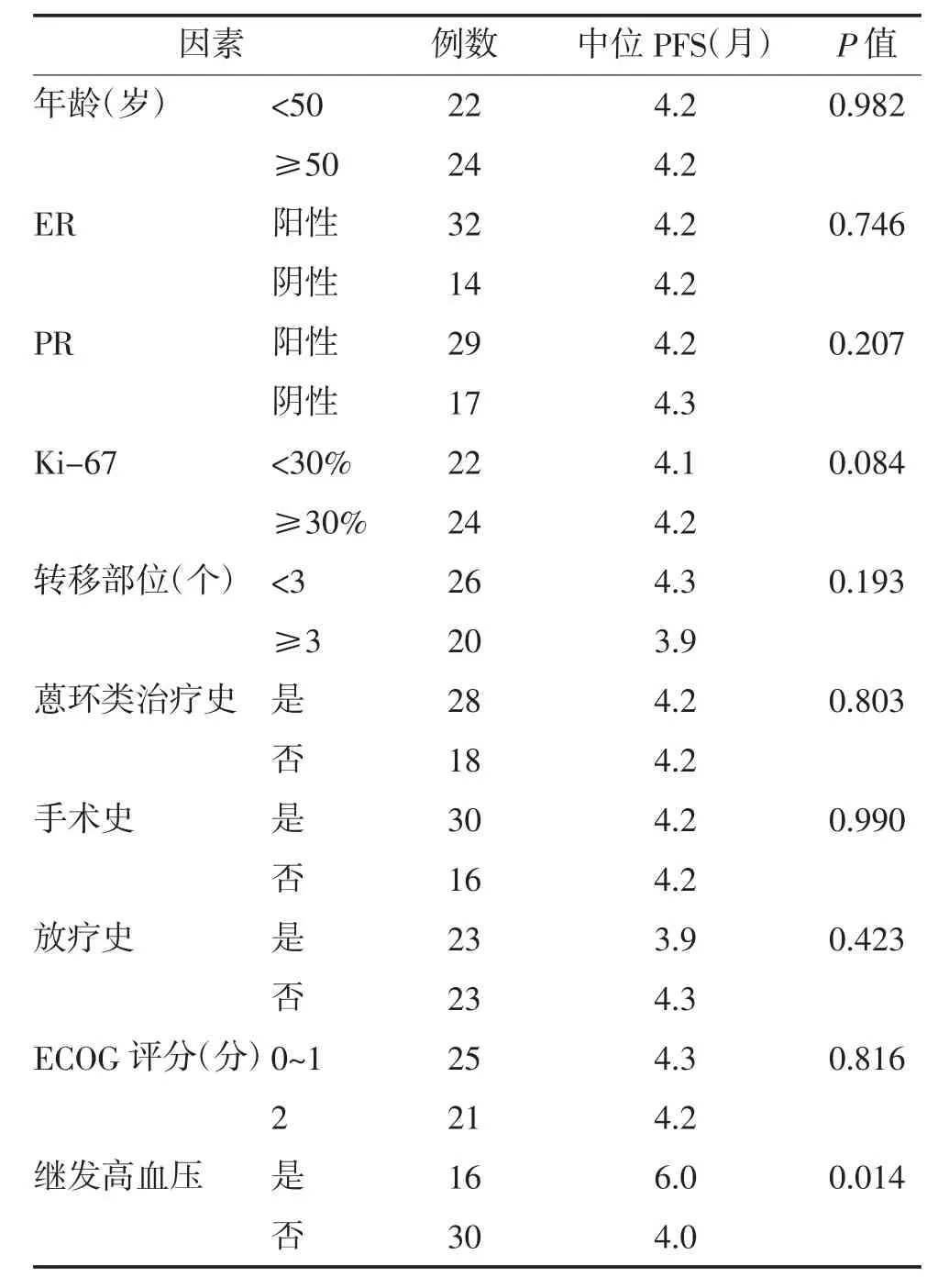
表1 影响晚期乳腺癌患者PFS 单因素分析
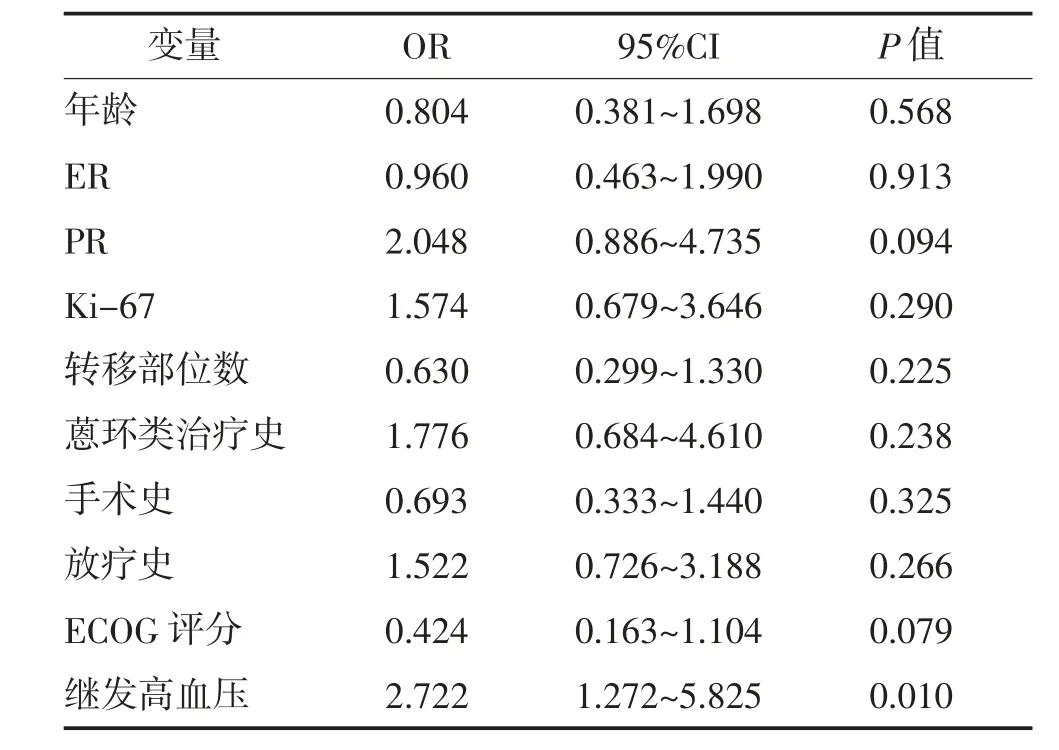
表2 影响晚期乳腺癌患者PFS 多因素分析
2.4 不良反应 阿帕替尼最常见的不良反应为高血压16 例(34.8%)、蛋白尿15 例(32.6%)、血液学毒性(粒细胞、血小板减少)15 例(32.6%)和手足综合征12 例(26.1%),较少见的为乏力纳差4 例(8.7%)、腹泻5 例(10.9%)、声音嘶哑1 例(2.2%)。有12 例出现3~4 级不良反应,予以暂停用药,经对症处理症状缓解后阿帕替尼剂量降至250 mg/d 继续治疗,无永久停药患者。其余患者不良反应为1~2级,经对症治疗后好转,维持阿帕替尼原剂量完成治疗。
3 讨 论
血管生成与肿瘤的生长、浸润、转移密切相关,VEGFR-2 作为促血管生成信号转导的重要分子枢纽,在诱导血管生成过程中发挥着重要作用[11],阻断VEGFR-2 通路被认为是一种潜在的抗肿瘤治疗方法。阿帕替尼是我国自主研发的抑制VEGFR-2 的小分子TKI,其毒副反应小且易控制,已在多种晚期恶性肿瘤中取得令人振奋的结果。有研究证实,阿帕替尼通过抑制p-Erk 信号通路诱导MDA-MB-231人乳腺癌细胞凋亡,同时促进细胞自噬,为该药用于乳腺癌临床治疗提供新的理论依据[12]。
目前有关阿帕替尼在乳腺癌中的临床研究还较少,处于探索阶段。HU 等[13-14]II 期临床试验证实,晚期三阴性乳腺癌患者中位PFS 为3.3 个月,中位OS为10.6 个月,晚期非三阴性乳腺癌患者中位PFS 为4.0 个月,中位OS 为10.3 个月。本研究结果与上述研究结果相似,全组患者的中位PFS 为4.2 个月,且近期疗效显著,ORR 达26.1%,DCR 达80.4%。提示多种方案治疗失败后的晚期乳腺癌患者应用阿帕替尼仍可获得较好疗效,临床获益显著。本研究分组研究显示,继发高血压组和无继发高血压组近期疗效差异无统计学意义(均P>0.05),但继发高血压组中位PFS 更长,差异具有统计学意义(P=0.014)。Cox多因素分析结果显示,治疗相关性高血压与患者PFS 有关(P=0.010),是PFS 延长的保护性因素。
本研究使用阿帕替尼500 mg/d 作为起始剂量,主要不良反应为高血压、蛋白尿、粒细胞和血小板减少及手足综合征,大多为1~2 级,3~4 级发生率较低,且通过减量、暂停用药及对症治疗后症状得到有效控制,均可继续服药,耐受性良好,与其它临床研究报道相当[13-15]。高血压是VEGF/VEGFR 抑制剂最常见的不良反应之一,本研究中高血压发生率最高,为34.8%。阿帕替尼引起高血压的机制尚不明确,可能由以下原因共同作用导致:抑制一氧化氮的合成和分泌,引起血管收缩;血管内皮损伤、凋亡,小血管及毛细血管数量减少、血管密度降低,增加外周血管压力;促使血管内皮细胞增生、血管僵硬、狭窄;与肾小球相应受体结合,抑制肾脏毛细血管的生长增殖,出现肾小球硬化、蛋白尿等,进而引起高血压等不良反应[16-18]。
综上所述,多线治疗失败的晚期乳腺癌患者可从阿帕替尼治疗中获益,不良反应可控可耐受,治疗相关性高血压可能是治疗有效的预测因素,值得临床推广应用。本研究样本量小,未随访患者总生存时间,存在一定的局限性,还有待于今后扩大样本量进一步深入研究。
