SD 大鼠骨髓基质干细胞的全骨髓培养与鉴定*
2023-05-06左右清胡熙苒
邓 娟,左右清,王 念,胡熙苒,曾 礼
(1 湘潭医卫职业技术学院临床学院,湖南 411104;2 中南大学湘雅医学院基础医学院)
应用组织工程技术修复损伤是当前研究的热点,其前提和关键是优化种子细胞的选取,骨髓基质干细胞(bone marrow mesenchymal stem cells,BMSCs)则是一种比较理想的种子细胞来源[1-2]。FRIEDENSTENI 通过培养骨髓液发现贴壁生长的细胞,随着传代次数的增加,细胞越来越均匀,呈形态一致的长形或长梭形[3]。全骨髓培养法操作相对简单,对设备要求不高,且细胞活性好[4]。因此本实验采集SD 大鼠股骨骨髓液,采用全骨髓培养方法培养骨髓基质干细胞,流式细胞仪检测BMSCs 表面标志物CD29、CD34、CD45,鉴定骨髓基质干细胞的纯度。
1 试剂与方法
1.1 实验动物及主要试剂 4 周龄SD 健康大鼠,体重180~200 g(中南大学湘雅医学院动物中心提供),L-DMEM 培养基(GIBCO 公司),胎牛血清(FBS,Hyclone 公司),FITC anti-rat CD29 及同型阴性对照、FITC anti-rat CD45 及同型阴性对照(Biolegend 公司),FITC anti-rat CD34 及同型阴性对照(北京博奥森公司)。
1.2 骨髓基质干细胞培养 取SD 大鼠1 只,乙醚麻醉,75%酒精中浸泡7~10 min。无菌条件下取双侧股骨,剪断两端,注射器吸取含10%胎牛血清L-DMEM 培养基5 mL 冲洗骨髓腔获得骨髓液,吸管反复吹打,制成单细胞悬液。分种在4 瓶50 mL 塑料培养瓶中,置于5%CO2、饱和湿度、37 ℃培养箱培养。分别于24 h、48 h 半量换液,注意不要摇晃,72 h时全量换液,换液时轻轻震荡培养瓶,倒出旧液,以去掉非贴壁细胞,之后每3 天换液1 次。待细胞融合铺满瓶底80%以上,用0.25%胰蛋白酶消化,以1∶2传代,7~10 天传第一代,以后3~5 天传代,传至第三代进行流式细胞仪检测。
1.3 流式细胞仪检测 每瓶培养瓶加0.8 mL 胰酶,在培养箱中消化30 s,待细胞大部分变圆,加入培养液终止消化,吹打并收集细胞于离心管中,1 500 r/min离心5 min,PBS 重悬细胞,进行细胞计数。1 000 r/min离心8 min,以含1%小牛血清的PBS 重悬细胞,离心弃上清,加1 mL 含1%小牛血清的PBS 重悬细胞,移入1.5 mL 大EP 管,1 000 r/min 离心6~8 min,弃上清,加400 μL PBS,重悬,分装8 支EP 管,每管50 μL 细胞悬液。加荧光直接标记一抗,国产抗体为5 μL/100 μL,进口抗体为1 μL/100 μL,混匀,涡旋5 min,在4℃冰箱孵育20~30 min,PBS 洗3~5 次,每管加入0.5 mL PBS 重悬,上流式细胞仪检测。
2 结 果
2.1 BMSCs培养不同时间点形态学特征 以全骨髓培养法培养BMSCs,将骨髓细胞接种于培养瓶中,镜下可见满视野小圆形、悬浮的有核细胞。24 h 半量换液时可见少量散在的贴壁细胞,细胞形态幼小、短圆。48 h 半量换液及72 h 全量换液时可见贴壁细胞增多和少量克隆样生长的细胞团,细胞形态稍变长,排列不紧密,间距较大(图1)。通过换液逐渐清除未贴壁细胞,贴壁细胞得以纯化,数量逐渐增多,间距逐渐变小,出现细胞集落和典型的长梭形或长形细胞(图2)。原代BMSCs 生长比较缓慢,一般7~10 天传第一代,传代后细胞生长迅速,3~5 天传一代,细胞间排列紧密,呈鱼群样或漩涡样生长。通过传代细胞不断纯化,传到第三代细胞形态趋于一致,呈长梭形、旋涡状或鱼群样生长,纯度可达到98.6%以上(图3、4)。

图1 原代第2 天(100×)

图2 原代第9 天(100×)
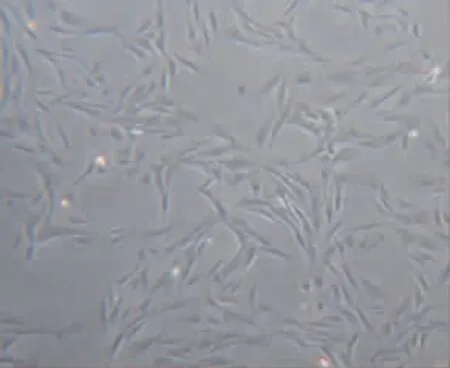
图3 第3 代第2 天(100×)

图4 第3 代第5 天(100×)
2.2 流式细胞仪检测结果 采用流式细胞仪检测第三代BMSCs 表面簇分化抗原(CD),CD29 阳性率为99.0%(图5),CD34 阳性率公为1.5%(图6)。CD45 阳性率公为0.8%(图7),说明获得的BMSCs纯度较高,基本排除了造血干细胞、单核细胞的干扰,与文献报道的骨髓来源BMSCs 表面表达的蛋白分子相同(图8)。
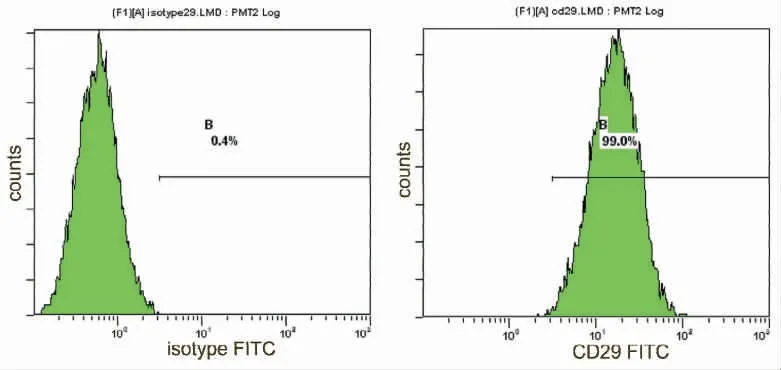
图5 CD29 同型对照与BMSCs 表面CD29 表达率
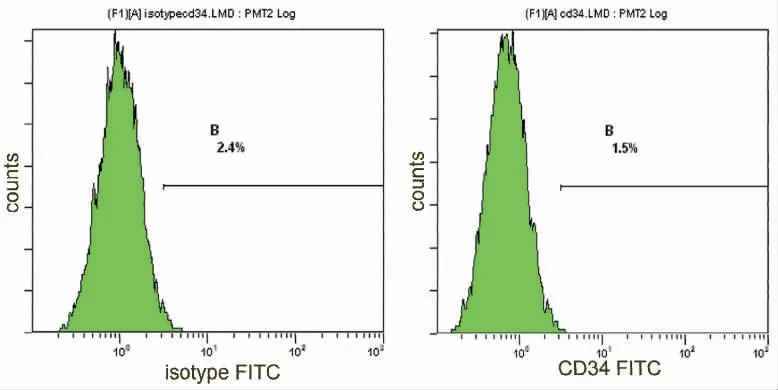
图6 CD34 同型对照与BMSCs 表面CD34 表达率
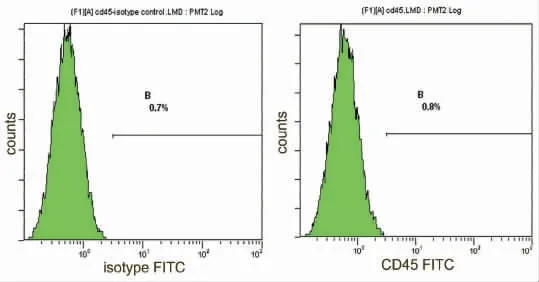
图7 CD45 同型对照与BMSCs 表面CD45 表达率
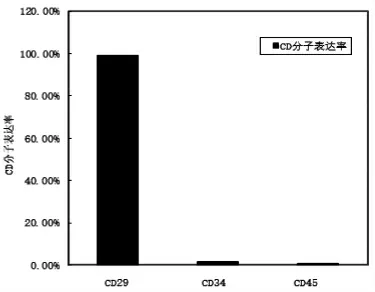
图8 BMSCs 表面CD 分子表达率
3 讨 论
骨髓基质干细胞是一种具有多向分化潜能的干细胞,当给予不同的理化或生物环境,可以向软骨细胞、神经细胞、成骨细胞、脂肪细胞等分化[5-8],在骨重建和损伤组织再生中发挥重要作用[9],在股骨头坏死[10]、软骨损伤、肌腱缺损、骨骼肌损伤、皮肤损伤[11]、脑缺血[12]等疾病中也具有广阔的应用前景。
骨髓基质干细胞培养方法主要有密度梯度离心法、免疫磁珠分离法、全骨髓培养法等[13]。前两者需要特殊设备和技术,虽然可得到高纯度骨髓基质干细胞,但离心和分选过程对细胞活性影响很大,甚至失活[14]。而全骨髓培养法操作简单、成本低廉、技术要求不高,能模拟体内骨髓环境,更适合细胞生长,且混杂的红细胞、白细胞等随着换液和传代而被去掉,得到较纯的BMSCs,因而被广泛采用。但需注意的是,在原代培养过程中红细胞密度过高会阻碍细胞贴壁,裂解产生的酸性产物等对细胞产生毒害作用。因此适当的种植密度和换液是培养成败的关键[15]。
迄今为止,仍未发现BMSCs 特异性分子,国际细胞治疗学会(International Society for Celluar Therapy,ISCT)提出了定义BMSCs 的三个标准[16]:(1)体外培养条件下BMSCs 必须贴壁生长;(2)BMSCs 必须积极表达多种抗原分子,如CD29、CD73、CD90、CD105,而不表达造血干细胞特异性表面抗原分子,如CD34、CD45 和单核细胞、B 淋巴细胞的表面标志分子;(3)这些细胞在体外特定培养条件下至少可以向骨、软骨和脂肪细胞三个方向分化。本实验采用全骨髓培养法,流式细胞仪检测细胞表面分子表达,结果显示细胞CD29 表达阳性率达99%,而CD34 阳性率公1.5%,CD45 阳性率公0.8%,排除了造血干细胞、单核细胞等干扰,得到较高纯度的BMSCs。
