细胞凋亡相关基因CD44 在甲状腺癌组织中的表达及其与肿瘤侵袭和免疫细胞浸润关系的生物信息学分析
2023-05-06肖志远马鑫雨金连辉
肖志远, 宋 冰, 马鑫雨, 金连辉, 郑 通, 柴 芳
(1.锦州医科大学附属第一医院甲状腺外科,辽宁 锦州 121001;2.锦州医科大学附属第一医院内分泌与代谢性疾病科,辽宁 锦州 121001;3.锦州医科大学公共卫生学院职业卫生与环境卫生学教研室,辽宁 锦州 121001)
甲状腺癌(thyroid carcinoma,THCA)是最常见的内分泌肿瘤之一,其发病率位于所有癌症中的第9 位,但其具体发病机制目前仍不清楚[1]。凋亡相关基因CD44 是一种细胞表面蛋白,其表达上调与肿瘤的细胞增殖、浸润、血管生成、转移和预后相关[2-3]。HU 等[4]研究显示:CD44 蛋白的表达可能与膀胱癌的进展、转移和预后有关。既往研究[5-6]表明:生物信息学分析对于阐明众多差异表达基因(differentially expressed genes,DEGs)的功能及评估THCA 发生发展的复杂性具有重要意义。本研究旨在应用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和TIMER 数据库分析CD44 mRNA 在THCA 组织及癌旁组织中表达水平的差异,并通过临床标本验证(免疫组织化学SABC 法),探讨CD44 蛋白与THCA 患者临床病理特征和肿瘤免疫细胞浸润的关系,为THCA的诊断及治疗提供参考。
1 资料与方法
1.1 数据下载从 TCGA 数 据 库 (https://portal.gdc.cancer.gov/)中筛选THCA 相关的RNA 序列表达谱,得到58 种正常组织和510 种肿瘤组织。从基因集 富 集 分 析 (Gene Set Enrichment Analysis,GSEA)分 子 特 征 数 据 库 v7.1 的 基 因 集“HALLMARK_ APOPTOSIS”中获得161 个凋亡相关基因(apoptosis-related genes,ARGs)[7]。
1.2 ARGs 的选择采用mRNA 表达谱、limma 软件包和R 软件(V3.6.3 版 本)中 的 Wilcoxon 秩 和t检 验[|log2FC|>1,错误发现率(false discovery rate,FDR)<0.05)]来分析THCA 队列中表达显著不同的ARGs。
1.3 THCA 中CD44 mRNA 的差异 表达通过分析TCGA 中CD44 mRNA 的表达数据检测CD44 mRNA 在THCA 中表达。使用受试者工作特征(receiver operating characteristic,ROC)曲线分析CD44 在THCA 样本和正常样本间的鉴别价值。
1.4 基因本体(Gene Ontology,GO)生物功能富集、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)和GSEA 分析及蛋白-蛋白互作(protein-protein interaction,PPI)网络分析通过GO 富集、KEGG 通路分析和GSEA 分析评估DEGs 的潜在生物学功能,通过R 软件包(V3.6.3 版本)进行可视化[8-9]。使用STRING 数据 库 (http://www.string-db.org/)中 的PPI 网络确定CD44 与所选DEGs 之间的相互作用,并使用 Cytoscape 软件(www.cytoscape.org/)进行可视化[10-11]。
1.5 CD44 mRNA 表达水平与肿瘤浸润淋巴细胞(tumor infiltrating leukocytes,TILs)的关系
采用TIMER 2.0 数据库Immune Association 模块中的Gene 分析CD44 mRNA 表达水平与免疫细胞(CD4+T 淋巴细胞、T 淋巴细胞、CD56 细胞、CD8+T 淋巴细胞、巨噬细胞和中性粒细胞)浸润丰度的相关性。基于基因表达谱,通过基因组变异分析推断出TILs 的相对浸润丰度。
1.6 CD44 蛋白表达与免疫检查点基因之间的相关性采用R 软件(V3.6.3 版 本)分析THCA 中CD44 蛋白表达与47 个免疫检查点基因之间的相关性,结果使用热图可视化。
1.7 临床资料收集锦州医科大学附属第一医院2021 年4—9 月行手术切除的THCA 患者标本,包括肿瘤组织和癌旁配对正常甲状腺组织(距癌灶2 cm 内)110 例,其中男性25 例,女性85 例,年龄(48±12)岁。纳入标准:①全部患者未行放疗、化疗和内分泌等针对肿瘤的任何治疗;②经手术后病理证实为THCA。排除标准:①并发桥本甲状腺炎等甲状腺相关疾病;②THCA 家族史。本研究经锦州医科大学附属第一医院伦理委员会批准(批准文号:202233),所有患者均签署知情同意书。
1.8 主要试剂和仪器兔 抗 人CD44 (货 号:WL03521,中 国Wanleibio 公司),HRP-标记山羊抗兔IgG(货号:111-035-003,美 国Jackson Immuno Research 公司),DAB 显色液(货号:DAB-1031,福州迈新生物技术开发有限公司),显微镜(型号:Eclipse Ci-L,日本尼康仪器有限公司),显微镜拍照系统(型号:Nikon DS-F12,日本尼康仪器有限公司),微波炉(型号:P70D20N1P-G5,中国格兰仕集团有限公司)。
1.9 免疫组织化学SABC 法检测CD44 蛋白表达情况
将所收集的110 例THCA 组织及癌旁组织进行免疫组织化学检测,采用10%甲醛溶液固定组织,常规脱水、透明和蜡块包埋,以厚度为4 μm 连续切片,微波修复,3%过氧化氢孵育,血清封闭。依次添加一抗(4 °C 过夜)和二抗,DAB 显色后,苏木精复染后常规脱水透明中性胶封口。PBS 缓冲液取代一抗作为阴性对照。结果判定:免疫组织化学检测结果由2 位经验丰富的病理科医生采用双盲法独立阅片。判定为阳性的结果是胞浆中具有棕黄色的颗粒沉淀。按照着色强度确定分级:无着色为0 级,浅黄色为1 级,黄色为2 级,棕黄色为3 级。根据细胞染色比例计分:阳性细胞的数目占全部细胞的数目百分率≤9%计为0 分,10%~25% 计为1 分,26%~50%计为2 分,51%~74%计为3 分,≥75%计为4 分。着色强度乘以阳性细胞百分率大于3 为阳性,其结果分为4 级:0~2 分(-),3~4 分(+),6~8 分(⧺),9~12 分(⧻)。
1.10 统计学分析
采用R 软件(V3.6.3 版本)进行数据整理、统计学分析和绘图,采用SPSS 25.0 统计软件进行统计学分析。TCGA-THCA 中CD44 mRNA表达水平和免疫细胞浸润的关联性指标不符合正态分布,组间比较采用Wilcoxon 检验。利用pROC包(1.17.0.1 版本)对ROC 曲线进行CD44 临界值检测,用ggplot2 包(3.3.0 版本)进行可视化。采用 Pearson 相关分析法分析CD44 mRNA 与免疫细胞浸润之间的相关性。以P<0.05 为差异有统计学意义。
2 结 果
2.1 TCGA 数据库中THCA 与CD44 的相关性
2.1.1 THCA 组织中DEGs 的表达水平 按照筛选条件,共获得32 个差异表达的DEGs,其中基因表 达 上 调(GPX1、CDKN1A、TGFB2、BAX、BCL2L1、CD44、ANXA1、PMAIP1、CCND2、F2R、CLU、TNFRSF12A、CCND1、ERBB3、BID、LGALS3、IGFBP6、CCNA1、TIMP1 和EREG)20 个,表 达 下 调(BMP2、AVPR1A、DCN、JUN、CTH、EGR3、IL6、CD69、ATF3、CD38、TGFBR3 和HGF)12 个,橙色代表表达上调基因,蓝色代表表达下调基因,黑色代表无差异基因,568 个样本中32 个差异表达基因热图见图1。

图1 TCGA 数据库中THCA 组织中DEGs 的表达Fig.1 Expression of DEGs in THCA tissue in TCGA Database
2.1.2 THCA 患者癌组织和癌旁组织中CD44 mRNA 表达水平 THCA 患者癌组织(n=58)中CD44 mRNA 表达水平明显高于癌旁组织(n=58)(P<0.001)。非配对数据分析结果显示:THCA 患者癌组织(n=510)中CD44 mRNA 的表达水平明显高于癌旁组织(n=58)(P<0.001)。见图2。

图2 THCA 患者癌组织和癌旁组织中CD44 mRNA 表达水平Fig.2 Expression levels of CD44 mRNA in cancer and paracancerous tissues of THCA patients
2.1.3 ROC 曲 线 确 定CD44 mRNA 对THCA 组织及癌旁组织的鉴别效能 ROC 曲线分析结果显示:ROC 曲线下面积(area under curve,AUC)最大为0.865(95% CI:0.833~0.897)。在临界值为6.855 时,其灵敏度、特异度和准确性分别为89.71%、75.13% 和72.91%,阳 性 预 测 值 为98.52%,阴性预测值为29.13%。见图3。
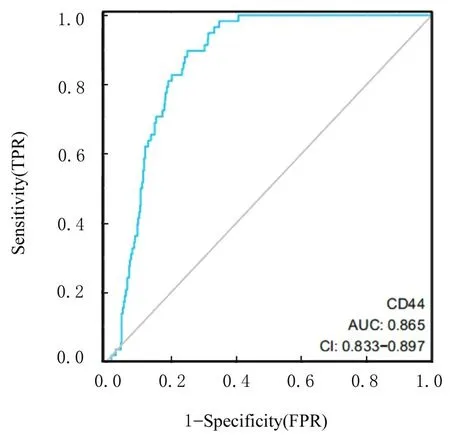
图3 CD44 mRNA 表达鉴别THCA 组织和癌旁组织的ROC 曲线Fig.3 ROC curves of expression of CD44 mRNA in THCA tissue and paracancerous tissue
2.1.4 DEGs 功能富集分析和PPI 网络构建 GO分析主要包括细胞组成(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)3 个部分,分析结果显示:BP 主要与外源性凋亡信号通路、线粒体释放细胞色素C 和凋亡信号通路的调控有关,MF主要与生长因子活性、蛋白激酶调节活性和细胞周期蛋白依赖性蛋白丝氨酸/苏氨酸激酶调节活性有关。GSEA 分析结果显示:DEGs 表达与中性粒细胞脱颗粒反应有关。KEGG 分析结果显示:DEGs主要富集在 p53 和磷脂酰肌醇 3-激酶(phospatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)等信号通路。PPI 分析结果显示:CD44 与DEGs 相互作用。见图4。
2.2 THCA 患者CD44 mRNA 表达水平与TILs 浸润丰度的相关性
应用TIMER 数据库分析CD44 mRNA 表达水平与7 种TILs 浸润丰度的相关性,结果显示:CD44 mRNA 表达水平与B 细胞、巨噬细胞、CD4+T 淋巴细胞、树突状细胞和中性粒细胞浸润丰度呈正相关关系(partial.cor>0,P<0.01),与肿瘤纯度和CD8+T 淋巴细胞浸润丰度无相关性(partial.cor≤0,P<0.01)。见图5。

图5 THCA 患者癌组织中CD44 mRNA 表达水平与TILs 浸润丰度的相关性Fig.5 Correlations between expression level of CD44 mRNA in cancer tissue of THCA patients and infiltration abundance of TILs
2.3 THCA 组织中CD44 蛋白表达水平与免疫检查点基因的关系
R 软件分析结果显示:在THCA 组织中CD44蛋 白 表 达 水 平 与NRP1、CD27、TNFSF15、TNFRSF25、CD276、CD200、HHLA2、TNFRSF8 和CD40 基因表达水平呈正相关关系(P<0.01),与CD274 基因表达水平呈负相关关系(P<0.01)。见图6。

图6 THCA 患者癌组织中CD44 蛋白表达水平与免疫检查点基因表达水平的关系Fig.6 Relationships between expression of CD44 protein and expression levels of immune checkpoint gene in cancer tissue of THCA patients
2.4 THCA 患者癌组织及其癌旁组织中CD44 蛋白阳性表达率
免疫组织化学SABC 法检测结果显示:CD44蛋白主要定位于细胞膜或细胞质,显微镜下可见黄色或棕黄色颗粒,癌旁组织局灶呈弱表达或不表达。见图7。在癌组织中CD44 蛋白阳性表达率高于 癌 旁 组 织 [69.09% (76/110)vs20.91%(23/110)],差 异 有 统 计 学 意 义(χ²=51.589,P<0.001)。
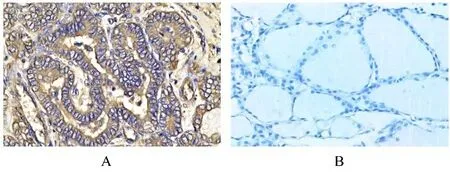
图7 THCA 患者癌组织和癌旁组织中CD44 蛋白的表达情况(免疫组织化学,×200)Fig.7 Expressions of CD44 protein in cancer tissue and paracancerous tissue of THCA patients(Immunohistochemistry,×200)
2.5 CD44 蛋白阳性表达率与THCA 患者临床病理特征的关系
免疫组织化学SABC 法检测结果显示:与癌旁组织比较,THCA 患者癌组织中CD44 蛋白阳性表达率与肿瘤直径和淋巴结转移有关(P<0.05),与患者性别、年龄和腺外侵犯无关(P>0.05)。见表1。
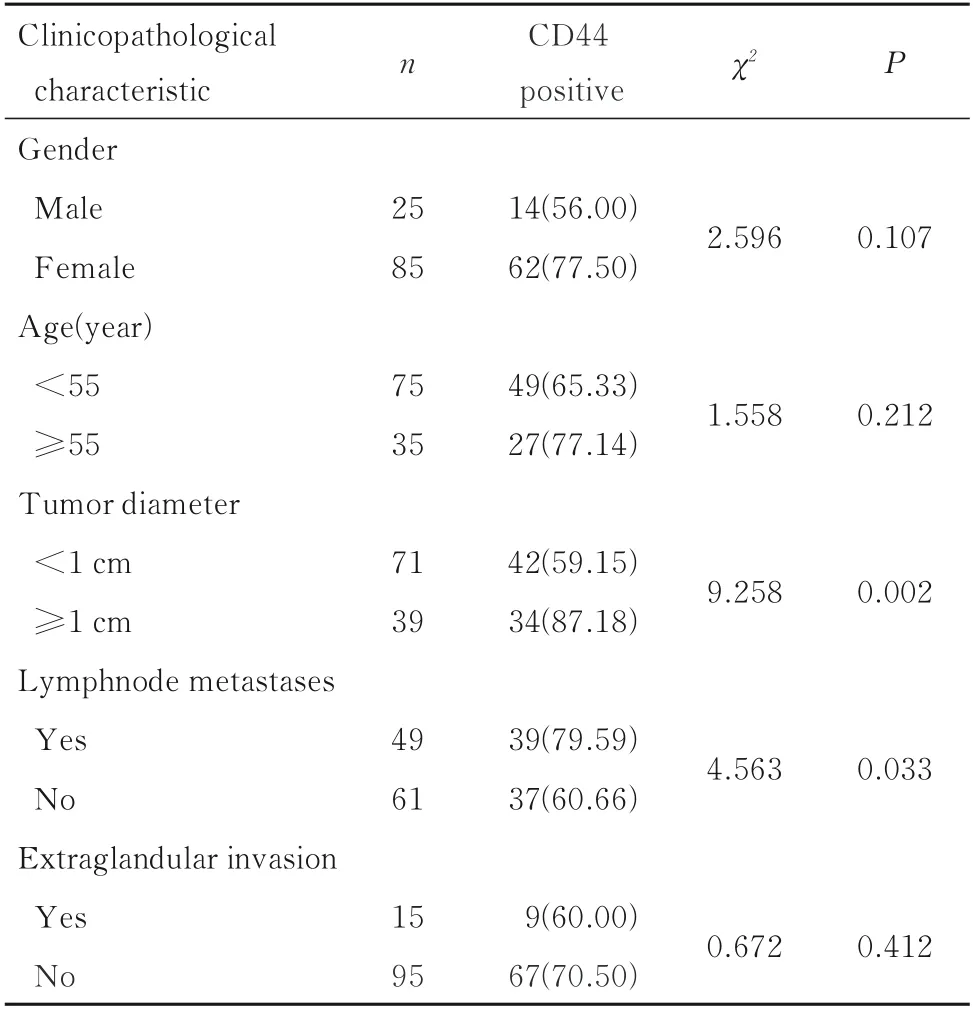
表1 THCA 患者癌组织中CD44 蛋白阳性表达率与患者临床病理特征的关系Tab.1 Relationships between expression of CD44 protein in cancer tissue and clinicopathological characteristics of THCA patients [n(η/%)]
3 讨 论
近年来THCA 的发病率迅速上升[12],通过手术治疗THCA 虽然可以取得满意的效果,但甲状腺活检呈特殊病例亚型及并发甲状腺局部晚期癌的患者预后仍然较差。本研究采用生物信息学方法筛选出32 个与THCA 相关的ARGs,GO 分析结果显示:上述32 个基因主要参与细胞凋亡相关的信号通路;KEGG 分析结果显示:32 个基因主要与p53、PI3K-Akt 和凋亡途径信号通路有关。而PI3K-Akt 信号传导通路的过度激活在THCA 的发生 发 展 过 程 中 起 重 要 作 用[13]。RYU 等[14]研 究 显示:CD44 mRNA 表达水平与THCA 患者的生存率有明显相关性。CD44 是编码人类11 号染色体上高度保守的基因,由20 个外显子和19 个内含子组成,是一种非激酶细胞表面跨膜糖蛋白,通过在肿瘤细胞中过表达促进癌细胞的增殖、转移、侵袭和迁移等[15-16]。NAM 等[17]认为:沉默CD44 mRNA 表达可以抑制三阴性乳腺癌细胞的生长和迁移。CD44蛋白在膀胱癌、胆囊癌、口腔鳞状细胞癌、卵巢癌、头颈部鳞癌和胃癌组织中广泛高表达,并且与肿瘤的侵袭性和不良预后有关[18-23]。本研究结果显示:在THCA 患者癌组织中CD44 蛋白表达水平明显高于癌旁组织,并与颈部淋巴结转移和肿瘤直径有关,与FIGGE 等[24]研究结果一致,提示该基因在促进THCA 进展的过程中起到一定作用。本研究中ROC 曲线分析结果显示:CD44 mRNA 表达水平在区分THCA 组织及癌旁组织中具有诊断意义,其灵敏度、特异度和准确性分别为89.71%、75.13%和72.91%。提示CD44 基因可作为一种诊断性肿瘤标志物,用于与正常组织相鉴别。
肿瘤微环境(tumor microenvironment,TME)由细胞外基质、癌相关成纤维细胞、血管上皮细胞和浸润性免疫细胞组成[25-26]。实体肿瘤中的免疫细胞浸润是TME 相关致癌机制中的关键因素[27]。肿瘤细胞中可通过调节TME 影响细胞凋亡,进而产生促癌作用,促进肿瘤细胞发生和发展[28]。本研究结果显示:THCA 患者癌组织中CD44 mRNA 表达水平与TILs(B 细胞、巨噬细胞、CD4+T 淋巴细胞、树突状细胞和中性粒细胞)浸润丰度呈正相关关系,提示THCA 组织中CD44 mRNA 过表达可能促进TILs 的增殖,进而改变TME,促进肿瘤发生和发展。本研究结果显示CD44 蛋白表达与9 个免疫检查点基因呈正相关关系,与1 个免疫检查点基因呈负相关关系,提示CD44 基因可能参与THCA 的免疫调节功能。上述结果显示:CD44 蛋白可能是THCA 潜在的免疫调节因子。
综上所述,CD44 蛋白表达上调可能与THCA的发生和发展及免疫浸润有关。本研究为THCA发病的分子机制研究提供了理论依据,CD44 蛋白有可能成为鉴别良、恶性甲状腺肿瘤的分子标志物,同时CD44 蛋白也有望成为THCA 新的临床治疗靶点。本研究未能进一步阐述CD44 蛋白作用机制及相关的信号通路,其具体的作用机制仍有待深入研究。
