基于MSR1 mRNA 和蛋白在泛癌组织中表达的生物信息学分析及其意义
2023-05-06张德洪郑明珠李家秋
张德洪, 郑明珠, 李家秋, 路 中
(1.潍坊医学院临床医学院,山东 潍坊 261053;2.潍坊医学院附属医院肿瘤科,山东 潍坊 261031)
肿瘤已经对人类健康和生存构成严重威胁,免疫治疗作为新兴的治疗方法虽然已经展现出很高的应用前景,但仅仅使部分患者受益[1]。因此,寻找新的敏感的生物标志物对肿瘤研究至关重要。近年来,泛癌分析为癌症研究提供了新的视角。随着测序技术的快速发展和在线数据库的建立,大量涌现的数据为全面的泛癌分析提供了依据[2]。泛癌分析是指通过使用生物信息学分析工具,在多种肿瘤类型中横向比较某些特征,旨在发现靶基因的作用机制,为肿瘤的诊断和治疗提供指导[3]。巨噬细胞清道 夫 受 体1 (macrophage scavenger receptor 1,MSR1)也 称 为 清 道 夫 受 体A 类(scavenger receptor class A,SR-A)或CD204,可以广泛识别各种“自我”和“非自我”成分,是树突状细胞(dendritic cell,DC)和巨噬细胞获得脂类的主要途径[4]。DC 作为抗原提呈细胞,在启动和维持T淋巴细胞免疫应答过程中发挥重要作用。研究[5-6]表明:DC 中MSR1 表达上调可以引起脂质摄取增加从而造成细胞内脂质积累,最终导致DC 交叉表达受损,影响其抗原提呈功能,已有研究[7]设计靶向MSR1 的DC 疫苗来增强抗肿瘤免疫效果,MSR1 高表达的肿瘤相关巨噬细胞(tumorassociated macrophage,TAM)具有促进肿瘤进展的表型[8]。鉴于MSR1 复杂的功能特性,其可能是肿瘤诱导免疫耐受的关键调节因子,靶向MSR1 在肿瘤免疫治疗中具有潜在价值。然而,尚未见有关MSR1 在泛癌中的表达、与患者预后的关系和免疫特性的相关报道。因此,综合分析MSR1 在泛癌中的作用具有重要意义。本研究利用多种公共数据库分析泛癌组织中MSR1 mRNA 和蛋白表达水平,评估MSR1 表达对肿瘤患者生存的影响,探讨MSR1 与多种免疫因素之间的关系,为肿瘤诊断和治疗提供理论依据。
1 资料与方法
1.1 临床生信之家检测MSR1 的表达及与免疫特征的相关性通过临床生信之家(https://www.aclbi.com/static/index.html#/)的泛癌模块对来自癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库的RNAseq 数据和相应的临床信息进行泛癌分析[9]。在“表达分析”部分,共选择全部肿瘤的10 228 个样本分析MSR1 在33 种肿瘤组织及其癌旁组织中的表达差异。在“免疫相关性”部分,分别选择“免疫相关性”和“免疫检查点”对肿瘤微环境中MSR1 表达与免疫评分或免疫检查点相关性进行评估。33 种肿瘤类型:肾上腺皮质癌(adrenocortical carcinoma,ACC)、膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、乳腺浸润癌(breast invasive carcinoma,BRCA)、宫颈鳞状细胞癌和宫颈腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)、胆 管 癌(cholangiocarcinoma,CHOL)、结肠癌(colon adenocarcinoma,COAD)、弥漫性大B 细胞淋巴瘤(lymphoid neoplasm diffuse large Bcell lymphoma,DLBC)、食 管 癌 (esophageal carcinoma,ESCA)、多 形 成 性 胶 质 细 胞 瘤(glioblastoma multiforme,GBM)、头颈鳞状细胞癌 (head and neck squamous cell carcinoma,HNSC)、肾嫌色细胞癌(kidney chromophobe,KICH)、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、肾 乳 头 状 细 胞 癌(kidney renal papillary cell carcinoma,KIRP)、急性髓系白血病(acute myeloid leukemia,LAML)、脑低级别胶质瘤(brain lower grade glioma,LGG)、肝细胞癌(liver hepatocellular carcinoma,LIHC)、肺 腺 癌(lung adenocarcinoma,LUAD)、肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)、间皮瘤(mesothelioma,MESO)、卵 巢 浆 液 性 囊 腺 癌(ovarian serous cystadenocarcinoma,OV)、胰腺癌(pancreatic adenocarcinoma,PAAD)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PCPG)、前 列 腺 癌 (prostate adenocarcinoma,PRAD)、直 肠 腺 癌 (rectum adenocarcinoma,READ)、肉瘤(sarcoma,SARC)、皮肤黑色素瘤(skin cutaneous melanoma,SKCM)、胃 腺 癌(stomach adenocarcinoma,STAD)、睾丸生殖细胞癌(testicular germ cell tumors,TGCT)、甲状腺癌 (thyroid carcinoma,THCA)、胸 腺 癌(thymoma,THYM)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)、子 宫 癌 肉 瘤(uterine carcinosarcoma,UCS)和葡萄膜黑素瘤(uveal melanoma,UVM)。
1.2 Sangerbox 数据库检测MSR1 mRNA 表达水平及其与预后和免疫标志物的相关性使用Sangerbox 数 据 分 析 平 台 (http://www.sangerbox.com/)的单基因泛癌分析工具进行MSR1 的泛癌分析。整合来自TCGA 数据库的肿瘤组织数据和来自GTEx 数据库的正常组织数据,分析在27 种肿瘤组织中MSR1 mRNA 表达水平,评估MSR1 表达对肿瘤患者预后的影响,并进行MSR1 表达与肿瘤突变负荷(tumor mutation burden,TMB)和微卫星不稳定(microsatellite instability,MSI)的相关性分析。
1.3 人类蛋白质图谱(The Human Protein Atlas,HPA)数据库检测MSR1 蛋白表达情况HPA 数据库(https://www.proteinatlas.org/)是旨在整合各种组学技术、探索人类蛋白质组的公共数据库。使用“TISSUE”模块和“PATHOLOGY”模块,查看MSR1 在不同肿瘤组织及其临近正常组织中免疫组织化学染色情况。
1.4 TISCH 数据库进行单细胞测序结果分析肿瘤免疫单细胞中心(Tumor Immune Single-cell Hub,TISCH)数 据 库 (http://tisch.compgenomics.org/documentation/)是一个scRNA-seq数据库,其整合了27 种癌症的76 个高质量肿瘤数据集中近200 万个细胞的单细胞转录组图谱[10],单细胞测序旨在通过细胞水平表征不同肿瘤或同一肿瘤的相同点与不同点。用单细胞分辨率的形式表征肿瘤微环境。选择“Dataset”模块,在“Cancer type”选择需要的肿瘤类型,在“Species”选择“Human”,其余参数默认。“Gene”部分输入“MSR1”,其余参数默认。
1.5 TIMER 2.0 数据库检测MSR1 与免疫浸润的相关性肿瘤免疫估计资源2.0(Tumor Immune Estimation Resource 2.0,TIMER 2.0)数 据 库(http://timer.cistrome.org/)是分析不同肿瘤中免疫细胞浸润水平的在线数据库[11]。使用“Immune Association”模块中的“Gene”部分,在“Gene Expression”输入“MSR1”;在“Immune Infiltrates”选 择“Tregs”、“Cancer associated fibroblast”、“DC”、“Macrophage”和“T cell CD8+”;勾选“Purity Adjustment”,对MSR1 表达和免疫浸润水平的相关性进行分析。
1.6 肿瘤免疫共基因小鼠(Tumor Immune Syngeneic Mouse,TISMO)数据库比较MSR1 在免疫治疗者中的表达水平TISMO 数据库(http://tismo.cistrome.org/)包含了大量同源小鼠模型数据,包括来自23 种癌症的49 个同源癌细胞系605 个体外样本的RNA-seq 数据,其中195 个接受细胞因子治疗;还包括来自19 种癌症的68 个同源小鼠模型1 518 个体内样本的RNA-seq 数据,其中832 个来自免疫检查点阻断(immune checkpoint blocking,ICB)研究[12]。为比较MSR1在ICB 治疗应答者和无应答者之间的体内表达水平,“Gene”模 块 选 择“GeneIn Vivo”;在“Gene”中 输 入“MSR1”、“ICB treatment”和“Tumor model”均为“All”。
1.7 TIDE 数据库预测免疫治疗反应肿瘤免疫功能障碍与排斥(Tumor Immune Dysfunction and Exclusion,TIDE)数 据 库 (http://tide.dfci.harvard.edu)整合已发表的ICB 试验、非免疫治疗肿瘤概况和CRISPR 筛选的大规模组学数据及生物标 志 物[13]。选 择“Biomarker Evaluation”模 块,将MSR1 与其他已发表的生物标志物进行比较。采用 受 试 者 工 作 特 征 (receiver operating characteristic,ROC)曲 线 下 面 积(area under curve,AUC)来评估生物标志物对ICB 反应状态的预测性能。
1.8 GSCA 数据库分析敏感性药物基因集癌症分 析 (Gene Set Cancer Analysis,GSCA)(http://bioinfo.life.hust.edu.cn/GSCA/#/)是用于基因组、药物基因组学和免疫基因组癌症分析的平台[14]。选择“Drug”模块,输入“MSR1”,勾 选 “CTRP drug sensitivity and expression correlation”对来自CTRP 数据集的敏感性药物和MSR1 表达的相关性进行分析。
1.9 统计学分析使用R 软件(4.0.3 版本)进行统计分析。采用Wilcoxon 秩和检验检测MSR1 mRNA 在不同肿瘤组织和正常组织中的表达水平,通过单因素生存分析和Kaplan-Meier 分析评估基因表达与患者生存率的相关性,MSR1 高表达组和低表达组组间比较采用Log-rank 检验。采用R 软件包通过MCP-counter 算法分析MSR1 的免疫相关性。采用Spearman 相关性分析检验MSR1 表达和免疫细胞浸润水平的相关性。采用R 软件(4.0.3 版本)通过Spearman 相关性分析检验MSR1 表达与免疫检查点相关性。采用Spearman 相关性分析检验MSR1 表 达 与TMB 和MSI 的 相 关 性。采 用DESeq2 (*FDR≤0.05,**FDR≤0.01,***FDR≤0.001)并通过Wald 检验评估ICB 治疗中MSR1 的表达差异。以P<0.05 为差异有统计学意义。
2 结 果
2.1 MSR1 mRNA 在泛癌组织中的表达水平采用临床生信之家数据库分析33 种肿瘤类型中MSR1 mRNA 表达水平(图1A),在22 种肿瘤组织中MSR1 mRNA 表达水平高于正常组织,在4 种肿瘤组织中低于正常组织(P<0.05);利用Sangerbox 数据库分析27 种肿瘤类型中MSR1 mRNA 表达水平(图1B),与正常组织比较,在18 种肿瘤组织中MSR1 mRNA 表达水平上调,在3 种肿瘤组织中MSR1 mRNA 表达水平下调(P<0.05)。比较上述2 种数据库的表达数据,结果显示:在17 种肿瘤组织中的MSR1 mRNA 表达水平均高于正常组织,包括BRCA、COAD、ESCA、GBM、HNSC、KIRC、KIRP、LGG、LIHC、OV、PAAD、PRAD、SKCM、STAD、TGCT、THCA 和UCS(P<0.01),表明MSR1 mRNA 在多种肿瘤组织中普遍高表达。
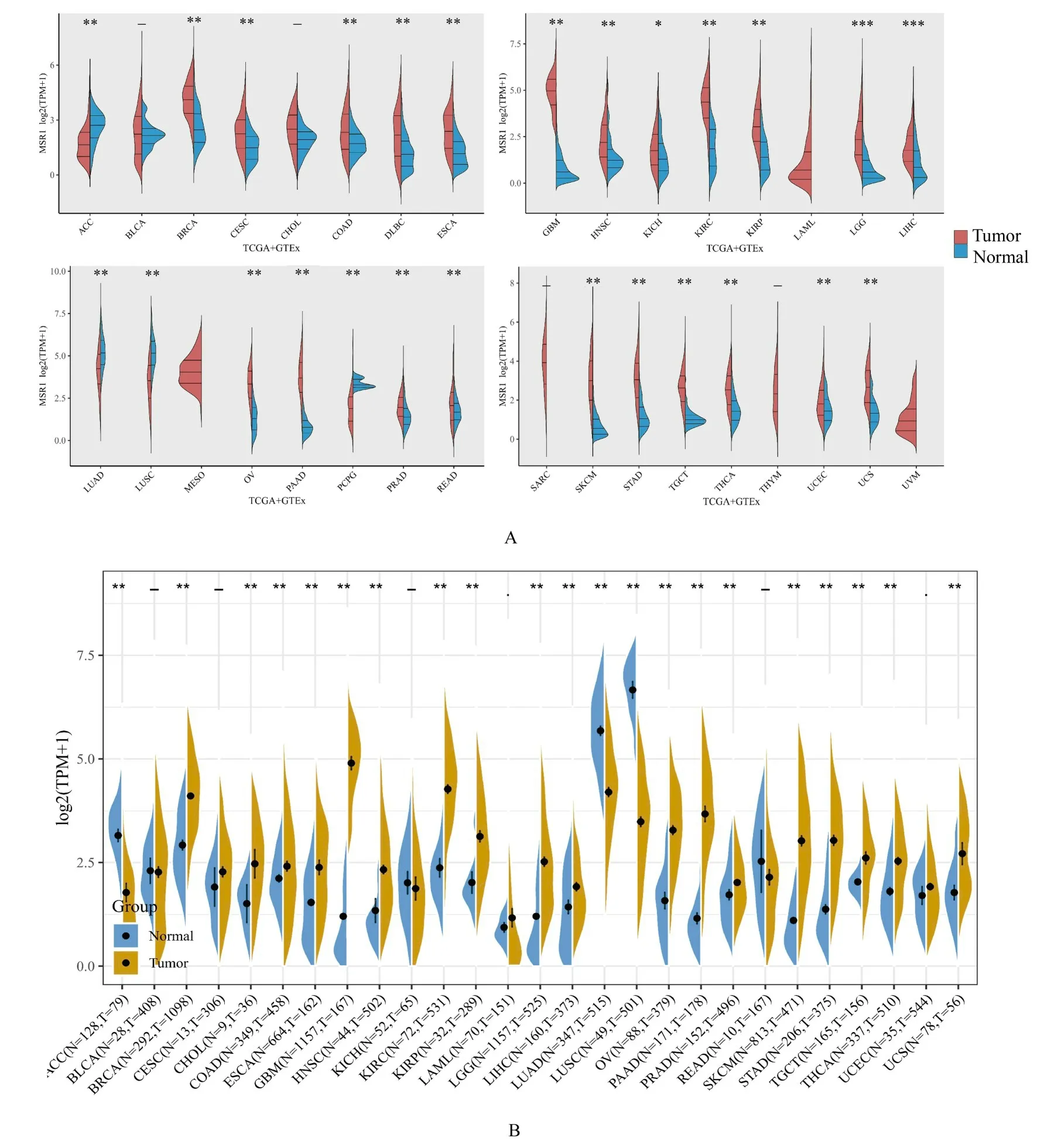
图1 临床生信之家数据库(A)和Sangerbox 数据库(B)中正常组织和肿瘤组织中MSR1 mRNA 表达水平Fig.1 Expression levels of MSR1 mRNA in normal tissue and tumor tissue in Assistant for Clinical Bioinformatic Database(A) and Sangerbox Database (B)
2.2 MSR1 蛋白在泛癌组织中的表达情况采用HPA 数据库比较正常组织与肿瘤组织中的MSR1蛋白表达水平。免疫组织化学染色结果显示:在正常乳腺、子宫内膜、肝脏、卵巢、皮肤和睾丸组织中未见MSR1 表达,而在乳腺癌、子宫内膜癌、肝癌、卵巢癌、皮肤黑色素瘤和睾丸癌组织中MSR1蛋白表达水平升高,呈低等程度或中等程度的免疫染色;MSR1 在正常胰腺和前列腺呈低等程度表达,在胰腺癌和前列腺癌呈中等程度表达。见图2。
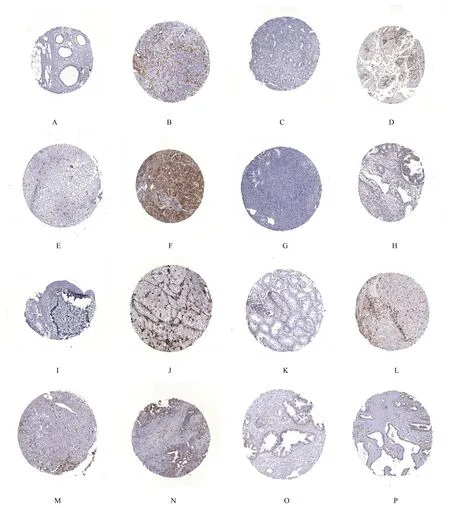
图2 免疫组织化学染色检测正常组织和肿瘤组织中MSR1 表达(×400)Fig.2 Expressions of MSR1 in normal tissue and tumor tissue detected by immunohistochemistry staining(×400)
2.3 MSR1 表达与肿瘤患者临床病理特征的关系使用TISIDB 和GEPIA2 数据库分析MSR1 表达与肿瘤患者临床病理分期和分级之间的相关性。MSR1 表 达 与BLCA、ESCA、HNSC、KICH、PAAD、SKCM、TGCT、THCA 和UCEC 患者的临床病理分期有密切关联(P<0.05);与KIRC、LGG、PAAD、STAD 和UCEC 在癌症分级有关联(P<0.05)。见图3。
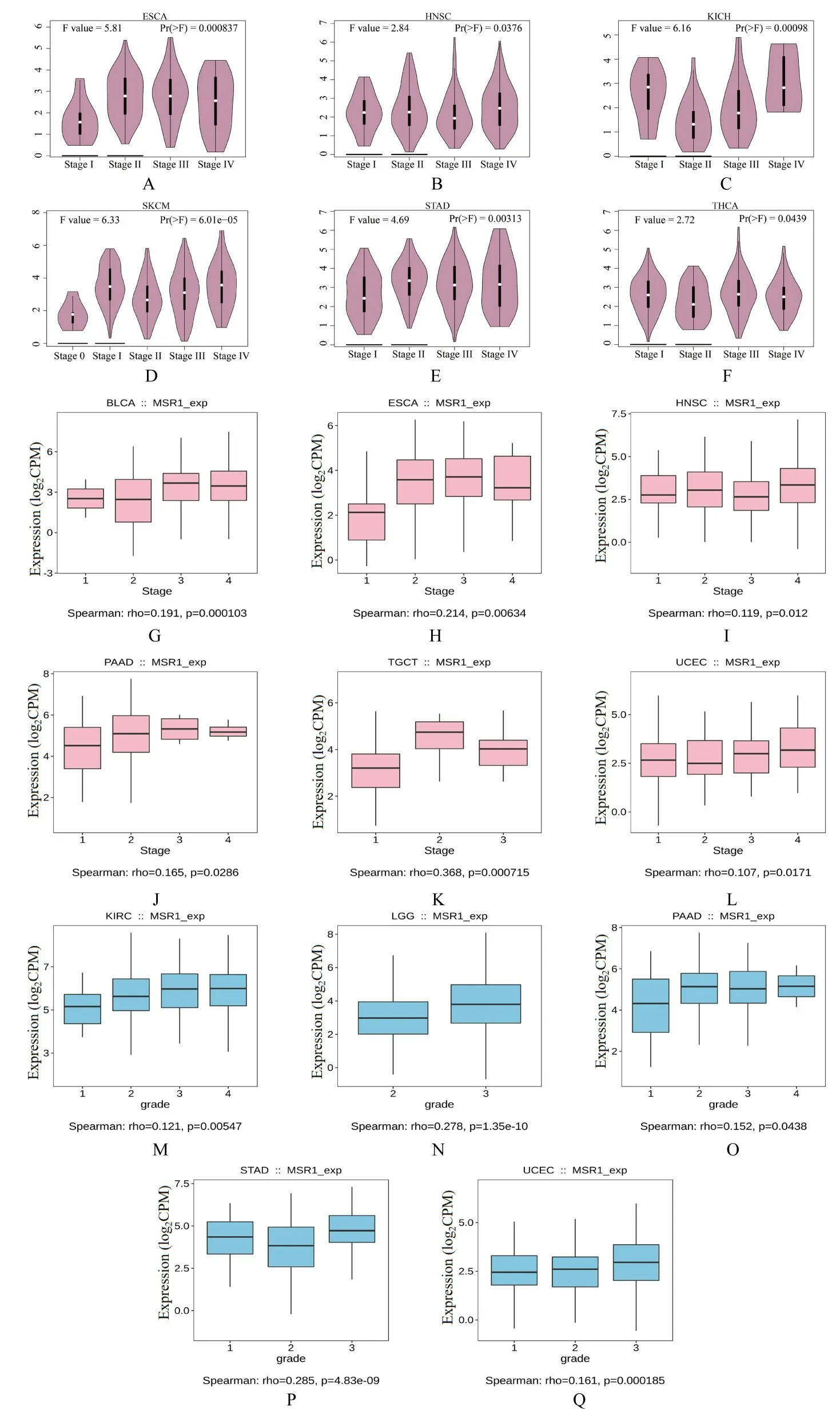
图3 不同肿瘤组织中MSR1 表达与患者临床病理分期和分级的相关性Fig.3 Correlations between expressions of MSR1 in different kinds of tumor tissues and clinicopathological stages and grades of patients
2.4 MSR1 表达与肿瘤患者预后的关系使用TCGA 数据库来源的临床数据对33 种类型肿瘤患者的预后进行分析,计算95%置信区间(95%CI)的Log-rankP值和风险比(hazard ratio,HR),用森林图呈现泛癌中MSR1 表达与患者总生存期(overall survival,OS)和 疾 病 特 异 生 存 期(disease-specific survival,DSS)的相关性。OS 森林 图 显 示:在BLCA [HR=1.01,P=0.047,95%CI(1.00,1.03)]、LGG[HR=1.03,P<0.001,95%CI (1.02,1.04)]、LIHC [HR=1.04,P=0.007,95%CI (1.01,1.07)]、OV[HR=1.02,P=0.028,95%CI (1.00,1.03)]、STAD[HR=1.02,P=0.016,95%CI(1.00,1.04)]、THCA [HR=1.06,P=0.006,95%CI (1.02,1.11)]和UVM [HR=1.18,P=0.044,95%CI(1.00,1.40)]中,MSR1 高表达对患者预后是一个危险因素;而MSR1 高表达对 SKCM [HR=0.99,P=0.016,95%CI(0.97,1.00)]患者预后具有保护意义。DSS 分析结果显示:MSR1 高表达可能是LGG [HR=1.03,P<0.001,95%CI (1.02,1.04)]、UCEC [HR=1.05,P=0.038,95%CI (1.00,1.10)]和UVM[HR=1.2,P=0.036,95%CI(1.01,1.41)]的 危 险 因 素;MSR1 高 表 达 是SKCM [HR=0.098,P=0.013,95%CI (0.97,1.00)]的保护因素。以上类型肿瘤的Kaplan-Meier 生存曲线结果表明:MSR1 表达与肿瘤患者的预后有明显的相关性。以上结果提示MSR1 可以作为相关肿瘤患者预后的预测因子。见图4。
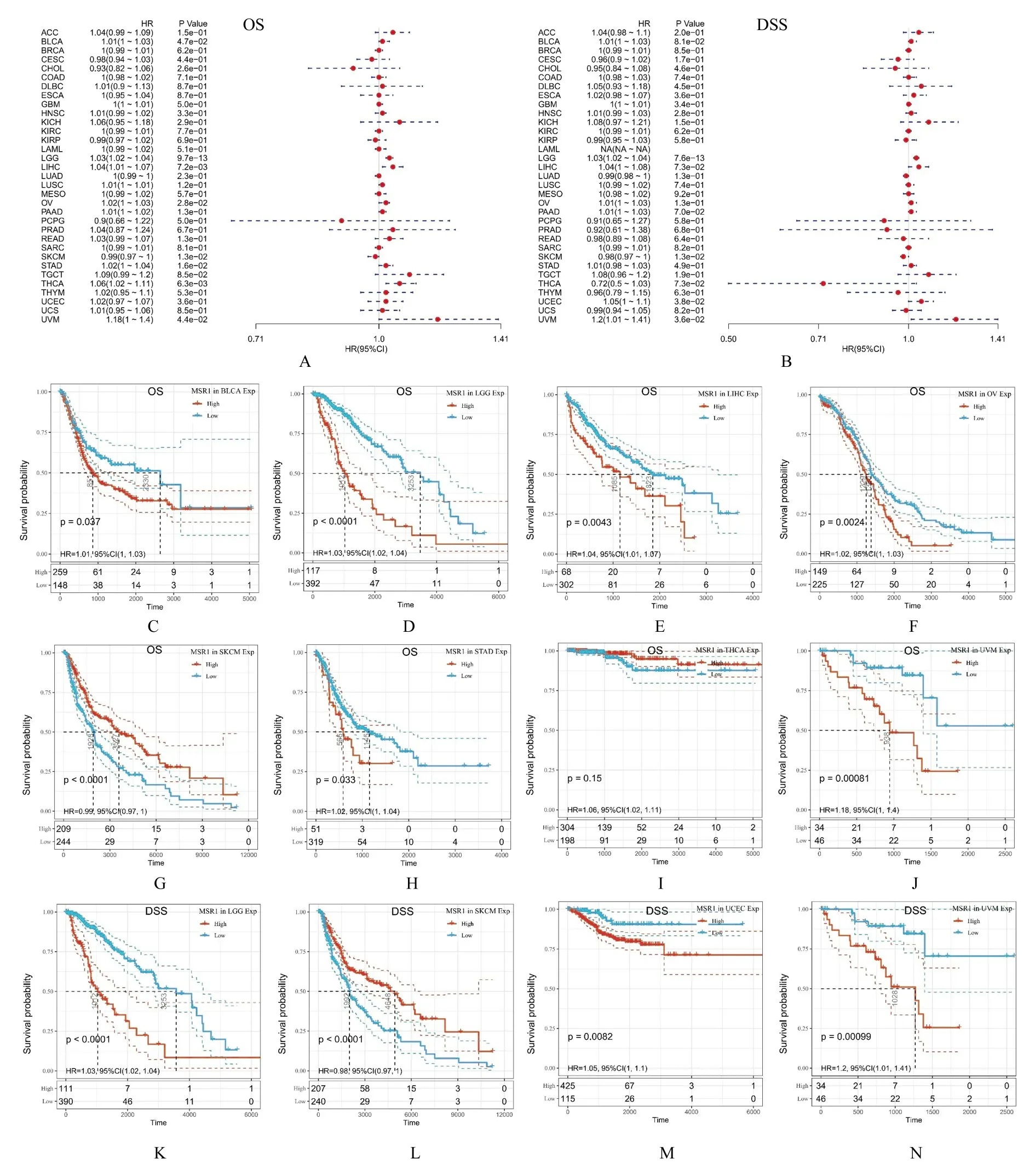
图4 MSR1 表达与患者预后的相关性分析Fig.4 Correlation analysis on relationships between expression of MSR1 and prognosis of patients
2.5 单细胞测序结果采用单细胞RNA-seq 数据分 析BRCA、Glioma、LIHC、KIRC、PAAD 和SKCM 中MSR1 在不同细胞中表达的异质性(图5),MSR1 主要表现为与DC 细胞和单核巨噬细胞共表达。

图5 单细胞测序分析MSR1 表达Fig.5 MSR1 expression analyzed by single-cell sequencing
2.6 免疫细胞浸润的泛癌分析通过临床生信之家数据库中MCPCOUNTER 算法分析泛癌中MSR1 表达与免疫浸润评分的相关性,结果显示:MSR1 表 达 与CD8+T 淋 巴 细 胞、NK 细 胞、DC 和巨噬细胞等细胞浸润均呈明显正相关关系(图6A)。TIMER 2.0 数据库检测结果显示:MSR1 表达与Treg、CAF、DC 细胞、巨噬细胞和CD8+T 淋巴细胞的浸润水平呈正相关关系(图6B)。
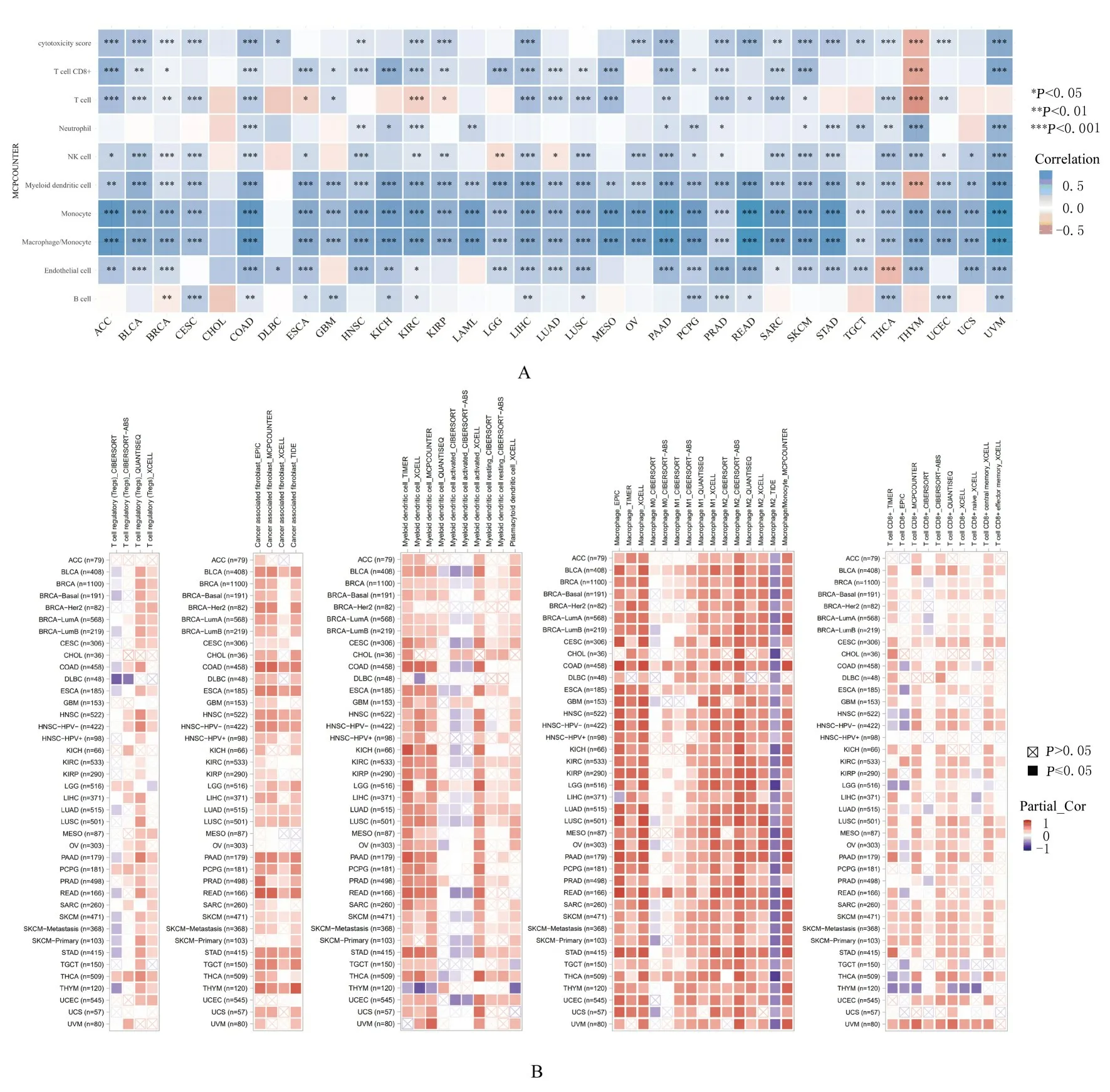
图6 临床生信之家数据库(A)和TIMER2.0 数据库(B)中MSR1 表达与免疫浸润细胞的相关性Fig.6 Associations between MSR1 expression and immune infiltrating cells in Assistant for Clinical Bioinformatic Database(A) and TIMER2.0 Database(B)
2.7 MSR1 表达与免疫检查点基因表达和免疫治疗反应相关的生物标志物的相关性分析MSR1 表达与8 种重要的免疫检查点相关基因表达呈正相关关系(图7A)。MSR1 表达与免疫治疗反应相关的生物标志物[肿瘤突变负荷(tumor mutation burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)]的 相 关 性 结 果 表 明:在BLCA、CESC、COAD、LGG、OV、PRAD、SARC、SKCM、THYM 和UCEC 中MSR1 表 达与TMB 呈正相关关系,在LIHC、THCA、UVM中MSR1 表达与TMB 呈负相关关系,在COAD 和PRAD 中MSR1 与MSI 呈正相关关系,在HNSC、LGG、LUAD、LUSC、OV、SKCM 和STAD 中,MSR1 与MSI 呈负相关关系。见图7B 和7C。
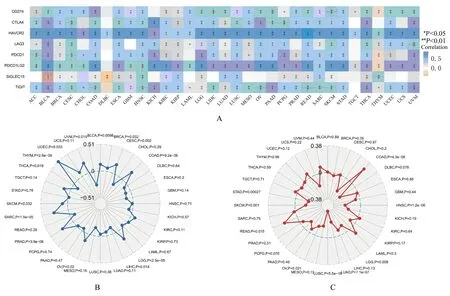
图7 临床生信之家数据库和Sangerbox 数据库中MSR1 表达与免疫检查点和生物标志物的相关性Fig.7 Correlations between MSR1 expression and immune checkpoints and biomarkers in Assistant for Clinical Bioinformatic Database and Sangerbox Database
2.8 MSR1 表达与免疫治疗反应的相关性分析
预测小鼠模型中MSR1 在不同ICB 治疗时的表达水平,包括抗细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T lymphocyte associated antigen 4,CTLA4)、抗 程 序 性 死 亡 受 体1 (prephenate dehydratase 1,PD-1)、抗 程 序 性 死 亡 配 体1(programmed death ligand 1,PD-L1)和抗PD-L2治疗。MSR1 表达在15 个治疗组和对照组之间差异有统计学意义(P<0.05),其中在13 组ICB 治疗的应答者中表达水平明显升高,在2 组ICB 治疗的应答者中表达水平降低(图8A)。此外,使用已发表的免疫治疗数据,将MSR1 与预测免疫治疗反应的生物标志物进行比较(图8B)。在MSR1 的24 个治疗组中,有11 组的 AUC 大于0.5,其预测值高于TMB(8 组AUC 大于0.5)、T 淋巴细胞克隆性(T.Clonality)(9 组AUC 大于0.5)和B 淋巴 细 胞 克 隆 性(B.Clonality)(7 组AUC 大 于0.5);而预测值低于TIDE(18 组AUC 大于0.5)、MSI(13 组AUC 大 于0.5)、CD274 (21 组AUC大 于0.5)、CD8 (18 组AUC 大 于0.5)、IFNG(17 组AUC 大于0.5)、Merck18(18 组AUC 大于0.5)。预测泛癌中MSR1 表达水平与前30 位敏感的CTRP 药物之间的相关性,其中MSR1 表达与austocystin D 呈正相关关系(r=0.19,FDR<0.001),与其他药物呈负相关关系(图8C)。以上结果提示MSR1 可能作为一种预测免疫治疗反应的新型生物标志物。

图8 TISMO (A)、TIDE (B)和CTRP 数据库(C)中MSR1 表达与预测免疫治疗反应、生物标志物和敏感药物的相关性Fig.8 Correlations between expression of MSR1 and prediction of immunotherapy response, biomarkers and sensitive drugs in TISMO (A), TIDE (B), and CTRP (C) Databases
3 讨 论
世界卫生组织的最新数据[15]显示:在绝大多数国家,癌症是70 岁之前的第二大死亡原因,预计未来全球癌症负担将持续增加。免疫治疗正在迅速影响癌症治疗的现状,对PD-1 和PD-L1 等免疫检查点加以阻断已经成为可以改善肿瘤进展的有应用前景的治疗策略[16]。虽然免疫治疗在肿瘤治疗方面取得了一定的成功,但由于肿瘤发生机制的复杂性,适合免疫治疗的人群仅占少数,甚至多数患者表现出耐药性,其临床应用仍面临着诸多挑战[17]。因此寻找新的敏感的生物标志物至关重要。
MSR1 是一种吞噬细胞模式识别受体(phagocytic pattern recognition receptor,PPR),主要表达于DC 细胞和单核巨噬细胞,可以识别多种配体,包括脂质、热休克蛋白、蛋白聚糖和各种微生物来源的分子等[4]。MSR1 是首个被发现与血管疾病相关的脂蛋白受体,通过增加脂蛋白的内化,促进动脉粥样硬化和心血管疾病的进展[18]。MSR1在肿瘤中的作用越来越多地被揭示出来[19],但是尚无在多种肿瘤类型中综合分析其作用的研究。本研究利用多种数据库对MSR1 进行生物信息学分析,结果显示:MSR1 mRNA 和蛋白水平在多数癌症类型中表达上调。MSR1 在肺癌和食管鳞癌中高表达可促进肿瘤侵袭[20-21]。因此提示MSR1 可以作为一种新型的诊断性的肿瘤标记物。MSR1 还可以被视为预后不良的标志,有研究[22]证实:巨噬细胞表达MSR1 影响肺鳞癌患者预后,本研究结果显示其在BLCA、LGG、LIHC、OV、STAD、UCEC 和UVM 中高表达与患者预后差有关,提示MSR1 也可以作为一种新型的预后性的肿瘤标记物。
与传统测序方法比较,单细胞测序分析具有表征肿瘤内细胞异质性的优势[23]。MSR1 在不同肿瘤中的单细胞测序结果显示:MSR1 主要在DC 细胞和单核巨噬细胞中高表达。肿瘤微环境由肿瘤细胞、免疫细胞、血管和细胞外基质等成分组成[24]。免疫细胞因在肿瘤进展中发挥重要作用而受到广泛关注。能量代谢重新编程和免疫逃逸被认为是肿瘤的重要特征[25]。在肿瘤发展的各个阶段,免疫细胞与肿瘤细胞持续相互作用,上述免疫细胞的代谢过程也有不同程度的改变,从而影响免疫细胞的组成和功能,使肿瘤朝有利于其本身的方向发展,以便利于肿瘤逃避免疫识别[26]。脂质是人体重要的能量物质,也是细胞结构的重要组成部分,涉及细胞信号调节等诸多方面。脂质代谢对肿瘤生长和生存至关重要,肿瘤倾向于进行代谢重编程以适应肿瘤微环境的变化[27]。DC 细胞是一种高效的抗原提呈细胞,是抗肿瘤免疫所必需的。研究[5,28]显示:细胞表面MSR1 的表达上调会引起细胞内脂质的积累,特别是氧化中性脂类(甘油三酯、脂肪酸和胆固醇酯)的积累会损害抗原加工和呈递过程,导致交叉呈递缺陷和免疫功能受损,负向调控抗肿瘤免疫。巨噬细胞分为M1 和M2 型2 种类型。M1 巨噬细胞具有抑制肿瘤的功能,而M2 巨噬细胞具有免疫抑制和促进肿瘤的功能[29],MSR1 高表达的TAM 通常表现出M2 样巨噬细胞的功能[30]。总之,MSR1 可能通过影响DC 细胞和巨噬细胞的脂质代谢过程促进肿瘤进展。因此,靶向MSR1 从而阻断肿瘤微环境中异常的脂质代谢过程进而抑制肿瘤进展可能成为一个有应用前景的治疗方式。
为了进一步探究MSR1 表达对肿瘤微环境的影响,本研究分析了MSR1 表达与免疫细胞浸润的相关性。MSR1 的表达与大多数肿瘤中的免疫细胞浸润呈高度正相关关系,其中包括Treg 细胞和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAF)。Treg 细胞在肿瘤免疫逃逸和免疫耐受中起关键作用[31]。肿瘤患者的低生存率与Treg 细胞高度浸润相关[32]。而CAF 是肿瘤微环境中最丰富、异质性最强的基质细胞,积极促进肿瘤进展[33]。因此MSR1 高表达可能影响免疫细胞间的相互作用,导致免疫逃逸的发生、促进肿瘤进展并影响患者预后。
经典的免疫检查点主要包括PD-1、PD-L1 和CTLA4。PD1/PD-L1 通路是介导肿瘤免疫逃逸的重要信号通路,使用PD1/PD-L1 抑制剂靶向治疗展现出较明显的抗肿瘤效果[34]。TMB 代表肿瘤新抗原负荷,作为免疫治疗的预测标志物,可以用来预测患者对免疫检查点治疗的反应[35];MSI 是DNA 错配修复缺陷的特征之一。本研究结果显示:泛癌组织中MSR1 表达与免疫检查点基因表达呈正相关关系,MSR1 表达在COAD 和PRAD 中与TMB 和MSI 均呈正相关关系,提示MSR1 可能对免疫治疗反应有一定的预测作用。MSI 发生率占所有结直肠癌患者的15%~20%[36],仅有部分患者从免疫治疗中受益。因此,发现更可靠的生物标志物对免疫治疗的预测至关重要。本研究结果显示:小鼠模型中免疫检查点治疗应答组的MSR1 表达更高,而且MSR1 对免疫治疗反应的预测价值不亚于其他的生物标志物,因此MSR1 在预测免疫治疗反应方面有比较高的应用价值。研究[37]表明:MSR1 基因敲除小鼠的抗肿瘤反应得到改善,靶向MSR1 可能具有重要的治疗意义。本研究通过GSCA 数据库预测针对MSR1 敏感的药物austocystin D,为靶向MSR1 治疗恶性肿瘤提供了新的方向和线索。本研究也存在一定的局限性:①本研究是基于公共数据库的数据进行生物信息学分析,网站纳入分析的数据不同,预测的结果也存在一定偏差;②本研究中的所有预测都需要进一步实验验证,因此需要对MSR1 进行更深入的研究来支持本研究的观点。
综上所述,MSR1 可以作为一种诊断性的和预后性新型肿瘤标记物,并且与免疫因素有密切关联,可以预测免疫治疗的疗效,有潜力成为一个新的分子靶点。
