沉默信息调节因子2 对大肠癌细胞有氧糖酵解和生长增殖的调控作用及其机制
2023-05-06岳金金庞一心张秀梅
岳金金, 庞一心, 张秀梅
(锦州医科大学基础医学院生物化学与分子生物学教研室,辽宁 锦州 121001)
代谢重编程是肿瘤细胞的一个主要代谢特征,能更好地协调肿瘤细胞对葡萄糖的利用过程,也能对肿瘤细胞生理机能进行调节。越来越多的研究[1-2]表明:代谢重编程能够维持肿瘤细胞恶性增殖的特征,目前针对肿瘤细胞的代谢研究已经成为肿瘤治疗新的靶点。肿瘤细胞快速增殖的重要机制之一是磷酸戊糖途径(pentose phosphate pathway,PPP),而在生物大分子合成过程中PPP 的中间产物起重要作用。PPP 是糖酵解途径的一个旁路,从糖酵解的中间产物葡糖6-磷酸开始进入PPP,经过一系列氧化和基团转移代谢转变产生2 个重要的中间产物:还原当量烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)和5-磷酸核糖。对于增殖速度较快的细胞,尤其是肿瘤细胞,充足的NADPH 和5-磷酸核糖的供应是维持其生长繁殖所必需的。研究[3-4]表明:与正常细胞比较,卵巢癌和胰腺癌肿瘤细胞中葡糖6-磷酸进入磷酸戊糖途径的流量有明显升高,其主要机制是肿瘤细胞内葡糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)的表达或活性增加。因此,G6PD 可能与肿瘤的发生发展有密切关联,其活性和定位受p21 激活激酶4(p21-activated kinase 4,PAK4)、p53、B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)相关基因3(Bcl-2 associated athanogene 3,BAG3)、肝细胞生长因子(hepatocyte growth factor,HGF)和AMP 激 活 的蛋 白 激 酶[Adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]等 直 接 调 控[5-7]。沉默信息调节因子(silent information regulator factor,SIRT)是一类由多个组蛋白去乙酰化酶成员组成的蛋白家族,SIRT 家族有7 个成员,包含SIRT1~SIRT7。SIRT 家族成员通过对组蛋白及多种非组蛋白进行去乙酰化修饰调节体内多种代谢途 径[8-10]。SIRT2 是SIRT 家 族 的 一 员,研 究[11-13]表明:SIRT2 可有效抑制乳腺癌的发展,在恶性肿瘤的生长和侵袭转移中发挥重要作用。但SIRT2在大肠癌中的作用目前还鲜有报道。本研究旨在探讨SIRT2 对大肠癌细胞有氧糖酵解及生长增殖的影响,阐明其调控机制,从而为结肠癌的临床治疗提供新的实验依据。
1 材料与方法
1.1 实验细胞、临床样本、主要试剂和仪器
HCT116 和SW480 大肠癌细胞为本实验室自有。大肠癌组织病理切片取自锦州医科大学附属第一医院病理科大肠癌患者手术切除的标本,本研究已获得锦州医科大学基础医学院伦理委员会批准,所有患者均对本研究内容充分知情,并签署知情同意书,均取癌组织和癌旁正常组织(距离肿瘤边缘>5 cm 处),所有病例均经病理诊断证实且术前未经放疗和化疗。细胞培养基和胎牛血清购自美国Gibco 公司,SIRT2 干扰RNA 购自苏州吉玛基因股份有限公司,葡萄糖氧化酶试剂盒购自Solarbio 公司,SIRT2、β-actin 和G6PD 抗体均购自英国Abcam 公司,CCK-8 试剂盒购自安诺伦(北京)生物科技有限公司,乳酸测试盒购自南京建成生物工程研究所,Clon Express Ultra One Step Cloning Kit 试剂盒购自日本 TaKaRa 公司,SIRT2 质粒购自武汉淼灵生物科技公司。凝胶成像仪和酶标仪购自美国 Bio-Rad 公司,CO2细胞培养箱购自美国Thermo 公司。
1.2 细胞培养、分组及转染分别将HCT116 细胞和SW480 细胞接种在6 孔细胞培养板中,当细胞密度达到约70% 时进行转染。HCT116 细胞转染SIRT2-siRNA 进行干扰实验,实验分为阴性对照组、SIRT2-siRNA#1 组、SIRT2-siRNA#2 组、和SIRT2-siRNA#3 组;4 组小干扰RNA 序列分别为SIRT2-siRNA#1:5′-GGACGAGCUGACCUUGGAATTUUCCAAGGUCAGCUCGU C C T T-3′,SIRT2-siRNA#2:5′-CCACCGGCCUCUAUGACAATTUUGUCAUAGAGGCCGGUG G T T-3′,SIRT2-siRNA#3:5′-CCAUCUGUCACUACUUCAUTTAUGAAGUAGUGACAGAUG G T T-3′,阴 性 对 照 组:5′-UUCUCCGAACGUGUCACGUTTACGUGACACGUUCGGAGAATT-3′。采用SW480 细胞进行过表达实验,实验分为空白组、空载体质粒转染组和SIRT2 质粒转染组。将SIRT2-siRNA#3 与G6PD 质粒均减半后混匀共转染进行回复实验,回复实验对照组是将阴性对照与空载体质粒均减半后混匀共转染进行实验。在转染后进行计时,6 h 后换液,将6 孔细胞培养板中液体吸出,更换为完全培养液进行培养。
1.3 Western blotting 法检测大肠癌细胞中SIRT2和G6PD 蛋白表达水平转染48 h 后,分别收取SIRT2 质粒转染组和SIRT2-siRNA 干扰组的细胞。在6 孔细胞培养板内每孔加入细胞裂解液和蛋白酶抑制剂共100 μL,细胞刮刀直接刮取,提取细胞总蛋白。采用BCA 蛋白质浓度检测法检测蛋白浓度,将蛋白样品浓度定量至20 μg;恒压90 V 进行SDS-PAGE 电泳后,21 V、20 min 半干转至PVDF膜,封闭液为5%脱脂奶粉,室温封闭2 h,将膜洗涤后分别与SIRT2 抗体(稀释浓度为1∶2 000)、G6PD 抗体(稀释浓度为1∶1 000)和β-actin 抗体(稀释浓度为1∶1 000)进行4 ℃孵育过夜,第2 天将PVDF 膜经洗涤后放进HRP 标记抗兔(稀释浓度为1∶10 000)二抗溶液中,室温进行孵育1 h,利用ECL 发光仪进行发光成像。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值。
1.4 试剂盒检测大肠癌细胞培养液中葡萄糖和乳酸水平转染和分组过程同实验步骤“1.2”,分别收集SIRT2 质粒转染组和 SIRT2-siRNA 干扰组转染后24 h 的培养液。按照葡萄糖检测试剂盒说明书和乳酸检测试剂盒说明书分别检测培养液中的葡萄糖水平和乳酸水平。
1.5 CCK-8 实验检测各组大肠癌细胞增殖活性转染和分组过程同实验步骤“1.2”,将转染24 h 后的细胞消化并进行细胞计数,将各组细胞浓度调整至每毫升4×104个细胞,各组取细胞悬液100 μL 接种于96 孔细胞培养板内,并设3 个复孔。将接种好的细胞放入培养箱中继续培养1、2 和3 d,每日定时每孔加入CCK-8 试剂10 μL,37 ℃恒温培养2 h 后酶标仪于450 nm 波长处测量各组的吸光度(A)值,以A 值代表细胞增殖活性。
1.6 克隆形成实验检测大肠癌细胞克隆形成率转染和分组过程同实验步骤“1.2”,将转染24 h 后的细胞消化并进行细胞计数,各组分别取一定数量的细胞接种于6 孔细胞培养板内,37 ℃恒温进行培养10~15 d,期间观察细胞群落生长状态,当单株细胞群落内含有一定数量的细胞时可停止培养并进行染色。细胞固定时,每孔加入4%多聚甲醛1 mL,1 h 后吸出多聚甲醛,加入结晶紫覆盖住细胞染色1 h,去除染色液后进行克隆计数,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
1.7 反转录PCR(reverse transcription-PCR,RT-PCR)法检测转染SIRT2 后大肠癌细胞中G6PD mRNA表达水平转染和分组过程同实验步骤“1.2”,分别收取SIRT2 质粒转染组和SIRT2-siRNA 干扰组转染48 h 后的细胞,采用Trizol 法提取各组细胞的总RNA,按照RT-PCR 试剂盒的说明书进行RT-PCR 一步法反应,反应体系:模板RNA 0.5 μg,上游引物和下游引物(10 μmol·L-1)各2 μL,One Step Enzyme Mix 2.5 μL,2×One Step Mix 25 μL,最后加入RNase free ddH2O 使得反应总体系为50 μL。反应程序:95 ℃、5 min;95 ℃、30 s,55 ℃、30 s,72 ℃、30 s,共25 次循环;72 ℃、10 min,4 ℃保存。取1 g琼脂糖加TAE电泳缓冲液定容至100 mL 配制成1%的琼脂糖凝胶,对PCR 产物行电泳检测,于凝胶成像系统中成像。采用2-ΔΔCt法计算G6PD mRNA 表达水平。
1.8 免疫组织化学技术检测大肠癌组织中SIRT2和G6PD 蛋白表达水平60 ℃烘干箱对癌组织和癌旁组织的切片烤片2 h,烤片后将组织切片进行常规脱蜡,然后加入枸橼酸缓冲液或EDTA 修复液进行修复,PBS 缓冲液(pH7.4)冲洗3 次;滴加3%过氧化氢后室温孵育15 min,PBS 缓冲液冲洗3 次,5%血清室温封闭30 min,滴加一抗(稀释浓度为1∶200),于4 ℃湿盒中孵育16 h;次日复温后PBS 缓冲液冲洗3 次,滴加二抗工作液,37 ℃孵育30 min,PBS 缓冲液冲洗3 次,滴加DAB 显色液。镜下观察显色反应充分反应后终止反应,Harris 苏木素进行复染,1%的盐酸乙醇进行分化,再经过脱水、透明、中性树胶封片,显微镜下观察,每张组织切片各选3 个视野采集图像进行保存,根据染色强度和染色阳性率取均数进行评分。
1.9 统计学分析采用SPSS 17.0 统计软件进行统计学分析,采用GraphPad Prism 8.0 软件绘图。各组细胞中相关基因mRNA 和蛋白表达水平,培养液中葡萄糖和乳酸水平,细胞增殖活性和细胞克隆形成率均行正态分布和方差齐性检验,符合正态分布的数据以±s表示,2 组间样本均数比较采用两独立样本t检验;采用χ2检验分析癌组织与癌旁组织SIRT2 和G6PD 蛋白表达差异。以P<0.05 为差异有统计学意义。
2 结 果
2.1 过表达和沉默SIRT2 后各组细胞培养液中葡萄糖和乳酸的水平Western blotting 法检测结果显示:SW480 细胞中SIRT2 蛋白表达水平较低,HCT116 细胞中SIRT2 蛋白表达水平较高,组间比较差异有统计学意义(P<0.05),因此选择SIRT2 本体表达高的HCT116 细胞进行后续的RNA 干扰实验,选择SIRT2 本体表达低的SW480细胞进行过表达实验。SIRT2 的3 组不同siRNA 干扰序列通过Western blotting 法验证,结果显示:与阴性对照组比较,SIRT2-siRNA#3 转染组HCT116 细胞中SIRT2 蛋白表达水平明显降低(P<0.05),故SIRT2-siRNA 干扰组处理均采用SIRT2-siRNA#3。Western blotting 法验证结果显示:与空白组和空载体质粒转染组比较,SIRT2 质粒过表达组细胞中SIRT2 蛋白表达水平明显升高(P<0.05)。见图1。细胞培养液中葡萄糖水平的检测结果显示:与阴性对照组比较,SIRT2-siRNA 干扰组HCT116 细胞培养液中葡萄糖水平明显升高(P<0.05);与空载体质粒转染组比较,SIRT2 质粒转染组SW480 细胞培养液中葡萄糖水平明显降低(P<0.05)。培养液中乳酸水平的检测结果显示:与阴性对照组比较,SIRT2-siRNA干扰组HCT116 细胞培养液中乳酸水平明显降低(P<0.05);与空载体质粒转染组比较,SIRT2 质粒转染组SW480 细胞培养液中乳酸水平明显升高(P<0.05)。培养液中葡萄糖水平检测结果显示:在HCT116 细胞中,与阴性对照组(葡萄糖水平3.19 mmol·L-1)比 较,SIRT2-siRNA 干 扰 组(葡萄糖水平5.28 mmol·L-1)培养液中葡萄糖水平明显升高(P<0.05);在SW480 细胞中,与空载体质粒转染组(葡萄糖水平5.02 mmol·L-1)比较,SIRT2质粒转染组(葡萄糖水平2.66 mmol·L-1)培养液中葡萄糖水平明显降低(P<0.05)。培养液中乳酸水平检测结果显示:在HCT116 细胞中,与阴性对照组(乳酸水平14.68 mmol·L-1)比较,SIRT2-siRNA 干扰组(乳酸水平11.29 mmol·L-1)培养液中乳酸水平明显降低(P<0.05);在SW480 细胞中,与空载体质粒转染组(乳酸水平13.76 mmol·L-1)比较,SIRT2 质粒转染组(乳酸水平20.32 mmol·L-1)培养液中乳酸水平明显升高(P<0.05)。
2.2 过表达和沉默SIRT2 后各组细胞增殖活性和克隆形成率CCK-8 实验检测结果显示:SIRT2-siRNA 干扰组细胞增殖活性较阴性对照组明显降低P<0.05)(图2A);SIRT2 质粒转染组细胞增殖活性较空载体质粒转染组和空白组明显升高(图2B)(P<0.05)。沉 默SIRT2 后,SIRT2-siRNA 干扰组HCT116 细胞克隆数明显少于阴性 对 照 组 (图3A~3C);过 表 达SIRT2 后,SIRT2 质粒转染组SW480 细胞克隆数明显多于空载体质粒转染组和空白组(图3D~3F)。沉默SIRT2 后,SIRT2-siRNA 干 扰 组HCT116 细 胞 克隆形成率明显低于阴性对照组(P<0.05)(图4A);过表达SIRT2 后,SIRT2 质粒转染组SW480 细胞克隆形成率明显高于空载体质粒转染组和空白组(P<0.05)(图4B)。
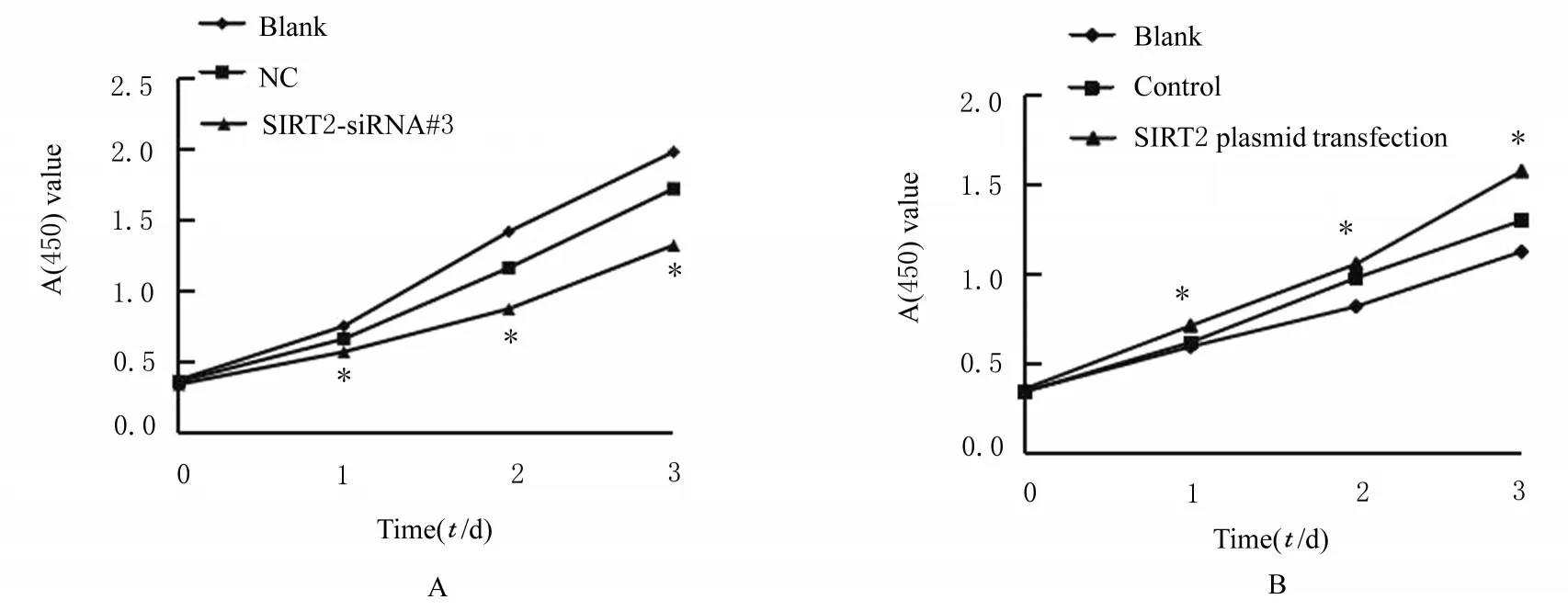
图2 CCK-8 法检测各组细胞增殖活性Fig.2 Proliferation activities of cells in various groups detected by CCK-8 method

图3 克隆形成实验检测各组细胞克隆形成情况(结晶紫)Fig.3 Colone formations of cells in various groups detected by colony formation assay(Crystal violet)
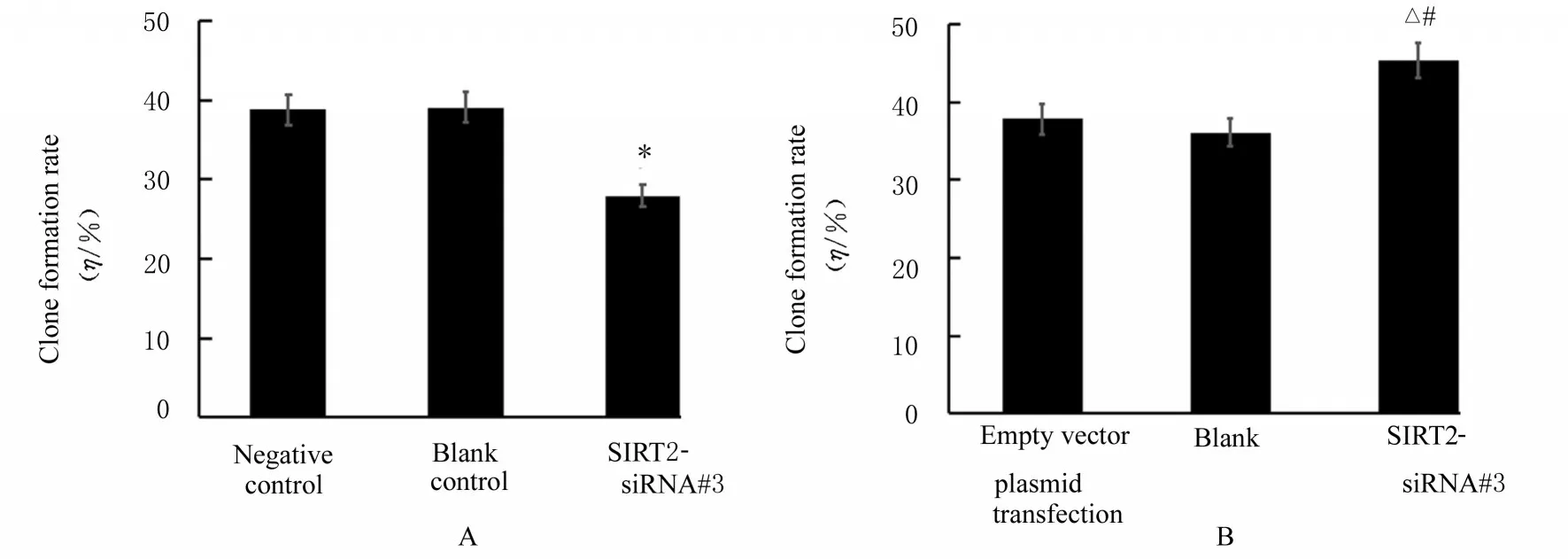
图4 各组细胞克隆形成率Fig.4 Clone formation rates of cells in various groups
2.3 过表达和沉默SIRT2 后各组细胞中G6PD mRNA 和蛋白表达水平RT-PCR 法检测结果显示:与阴性对照组比较,SIRT2-siRNA 干扰组HCT116 细胞中G6PD mRNA 表达水平明显降低;而SIRT2 质粒转染组SW480 细胞中G6PD mRNA表达水平较空载体质粒转染组明显升高。Western blotting 法检测结果显示:与阴性对照组比较,SIRT2-siRNA 干 扰 组 的HCT116 细 胞 中G6PD 蛋白表达水平降低(P<0.05);而SIRT2 质粒转染组SW480 细胞中G6PD 蛋白表达水平较空载体质粒转染组明显升高(P<0.05),见图5。
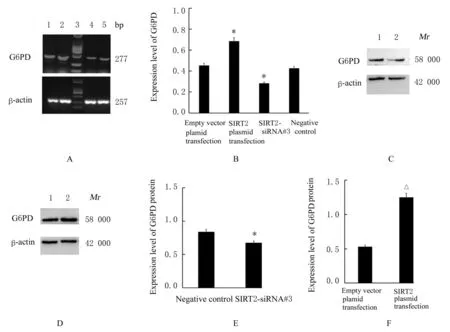
图5 各组细胞中G6PD mRNA 和蛋白表达电泳图和直条图Fig.5 Electropherograms and histograms of expressions of G6PD mRNA and protein in cells in various groups
2.4 大肠癌组织和癌旁组织中SIRT2 和G6PD 蛋白的表达水平采用免疫组织化学技术检测大肠癌临床样本中SIRT2 和G6PD 蛋白表达水平,结果显示:癌旁组织中SIRT2[SIRT2 蛋白高水平表达:37.5%(15/40)]和G6PD 蛋白表达水平[G6PD蛋白高水平表达:27.5%(11/40)]低于癌组织[SIRT2蛋白高水平表达:67.5% (27/40),G6PD蛋白高水平表达:77.5%(31/40)](P<0.05)。见图6。

图6 大肠癌和癌旁组织中SIRT2 和G6PD 的表达(免疫组织化学,×400)Fig.6 Expressions of SIRT2 and G6PD in colorectal cancer tissue and adjacent tissue (Immunohistochemistry,×400)
2.5 回复实验中各组细胞培养液中葡萄糖和乳酸水平、细胞增殖活性和克隆形成率与对照组比较,SIRT2-siRNA#3 和G6PD 质粒共转染组细胞培养液中葡萄糖和乳酸水平差异无统计学意义(P>0.05);与 SIRT2-siRNA#3 组 比 较,SIRT2-siRNA#3 和G6PD 共转染组细胞培养液中葡萄糖水平降低(P<0.05),乳酸水平升高(P<0.05)(图7)。CCK-8 实验检测结果显示:与对照组比较,SIRT2-siRNA#3 和G6PD 质粒共转染组细胞增殖活性差异无统计学意义(P>0.05);与SIRT2-siRNA#3 组 比 较,SIRT2-siRNA#3 和G6PD 共转染组细胞增殖活性升高(P<0.05)(图8)。克隆形成实验结果显示:与对照组比较,SIRT2-siRNA#3 和G6PD 质粒共转染组细胞克隆形成数量和克隆形成率差异无统计学意义(P>0.05);与 SIRT2-siRNA#3 组 比 较,SIRT2-siRNA#3 和G6PD 共转染组细胞克隆数增加(P<0.05),克隆形成率升高(P<0.05)。见图9和10。

图7 各组细胞培养基中葡萄糖和乳酸水平Fig.7 Levels of glucose(A) and lactic acid(B) in culture medium of cells in various groups
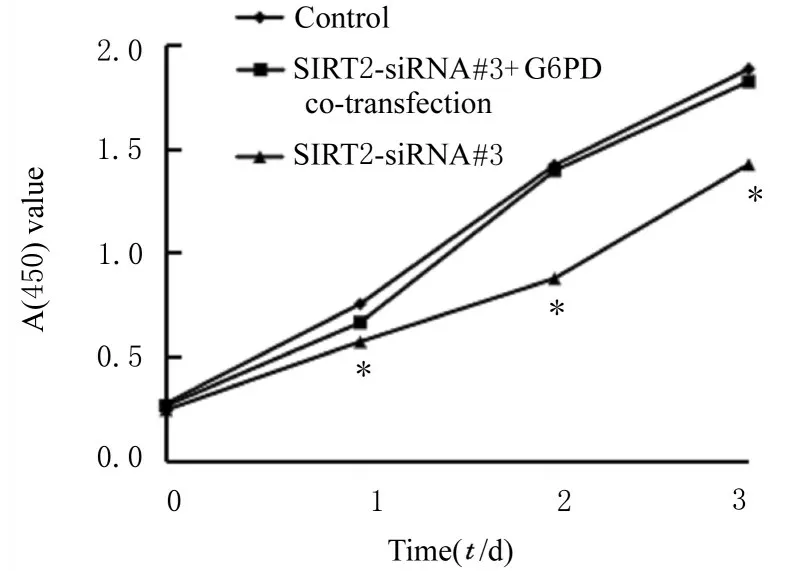
图8 CCK-8 法检测3 组不同时间点细胞增殖活性Fig.8 Proliferation activities of cells in various groups at different time proteins detected by CCK-8 method

图9 克隆形成实验检测各组细胞克隆形成情况(结晶紫)Fig.9 Colone formations of cells in various groups detected by colony formation assay(Crystal violet)
3 讨 论
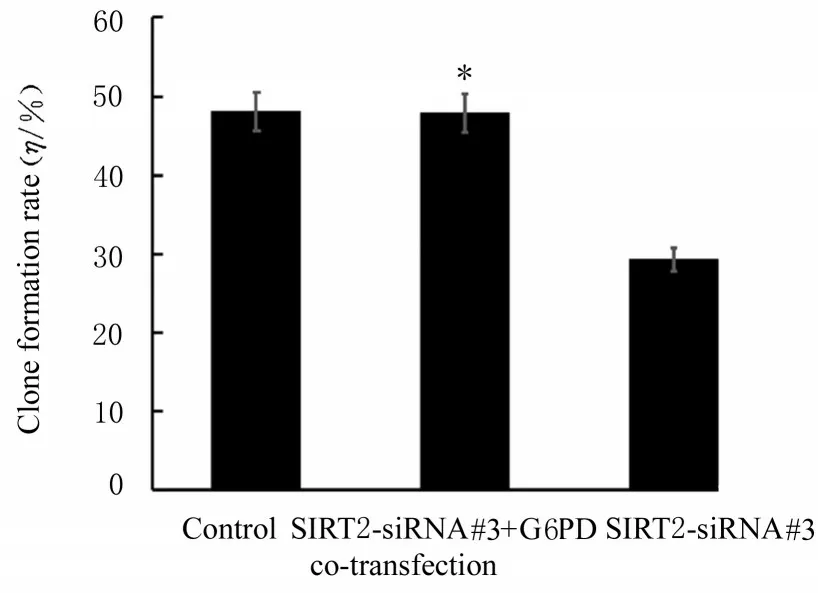
图10 回复实验中各组细胞克隆形成率Fig.10 Clone formation rates of cells in various groups in recovery experiment
SIRT2 作为SIRT 家族的一员,主要定位于细胞质,参与调控氧化应激和细胞程序性死亡等生物过程。研究[14]显示:SIRT2 促进宫颈癌的发生发展,其表达水平与宫颈癌的恶性程度有关;在裸鼠原位肝癌肺转移模型中,敲低SIRT2 基因可以激活蛋白激酶B(protein kinase B,Akt)进而影响糖原 合 成 酶 激 酶 3β (glycogen synthase kinase3β,GSK3β)/β-连环蛋白(β-catenin)信号通路,抑制人肝癌细胞的增殖和肺转移[15]。SIRT2 在大肠癌细胞糖代谢和增殖中的作用目前尚不明确。本研究选择大肠癌HCT116 细胞和SW480 细胞,Western blotting 法检测SIRT2 蛋白在HCT116 细胞中呈高表达,在SW480 细胞中呈低表达,因此选择HCT116 细胞进行后续RNA 干扰实验,选择SW480 细胞进行后续的过表达实验。合成si-RNA小链,构建重组质粒pcDNA3.1-HA-SIRT2,采用瞬时转染法将si-RNA 小链和质粒分别转染至HCT116 和SW480 细胞。细胞培养液中葡萄糖和乳酸水平检测结果显示:si-SIRT2 转染组培养液中葡萄糖水平明显高于阴性对照组,乳酸水平明显低于对照组;而SIRT2 转染组培养液中葡萄糖水平明显低于对照组,乳酸水平高于对照组。20 世纪30 年代 WARBURG 首次提出肿瘤细胞中存在“Warburg 效应”,即有氧糖酵解,是指肿瘤细胞即使在氧气充足的情况下也会利用糖酵解供能产生乳酸。因此本研究证实了SIRT2 促进大肠癌细胞葡萄糖的摄取和乳酸的生成,即促进大肠癌细胞有氧糖酵解。有氧糖酵解可以为肿瘤细胞的生长提供以下优势:一是迅速产生能量;二是为肿瘤细胞生物大分子的合成提供原料,满足肿瘤细胞快速增殖的需求[16]。本文作者推测SIRT2 可能通过提高糖酵解进而促进大肠癌细胞的增殖,CCK-8 实验和克隆形成实验均证实SIRT2 促进大肠癌细胞的增殖。CHEN 等[17]研究证实:SIRT2 调节Akt 的去乙酰化和活化,随后影响GSK3β/β-catenin 信号通路以调节上皮间质转化 (epithelial-mesenchymal transition,EMT)。牛虹等[18]研究证实:在胃癌细胞中SIRT2 存在明显的表达上调,沉默SIRT2可 能 通 过 调 节 磷 脂 酰 肌 醇 -3- 激 酶(phosphatidylinositol-3-kinase,PI3K)/Akt 通 路,从而抑制胃癌细胞迁移、增殖和侵袭;GUO 等[19]研究也证实敲低 SIRT2 使子宫内膜癌(endometrial carcinoma,EC)细胞增殖降低,其机制与SIRT2 对 EC 细胞大鼠肉瘤病毒/细胞外信号调节激酶(rat sarcoma virus/extracellular signalregulated kinase,RAS/ERK)通路的调节有关,与本研究结果一致。
磷酸戊糖途径是糖酵解支路,该途径与细胞增殖密切相关,其中间产物最终进入糖酵解途径。G6PD 是磷酸戊糖途径的限速酶,研究[20-22]证实:G6PD 在多种肿瘤组织或细胞系中均表现出高表达和高活性,降低G6PD 的表达将抑制癌细胞的增殖[23]。本研究结果显示:沉默SIRT2 后细胞中G6PD mRNA 和蛋白表达水平均降低,而过表达SIRT2 后细胞中G6PD mRNA 和蛋白表达水平均升高,SIRT2 对G6PD 有明显的正向调控作用。作为去乙酰化酶,SIRT2 通过何种机制调控G6PD 的基因表达需进一步研究。为了证实 G6PD 参与SIRT2 对大肠癌细胞的有氧糖酵解和细胞增殖的调控作用,本研究在 HCT116 细胞中共转染SIRT2-siRNA 和G6PD 质粒,结果显示:与 si-SIRT2 单独转染组比较,si-SIRT2&G6PD 质粒共转染组细胞的有氧糖酵解和增殖能力均得以恢复。由此推断 G6PD 参与 SIRT2 调控大肠癌细胞葡萄糖的消耗、乳酸的生成和细胞增殖。已有研究[24-25]证实:SIRT2 能够激活G6PD 进而促进白血病细胞的克隆形成和增殖,沉默SIRT2 抑制G6PD 活性,导致白血病细胞的增殖降低,与本研究结果一致。本研究中免疫组织化学检测结果显示:SIRT2 和G6PD 在大肠癌组织中均为高表达。
综上所述,SIRT2 促进大肠癌细胞的有氧糖酵解和增殖,其机制可能与SIRT2 调控G6PD 的基因表达有关。
