鹿茸多肽预处理通过miR-133a 调控TGF-β/Smad 信号通路对TBHP 诱导心肌H9c2 细胞损伤的保护作用
2023-05-06周高峰刘俊秀律广富王雨辰黄晓巍
周高峰, 肖 静,2, 周 佳, 刘俊秀, 律广富, 王雨辰, 林 贺, 黄晓巍
(1.长春中医药大学药学院临床药学与中药药理教研室,吉林 长春 130117;2.中国医学科学院药用植物研究所,北京 100094;3.长春中医药大学 吉林省人参研究科学院中药药理组,吉林 长春 130117)
急性心肌梗死(acute myocardial infarction,AMI)在心血管疾病中死亡率较高,死亡人数近年来迅速增加,并倾向于在年轻个体中较多发生,且预后较差,给患者和社会均带来沉重负担[1]。鹿茸为鹿科动物梅花鹿或马鹿的雄鹿未骨化密生茸毛的幼角,是哺乳动物中唯一具有完全再生能力的附属器官[2]。心肌梗死后再灌注治疗也会导致炎症和氧化应激等一系列的病理生理反应,进而导致细胞凋亡及坏死。慢性心肌梗死后会发生持续性的细胞凋亡及心室重构和心肌纤维化,最终导致心力衰竭[3]。心肌梗死及再灌注损伤仍是临床难题,中药及其提取物在保护心脏、防止心肌细胞凋亡及纤维化等方面具有良好的疗效[4]。《本草纲目》记载:“鹿茸能生精补髓,养血益阳,强筋健骨,治一切虚损,耳聋,目暗,眩晕,虚痢”。鹿茸多肽(velvet antler polypeptide,VAP)对大鼠循环、免疫、运动和神经系统具有改善和治疗作用,并对心肌缺血损伤、心肌梗死、心肌缺血再灌注和冠心病心绞痛具 有 保 护 作 用[5-6]。VAP 通 过 调 控Notch 通 路 和 蛋白激酶B/哺乳动物雷帕霉素靶蛋白(protein kinase B/mammalian target of rapamycin,Akt/mTOR)信号通路调控内皮祖细胞增殖和迁移保护心脏微血管[7];VAP 能明显降低阿霉素诱导的心肌细胞损伤模型中转化生长因子β(transforming growth factor-β,TGF-β)蛋白表达水平,减少心肌细胞凋亡,保护心肌组织[8];通过调节心肌特异性 转 录 因 子 Nkx2.5 和 GATA 结 合 蛋 白 4(transcription factor GATA4,GATA4)的表达缓解阿霉素所致的心肌细胞损伤[9]。微小RNA(microRNAs,miRNAs)是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA 分子。miR-133是一种肌源性miRNA,可通过降低TGF-β1表达保护心肌细胞,在正常的心肌细胞中表达丰富,具有调节心肌细胞肥大和心肌细胞分化发育的功能,其表达与多种心脏疾病密切相关[10-11]。李敏[12]研究表明:稳心中药可提高血清球蛋白水平,降低血清心肌酶水平,增加miR-133 表达水平发挥强心作用。YU 等[13]研究发现:芦荟大黄素可通过上调miR-133 表达水平来减轻心肌梗死和心肌细胞凋亡。同时,miR-133 可调控TGF-β/Smads、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和 磷 脂 酰 肌 醇 3-激 酶(phosphoinositide 3-kinase,PI3K)/Akt 等 多 条 通路改善心肌细胞能量代谢,修复受损心肌[14]。本课题组前期动物实验研究[15]表明:VAP 可通过TGF-β/Smads 信号通路改善大鼠冠状动脉左前降支结扎诱导的心肌梗死后缺血损伤及纤维化损伤,改善心肌组织病理状态,减少心肌细胞凋亡。本研究通过采用叔丁基过氧化氢 (tert-butyl hydroperoxide,TBHP)诱 导 大 鼠 心 肌H9c2 细 胞损伤,探讨VAP 含药血清对心肌细胞的保护作用,阐明VAP 对miR-133/TGF-β/Smad 轴的作用机制,为研究VAP 对心肌细胞损伤的修复作用提供实验依据。
1 材料与方法
1.1 实验动物、细胞、药物、主要试剂和仪器SPF级Wistar 雄性大鼠21 只,体质量(180±20)g,购自长春市亿斯实验动物技术有限公司,动物生产许可证号:SCXK(吉)-2020-0002。VAP(长春中医药大学药学院制备,每1 g VAP 约含生药28.9 g,批号:20201120)。大鼠H9c2 细胞(中国科学院上海细胞库,批号:3111C0001CCC000219)。青链霉素(北京索莱宝科技有限公司,货号:P1400),胎牛血清(中国CLARK Bioscience 公司,货号:FB15015C),高糖DMEM 培养基(货号:31053036)和胰蛋白酶-EDTA (0.25%)(批号:25200072)购自美国Gibco 公司,TBHP[西格玛奥德里奇(上海)贸易有限公司,货号:458139],micrOFF gga-miR-133a-3p inhibitor(广州锐博生物技术有限公司),二甲基亚砜和PBS 缓冲液(北京索莱宝科技有限公司,批号:D8371、P1022),肌酸激酶同工酶(creatine kinase-MB,CK-MB)、心肌肌钙蛋白T(cardiac troponin T,cTnT)和心肌肌钙蛋白I(cardiac troponin I,cTnI)酶联免疫吸附 试 验 (enzyme linked immunosorbent assay,ELISA)试剂盒(江苏酶免生物科技有限公司,货号:MM-0625R1、MM-0795R1和MM-61550R1),PrimeScript™ Ⅱ High Fidelity RT-PCR Kit 试 剂 盒(日本TaKaRa 技术有限公司,货号:R023A50),RNAsimple Total RNA Kit 总RNA 提取试剂盒(天根生化科技有限公司,货号:DP419),全蛋白提取试剂盒(货号:p0033)和BCA 蛋白浓度测试试剂盒(上海碧云天生物技术有限公司,货号:p0012s),TGF-β1 抗体、Smad4 抗体和p-Smad2/3抗体(北京索莱宝科技有限公司,货号:21898-1-AP、10231-1-AP 和K009346P)。多功能微孔板酶标仪(型号:SUNERGY-HTX)和二氧化碳培养箱(型号:311)购自赛默飞世尔科技(中国)有限公司,电泳仪和电泳槽(型号:BE6085)购自美国伯乐 Bio-Rad 公司,多道生理记录仪(型号:ML22)购自埃德仪器国际贸易有限公司,倒置荧光显微镜(型号:CKX4)购自日本奥林巴斯公司。
1.2 VAP 含药血清制备健康Wistar 大鼠21 只,随机分为空白血清组、低剂量(100 mg·kg-1)VAP 组和 高剂量(400 mg·kg-1)VAP 组,均灌胃给药,每天1 次,连续7 d。于第7 天灌胃2 h 后,腹主动脉 取 血,3 000 r·min-1离 心15 min,分 离 血 清,0.22 μm 微孔滤膜过滤除菌后分装,置于-80 ℃冰箱保存备用。
1.3 细胞培养与转染大鼠H9c2 细胞生长于含10% 胎牛血清的DMEM 培养液中,置于37 ℃、5%CO2饱和湿度的恒温密闭培养箱中进行常规培养并传代,0.25%胰蛋白酶消化,每3 d 消化传代1 次。接种2×104个细胞至含有适量完全培养基的24 孔细胞培养板中。转染:用30 μL 1×Buffer 稀释1.25 μL 20 μmol·L-1miRNA inhibitor,轻 轻 混匀;加入3 μL CP Reagent,轻轻吹打混匀,室温孵育0~15 min。将混合液加入到无双抗完全培养基中,轻轻混匀;24 h 后进行加药处理。
1.4 实验分组将6 孔细胞培养板中培养24 h 的H9c2 细胞更换新培养液,每2 孔行不同的药物处理。H9C2 细胞分为空白对照组、空白血清组、TBHP 组、TBHP+低剂量VAP 组、TBHP+高剂量VAP 组和miR-133 inhibitor 组;除空白对照组和TBHP 组外,其余各组细胞均给予VAP 20%含药血清,miR-133 inhibitor 组细胞先转染miR-133 inhibitor 后再给予VAP 含药血清。
1.5 MTT 法检测各组细胞存活率将H9c2 细胞分为空白对照组(无任何处理)、正常对照组(加入5%或10%或20%空白血清)、低剂量VAP 组(加入5% 或10% 或20% 低剂量VAP 含药血清)和高剂量VAP 组(加入5%或10%或20%高剂量VAP 含药血清)。药物干预24 h 后,每孔加入15 μL 四甲基偶氮唑蓝,孵育4 h 后,弃去上清液。每孔加入150 μL 二甲基亚砜,避光处振摇10 min,采用多功能微孔酶标仪测定490 nm 处的A 值。将H9c2 细胞分为6 组:空白对照组(无任何处理)、正常对照组(20%空白血清)、TBHP 组(20%空白血清+200 μmol·L-1TBHP)、低剂量VAP 含药血 清组(20%低剂量VAP 含药血清+200 μmol·L-1TBHP)、高剂量VAP 含药血清组(20% 高剂量VAP 含 药 血 清+200 μmol·L-1TBHP)、miR-133抑 制 剂 组(miR-133 inhibitor 24 h+400 mg·kg-1VAP 24 h+200 μmol·L-1TBHP)。药物干预24 和48 h 后,按照上述实验方法操作。细胞存活率=实验孔平均A 值/对照孔平均A 值×100%。
1.6 ELISA 法检测各组细胞培养上清液中cTnT、cTnI 和CK-MB 水平将H9c2 细胞接种于6 孔细胞培养板(每孔6×104个细胞)中培养24 h。收集细胞上清液,采用ELISA 法检测各组细胞培养上清液中cTnT、cTnI 和CK-MB 水平,具体步骤参照试剂盒说明书进行。
1.7 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组细胞中miR-133 表达水平将H9c2 细胞接种于6 孔细胞培养板(每孔6×104个细胞)中培养24 h。实验分组同“1.4”,收集细胞,TRIzol 法提取细胞中的总RNA,实验步骤参照试剂盒说明书。应用紫外分光光度计检测RNA 的浓度和纯度,反转录合成cDNA,步骤参照cDNA 合成试剂盒,根据RT-qPCR 试剂盒检测miR-133 表达水平,内参基因为GAPDH。反应总体积为20 μL,反应程序:94 ℃、15 s(变性);58 ℃、15 s(退火),72 ℃、15 s(延伸),30个循环。miR-133a正向引物:5′-ACACTCCAGCTGGGCAAAGTTACAGTGC-3′,反 向引 物:5′-CTCAACTGGTGTCGTGGA-3′;GAPDH 正 向 引 物:5′-GCTVATTTGCAGGGGGGAG-3′,反 向 引 物:5′-GTTGGTGGTGCAGGAGGCA-3′。以GAPDH为内参对照,采用2-△△Ct法计算各组细胞中miR-133 表达水平。
1.8 Western blotting 法检测各组细胞中TGF-β1、p-Smad2/3 和Smad4 蛋白表达水平将细胞接种于6 孔细胞培养板(每孔6×104个细胞)中培养24 h。细胞分组和处理见“1.4”。收集各组细胞,按照总蛋白提取试剂盒说明书提取各组总蛋白,采用BCA 定量,每孔上样20 μL 蛋白,进行凝胶电泳,90 min 后转膜至PVDF 膜上,奶粉封闭液封闭1 h,加入兔抗GAPDH、TGF-β1、p-Smad2/3 和Smad4 一抗,4 ℃孵育过夜,次日加入抗兔二抗,并在室温摇床孵育2 h,按照高敏感度化学发光检测试剂盒说明书滴加发光工作液显色后,以GAPDH 为内参,采用Imageproplus 6.0 软件进行灰度值分析。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.9 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组H9c2 细胞存活率,各组H9c2 细胞培养上清中cTnT、cTnI 和CK-MB 水平,各组H9c2 细 胞 中 miR-133 表 达 水 平 及 TGF-β1、p-Smad2/3 和Smad4 蛋白表达水平均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组细胞存活率与空白对照组比较,空白血清组细胞存活率差异无统计学意义(P>0.05);与空白对照组比较,5%和10%VAP 含药血清组细胞存活率明显降低(P<0.05),故选取20%含药血清浓度。TBHP 作用H9c2 细胞24 和48 h 后,与空白对照组比较,TBHP 组细胞存活率明显降低(P<0.05);与TBHP 组比较,低和高剂量VAP 组的细胞存活率明显升高(P<0.05),miR-133 inhibitor组的细胞存活率差异无统计学意义(P>0.05)。见表1。
表1 各组H9c2 细胞存活率Tab.1 Survival rates of H9c2 cells in various groups (n=6,±s,η/%)
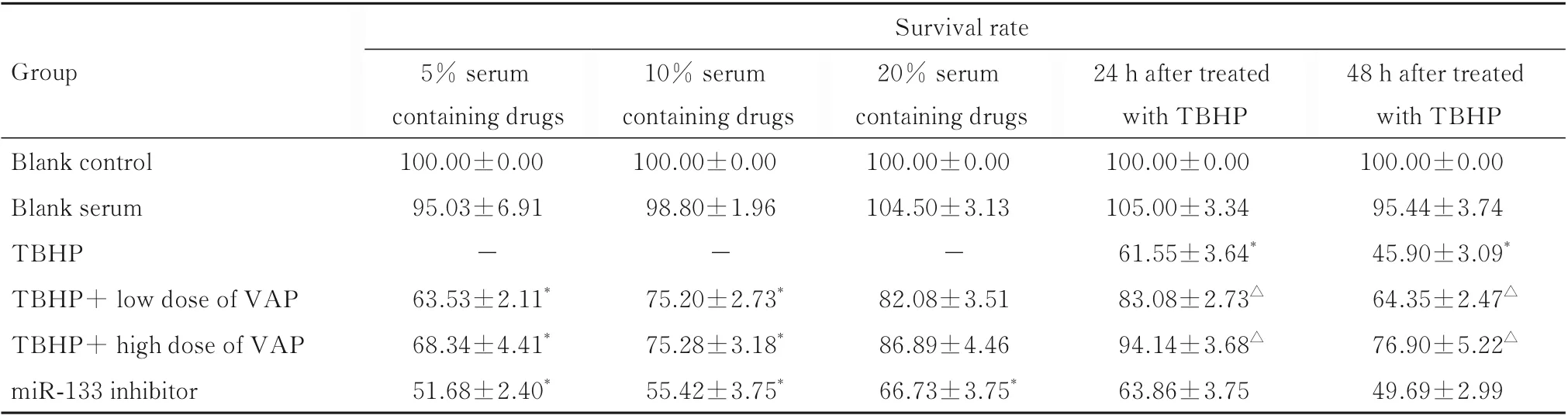
表1 各组H9c2 细胞存活率Tab.1 Survival rates of H9c2 cells in various groups (n=6,±s,η/%)
“-”:No data.*P<0.05vsblank control group;△P<0.05vsTBHP group.
Survival rate Group 20% serum containing drugs 100.00±0.00 104.50±3.13-82.08±3.51 86.89±4.46 66.73±3.75*48 h after treated with TBHP 100.00±0.00 95.44±3.74 45.90±3.09*64.35±2.47△76.90±5.22△49.69±2.99 24 h after treated with TBHP 100.00±0.00 105.00±3.34 61.55±3.64*83.08±2.73△94.14±3.68△63.86±3.75 5% serum containing drugs 100.00±0.00 95.03±6.91-63.53±2.11*68.34±4.41*51.68±2.40*10% serum containing drugs 100.00±0.00 98.80±1.96-75.20±2.73*75.28±3.18*55.42±3.75*Blank control Blank serum TBHP TBHP+ low dose of VAP TBHP+ high dose of VAP miR-133 inhibitor
2.2 各组细胞培养上清液中cTnT、cTnI 和CK-MB 水平与空白对照组比较,TBHP 组细胞培养上清液中cTnT、cTnI 和CK-MB 水平明显升高(P<0.05);与TBHP 组比较,TBHP+低剂量VAP 组和TBHP+高剂量VAP 组细胞培养上清液中cTnT、cTnI 和CK-MB 水平明显降低(P<0.05 或P<0.01),miR-133 inhibitor 组细胞培养上清液中cTnT、cTnI 和CK-MB 水平差异无统计学意义(P>0.05)。见表2。
表2 各组H9c2 细胞中cTnT、cTnI 和CK-MB 水平Tab.2 Levels of cTnT, cTnI, and CK-MB in H9c2 cells in various groups (n=6,±s)
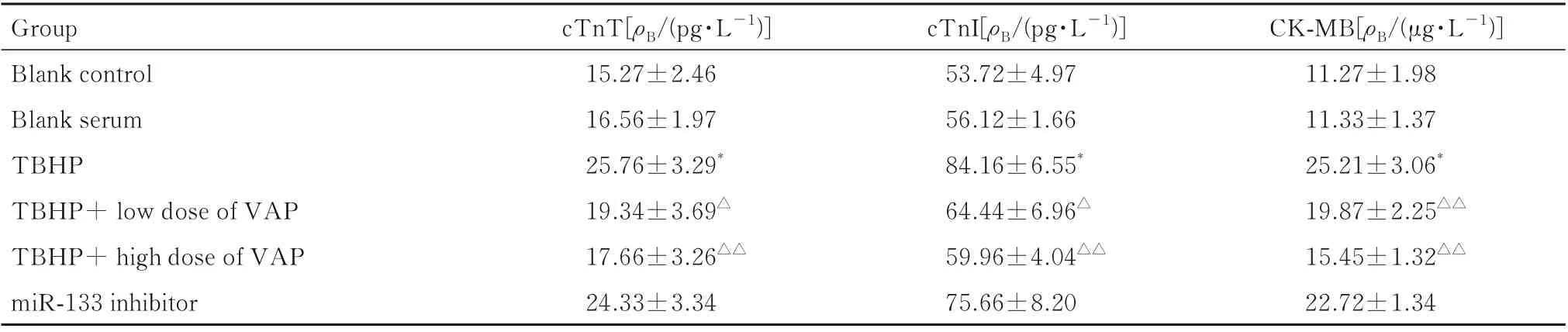
表2 各组H9c2 细胞中cTnT、cTnI 和CK-MB 水平Tab.2 Levels of cTnT, cTnI, and CK-MB in H9c2 cells in various groups (n=6,±s)
*P<0.05vsblank control group;△P<0.05,△△P<0.01vsTBHP group.
Group Blank control Blank serum TBHP TBHP+ low dose of VAP TBHP+ high dose of VAP miR-133 inhibitor CK-MB[ρB/(μg·L-1)]11.27±1.98 11.33±1.37 25.21±3.06*19.87±2.25△△15.45±1.32△△22.72±1.34 cTnT[ρB/(pg·L-1)]15.27±2.46 16.56±1.97 25.76±3.29*19.34±3.69△17.66±3.26△△24.33±3.34 cTnI[ρB/(pg·L-1)]53.72±4.97 56.12±1.66 84.16±6.55*64.44±6.96△59.96±4.04△△75.66±8.20
2.3 各组H9c2 细胞中miR-133 表达水平与空白对照组比较,TBHP 组细胞中miR-133a 表达水平明显降低(P<0.05);与TBHP 组比较,TBHP+低剂量VAP 组和TBHP+高剂量VAP 组细胞中miR-133a 表达水平明显升高(P<0.05 或P<0.01),miR-133 inhibitor 组 细 胞 中miR-133a 表 达水平明显降低(P<0.01)。见表3。
表3 各组H9c2 细胞中miR-133 表达水平Tab.3 Expression levels of miR-133 in H9c2 cells in various groups (n=6,±s)
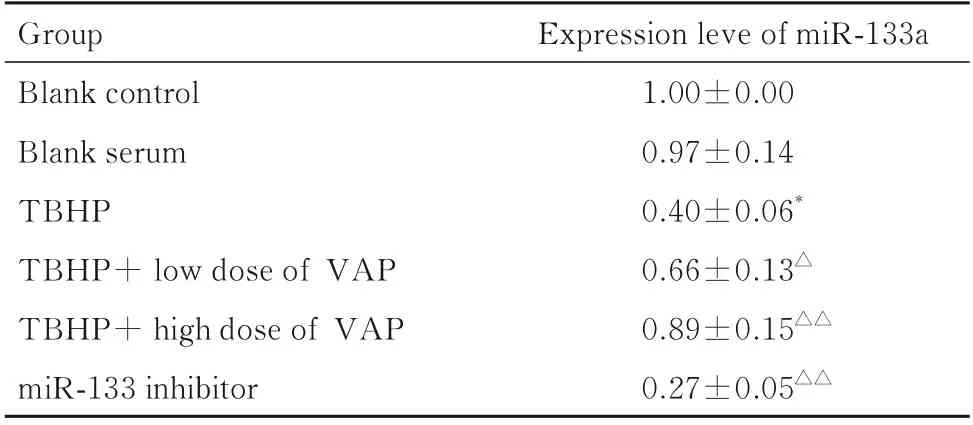
表3 各组H9c2 细胞中miR-133 表达水平Tab.3 Expression levels of miR-133 in H9c2 cells in various groups (n=6,±s)
*P<0.05vsblank control group;△P<0.05,△△P<0.01vsTBHP group.
Expression leve of miR-133a 1.00±0.00 0.97±0.14 0.40±0.06*0.66±0.13△0.89±0.15△△0.27±0.05△△Group Blank control Blank serum TBHP TBHP+ low dose of VAP TBHP+ high dose of VAP miR-133 inhibitor
2.4 各组 细 胞中TGF-β 1、p-Smad2/3 和Smad4蛋白表达水平与空白对照组比较,TBHP组细胞中TGF-β1、p-Smad2/3和Smad4 蛋白表达水平明显升高(P<0.05);与TBHP 组比较,TBHP+低和高 剂 量VAP 组 细 胞 中TGF- β1、p-Smad2/3 和Smad4 蛋白表达水平明显降低(P<0.05),miR-133a inhibitor 组细胞中上述指标差异无统计学意义(P>0.05)。见表4 和图1。
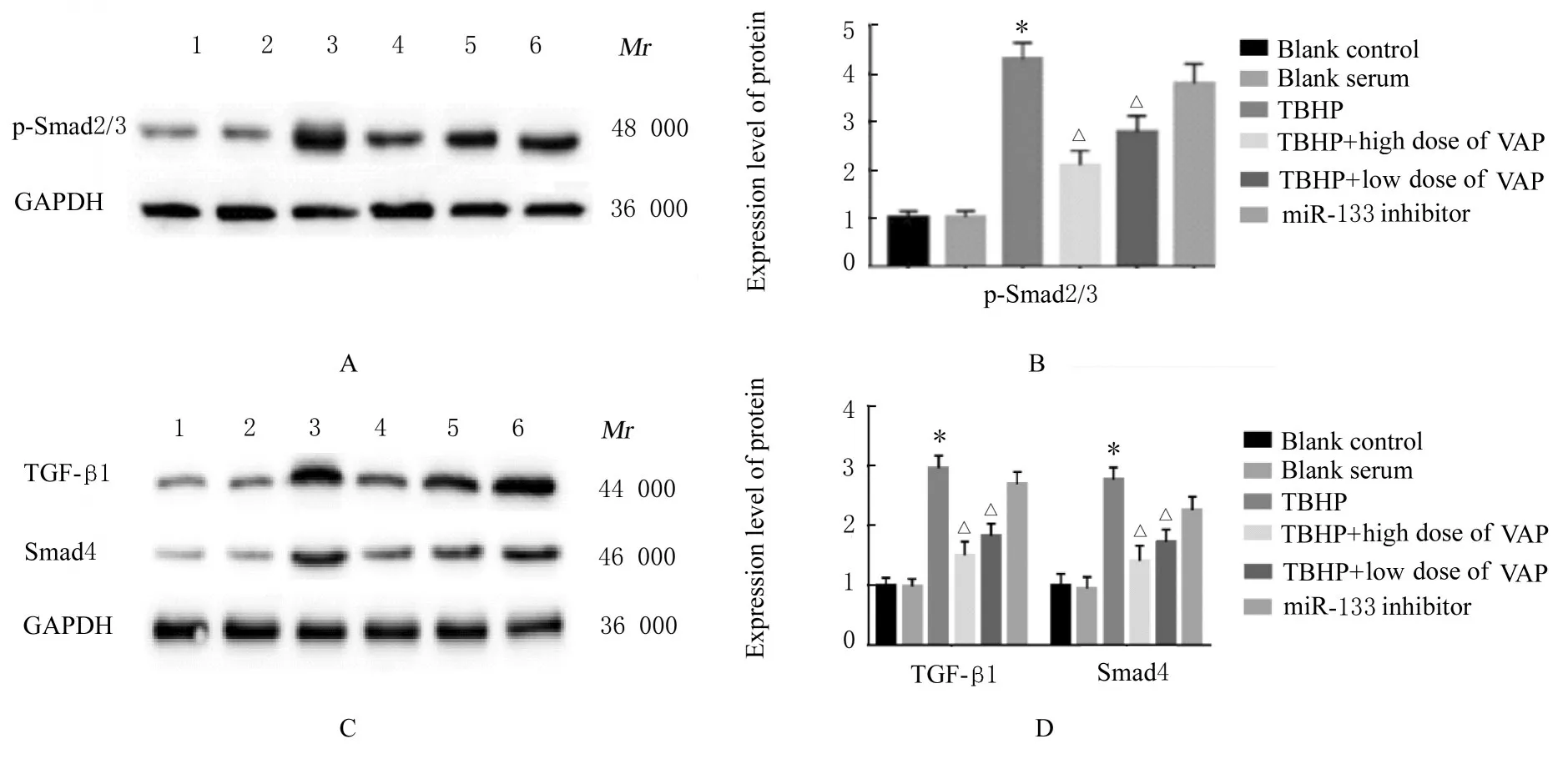
图1 各组H9c2 细胞中p-Smad2/3、TGF-β1 和Smad4 蛋白表达电泳图(A,C)和直条图(B,D)Fig.1 Electrophoregrams(A,C) and histograms(B,D) of expressions of p-Smad2/3,TGF-β 1,and Smad4 proteins in H9c2 cells in various groups
表4 各组H9c2 细胞中TGF-β1、p-Smad2/3 和Smad4 蛋白表达水平Tab.4 Expression levels of TGF-β1,p-Smad2/3,and Smad4 in H9c2 cells in various groups (n=6,±s)

表4 各组H9c2 细胞中TGF-β1、p-Smad2/3 和Smad4 蛋白表达水平Tab.4 Expression levels of TGF-β1,p-Smad2/3,and Smad4 in H9c2 cells in various groups (n=6,±s)
*P<0.05vsblank control group;△P<0.05vsTBHP group.
Group Blank control Blank serum TBHP TBHP+ low dose of VAP TBHP+ high dose of VAP miR-133 inhibitor Smad4 1.00±0.00 0.96±0.11 2.81±0.24*1.32±0.35△1.47±0.32△2.63±0.41 p-Smad2/3 1.00±0.00 1.03±0.12 4.31±0.34*2.14±0.35△2.83±0.32△3.92±0.41 TGF-β1 1.00±0.00 1.11±0.12 2.92±0.36*1.86±0.15△1.96±0.22△2.51±0.31
3 讨 论
TBHP 可以损伤心肌细胞,是诱导心肌细胞氧化应激和凋亡的体外造模方法。本研究采用MTT法筛选出TBHP 制备H9c2 损伤模型的作用最佳时间(24 h)和 浓 度(200 μmol·L-1);当TBHP 浓度 为200 μmol·L-1时,cTnT、cTnI 和CK-MB 大量释放至细胞中,TGF-β1、p-Smad2/3 和Smad4蛋白表达水平及miR-133 表达水平发生明显变化,提 示TBHP 浓 度 在200 μmol·L-1时 引 起H9c2 损 伤明显;通过VAP 含药血清干预后,能够达到改善H9c2 造模后的损伤程度[16]。VAP 可明显降低阿霉素诱导心肌损伤模型大鼠心肌组织中TGF-β1 蛋白表达水平,改善心肌损伤;可激活核因子E2 相关因子2/抗氧化反应元件(nuclear factor E2-related factor 2/antioxidant response element,Nrf2/ARE)信号通路,促进下游人血红素加氧酶1 (heme oxygenases-1,HO-1)表达,防止心肌缺血再灌注损伤[17-18]。前期研究[15]证明:VAP 可以改善冠状动脉左前降支结扎诱导的大鼠心肌梗死后缺血损伤,降低血清中cTnT、cTnI 和CK-MB 水平,调控TGF- β/Samds 表 达 水 平,降 低Ⅰ型 胶 原(collagen Ⅰ,ColⅠ)和Ⅲ型胶原(collagen Ⅲ,ColⅢ)蛋白表达,改善心肌组织病理状态,减少心肌细胞凋亡。本研究结果显示:与TBHP 组比较,VAP 给药组细胞中cTnT、cTnI 和CK-MB 水平明显降低,miR-133a 表达水平升高,TGF-β1、p-Smad2/3 和Smad4 蛋白表达水平降低,miR-133 inhibitor 可以逆转VAP 给药组相应的改变。本研究结果表明:VAP 对心肌细胞具有保护作用,可能是通过miR-133a 调控TGF-β/Smads 信号通路发挥相应作用。TGF-β/Smads 信号通路是典型的纤维化通路,心肌细胞发生损伤后,激活其通路并磷酸化下游的Smad2 和Smad3 蛋白,与Smad4 蛋白结合后入细胞核发挥相应作用[15]。miR-133 在正常心肌细胞中表达丰富,有研究[19-20]表明:过表达miR-133 能改善心肌细胞纤维化损伤,而抑制miR-133 表达会使心肌纤维化损伤加重。本研究结果表明:VAP 能通过增加miR-133 表达水平改善心肌细胞损伤。研究[21-23]表明:miR-133 被抑制并伴有心肌损伤时TGF-β 水平升高导致上皮间质转化,相反,miR-133 表达水平升高时会阻断TGF-β 诱导的上皮间质转化。本研究结果表明:VAP 能通过提高miR-133 的表达调控TGF-β/Smads 信号通路进而保护TBHP 诱导的H9c2 细胞损伤。
综上所述,VAP 含药血清预处理可以有效抑制TBHP 所致的H9c2 细胞损伤,其机制可能是通过升高H9c2 细胞中miR-133a 表达水平调节TGF-β/Samds 传导通路进而发挥保护心肌细胞的作用。
