美国心血管造影和介入学会休克分类在真实世界急性心肌梗死合并心原性休克的应用价值
2023-05-06曾繁芳何松坚胡伟王小庆闫少迪陈怡粤房子熙郭文钦罗颖宋莉颜红兵
曾繁芳 何松坚 胡伟 王小庆 闫少迪 陈怡粤 房子熙 郭文钦 罗颖 宋莉 颜红兵
急性心肌梗死(acute myocardial infarction,AMI)合并心原性休克(ca rdiogenic shock,CS)长期以来没有统一标准,临床研究无统一方法[1-2]。目前对CS的公认定义主要参考:休克(SHOCK)[3]、主动脉内球囊反搏-休克(intraaortic balloon pump SHOCK,IABP-SHOCK)Ⅱ[4]和2016年欧洲心力衰竭指南[5]。但是CS存在不同的血流动力学状态和预后不佳等问题[6],因此2019年美国心血管造影和介入学会(Society of Cardiovascular Imaging and Intervention,SCAI)发布了CS的临床专家共识[7],首次将CS分为5期,分别为A“风险期”、B“开始期”、C“典型期”、D“恶化期”、E“终末期”,已广为接受。国内有研究提示SCAI-CS分类法可以作为入院时快速评价疾病风险的分层方法[8],然而临床研究应用和验证中发现其不足,如分期参数不够明确具体等,故2022年发布了修订版的SCAI-CS专家共识[9]。至今在真实世界中应用该修订版评估AMICS少有报道,因此本研究回顾性地对中国医学科学院阜外医院深圳医院的AMICS患者按照SCAI-CS分类法及其修订版进行诊断、治疗及预后分析,并总结其临床指导意义。
1 对象与方法
1.1 研究对象
收集2019年1月1日至2021年12月31日入住中国医学科学院阜外医院深圳医院的AMI住院患者资料。纳入标准:按照第四版心肌梗死全球统一定义[10]A M I的诊断标准对这些患者逐个核实并筛选出确诊A MI的患者,再根据传统休克、2019年及修订版SCAI-CS分类法定义筛选出AMICS患者。传统休克定义[3-5]:(1)收缩压低于90 mmHg(1 mmHg=0.133 kPa)并持续30 min,或者需要药物和(或)器械辅助维持收缩压90 mmHg;(2)组织和器官灌注不足的证据,如尿量每小时少于30 ml、四肢冰凉。2019年SCAICS分类法[7]定义:A“风险期”,患者的血流动力学稳定,无休克的临床证据,但有发展为休克的风险,比如大面积心肌梗死;B“开始期”,患者无低灌注,但有血流动力学不稳定的临床证据(包括低血压、心动过速或者全身血流动力学异常);C“典型期”,通常出现低血压,有低灌注的临床证据,初始治疗需要药物或者器械循环辅助;D“恶化期”,尽管治疗升级,患者仍出现休克恶化/治疗未改善的临床证据;E“终末期”,患者出现难治性休克或实际/即将发生循环衰竭。修订版SCAI-CS[9]分类法定义:A“风险期”,患者目前未出现CS体征或症状,但存在进展为CS的风险;B“开始期”,患者有血流动力学不稳定(血压相对降低或心动过速)的临床证据,但无低灌注;C“典型期”,患者表现为低灌注且除容量复苏外,还需要给予其他干预(药物或机械循环支持),患者通常表现为血压相对降低(但不需要符合低血压标准);D“恶化期”,与C期相似但患者病情恶化,血流动力学恶化或乳酸升高证明初始支持策略未能恢复灌注;E“终未期”,实际或即将发生的循环衰竭,如患者通常昏迷,脉搏近乎消失,心脏衰竭多次除颤,乳酸≥8 mmol/L,心肺复苏(A-修饰因子),严重酸中毒(pH<7.2,碱缺失>10 mEq/L),尽管有最大的血流动力学支持,仍出现严重的低血压。本研究获得中国医学科学院阜外医院深圳医院临床试验伦理委员会许可,患者知情并签署相关知情同意书。
1.2 临床数据采集
通过电子病历数据库获得所有患者临床资料和实验室数据,收集患者住院期间的数据,包括人口学资料、临床资料、实验室参数、诊疗措施及结果等(图1)。通过审查电子病历系统和电话随访确定包括全因死亡率在内的院内和出院30 d内主要不良心脑血管事件(major adverse cardiac and cerebrovascular event,MACCE)。
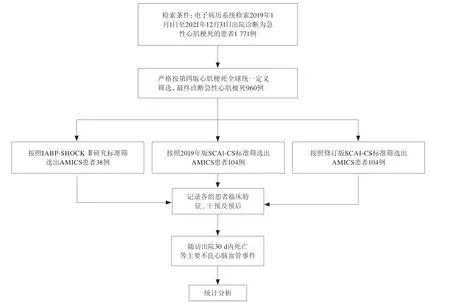
图1 研究路线Figure 1 Research route
1.3 统计学分析
采用SPSS 20.0软件进行数据处理。分类变量以数量和百分比(%)表示,组间比较采用卡方检验;连续变量以均数±标准差(±s)表示。以P<0.05为差异有统计学意义。
2 结果
通过电子病历系统按照出院诊断为“急性心肌梗死”检索出病历1 771份,严格按照AMI诊断标准逐个审核,最终确诊为AMI的患者960例。按照IABP-SHOCK Ⅱ诊断休克标准,筛查出AMICS 38例(3.96%),按照修订版SCAI-CS分类法,符合A/B期的均为0,符合C、D、E期的分别为15例(39.47%)、11例(28.95%)、12例(31.58%);出院30 d内死亡21例(55.26%)。按照2019年版和修订版SCAI-CS分类法均从中筛查出AMICS 104例(10.83%),处 于A至E期的分别有34例(32.69%)、27例(25.96%)、20例(19.23%)、11例(10.58%)、12例(11.54%);出院30 d内死亡24例(23.08%),死亡率从A至E期分别为1例(2.94%)、0、3例(15.00%)、8例(72.73%)、12例(100.00%)。除死亡外,无其余MACCE发生(表1)。随访6个月,无新增MACCE发生。失访率7.5%。
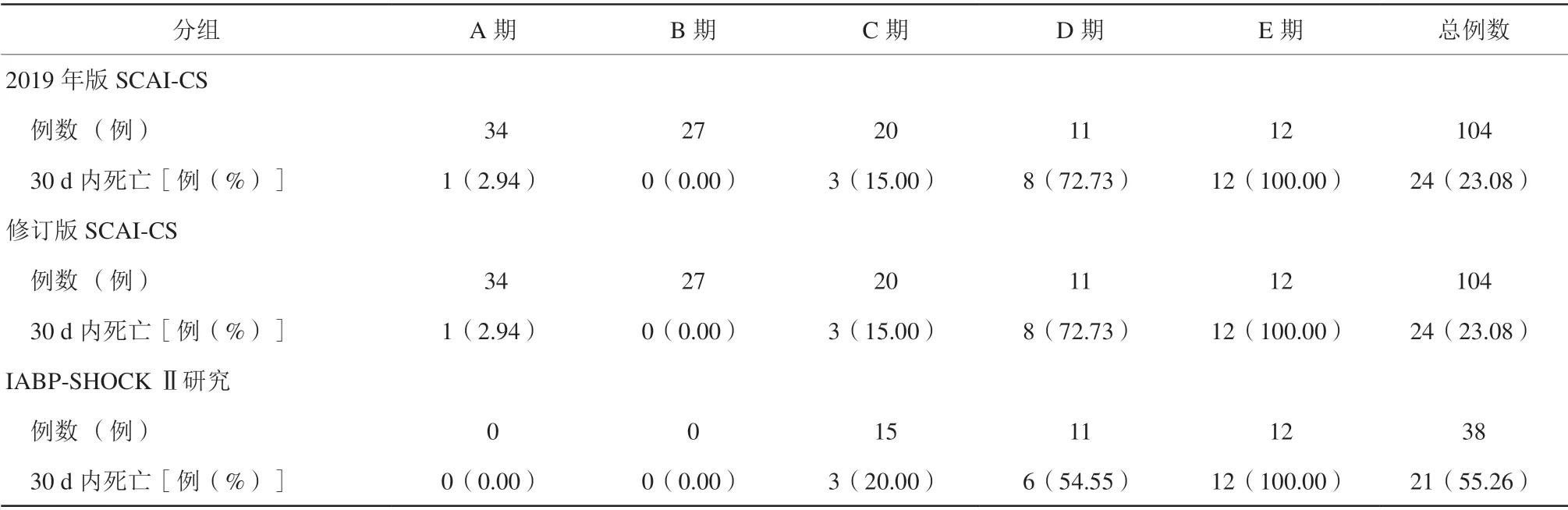
表1 2019 年版和修订版SCAI-CS 诊断与传统休克(IABP-SHOCK Ⅱ研究)诊断对比Table 1 Comparison between the 2019 and revised versions of SCAI-CS diagnosis and traditional shock (IABP-SHOCK Ⅱ study)diagnosis
2.1 不同SCAI-CS分期患者的人口学特征和临床资料
按照修订版诊断为AMICS的患者平均年龄(61.3±14.2)岁,各分期年龄差异无统计学意义,女性患者总体占比22.12%,各期间女性患者占比相似。合并高血压病51例(49.04%),吸烟50例(48.08%),陈旧性心肌梗死史22例(21.15%),各分期比较,差异均无统计学意义(均P>0.05)。合并糖尿病、射血分数、乳酸、高敏肌钙蛋白I峰值,各分期比较,差异均有统计学意义(均P<0.05)。入院时心率从A期到E期有上升的趋势,入院时收缩压和舒张压从A期至E期有下降趋势,差异均有统计学意义(均P<0.001,表2)。
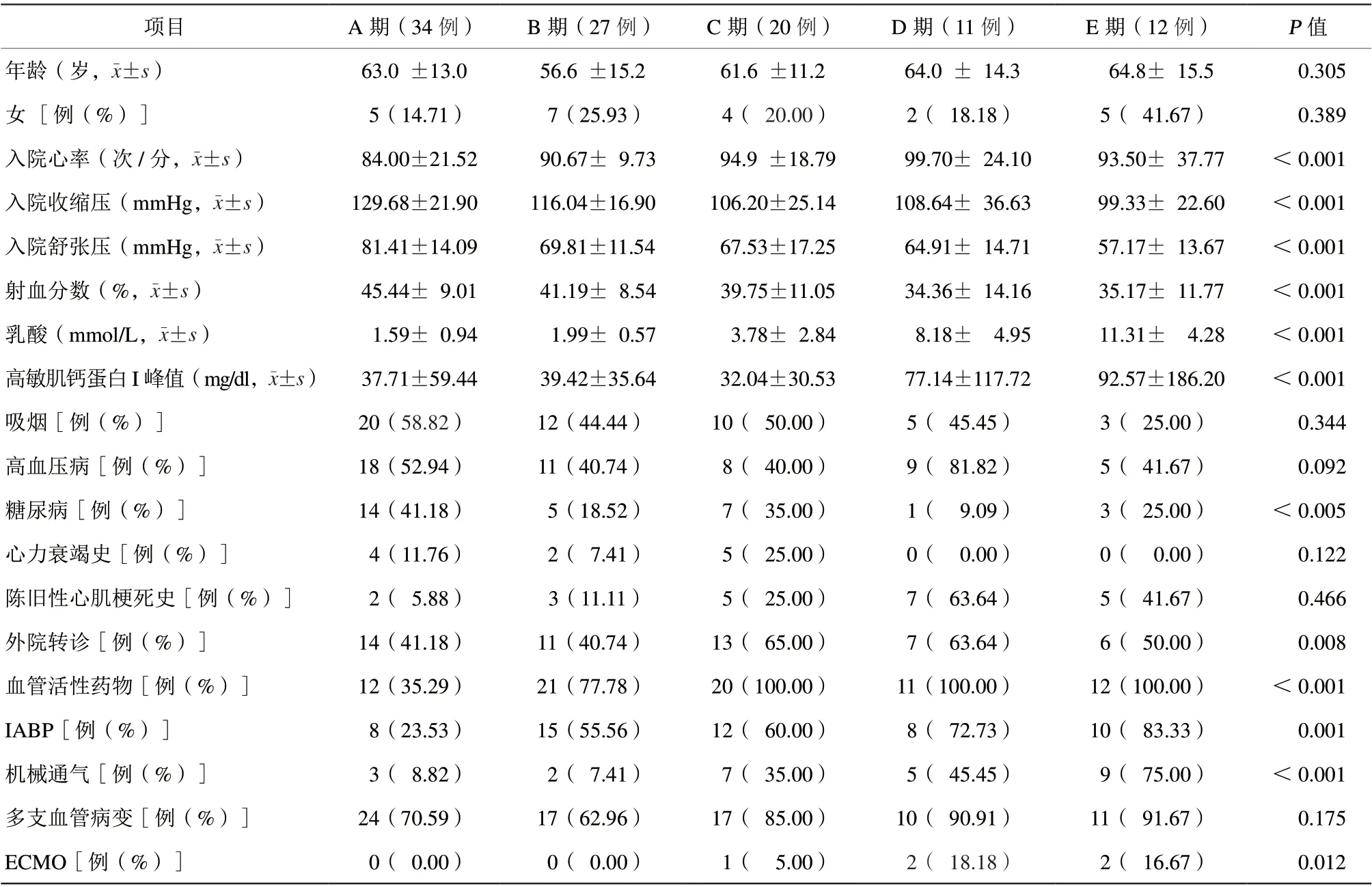
表2 不同SCAI-CS 分期患者的人口学特征和临床资料Table 2 Demographic characteristics and clinical data of patients with diff erent SCAI-CS stages
2.2 不同SCAI-CS分期患者的冠状动脉病变情况及干预情况
血运重建[经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和(或)冠状动脉旁路移植术(coronary artery bypass graf ting,CABG)]86例(82.69%),死亡15例(17.44%),A至E期死亡率分别为0、0、16.67%、71.43%、100.00%。非血运重建患者17例,死亡8例,死亡率47.06%。冠状动脉血运重建效果方面:除E期患者有2例PCI术中出现超过30 min的无复流外,其余均成功。器械辅助方面:E期2例使用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)辅助时患者已出现低灌注时间过长而多脏器衰竭。冠状动脉病变方面:相对于D/E期,A/B期单支病变占比更高;三支病变方面,E/D期占比较高,但差异均无统计学意义(均P>0.05,表3)。
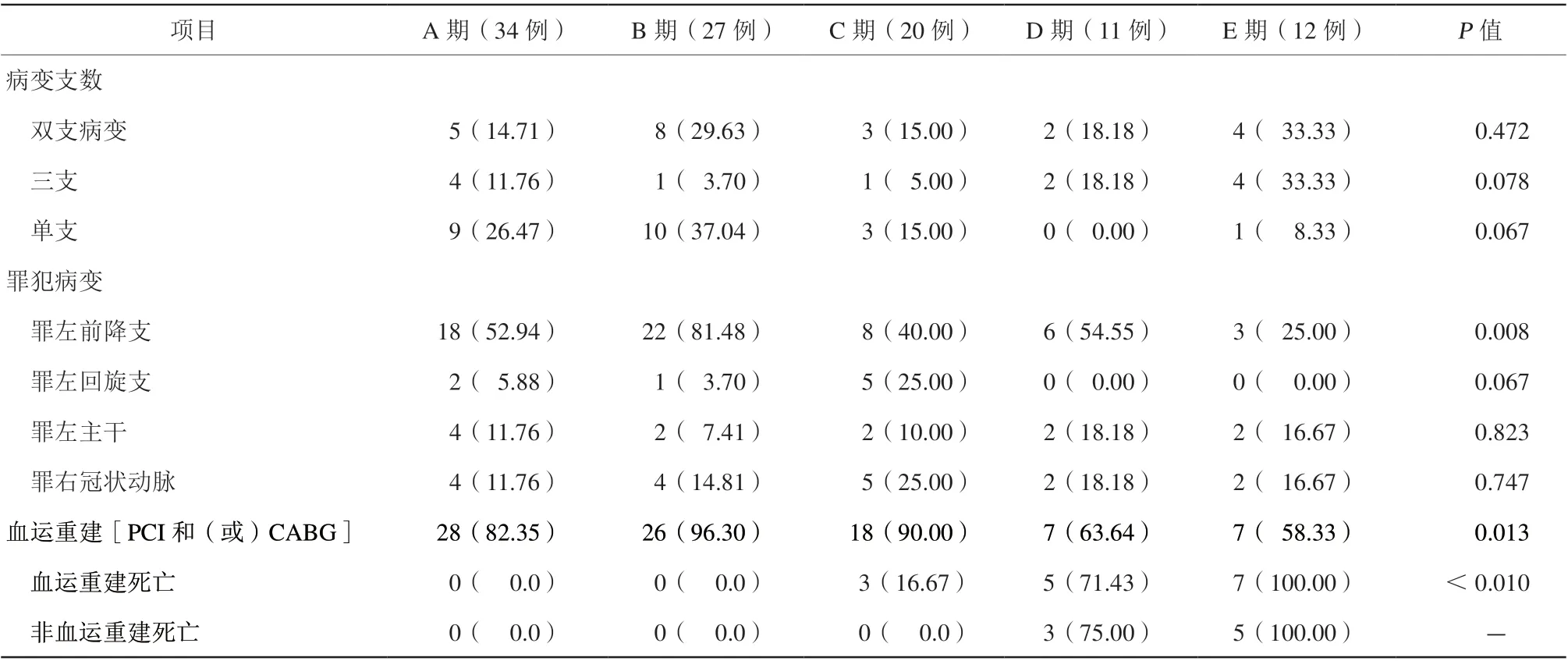
表3 不同SCAI-CS 分期患者冠状动脉病变情况及冠状动脉干预情况[例(%)]Table 3 Coronary artery lesions and coronary intervention in each stage of SCAI-CS
2.3 不同SCAI-CS分期患者心肌梗死部位情况
不同SCAI-CS分期患者与心肌梗死部位方面,ST段抬高型心肌梗死并且累及前壁(包括广泛前壁、前壁、前壁加下壁)共58例,30 d内死亡11例;非ST段抬高型心肌梗死有33例,30 d内死亡9例;未累及前壁的ST段抬高型心肌梗死有13例,30 d内死亡4例。
2.4 不同SCAI-CS分期循环辅助情况
随着SCAI-CS分期的递增,使用血管活性药比例增加(P<0.001);IABP使用增加(均P<0.001)。B期患者使用血管活性药占比77.78%,出院30 d死亡率为0。C期IABP组死亡率0,非IABP组死亡率42.86%,而D/E期患者无论使用IABP与否,其死亡率比较,差异无统计学意义(表4)。
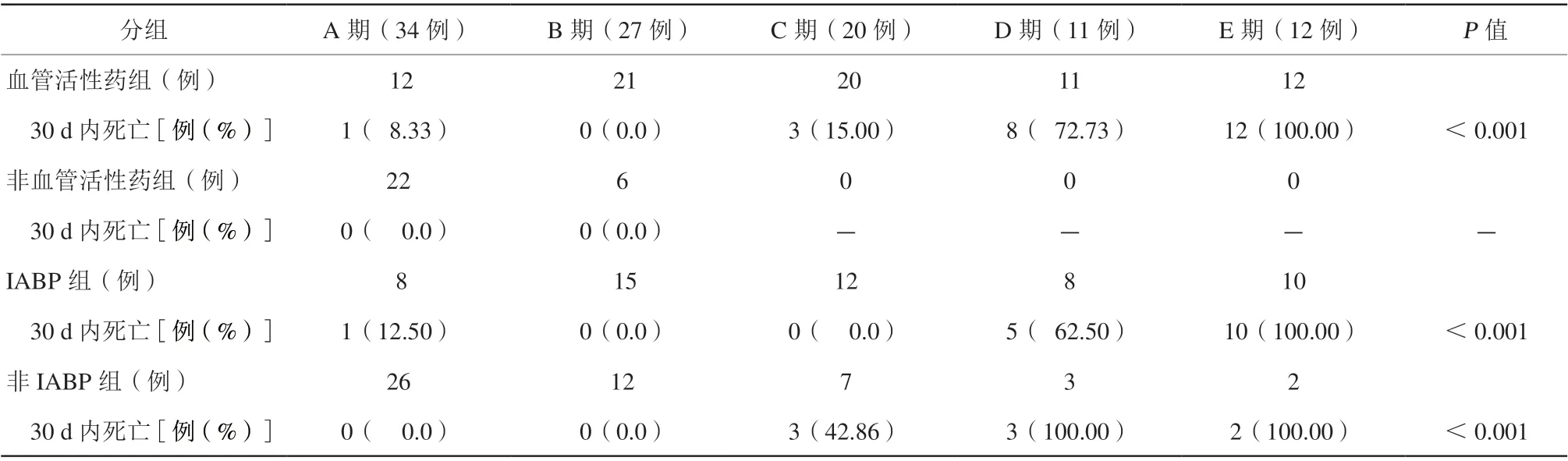
表4 不同SCAI-CS 分期患者循环辅助比较Table 4 Comparison of cycle assistance between SCAI-CS phases
3 讨论
自从里程碑式的SHOCK研究奠定了紧急PCI作为AMICS的默认治疗方法后[3],CS的注册研究和随机试验不断增加。但由于CS患者基线状态的差异,病情严重程度和合并症不同,不同研究之间生存率差异较大。因此2019年SCAI发布了CS的共识,对CS进行危险分层,迅速获得了临床医师的认可[7]。随后2年有多个验证研究发表,提示其对不同程度的CS预后具有预测能力且简单、可视化、易理解[11-17]。但是,2019年版SCAI-CS对于每期的定义过于简单,缺乏精确的参考标准,造成不同的研究对于分期有分歧,如回顾性分析美国心原性休克倡议的研究数据提示:A/B期统计数据是0,C期占1/3,D期10%,E期40%[18]。又例如对于D期的确定,2019年版认为是在C期的基础上,出现恶化和初始的干预措施效果不佳。而修订版的D期在2019年版的基础上,增加了更加具体的参考标准,如:恶化的证据是血流动力学状况和乳酸进一步升高且>2 mmol/L。本研究因病例数少,参考2019年版和修订版的SCAI-CS共识,未见分期方面的差异,但参考SCAI-CS修订版对本研究的病例进行分期显示其更精确和快捷。
本研究通过应用传统CS定义和SCAI-CS 2019年版和修订版CS定义,回顾性分析中国医学科学院阜外医院深圳医院真实世界中AMICS的诊断、干预与预后。AMICS方面,由于A/B期尚未出现典型休克表现,故按照IABP-SHOCK Ⅱ研究标准分析诊断为0。更新版SCAI-CS C期诊断标准为:低灌注且除容量复苏外,还需要给予其他干预(药物或机械循环支持),患者通常表现为血压相对降低(但不需要符合低血压标准)[9]。但其中5例未出现持续30 min的收缩压<90 mmHg,故按IABPSHOCK Ⅱ研究标准诊断[4]较SCAI-CS分级少5例。按照SCAI-CS分期诊断A/B期共61例,由于A/B期患者血压尚正常,未达到传统的AMICS诊断标准,提示SCAI-CS诊断较传统定义会有更高的诊断率。
如SCAI-CS分期共识所示,较高的SCAI-CS分期与较高的死亡率一致相关,如本研究C期死亡率15.00%,E期死亡率100.00%。提示SCAI-CS分期不同的CS危险分层对于死亡率的预测能力,与国外多个SCAI-CS验证研究结论类似[12-13]。
本研究提示,在循环支持方面,SCAI-CS中73.08%的患者使用了血管活性药,其中A/B/C期的临床结局较好,E期结局差。如B期CS患者,77.78%使用了血管活性药;虽然尚未出现低灌注,即使血压正常,也给予积极处理和严密监测,使得出院30 d内死亡率为0。早期识别休克风险并积极使用血管活性药有积极的意义[19]。
另外,SCAI-CS分期越高,药物和器械辅助循环(mechanical circulatory support,MCS)的使用率更高,但总体而言,IABP使用不能体现获益,其中A/B期患者使用IABP与否未见差异。C期和D期使用IABP组较未使用IABP患者,出院30 d内死亡率较低。C期使用IABP组出院30 d死亡率为0,而未使用IABP组患者死亡率42.86%。11例D期患者中,IABP组(部分使用ECMO/左心室辅助)有8例,死亡率62.50%;非IABP组3例,死亡率100.00%。虽然病例数少,但可看出IABP等循环辅助在C期和D期能起到积极的效果,与现行的经皮机械循环辅助(percutaneous mechanical circulatory support,pMCS)共识推荐一致[15,20-21]。在本院诊疗选择使用ECMO的5例患者中,C期1例、D期2例、E期2例;其中左心室辅助装置D期1例。而C期患者在使用ECMO后预后良好,D期2例均院内死亡,E期患者均死亡。D期左心室辅助装置预后好。也说明C、D期患者积极使用MCS后有效地阻止进一步恶化转为E期。虽样本量少,但有趋势说明MCS使用时机的重要性。因此应用SCAI-CS分期,早期识别不同CS分期并根据危险分层合理地进行包括MCS在内的血流动力学支持具有非常重要的价值,有可能改善患者的预后[15-16,22]。也提示建立休克团队和重视MCS干预时机,对于减少AMICS恶化进而降低死亡率极其重要[15,23]。由于休克患者病情变化快,故及时有效地早期识别和治疗AMICS是关键,修订版SCAI-CS分期能使分期指标细化和精确,心脏指数和肺毛细血管楔压是鉴别休克的关键指标之一[20],但真实世界中常缺乏漂浮导管等有创血流动力学监测。
本研究提示,与非血运重建组相比,血运重建组总死亡率明显下降,其中A/B/C期患者冠状动脉血运重建死亡率明显下降,D/E期冠状动脉血运重建死亡率略高,说明尽早血运重建的重要性。另外,E期患者三支病变占比较高,也是预后不佳的原因之一。由于D/E期患者冠状动脉血运重建后仍有较高的死亡率,考虑积极维持循环稳定及评估获益与风险的重要性[24]。
本研究提示,E期患者外院转诊比例较高,预后也不佳。因深圳本地多数医疗机构不具备医治CS的所有条件,部分患者需转院至休克中心。因此,通过应用修订版SCAI-CS共识提示,需要建立一套转院分类体系,以识别病情最重、存活概率最大的患者。不可逆的高风险患者转院时,属于无效医疗,不会改变最终结局,但会剥夺那些原本可能获益患者的权益。新共识建议对医疗机构按救治能力分类,构建“车轮式中心辐射”体系。具备MCS能力的外围中心可救治C期患者,当病情进展至D期(E期之前)应考虑转院。在此期间,患者是否有高级支持治疗的候选资格,应始终是转院的核心考虑。
综上,SCAI-CS分期不仅便于临床早期识别和预测预后,还有利于评估患者、促进临床决策和医患沟通,更重要的是,能早期识别和尽早逆转病程。
修订版SCAI-CS也有引发思考的地方,如在不同临床环境下,需评估其实用性,特别是基层医院救治能力尚不能齐备的情况下。另外,需明确最佳的重新评估间隔。最后是,修订版提出A期的有创监测是否必要,因为A期与B期之间有创参数并未调整标准。
局限性:本研究样本量较少且因回顾性研究无法获得足够的病史资料如一般状态、皮肤湿冷或意识状态,以及有创血流动力学参数、实验室数据等,对患者实际评估产生影响。纳入的研究人群是否能代表真实的临床状态,未来还需要前瞻性研究以控制偏倚。
利益冲突所有作者均声明不存在利益冲突
