罗红霉素片体外溶出模型建立与验证
2023-04-29傅蓉刘亚威姚兰张亚杰王棘
傅蓉 刘亚威 姚兰 张亚杰 王棘
摘要:目的 建立罗红霉素片体内外相关性模型,并验证体内外相关性,用于仿制产品评价与开发。方法 测定罗红霉素片参比制剂及4批次国内自研样品溶出曲线,使用GstroPlus软件,建立罗红霉素片体内外相关性模型。采用参比制剂罗红霉素片(罗力得片)及国内自研样品的溶出曲线相关研究数据对模型进行验证和再验证。结果 参比制剂在pH 6.0介质条件更具有体内外相关性,Cmax值、AUC预测误差都更小;国内自研样品在pH 6.0介质条件下模型拟合结果与体外溶出曲线相似性测定结果一致。结论 建立的评价模型能通过体外溶出实验反映体内情况,该模型可用于仿制产品评价与开发。
关键词:罗红霉素片;溶出度;溶出曲线;体外溶出模型;验证;仿制药一致性
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)01-0019-07
Establishment and Validation of in vitro Dissolution Model of Roxithromycin Tablets
Fu Rong, Liu Ya-wei, Yao Lan, Zhang Ya - jie, Wang Ji
(Liaoning Inspection, Examination & Certification Centre, Liaoning Institute for Drug Control, Shenyang 110036)
Abstract: Objective To establish and verify the correlation model of roxithromycin tablets in vivo and in vitro, for the evaluation and development of imitation products. Methods The dissolution curves of reference preparation and 4 batches of domestic self-developed samples of roxithromycin tablets were determined. Establish the correlation model of roxithromycin tablets in vitro and in vivo by GstroPlus software. The model was validated and revalidated with the dissolution curve data of reference preparation and domestic self-developed samples. Results The reference preparation is more relevant in vivo and in vitro under pH 6.0 medium conditions, C max value and AUC prediction deviation are smaller. The model fitting results of domestic self-developed samples in pH 6.0 medium are consistent with the determination results of the similarity of dissolution curves in vitro. Conclusion The established evaluation model can reflect the situation in vivo through in vitro dissolution test. The model can be used for evaluation and development of imitation products.
Key words: roxithromycin tablets; dissolution; dissolution curve; in vitro dissolution model; validated; similarity assessment of generic grugs
罗红霉素(Roxithromycin)为大环内酯类抗生素药物,由法国 Roussel-Uclaf公司研制,1987 年在法国首次上市,商品名为罗力得(Rulide)。国内浙江震元制药有限公司于 1995 年生产上市,目前已有数十家原料药和制剂生产企业。其抗菌谱与红霉素相仿,其体外抗菌作用与红霉素相似,体内抗菌作用比红霉素强1~4倍,不良反应一般轻微, 发生率较低,目前在我国临床应用广泛。
国家药监局网站公布的罗红霉素参比制剂为法国赛诺菲公司片剂(罗力得,第十批目10-92、10-93号)。本文收集了3批参比制剂罗红霉素片剂及国内4个生产厂家4批次自研样品,进行了罗红霉素片剂的体外溶出曲线考察。通过查阅相关文献等获得罗红霉素相关理化参数,使用GstroPlus软件,建立罗红霉素片剂体内外相关性模型。采用参比制剂溶出曲线相关研究数据,对模型进行评估,结果发现pH 6.0和pH 6.8介质条件都具有一定的体内外相关性,而对比而言pH 6.0介质条件更具有体内外相关性,Cmax值、AUC预测误差都更小。采用4个国内自研样品在pH 6.0介质中溶出曲线数据,对模型进行再验证,发现模型拟合结果与体外溶出曲线相似性比较结果一致。建立的评价模型能通过体外溶出实验反映体内情况,该模型可用于仿制产品评价与开发。
1 材料
1.1 样品及对照品
参比制剂: 罗红霉素片(罗力得片)(批号: 6 GN 5 A、6 GN 4 A、5 EE 7 A,规格: 150 mg,法国赛诺菲公司;国内自研样品:罗红霉素片剂(规格: 均为150 mg,来自4个国内生产厂家分别用A、B、C、D代称。)
对照品: 罗红霉素(批号: 130557-201 604,含量96.0 %,购自中国食品药品检定研究院)。
1.2 仪器设备
自动溶出仪: Agilent 708-850 DS CARY 60 UV;高效液相色谱仪: Waters 1525-2489;电子天平: METTLER TOLEDO XP 205;pH计: Thermo Scientific Orion 3 Star。
1.3 试剂试药
乙腈(色谱纯): 批号17 045119,TEDIA Company,Inc.;无水乙酸钠(分析纯): 批号20140804;三乙胺(分析纯): 批号20131104;磷酸二氢铵(分析纯): 批号20170320;氢氧化钠(分析纯): 批号20161118;磷酸二氢钾(分析纯): 批号10017618,盐酸(分析纯): 批号20150309,均购自国药集团化学试剂有限公司。
2 方法
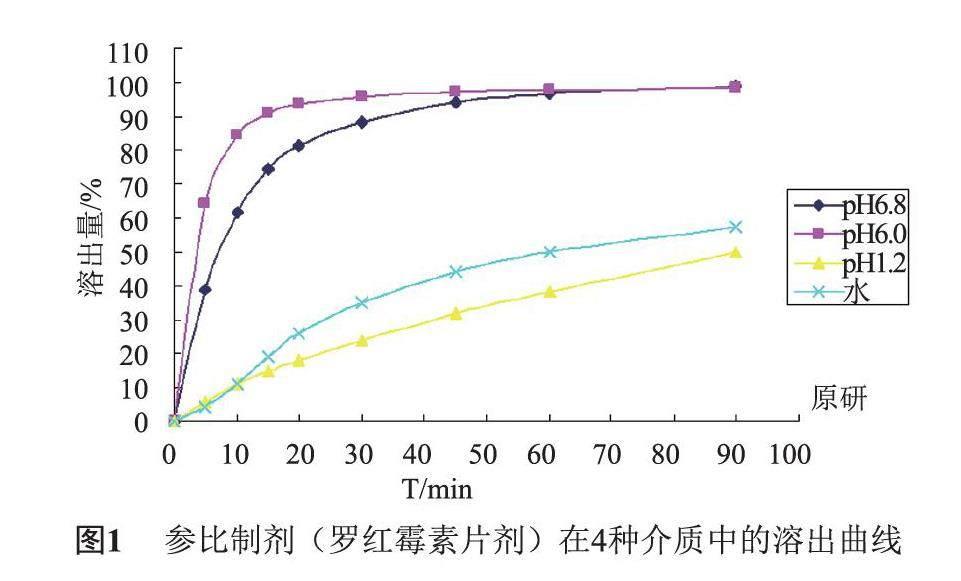
罗红霉素属于BCS Ⅱ类,即为低溶解、高渗透药物,且为pH值依赖性药物。日本橙皮书收载了该品种,给出了规格为150 mg的罗红霉素片建议使用的4种溶出介质,但没有收载相关溶出曲线的研究资料。在前期研究中发现罗红霉素片剂最具区分力的介质为pH 6.0磷酸盐缓冲液[1]。因此,分别测定参比制剂4种溶出介质,国内自研样品在pH 6.0磷酸盐缓冲液中的溶出曲线。
2.1 原研样品4条溶出曲线考察
取参比制剂(罗红霉素片剂)分别采用pH 1.2盐酸溶液,pH 6.0磷酸盐缓冲液,pH 6.8磷酸盐缓冲液及水,作为溶出介质,采用《中国药典》四部通则 0931 溶出度与释放度测定法(第二法)测定[2],转速为50 r/min。取样时间点设置为: 5,10,15,20,30,45,60,90 min。以罗红霉素对照品为对照,采用HPLC法(具体方法见《中国药典》二部罗红霉素片含量测定项下方法[3]),按外标法计算溶出量。由于罗红霉素在pH 1.2的酸性介质环境中迅速降解转化成去红霉糖罗红霉素,在酸性介质中溶出量是以罗红霉素的降解产物去红霉糖罗红霉素计算。以取样时间(min)对平均溶出量(%)绘制溶出曲线。
2.2 国内自研家样品pH 6.0介质溶出曲线考察
取国内4批自研样品,配制pH 6.0磷酸盐缓冲液作为溶出介质,取样时间点设置为: 5、10、15、20、30、45、60 min。按照上述2.1方法测定并绘制溶出曲线。
2.3 溶出曲线相似性比较
采用非模型依赖法中的相似因子(f2)法判定4批样品在pH 6.0介质中是否与参比制剂溶出曲线相似。F2≥ 50,判定为具有相似性。
2.4 体外溶出模型建立
2.4.1相关理化参数查询
收集并梳理罗红霉素的理化与生物药剂学性质参数,如溶解度、渗透性、脂溶性、血浆蛋白结合率等;查阅、提取文献报道的罗红霉素口服给药后在不同人体内的血浆PK数据(中国人群)。
2.4.2罗红霉素基础PK模型的搭建
以文献报道的150 mg 速释片剂的PK数据作为参照,通过GastroPlus软件建立罗红霉素基础PK模型,设置与文献中报道相同的给药途径、给药剂量、受试者人群等相关信息,然后进行血浆PK曲线的预测,并比对预测与实测曲线间的吻合程度。初步建立罗红霉素基本PK模型,初步确定建模过程中的所用的药物的吸收、分布、代谢、排泄过程(ADME)性质参数,以及相应的模型计算公式等。
2.4.3罗红霉素模型的验证
建立不同给药剂量(300 mg及600 mg等)的罗红霉素片剂在成人体内单次给药后的模型,按照临床试验的相关信息设置模型的参数,并将预测的血浆PK曲线与实测临床药代数据进行准确性评估:(1)考察模型对罗红霉素不同给药剂量的人体内ADME过程及药代动力学行为预测的准确性;(2)确定罗红霉素最终体内PK模型所采用的各自药物建模数据和模型公式;(3)选择合理可靠的药物PK模型,评估其是否可以进一步用于体内外相关性的研究。
2.4.4 体内外相关性评估验证及再验证
通过考察不同条件对应的溶出曲线的PK预测结果与实测结合的拟合情况,从而确定体内外相关的溶出方法。
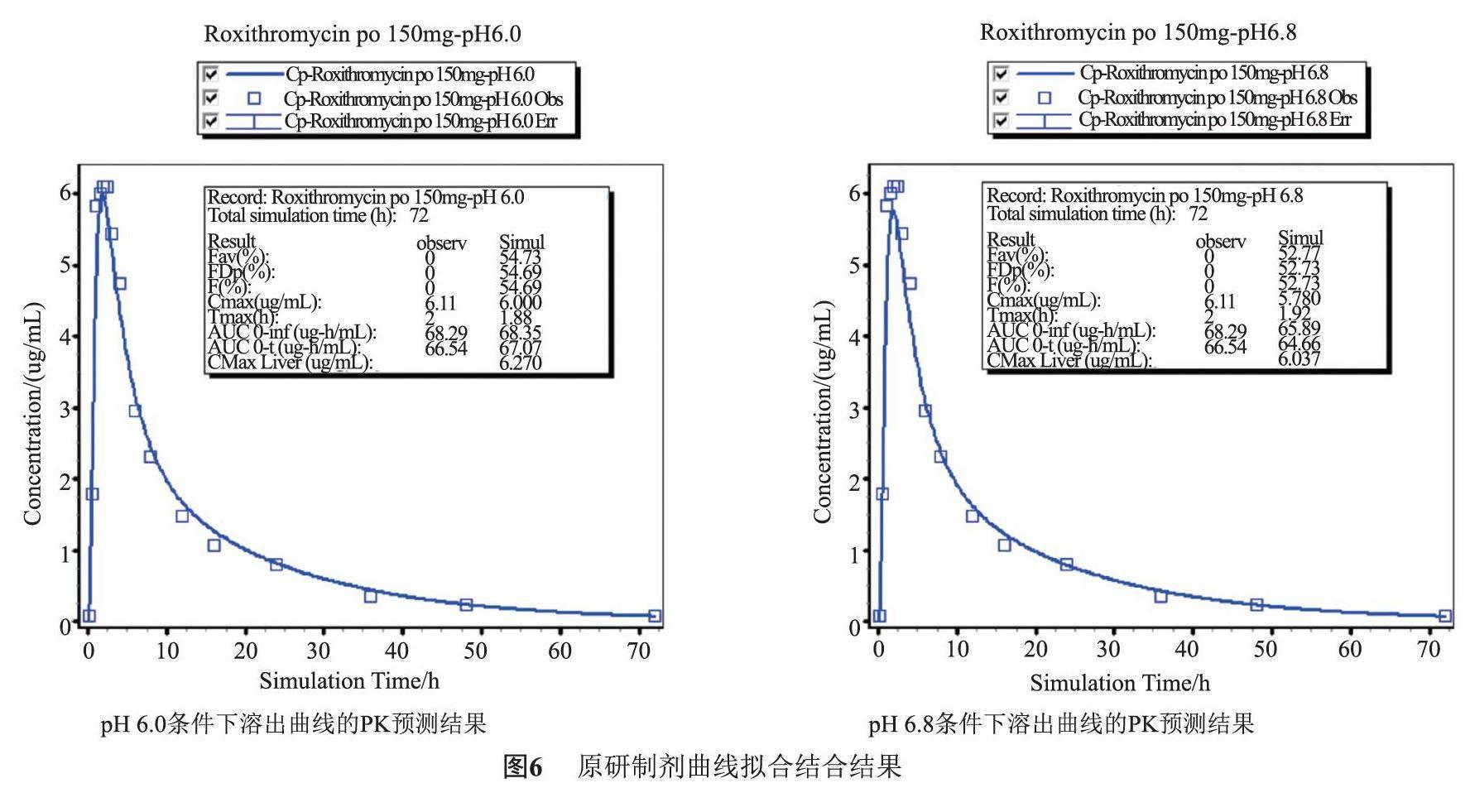
将参比制剂在不同溶出条件(pH 6.0介质,pH 6.8介质)下的溶出曲线加载到GastroPlus软件中,使用口服150 mg罗红霉素的PK模型评估不同溶出方法的体内外相关性。
将4批国内自研样品在pH 6.0介质中的溶出曲线加载到GastroPlus软件中,使用口服150 mg罗红霉素的PK模型验证,体内外测定的一致性。
2.4.5 罗红霉素PK模型的应用
采用所搭建的口服不同剂量(150 mg、300 mg、600 mg)的罗红霉素PK模型,分析罗红霉素体内吸收和处置过程特点;结合不同pH条件对应的溶出曲线预测的PK行为及罗红霉素的吸收部位,探索具体内外相关性的溶出条件。
3 结果
3.1 溶出曲线结果
参比制剂在4种介质中溶出曲线,以及4批样品在pH 6.0溶出介质下的体外溶出曲线,见图1,图2。
3.2 溶出曲线相似性比较
采用f2因子法,比较原研和自研样品溶出曲线相似性,结果见表1。
3.3 罗红霉素体外溶出模型搭建及验证
利用文献报道的不同给药剂量、不同临床受试群体的药代动力学曲线,在GastroPlus的模型中进行相应的临床参数设置,进行PK曲线的模拟;并对比预测结果与实测数值间的差异,评估模型预测的准确性。
3.3.1口服罗红霉素150 mg的PK模型
通过查阅相关文献[4],筛选并输入相关参数,得到PK曲线模拟与实测图,见图3。其中,点是实测数值,曲线为模型拟合结果。
基于文献报道[4]的PK数据点(图3方块点),进行罗红霉素人体内清除率的计算,利用GastroPlus软件的PKPlus模块计算得到罗红霉素的体内处置参数,并将该数值带入模型中,以进行PK曲线的拟合,但结果显示采用默认的胃肠道模型软件预测的误差较大,根据罗红霉素片剂的产品资料,该药物的口服绝对生物利用度约50%左右,且进入体内快速吸收的特点,因此采用GastroPlus软件的Optimization模块又对各肠断吸收放大因子(ASF)、处置参数进行了优化,同时将肾清除率设置为总清除的7%;最终建立了口服150 mg罗红霉素片剂的房室模型。口服150 mg罗红霉素后的参数统计见表2。
拟合结果显示,主要的PK参数,预测与实测数值基本接近;其拟合度以及误差数值也体现预测与实测值较为一致;从图中的拟合曲线来看,预测曲线与实测数据点的每个点也基本重合在一起;表明初步的罗红霉素模型能够较好地反映罗红霉素口服给药后在人体内的吸收、分布和清除特征。
虽然建立的口服150 mg罗红霉素采用的文献PK数据与参比制剂的临床试验并非同一人群、临床试验中的很多因素也有差异,但目前建立的模型预测结果与罗红霉素片剂产品资料中的关键数值基本一致,见表3。因此可以认为目前建立的口服150 mg罗红霉素的模型较为准确,可以将该模型用于其他剂量的PK曲线预测。
3.3.2 口服罗红霉素300 mg和600 mg的PK模型
通过查阅相关文献[5-6],筛选并输入相关参数,得到PK曲线模拟与实测图,见图 4,图 5。其中,点是实测数值,曲线为模型拟合结果。
建立口服罗红霉素300 mg和600 mg的PK模型,分别验证罗红霉素口服给药300 mg和600 mg的模型,在模型中采用150 mg模型的胃肠道模型、处置参数,然后按照文献[4-5]报道的临床给药方式、给药剂量的人群参数的设置,并进行PK曲线的模拟;后将文献的PK数据点加载到模型中去,考察及分析预测结果与实测数据之前的误差情况。口服150 mg罗红霉素绝对生物利用度为50%左右,也有文献报道[7] 罗红霉素存在吸收饱和的情况,因此在建立口服300 mg罗红霉素时考虑到吸收饱和情况的存在,在模型中增加了30%的肠道首过效应;在建立口服600 mg罗红霉素时,模型中增加了60%的肠道首过效应。参数统计见表4。
拟合结果显示,300 mg主要的PK参数、预测曲线与实测数据点的曲线拟合度与误差等都基本体现所建立的罗红霉素口服300 mg模型,能够准确地反映罗红霉素口服300 mg给药后在相应人体内的分布和消除过程;表明基于GastroPlus软件内建的有关吸收、代谢的公式,以及文献报道的罗红霉素相关理化、生物药剂学和代谢方面的数据,可以比较准确地对罗红霉素口服给药后体内过程进行预测与表征。
600 mg主要的Cmax值与文献值较为接近,Tmax和AUC有所差异,但从文献的实测结果来看,Tmax和AUC均有较大的误差,其中Tmax= 2±1 h,AUC0-48=156.7±57 μg.h /mL。
综合考虑目前的模型对口服150 mg、300 mg、600 mg的预测准确度,基本表明可以对罗红霉素不同剂量口服给药后体内过程进行预测与表征。
3.4 罗红霉素体内外相关性评估
3.4.1体内外相关性验证
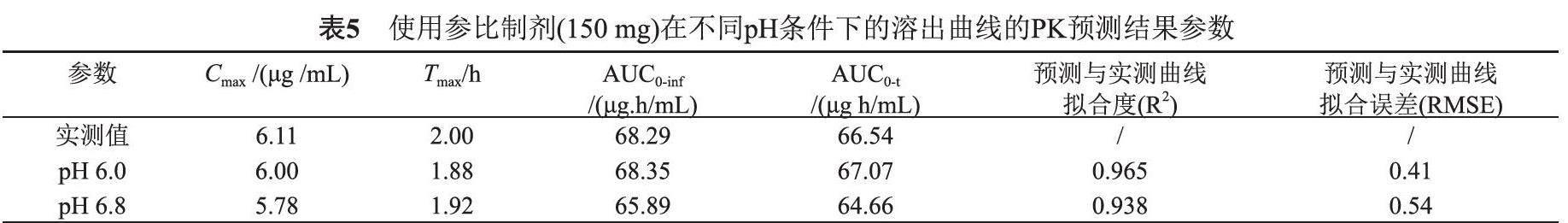
由图6,表5,其中图中点是实测数值,曲线为模型拟合结果。参比制剂不同溶出条件(pH 6.0介质,pH 6.8介质)下的溶出曲线加载到GastroPlus软件中,可见使用口服150 mg罗红霉素的PK模型评估不同溶出方法的体内外相关性。拟合结果显示,pH 6.0和pH 6.8介质中的溶出条件都具有一定的体内外相关性,但对比而言,pH6.0介质的溶出条件更具有体内外相关性,Cmax值、AUC预测误差都更小。
3.4.2模型再验证
将4批国内自研样品(规格均为150 mg),pH 6.0介质的溶出曲线数值带入模型,得到预测结果见图7,表6。结果发现,模型拟合结果A、B、D 3个厂家拟合度较好;C厂家拟合度较差,与体外溶出曲线相似性比较结果一致。
3.5 罗红霉素在胃肠道吸收部位预测
罗红霉素在进入胃肠道快速吸收,十二指肠和空肠上端是主要的吸收部位,空腹条件下十二指肠的pH约为 6.0、空肠上端的pH约为 6.2,而只有回肠中段和结肠段的pH约为 6.8,从吸收部位来说pH 6.0 体内外相关性更好,见图8。
对于口服罗红霉素150 mg,从不同条件的溶出曲线预测PK曲线的拟合结果及罗红霉素的吸收部位,建议将pH 6.0的溶出方法作为体内外相关性的溶出条件。
4 小结与展望
(1)通过收集罗红霉素的理化、生物药剂学参数及文献报道的PK数据,成功搭建了口服不同剂量(150 mg、300 mg、600 mg)的罗红霉素PK模型,实现了对不同临床个体口服不同剂量的罗红霉素的PK预测,准确地反映了罗红霉素体内吸收和处置过程。
(2)结合不同pH条件对应的溶出曲线预测的PK行为及罗红霉素的吸收部位,发现pH6.0的溶出方法最具有体内外相关性。
(3)本研究搭建了口服不同剂量(150 mg、300 mg、600 mg)的罗红霉素PK模型,可以用于体内外相关性的考察,但从目前调研的文献出发,还有一些问题值得进一步思考,比如:不同剂量对应的Cmax、AUC不成线性是什么原因导致的、罗红霉素的血浆蛋白结合率随药物浓度变化如何考虑、参比制剂(150 mg)在中国人群的PK是否与文献报道的非参比制剂一致等,这些问题若能调研清楚并对模型进一步优化,将更能准确地反映罗红霉素在体内药代动力学过程。
参 考 文 献
刘亚威, 姚兰,张亚杰. 罗红霉素片仿制药与原研药溶出行为一致性研究及溶出度方法的建立[J]. 中国抗生素杂志, 2019, 44(6): 716 - 721.
国家药典委员会.中华人民共和国药典[S]. (2020年版四部). 北京: 化学工业出版社, 2015: 通则 0931.
国家药典委员会. 中华人民共和国药典[S]. (2020年版二部). 北京: 化学工业出版社, 2015: 651- 652.
郑莉, 徐楠, 等. 液质联用法研究罗红霉素在健康人体内的药代动力学和相对生物利用度[J]. 生物医学工程学杂志, 2009, 26(6): 1315 - 1319.
乔海灵, 张莉蓉, 张启堂, 等. 进口罗红霉素在健康人体内的药代动力学[J]. 河南医科大学学报, 1998, 33(3): 107- 109.
杜光, 任秀华, 申玲玲, 等. 液-质联用测定人血浆中罗红霉素浓度[J]. 中国医院药学杂志, 2011, 31(2): 107 - 110.
Koyama M, Tateno M, Shirotsuka M, et al. Absorption, metabolism and excretion of RU 28965 in humans[J]. Chemotherapy, 1988, 36: 164–183.
