基于网络药理学的莫匹罗星抗结直肠癌潜在靶点及作用机制研究
2023-04-29黄吉李子烜孙震晓
黄吉 李子烜 孙震晓

摘要:目的 基于网络药理学探讨莫匹罗星抗结直肠癌(CRC)的潜在靶点及作用机制。方法 通过SwissTargetPrediction数据库预测莫匹罗星作用靶点,通过GeneCard数据库获取CRC相关靶点,利用Venny平台筛选出二者交集靶点作为莫匹罗星抗CRC潜在靶点,并通过String数据库构建潜在靶点的蛋白—蛋白相互作用(Protein-protein interaction,PPI)网络,利用Cytoscape软件对PPI进行拓扑分析及可视化。将潜在靶点导入Metascape及Bioinformatics平台,进行GO和KEGG富集分析,构建热图,气泡图以及通路图。结果 获得了莫匹罗星抗CRC潜在作用靶点89个,其中关键靶点为JUN、PTGS2、SRC、STAT3、IL1B及CASP3。富集度较高的生物学过程、细胞组成及分子功能分别主要为细菌源性分子的反应、内溶酶体和蛋白激酶c活性等。莫匹罗星抗CRC的信号通路有TRP通道的炎症介质调节、HIF-1信号通路等。结论 莫匹罗星抗CRC可能机制包括抑制癌细胞增殖和诱导癌细胞凋亡、抗炎以及破坏癌细胞微环境等。
关键词:网络药理学;莫匹罗星;结直肠癌;靶点;作用机制;信号通路
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)01-0007-06
Possible Targets and Mechanisms of Mupirocin Against Colorectal Cancer Based on Network Pharmacology
Huang Ji, Li Zi-xuan, Sun Zhen-xiao
(School of Life Sciences, Beijing University of Chinese Medicine, Beijing 102488)
Abstract: Objective To investigate the possible targets and mechanisms of mupirocin (MPC) against colorectal cancer (CRC) by network pharmacology. Methods The targets of mupirocin were predicted by the SwissTargetPrediction database, and the CRC-related targets were obtained from the GeneCard database. Using Venny platform to screen the intersection target of the two as the potential anti-CRC target of mupirocin,and the protein-protein interaction network (PPI) of the potential targets was constructed through the String database. Cytoscape was used to analyze and visualize the PPI topology. Potential targets of MPC against CRC were imported into Metascape and Bioinformatics platforms, GO and KEGG enrichment analysis was conducted, and heat maps, bubble maps and pathway maps were built. Results 89 potential targets of mupirocin anti-CRC were obtained, among which the key targets were JUN, PTGS2, SRC, STAT3, IL1B and CASP3. The biological process, cellular composition and molecular function with high enrichment were mainly the reaction of bacterial-derived molecules, endolysosome and protein kinase c activity, etc. The signaling pathways of mupirocin against CRC include the regulation of inflammatory mediators of TRP channels and the HIF-1 signaling pathway, etc. Conclusion The anti-colorectal mechanisms of MPC include inhibiting cancer cell proliferation and inducing cancer cell apoptosis, anti-inflammatory, and destroying cancer cell microenvironment, etc.
Key words: network pharmacology; mupirocin;colorectal cancer;targets; mechanisms;signaling pathways
近年来,我国结直肠癌(Colorectal cancer, CRC)的发病率和死亡率均呈上升趋势。2018中国癌症统计报告显示,我国CRC发病率和死亡率在全部恶性肿瘤中分别位居第3位和第5位,新发病例37.6万例,死亡病例19.1万例,CRC发病率上升显著,多数患者在确诊时已属于中晚期[1]。全球结直肠癌2020—2040年癌症负担分析指出,2020年,CRC占全球癌症发病率的10%,占癌症死亡人数的9.4%,根据对老龄化、人口增长和人类发展的预测,预计到2040年,全球CRC新发病例数将达到320万例[2]。
研究发现[3],肠道微生物组在CRC的发展中起重要作用,而抗生素可以改变肠道微生物组,因此抗生素可能具有抗CRC活性。莫匹罗星是假单胞菌酸A,是临床广泛使用的抗生素,可通过与细菌异亮氨酰-tRNA合成酶特异性结合抑制蛋白质合成,具有抗菌作用[4]。本课题组[5]前期在有关抗CRC小分子药物筛选中,发现莫匹罗星可能有抗CRC作用,体外研究发现,不同浓度的莫匹罗星作用于人结直肠癌HCT116细胞24、48和72 h,可以剂量和时间依赖性的方式抑制HCT116细胞活力。
已知在CRC发生发展过程中涉及大量癌细胞细胞增殖、分化、凋亡及炎症等微环境相关的蛋白质及靶点,单一基因突变或信号通路改变无法解释CRC的形成,同样药物抗结直肠癌也往往不是通过作用单一靶点或信号通路。网络药理学是融合系统生物学、生物信息学、网络科学等的学科,从系统层次和生物网络的整体角度出发,解析药物与治疗对象之间的分子关联,揭示药物的系统性药理机制,从而指导新药研发和临床诊疗,是人工智能和大数据时代药物系统性研究的新兴原创学科[6]。本文将采用网络药理学来分析莫匹罗星抗CRC可能的靶点和作用机制,为后续莫匹罗星抗CRC临床前及临床研究提供理论依据。
1 材料与方法
1.1 莫匹罗星作用靶点预测
利用PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库检索莫匹罗星(Mupirocin),获取化合物简化分子线性输入系统(Simplified Molecular Input Line Entry System,SMILES)结构式。将检索得到的莫匹罗星的SMILES导入 SwissTargetPrediction 数据库(http://www.swisstargetpre-diction.ch)进行反向分子对接,获得莫匹罗星作用靶点。
1.2 获取CRC相关疾病靶点
以“Colorectal Cancer”为关键词,通过GeneCards(http://www. genecards. org/)数据库检索CRC相关的疾病靶点。
1.3 获取莫匹罗星抗CRC的潜在靶点
将1.1,1.2获取到的靶点通过Venny(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,取交集作为莫匹罗星抗CRC的潜在靶点进行机制探讨。
1.4 蛋白互作网络构建及关键靶点筛选
将莫匹罗星抗CRC潜在靶点导入String数据库(https://string-db. org),构建蛋白—蛋白相互作用(Protein-protein interaction,PPI)网络,物种设定为“Homo sapiens”,利用Cytoscape 3.8.0 软件对PPI进行可视化,并进行拓扑分析,根据介度中心性(Betweenness centrality),紧密中心性(Closeness centrality),节度中心性(Degree)筛选莫匹罗星抗CRC的关键靶点。
1.5 莫匹罗星抗CRC潜在靶点生物功能分析及通路分析
将潜在靶点导入Metascape及Bioinformatics平台,对莫匹罗星抗CRC的潜在靶点进行GO(Gene ontology)功能富集分析和 KEGG(Kyoto encyclopedia of genes and genomes)信号通路富集分析,GO功能富集内容包括生物学过程(Biological process,BP)、细胞组成(Cellular component,CC)和分子功能(Molecular function,MF);KEGG整合了基因组、化学分子和生化系统等方面的数据,富集内容主要涉及代谢通路(Pathway)。筛选出莫匹罗星抗CRC可能参与的生物学过程与涉及的信号通路,并对结果进行可视化。
2 结果
2.1 莫匹罗星抗CRC疾病靶点筛选
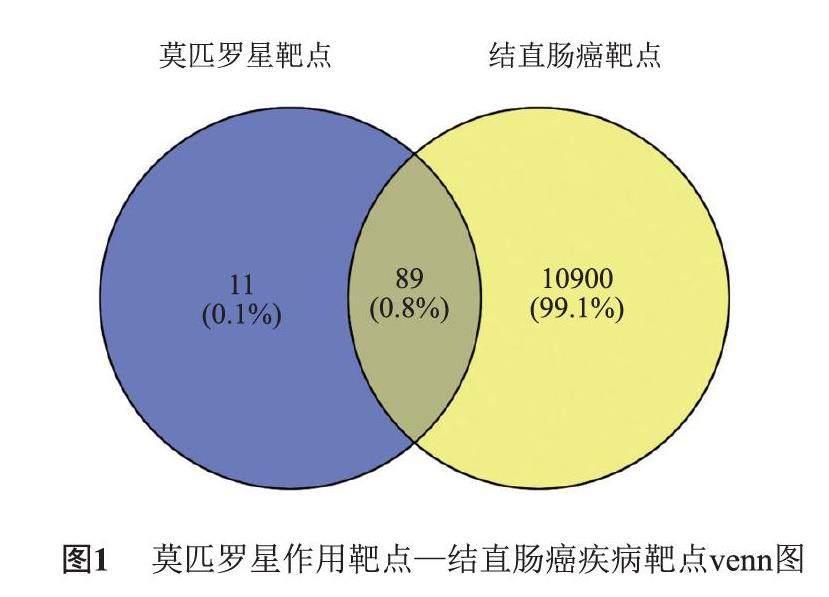
共获得莫匹罗星作用靶点100个,CRC相关疾病靶点10 989个,二者共同作用靶点89个为潜在的莫匹罗星抗CRC靶点,绘制venn图(图1)。
2.2 莫匹罗星抗CRC关键靶点筛选
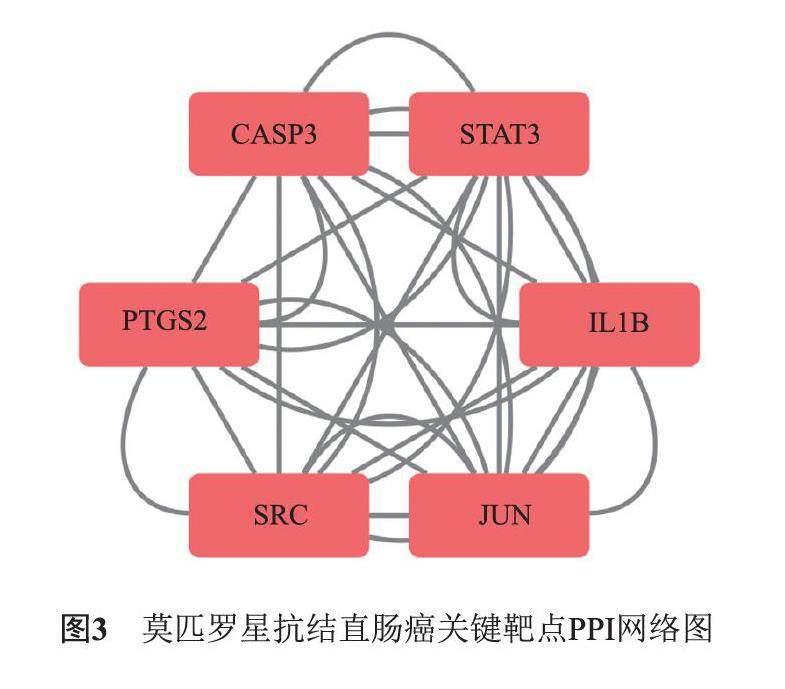
将莫匹罗星抗CRC潜在靶点导入String数据库,构建PPI网络图(图2),再利用Cytoscape软件对潜在靶点进行拓扑分析,以其介度中心性(Betweenness centrality),紧密中心性(Closeness centrality),节度中心性(Degree)作为指标进行筛选,各组数值中大于本组中位数的靶点予以保留,按上述规则重复筛选3次,获得莫匹罗星抗CRC关键靶点,即JUN,PTGS2,SRC,STAT3,IL1B及CASP3,并利用Cytoscape软件将其可视化(图3)。
2.3 莫匹罗星抗CRC潜在靶点GO功能分析
利用Metascape及Bioinformatics平台对莫匹罗星抗CRC潜在靶点进行GO生物过程富集分析。选取P值最小的前10个项目进行可视化(图4),生物学过程主要涉及细菌源性分子的反应、脂多糖的反应、药物的反应、循环系统血管功能、肽分泌的调节、氧气水平的反应、蛋白质分泌的调节、缺氧的反应、炎症反应的调节以及血循环调节的反应。细胞组成主要包括内溶酶体、花萼突触、内腔、膜筏、膜微区、膜区、细胞顶端、顶端质膜、空泡腔以及突触后致密蛋白等。同时莫匹罗星抗CRC可能与蛋白激酶c活性、钙依赖性蛋白激酶c活性、钙依赖性蛋白丝氨酸/苏氨酸激酶活性、钙依赖性蛋白激酶活性、天冬氨酸型内肽酶活性、天冬氨酸型肽酶活性、核受体活性、配体、活化转录因子活性、内肽酶活性、肾上腺素受体结合等分子功能密切相关。
2.4 莫匹罗星抗CRC潜在靶点KEGG通路富集分析
利用Metascape及Bioinformatics平台对莫匹罗星抗CRC潜在靶点进行KEGG通路富集分析(图5),莫匹罗星抗CRC可能涉及的主要信号通路包括TRP通道的炎症介质调节(Inflammatory mediator regulation of TRP channels),HIF-1信号通路(HIF-1 signaling pathway),人巨细胞病毒感染 (Human cytomegalovirus infection),糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications),化学致癌-受体激活(Chemical carcinogenesis-receptor activation),cAMP信号通路(cAMP signaling pathway),钙信号通路(Calcium signaling pathway),甲状旁腺激素的合成、分泌和作用(Parathyroid hormone synthesis, secretion and action),EGFR酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)以及非洲锥虫病代谢(African trypanosomiasis)等。
3 讨论
本研究通过网络药理学对莫匹罗星可能抗CRC的靶点和机制进行了解析。筛选到莫匹罗星抗CRC可能的关键靶点为JUN、PTGS2、SRC、STAT3、IL1B及CASP3;主要生物学过程、细胞组成及分子功能分别主要为细菌源性分子的反应、内溶酶体和蛋白激酶c活性等。莫匹罗星抗CRC的主要信号通路为TRP通道的炎症介质调节等。
莫匹罗星抗CRC的6个关键靶点涉及细胞增殖、细胞凋亡、炎症调控及肿瘤血管生成等。如非受体酪氨酸激酶(SRC),首先在CRC患者中被发现,其在超过80%的CRC患者中异常过度表达和激活[7],与健康人群正常黏膜相比,CRC患者SRC平均表达水平高2.4倍,CRC肝转移瘤中增加2.2倍,肝外结直肠转移瘤上调12.7倍[8]。SRC是有丝分裂关键调节因子,可活化调节黏附蛋白在细胞基质附着位点上的积累和局部密度,促进CRC细胞进入M期,促进细胞增殖[9]。白细胞介素-1β(IL-1β),参与多种细胞活动,如细胞增殖、分化和凋亡,另外研究发现,由IL-1β介导的髓系细胞产生的CTLA4信号直接促进肿瘤发生,并间接抑制免疫作用,促进肿瘤进展和转移,阻断IL-1β可显著抑制抗PD1治疗小鼠模型中的肿瘤进展和转移[10],研究还发现,巨噬细胞产生的IL-1β诱导CRC细胞,可促进细胞迁移和侵袭的血清淀粉样蛋白A1(SAA1)表达[11]。胱天蛋白酶3(CASP3)是细胞凋亡通路中最为关键的酶之一,与癌症的发生等有重要联系。miR-524-5p(CASP3为其靶基因)在GC(胃癌)组织样品和细胞系中的表达显著降低,GC细胞中miR-524-5p的增加显著降低了细胞增殖能力,促进了细胞凋亡并诱导了G0/G1期的细胞周期停滞,miR-524-5p水平降低则促进了肿瘤的发生发展 [12]。JUN蛋白包含了v-Jun、c-Jun、Jun-B和Jun-D,是激活子蛋白-1(Activator Protein-1,AP-1)转录因子的家族成员之一,其中c-Jun作为AP-1家族的关键组分,在肿瘤的形成、转移和侵袭中发挥重要作用[13]。c-Jun可以抑制miR-22的转录,miR-22直接与HuR的3'-UTR结合,导致HuR蛋白的抑制,从而抑制CRC在体外增殖和迁移,并减缓CRC异种移植肿瘤在体内的生长[14]。环氧合酶2(PTGS2),是前列腺素(PG)生物合成中的关键酶,PG参与细胞增殖分化凋亡等,影响炎症、癌症等病理过程。分析表明,基质PTGS2的表达促进癌症相关成纤维细胞在肠腔附近发挥屏障功能[15]。但在放射治疗时,PTGS2可激活NF-κB信号通路,防止DNA损伤,促进了肿瘤细胞增殖并提高其耐受性[16]。信号传感器和转录激活器3(STAT3)与肿瘤细胞增殖、转移和细胞因子促炎等有关。在原发性CRC中,集落刺激因子1受体(CSF1R)增加,STAT3通过介导miR-34a下调诱导CSF1R活化使CRC细胞迁移,侵袭和转移[17]。血管生成对肿瘤发展至关重要,STAT3可激活具有促血管生成活性的YAP(Yes 相关蛋白)和TAZ(具有 PDZ 结合基序的转录共激活因子)。在小鼠CRC模型中,使用YAP/TAZ抑制剂Verteporfin治疗,降低了血管密度和肿瘤进展[18]。
对莫匹罗星抗CRC潜在靶点进行KEGG通路富集分析,排名第一的为TRP通道的炎症介质调节通路(图6),影响背景框代表在该通路中莫匹罗星抗CRC的潜在靶点。由图可见,莫匹罗星可以通过作用于MAPK信号通路(MAPK signaling pathway)、花生四烯酸代谢(Arachidonic acid metabolism)、钙信号通路(Calcium signaling pathway)等途径上的蛋白靶点调控CRC发生发展。
c-Jun N-末端激酶(JNK)是有丝分裂原活化蛋白激酶(MAPK)三个主要亚家族成员之一[19]。MAPK的3个主要亚家族均参与细胞代谢调控,通过上调基质金属蛋白酶的表达,使癌细胞逃避凋亡[19-20]。莫匹罗星亦可作用IL-1B,在CRC细胞中, IL-1B可通过激活p38/JNK途径诱导miR-31的转录,而miR-31与癌细胞的恶性程度、浸润水平和转移能力呈正相关[21-22]。炎症是公认的癌症标志,肿瘤微环境(TME)中炎症细胞和介质的释放可以增加癌细胞的存活率,促进肿瘤的进展,侵袭和转移[23]。多不饱和脂肪酸(PUFAs)的氧化代谢对结肠肿瘤发生有强烈影响,花生四烯酸的水平可有助于炎症微环境的发展[24],莫匹罗星可促进花生四烯酸的代谢,从而抑制炎症的进展。TME往往由癌细胞、巨噬细胞等免疫细胞、内皮细胞、血细胞和肿瘤相关成纤维细胞(CAFs)组成,CAFs是生长因子的主要来源。钙信号转导是细胞内和细胞间信号转导通路的关键第二信使,在肿瘤进展中重要的细胞机制通常是受钙离子变化的驱动或影响[25]。CAFs参与肿瘤细胞的复杂双向通信,有研究发现,白藜芦醇激活CAFs中的TRPA1钙通道,并导致大量的Ca2+流入和分泌VEGF和HGF[26]。这些发现表明CAFs产生并分泌基质细胞衍生因子-1(SDF-1)可促进癌细胞的迁移和侵袭。而莫匹罗星可通过作用钙信号通路,从而影响CAFs的合成。
目前针对莫匹罗星抗肿瘤的实验研究较少,除了前述我们课题组研究发现莫匹罗星体外有抗CRC活性[5],也有其他课题组报道了莫匹罗星对黑色素瘤细胞和乳腺癌细胞有细胞毒作用,还发现莫匹罗星可诱导肿瘤细胞凋亡和抑制(PI3K)-Akt信号通路[27]。由于莫匹罗星血清半衰期仅有30 min,通常作为外用抗菌药物,但已有文献报道,可将莫匹罗星配制成纳米结构脂质载体,其释放药物的时长可长达24 h[28],也有研究证明莫匹罗星脂质体可以血管内给药[29],因此通过网络药理学对莫匹罗星抗CRC的可能靶点和机制的解析,可以为将来莫匹罗星药物重定位用于抗CRC研究提供支持。
参 考 文 献
中华人民共和国国家卫生健康委员会医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2020年版)[J]. 中国实用外科杂志, 2020, 40(6): 601-625.
Xi Y, Xu P. Global colorectal cancer burden in 2020 and projections to 2040[J]. Transl Oncol, 2021, 14(10): 101174.
Aneke-Nash C, Yoon G, Du M, et al. Antibiotic use and colorectal neoplasia: a systematic review and meta-analysis[J]. BMJ Open Gastroenterol, 2021, 8(1): e000601.
Khoshnood S, Heidary M, Asadi A, et al. A review on mechanism of action, resistance, synergism, and clinical implications of mupirocin against Staphylococcus aureus[J]. Biomed Pharmacother, 2019, 109: 1809-1818.
Li Y, Li Y, Li D, et al. Repositioning of hypoglycemic drug linagliptin for cancer treatment[J]. Front Pharmacol, 2020, 11:187.
牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读[J]. 中草药, 2021, 52(14): 4119-4129.
Zhang S, Yang Z, Bao W, et al. SNX10 (sorting nexin 10) inhibits colorectal cancer initiation and progression by controlling autophagic degradation of SRC[J]. Autophagy, 2020, 16(4): 735-749.
Jin W. Regulation of Src family kinases during colorectal cancer development and its clinical implications[J]. Cancers, 2020, 12(5): E1339.
Sun X, Qi H, Zhang X, et al. Src activation decouples cell division orientation from cell geometry in mammalian cells[J]. Biomaterials, 2018, 170: 82-94.
Imazeki H, Ogiwara Y, Kawamura M, et al. CD11b+CTLA4+ myeloid cells are a key driver of tumor evasion in colorectal cancer[J]. J Immunother Cancer, 2021, 9(7): e002841.
Sudo G, Aoki H, Yamamoto E, et al. Activated macrophages promote invasion by early colorectal cancer via an interleukin 1β-serum amyloid A1 axis[J]. Cancer Sci, 2021, 112(10): 4151-4165.
Zhu C Y, Meng F Q, Liu J. MicroRNA-524-5p suppresses cell proliferation and promotes cell apoptosis in gastric cancer by regulating CASP3[J]. Eur Rev Med Pharmacol Sci, 2019, 23(18): 7968-7977.
Zhu G, Cheng Z, Huang Y, et al. TRAF6 promotes the progression and growth of colorectal cancer through nuclear shuttle regulation NF-kB/c-jun signaling pathway[J]. Life Sciences, 2019, 235: 116831
Liu Y, Chen X, Cheng R, et al. The Jun/miR-22/HuR regulatory axis contributes to tumourigenesis in colorectal cancer[J]. Mol Cancer, 2018, 17(1): 11.
Venè R, Costa D, Augugliaro R, et al. Evaluation of glycosylated PTGS2 in colorectal cancer for NSAIDS-based adjuvant therapy[J]. Cells, 2020, 9(3): 683.
Tan C, Liu L, Liu X, et al. Activation of PTGS2/NF-κB signaling pathway enhances radiation resistance of glioma[J]. Cancer Med, 2019, 8(3): 1175-1185.
Shi X, Kaller M, Rokavec M, et al. Characterization of a p53/miR-34a/CSF1R/STAT3 feedback loop in colorectal cancer[J]. Cell Mol Gastroenterol Hepatol, 2020, 10(2): 391-418.
Shen Y, Wang X, Liu Y, et al. STAT3-YAP/TAZ signaling in endothelial cells promotes tumor angiogenesis[J]. Sci Signal, 2021, 14(712):eabj8393.
Kim E K, Choi E J. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochimica et Biophysica Acta, 2010, 1802(4): 396-405.
Huang Y, Zou Y, Lin L, et al. miR101 regulates the cell proliferation and apoptosis in diffuse large Bcell lymphoma by targeting MEK1 via regulation of the ERK/MAPK signaling pathway[J]. Oncology Reports, 2019, 41(1): 377-386.
Stefani C, Miricescu D, Stanescu-Spinu Ⅱ, et al. Growth factors, PI3K/AKT/mTOR and MAPK signaling pathways in colorectal cancer pathogenesis: where are we now?[J]. International J Molecular Sciences, 2021, 22(19): 10260.
Zhong L, Simoneau B, Huot J, et al. p38 and JNK pathways control E-selectin-dependent extravasation of colon cancer cells by modulating miR-31 transcription[J]. Oncotarget, 2017, 8(1): 1678-1687.
Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444.
Tutino V, De Nunzio V, Caruso M G, et al. Elevated AA/EPA ratio represents an inflammatory biomarker in tumor tissue of metastatic colorectal cancer patients[J]. International J Molecular Sciences, 2019, 20(8): E2050.
Monteith G R, Prevarskaya N, Roberts-Thomson S J. The calcium-cancer signalling nexus[J]. Nature Reviews Cancer, 2017, 17(6): 367-380.
Sadras F, Monteith G R, Roberts-Thomson S J. An emerging role for calcium signaling in cancer-associated fibroblasts[J]. Int J Mol Sci, 2021, 22(21): 11366.
Reva O N, Rademan S, Visagie M H, et al. Comparison of structures and cytotoxicity of mupirocin and batumin against melanoma and several other cancer cell lines[J]. Future Med Chem, 2019, 11(7): 677-691.
Singh A P, Sharma S K, Gaur P K, et al. Fabrication of mupirocin-loaded nanostructured lipid carrier and its In vitro characterization[J]. Assay Drug Dev Technol, 2021, 19(4): 216-225.
Alcantara K P, Zulfakar M H, Castillo A L. Development, characterization and pharmacokinetics of mupirocin-loaded nanostructured lipid carriers (NLCs) for intravascular administration[J]. Int J Pharm, 2019, 571: 118705.
