基于PiggyBac转座系统的低溢漏诱导型Tet-On过表达体系的建立及应用
2023-04-29张柏权李中瀚殷旖珂
张柏权 李中瀚 殷旖珂
为避免诱导基因稳定表达的Tet-On诱导表达系统溢漏表达,实现简便且高效的外源基因稳定诱导表达, 本研究拟在Tet-On调控的转录水平基础上,将基于稳定配体Shield-1的不稳定结构域FK506结合蛋白引入目的基因的N端,从蛋白水平控制其本底表达水平.为验证该系统的效果,本研究以荧光蛋白TdTomato为报告基因,经流式分析结果证明优化后的体系较原体系的溢漏表达在蛋白水平上降低7倍左右.将该系统应用于基于小鼠胚胎干细胞的体外牙向分化模型,在诱导因子Dox和稳定配体Shield-1的协同作用下,诱导表达牙齿发育相关转录因子Hand2提高了牙向分化诱导的完成度.
PiggyBac转座系统; Tet-on诱导型过表达系统; 溢漏表达; 不稳定结构域; 稳定配体Shield-1
Q28A2023.036004
收稿日期: 2022-08-15
基金项目: 国家自然科学基金青年基金(31900900)
作者简介: 张柏权(1997-), 男, 陕西西安人, 硕士研究生, 主要从事细胞生物学研究. E-mail: 248857314@qq.com
通讯作者: 殷旖珂.E-mail: ytyike@outlook.com
Establishment and application of a low-leakage Tet-On inducible overexpression system based on the PiggyBac transposition system
ZHANG Bai-Quan, LI Zhong-Han, YIN Yi-Ke
(College of Life Sciences, Sichuan University, Chengdu 610064)
In order to avoid the leakage expression of the Tet-on inducible expression system and to achieve easy, stable and efficient expression of exogenous gene when induced at a specific time, this study planned to add the destabilizing domain FK506-binding protein, regulated by the stable ligand Shield-1, to the N-terminal of the target gene to control its background expression at the protein level. To verify the performance of this system, the fluorescent protein TdTomato was used as the reporter gene in this study. The results of flow analysis showed that the leakage expression in the optimized system was reduced about 7 times compared with the original one at the protein level. This system was applied to the in vitro odontogenic induction system based on mouse embryonic stem cells. Under the synergistic effect of the inducible factor Dox and the stable ligand Shield-1, the induced overexpression of tooth development-related transcription factor Hand2 could improve the completion of odontogenic induction.
PiggyBac transposition system; Tet-On inducible overexpression system; Leakage expression; Destabilizing domain; Stable ligand Shield-1
1 引 言
在發育生物学中,某些关键基因在特定时间段的表达,是实现体外组织器官再生的关键步骤,利用Cre-loxP、Tet-On等系统可在体外实现特定基因的定时表达[1-4].其中,Cre-loxP系统实现对目的基因表达开启是不可逆的[2, 5].而Tet-On系统凭借其添加或去除诱导因子Dox实现目的基因表达起始或停止这一优势,而被广泛使用[3, 6].通常情况下,在Tet-On过表达系统中,持续表达的rtTA处于游离状态,不会结合诱导型tetO启动子,无法起始目标基因的表达;而在添加了四环素诱导因子(Doxycycline, Dox)后,Dox结合rtTA并改变其构象,使其结合于tetO启动子上,进而起始目标基因的表达[6, 7].如添加诱导因子Dox实现基于Tet-On系统的转录因子Nanog的过表达,进而实现对原始生殖细胞(Primordial germ cells)的分化诱导[4].
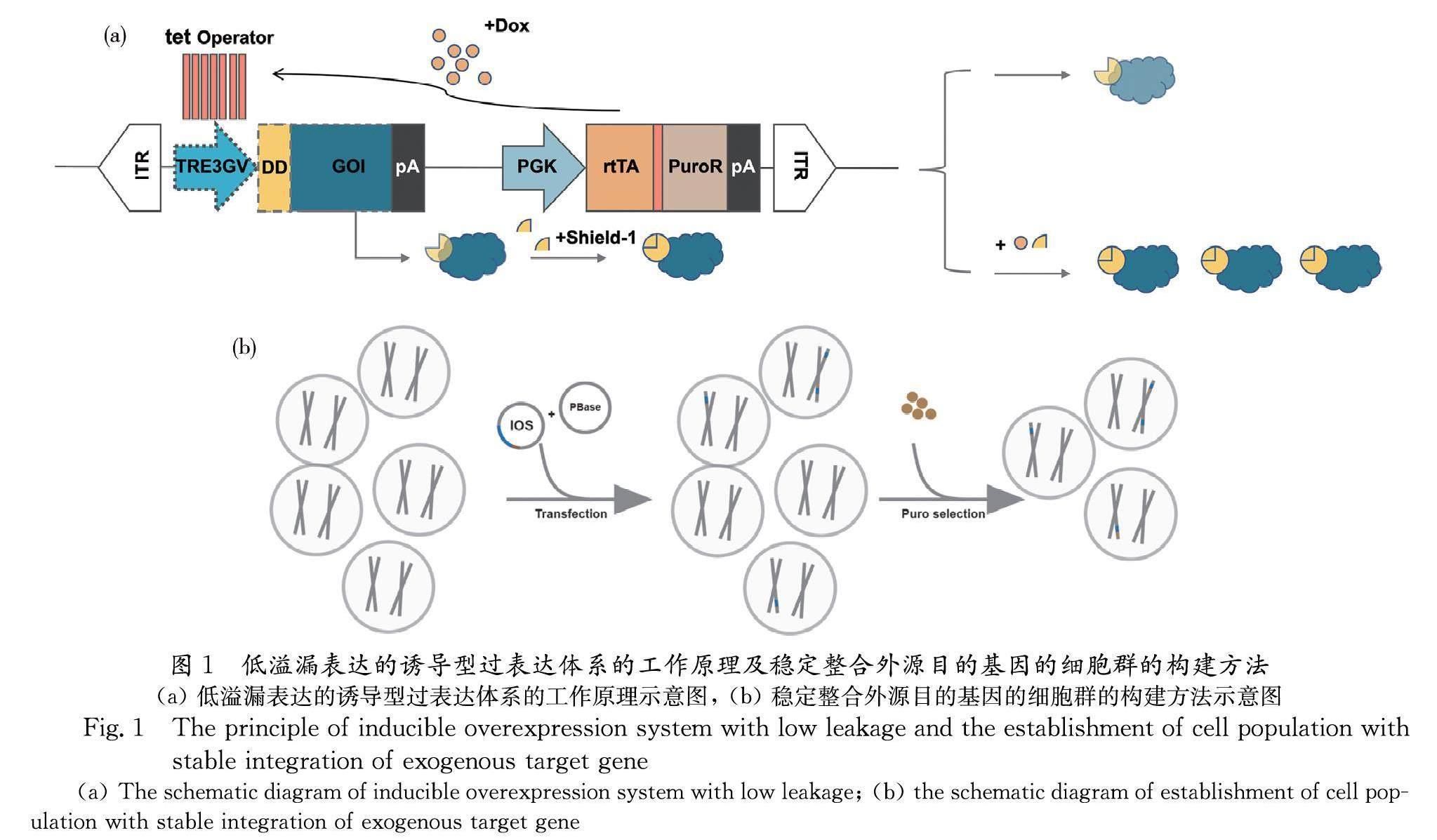
慢病毒感染或PiggyBac转座系统可以实现外源基因稳定整合与表达[8, 9].其中慢病毒感染包含慢病毒生产这一关键步骤,耗时长[8].而步骤简单,操作便利的PiggyBac转座系统,仅需将转座酶PBase与包含目的基因的载体共同转染进目标细胞群,即可通过转座酶PBase高效且稳定地将位于反向末端重复序列(inverted terminal repeats sequences, ITRs)间的目的片段,以“剪切-粘贴”的方式,整合至基因组的TTAA序列之间,实现基因片段的稳定插入[9, 10],如通过PiggyBac转座系统实现Nanog表达元件在细胞基因组中的整合[4].因此,基于PiggyBac转座系统的Tet-On诱导型过表达系统,可以方便快捷的构建研究目的基因的体外细胞模型,且在诱导因子Dox存在时,可以稳定地起始目的基因的过表达[3, 6, 7].
然而,该系统也存在一定的缺点.即在没有诱导因子Dox存在时,处于静息状态的系统,仍有少量目的基因的表达,该现象称之为溢漏(leakage)[3, 7],而该现象可能会对体外分化造成严重影响.为了减少溢漏现象,并增强体系的精确度,本研究拟在目的基因的N端引入不稳定结构域(destabilizing domain, DD),即含F36V和L106P突变的FK506结合蛋白(FK506 binding protein, FKBP),其与稳定配体(stabilizing ligand)Shield-1具有更高的结合稳定性[11].添加不稳定结构域后,在缺乏诱导因子Dox时,系统溢漏表达的mRNA经核糖体翻译后,形成携带FKBP的融合蛋白,该蛋白在缺乏其稳定配体时Shield-1时,会处于不稳定的状态,从而经泛素-蛋白酶体系统(ubiquitin-proteasome system)途径快速降解,实现系统溢漏表达在蛋白水平的降低.因此,当添加诱导因子Dox和稳定配体Shield-1时,Dox将起始融合蛋白的mRNA的转录,稳定配体Shield-1结合翻译后的融合蛋白使其处于稳定状态,进而发挥其生物学功能[11-13].
人的牙齿不具有再生能力,牙齿再生有望实现牙齿生理功能的全面恢复 [14].现阶段,尚无基于小鼠胚胎干细胞体外从头再生的先例.受过表达转录因子Sox9和Foxc1可以在体外再生唾液腺的启发[15],本研究拟通过优化后的诱导型过表达体系,过表达牙齿发育相关转录因子,探究其对于牙向分化诱导的作用.在脊椎动物中,Hand2在颅面部神经嵴发育至下颌过程的间充质细胞中表达,并决定下颌的发育命运[16-18],在神经嵴中,Hand2基因突变将影响下颌以及相关结构的发育[17],过表达Hand2将改变上颌的发育命运,使之获得下颌的发育命运[16].本实验室RNA-seq数据分析显示胚胎发育E10.5天的牙胚的间充质细胞中,Hand2呈现高表达的状态.然而从本实验室建立的小鼠胚胎干细胞体外牙向分化数据分析,Hand2的表达水平较低.因此,本研究拟结合上述诱导表达系统,将Hand2作为目标基因,探究该系统的应用前景并及Hand2对于牙向分化诱导的作用.
综上,本文优化了现有的基于PiggyBac转座系统的Tet-On诱导型过表达系统,并证明在目的基因的N端添加不稳定结构域后,以TdTomato荧光蛋白为报告基因,在无诱导因子Dox和稳定配体Shield-1时,体系的溢漏表达在蛋白水平上降低7倍左右;且在诱导因子Dox和稳定配体Shield-1的协同作用下,可以实现荧光蛋白TdTomato的稳定过表达;并且,将该体系应用在基于小鼠胚胎干细胞的体外分化模型中,拟胚体分化的第8~12 d,添加Dox和Shield-1可以提高转录因子Hand2和下游靶基因Pitx1的表达程度[16],Pitx1在胚胎发育过程中,是拟发育成牙上皮的细胞群的标志基因之一[19],证明过表达Hand2可以提高牙向分化诱导的完成度.本文首次实现基于PiggyBac转座系统,通过不稳定结构域降低溢漏表达的Tet-On诱导型过表达系统的建立.该系统为解析发育过程中的重要事件提供了高效且精确的研究手段,也为研究特定基因在发育过程中如何指导细胞命运和分化决策提供重要方法.
2 材料和方法
2.1 材 料
小鼠原代胚胎干细胞单克隆细胞系6#-13,E.coli HST08 Competent Cells(Takara,9128),DMEM basic(Gibco,C11995500BT),Fetal Bovine Serum(Hyclone,SH30396.03),GlutaMAX(Gibco,335050-061),MEM NEAA(Gibco,11140-050),Pen-Strep(Gibco,15140-122),Recombination Human Lif(Novoprotein,C017),β-Mercaptoethanol(Gibco,M3148),Trizol(Sigma,T9424),氯仿(成都长联化工,XK13-201-00213-016),异丙醇(Fisher chemical,A451),质粒小提试剂盒(TIANGEN,DP103),反转录试剂盒(TAKARA,RR047A),PBS(Gibco,C10010500BT),Gelatin from porcine skin(Sigma,G1890-100G),Lipofectamine 3000 Transfection Kit(Invitrogen,L3000-015),Dox(TAKARA,631311),Shield-1(MCE,HY-112210),0.25% Trypsin-EDTA(Gibco,25200072),ClonExpress MultiS One Step Cloning Kit(诺唯赞,C113)
2.2 方 法
2.2.1 载体构建 本实验室提供基于PiggyBac转座系统的Tet-On过表达TdTomato的质粒,PiggyBac-Tet-On-TdTomato,并携带Puro抗性基因.提取小鼠E10.5的牙胚的RNA并通过反转录获得cDNA,以cDNA为模板,使用高保真酶扩增出Hand2序列.以HEK293FT细胞的基因组为模板,使用高保真酶扩增出DD序列.通过ClonExpress MultiS One Step Cloning Kit,以同源重组的方式完成载体PiggyBac-Tet-On-DD-TdTomato和PiggyBac-Tet-On-DD-Hand2的构建.随后进行转化、涂板、菌落PCR鉴定、摇菌、提质粒、测序等操作获得目的质粒.
2.2.2 细胞培养 配置维持6#-13细胞培养所需的培养基,配方为409.45 mL DMEM,75 mL FBS,5 mL Pen-Strep,5 mL GlutaMAX,5 mL NEAA, 500 μL β-Mercaptoethanol和50 μL Lif.传代过程为:0.1%的gelatin处理培养板20 min;弃培养基,添加胰酶,37 ℃消化3 min,ES培养基中和,1500 r/min离心3 min后弃上清,使用ES培养基重悬细胞,按合适比例传代至处理后的细胞培养板中,并补充ES培养基至2 mL,随后将细胞培养板放置于培养箱中培养.Dox的工作浓度为1μg/mL.观察细胞荧光表达情况的曝光时间为100ms(-Dox)和5ms(+Dox).
2.2.3 细胞转染 质粒的转染使用Lipo3000转染试剂盒,按照说明书进行操作,其中空载质粒、质粒PiggyBac-Tet-On-DD-Hand2、质粒PiggyBac-Tet-On-DD-TdTomato或质粒PiggyBac-Tet-On-TdTomato分别与PiggyBac转座酶PBase进行转染,且质粒的摩尔比为1∶1.转染两天后的细胞群开始药筛,每1 mL培养基加入0.1 μL浓度为10 mg/mL的Puromycin.药筛传代3次后,获得稳定的细胞系,进行细胞冻存,并用于后续的实验
2.2.4 荧光定量 RNA的提取按照Trizol法进行操作,提取后的RNA使用NanoDrop检测浓度,做好标记,置于-80 ℃冰箱保存;反转录使用Takara反转录试剂盒,并按照说明书的步骤进行操作.完成反转录的cDNA添加无DNase的水进行稀释,置于-20 ℃冰箱保存;根据需要合成qPCR实验所需的引物;实验体系参考Vazyme的SYBR qPCR Master Mix的说明书进行配置,并进行实验,GAPDH为内参.
qPCR引物:
GAPDH F:GCACAGTCAAGGCCGAGAAT
GAPDH R:GCCTTCTCCATGGTGGTGAA
TdTomato F:GTGAGCAAGGGCGAGGAGGTCATCAAAGAG
TdTomato R:CTACTTGTACAGCTCGTCCATGCCGTACAGGA
Hand2 F:CCGACACCAAACTCTCCAA
Hand2 R:GATCCATGAGGTAGGCGATG
Pax9 F:CTCCATCACCGACCAAGG
Pax9 R:CCCTTCTCCAATCCATTCAC
Lhx8 F:GAAGTGGAGAACGGTAATGGG
Lhx8 R:TGTTGTCCTGAGCGAACTGT
Pitx1 F:ACTCCTACAACAACTGGGCG
Pitx1 R:GGGCCGAGAACATGGATTGA
2.2.5 流式分析 收集样品于15mL离心管中,用PBS洗3次,随后加入0.25%的Trypsin-EDTA消化5 min,用移液器吹打至散开,随后再37 ℃消化2 min,加入3倍体积的培养基中和胰酶,并加入适量DNase,吹打至无细胞团,500 g离心3 min,去上清,用PBS重悬细胞并用细胞筛过滤至流式管中.流式细胞仪按照说明书的指示调整至正常工作状态,并进行实验.
3 结果与分析
3.1 诱导型过表达载体的优化原理和应用方法
基于PiggyBac转座系统的Tet-On诱导型过表达系统,在没有诱导因子Dox的存在下,诱导型启动子仍能起始目的基因(gene of interests,GOI)的表达,这种现象称为溢漏(leakage)[3, 7].为降低系统的溢漏,本研究拟在目的基因的N端的引入不稳定结构域,即FK506结合蛋白,使新的目的基因表达元件经核糖体翻译后,形成融合蛋白.理论上,优化后的系统有两种工作状态:一,在无诱导因子和稳定配体存在时,溢漏表达的融合蛋白因携带不稳定结构域会经泛素-蛋白酶体途径被快速降解;二,在诱导因子Dox和稳定配体Shield-1同时存在时,系统可以稳定的过表达融合蛋白,不被降解,进而发挥其生物学功能,如图1a所示.而该系统通过转座酶(PBase)识别诱导型过表达系统(inducible overexpression system,IOS)两端的反向末端重复序列(inverted terminal repeats,ITR),并将其稳定整合于细胞基因组中,后经药物筛选,可获得包含稳定整合诱导型过表达系统的细胞群,用于后续实验,如图1b所示.
3.2 不稳定结构域显著降低诱导型过表达系统的溢漏表达
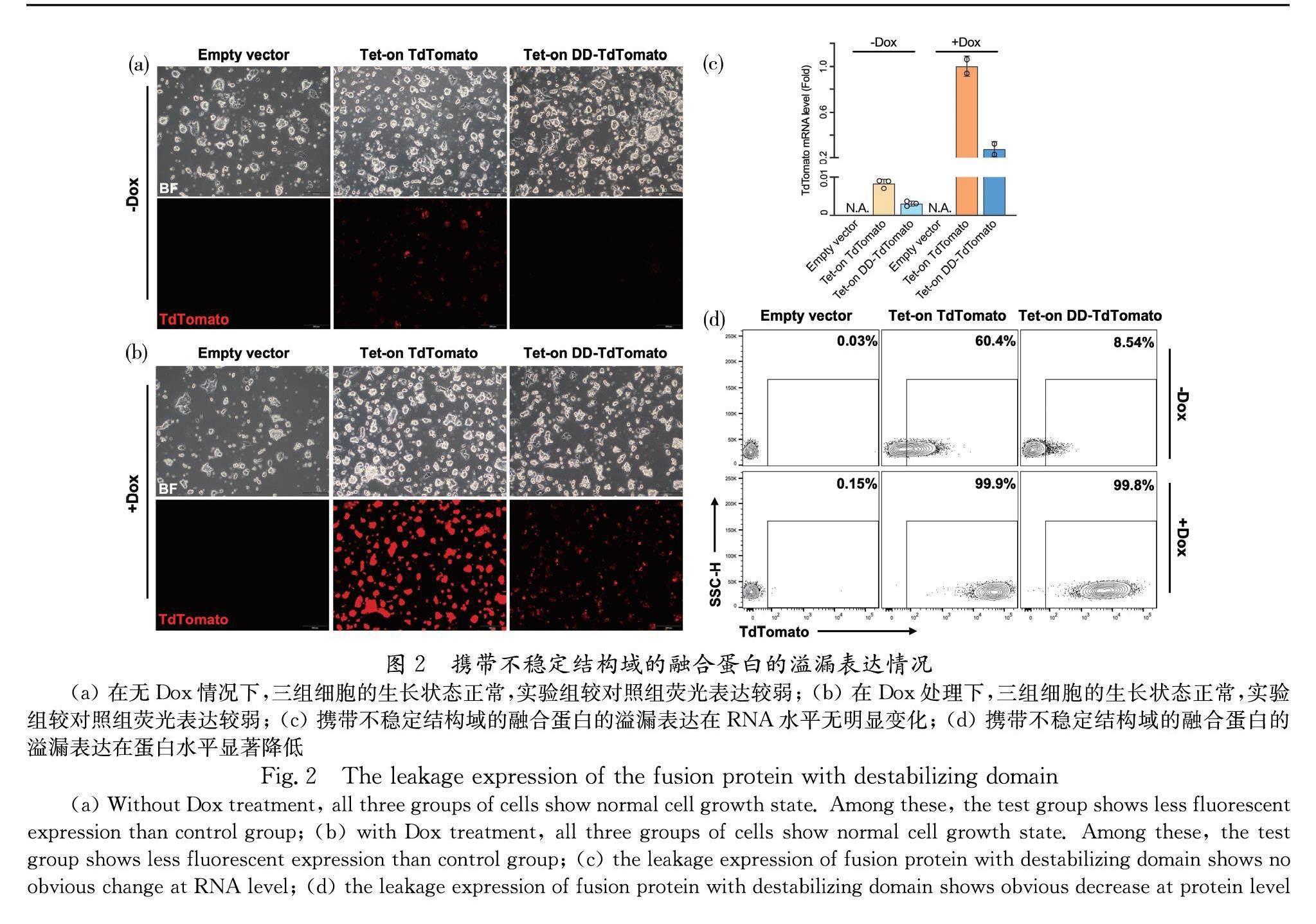
本研究基于小鼠原代胚胎干细胞株6#-13,分别构建转染空载(空白对照组)、PiggyBac-Tet-On-TdTomato(对照组)或PiggyBac-Tet-On-DD-TdTomato(实验组)的细胞群,后经药物筛选,获得稳定整合诱导型过表达系统的细胞群.细胞群在培养24 h后,通过荧光显微镜观察其荧光蛋白表达情况.同等曝光时间下,不添加诱导因子Dox时,实验组较对照组荧光信号低,证明不稳定结构域DD可以降低系统的溢漏表达,如图2a所示;同等曝光时间下,在添加诱导因子Dox时,实验组较对照组荧光信号低,证明体系虽过表达融合蛋白,但大部分融合蛋白被迅速降解,如图2b所示;RT-qPCR结果显示,无论是否存在诱导因子Dox,实验组的TdTomato在mRNA表达水平上,始终低于对照组五倍左右,如图2c所示.因此,不稳定结构域不影响体系目的基因在mRNA水平上的表达.流式分析结果显示,实验组较对照组的TdTomato在蛋白水平上表达差异较大,溢漏表达降低7倍左右,如图2d所示.其中,空白对照组始终无荧光信号.以上实验结果均显示不稳定结构域的引入,能够大幅度从蛋白水平上降低系统的溢漏现象.
3.3 稳定配体 Shield-1可以恢复目的蛋白的稳定过表达
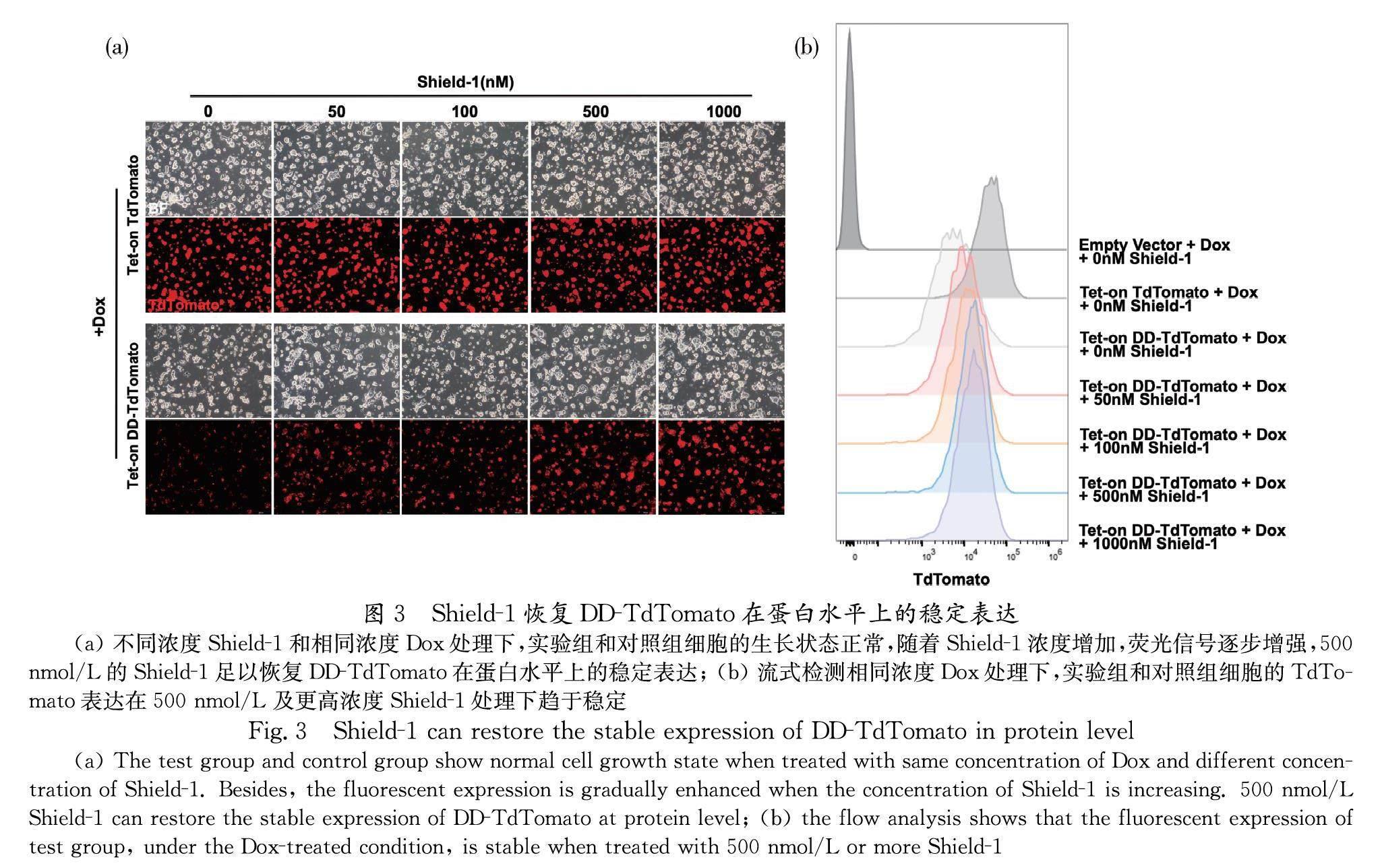
本研究在细胞的培养过程中加入相同浓度的诱导因子Dox和不同浓度的稳定配体Shield-1,以恢复含不稳定结构域(DD)的融合蛋白的稳定过表达.细胞在传代24 h后,通过荧光显微镜观察其荧光蛋白表达情况.在相同曝光时间下,实验组TdTomato的荧光信号随着Shield-1的浓度增加而逐渐变强,而对照组TdTomato的荧光信号不随Shield-1的浓度改变,证明优化后的体系,具有依赖于稳定配体Shield-1浓度的蛋白稳定表达的特征,如图3a所示;流式分析的结果证明,500 nmol/L的Shield-1足以恢复实验组的TdTomato在蛋白水平上的稳定表达,已达到TdTomato稳定表达的阈值,如图3b所示.其中,空白对照组始终无荧光信号.综上,经优化后的体系可以在Dox和Shield-1的协同作用下,过表达目的基因.
3.4 过表达转录因子Hand2可以提高牙向分化诱导的完成度
为了探究转录因子Hand2对牙向分化诱导的作用,本研究构建了稳定表达PiggyBac-Tet-On-DD-Hand2的6#-13细胞群,称为6#-13(Hand2 OE)(OE, overexpression),如图4a所示.添加诱导因子Dox可以实现Hand2在mRNA水平上的过表达,如图4b所示.由于牙齿发育需牙上皮细胞和牙间充质细胞协同作用[20, 21],故分化体系内,只需部分细胞过表达转录因子Hand2,因此,我们将未经过转染的6#-13细胞群(对照组)与6#-13(Hand2 OE)细胞群按数量比1∶1混合,形成6#-13(Hand2 OE + WT) (WT, wild type)(实验组),并采用图4c所示的实验方案开展实验,即在体外分化的8~12 d,添加Dox和Shield-1起始Hand2的稳定过表达.经体外牙向诱导分化处理,实验组与对照组形成的拟胚体在外观上基本无差异,均为表面光滑的球体,如图4d所示.收集第12 d的拟胚体并抽提RNA,经RT-qPCR,证明实验组较对照组,实现了转录因子Hand2在RNA水平和蛋白水平上的过表达,其中,Hand2在蛋白水平上的过表达反映为其下游靶基因Pitx1的RNA表达水平提升,如图4e所示.本实验室建立的小鼠胚胎干细胞体外牙向分化数据分析显示,作为牙上皮细胞的标志基因之一的Pitx1表达量较低[19].在小鼠牙胚发育过程中,表达Pax9和Lhx8的细胞将拟发育成牙间充质细胞[19],由实验结果可知,实验组依然维持高水平的Pax9和Lhx8的表达,如图4e所示,证明优化后的过表达体系不会对原有的牙向分化体系产生影响.综上,我们认为,优化后的诱导型过表达体系可以成功应用于,基于小鼠胚胎干细胞的体外分化模型的研究,且过表达转录因子Hand2可以提高了体外牙向分化诱导的完成度.
4 讨 论
PiggyBac转座系统可以高效、快捷地构建稳定整合外源基因片段的细胞群,Tet-On诱导型过表达系统则可以在特定时间,通过添加诱导因子Dox实现目的基因的过表达,并发挥其作用,去掉诱导因子Dox的12~24 h内,目的基因的过表达会被关闭,系统恢复静息状态[3].无论是细胞分化模型还是疾病模型,基于该系统建立的研究体系均有良好的表现,为研究某一基因的功能及其相关的基因调控网络提供重要的研究手段[4, 6].但是,该系统存在的溢漏表达,使得基于此系统产生的实验结果的准确度降低,故大量文献尝试对包含不同氨基酸突变的诱导型过表达系统进行测试,寻找低溢漏表达的诱导型系统[7].本文通过在目的基因N端引入不稳定结构域,欲从蛋白水平上降低诱导型过表达体系溢漏表达.由TdTomato荧光报告蛋白的实验结果来看,不稳定结构域的引入,能够大幅度从蛋白水平上降低系统的溢漏现象,因此,该系统对于目的基因的表达控制更加精准,具有更高的应用价值. 为进一步研究该系统在实际中的应用,本研究在基于小鼠胚胎干细胞的体外牙向分化诱导体系中,探究了转录因子Hand2对牙向分化的诱导作用.由于Hand2也可以促进中胚层来源的心脏的发育[18],基于低溢漏表达的诱导型过表达体系,可以避免Hand2在拟胚体的外胚层发育诱导过程(day0-day8)中的潜在影响.利用该系统,过表达转录因子Hand2使拟胚体在原分化体系的基础上,实现了更多的牙齿发育相关基因的高表达,使其更贴近于小鼠原代牙胚相关基因的表达趋势.原分化体系其他低表达的牙齿发育相关基因可以通过该体系实现基因的高表达,富集多种牙齿发育相关基因的拟胚体有望首次实现小鼠牙齿的体外从头再生.在体外发育生物学研究过程中,多数情况下,需要严格控制目的基因只在特定的时期进行表达,因此,低溢漏表达的诱导型过表达体系的建立十分必要,基于该体系产生的实验结果具有更高的可信度.
本文将不稳定结构域FKBP蛋白引入基于PiggyBac转座系统的诱导型Tet-On过表达体系,建立了低溢漏表达的诱导型过表达体系,一定程度上提高了系统的准确度,基于该系统所做的研究产生的成果也将更有说服力.对优化的诱导型表达体系的合理应用,可以加速对发育生物学研究中重要事件的解析,也为疾病模型、分化模型等研究提供了重要的手段,推动干细胞研究向临床应用方面的转化.
参考文献:
[1] Wiegand C, Banerjee I. Recent advances in the applications of iPSC technology [J]. Curr Opini Biotechnol, 2019, 60: 250.
[2] Saito E, Suzuki D, Kurotaki D, et al. Down-regulation of Irf8 by Lyz2-cre/loxP accelerates osteoclast differentiation in vitro [J]. Cytotechnology, 2017, 69: 443.
[3] Randolph L N, Bao X P, Zhou C K, et al. An all-in-one, Tet-On 3G inducible PiggyBac system for human pluripotent stem cells and derivatives [J]. Sci Rep, 2017, 7: 1549.
[4] Murakami K,Günesdogan U, Zylicz J J, et al. NANOG alone induces germ cells in primed epiblast in vitro by activation of enhancers [J]. Nature, 2016, 529: 403.
[5] Ishii M, Arias A C, Liu L Q, et al. A stable cranial neural crest cell line from mouse [J]. Stem Cells Dev, 2012, 21: 3069.
[6] Sakemura R, Terakura S, Watanabe K, et al. A Tet-On inducible system for controlling CD19-Chimeric antigen receptor expression upon drug administration [J]. Cancer Immunol Res, 2016, 4: 658.
[7] Das A T, Zhou X, Metz S W, et al. Selecting the optimal Tet-On system for doxycycline-inducible gene expression in transiently transfected and stably transduced mammalian cells [J]. Comparative Study, 2016, 11: 71.
[8] Oberbek A, Matasci M, Hacker D L, et al. Generation of stable, high-producing CHO cell lines by lentiviral vector-mediated gene transfer in serum-free suspension culture [J]. Biotechnol Bioeng, 2011, 108: 600.
[9] Zhao S,Jiang E Z, Chen S S, et al. PiggyBac transposon vectors: the tools of the human gene encoding [J]. Transl Lung Cancer Res, 2016, 5: 6.
[10] Yusa K, Rad R, Takeda J, et al. Generation of transgene-free induced pluripotent mouse stem cells by the piggyBac transposon [J]. Nat Methods, 2009, 6: 363.
[11] Iwamoto M, Bjrklund T, Lundberg C,et al. A general chemical method to regulate protein stability in the mammalian central nervous system [J]. Chem Biol, 2010, 17: 981.
[12] Park A, Won S T, Pentecost, et al. CRISPR/Cas9 allows efficient and complete Knock-In of a destabilization Domain-Tagged essential protein in a human cell line, allowing rapid knockdown of protein function [J]. PLoS One, 2014, 9: e95101.
[13] Sellmyer M A, Chen L C, Egeler E L, et al. Intracellular context affects levels of a chemically dependent destabilizing domain [J]. PLoS One, 2012, 7: e43297.
[14] Bertassoni L E, Coelho P G. Engineering mineralized and load bearing tissues [M]. Switzerland: Springer International Publishing, 2015.
[15] Tanaka J, Ogawa M,Hojo H, et al. Generation of orthotopically functional salivary gland from embryonic stem cells [J]. Nat Commun, 2018, 9: 4216.
[16] Funato N, Kokubo H, Nakamura M, et al. Specification of jaw identity by the Hand2 transcription factor [J]. Sci Rep, 2016, 6: 28405.
[17] Yanagisawa H,Clouthier D E, Richardson J A, et al. Targeted deletion of a branchial arch-specific enhancer reveals a role of dHAND in craniofacial development [J]. Development, 2003, 130: 1069.
[18] Firulli A B. A handful of questions: the molecular biology of the heart and neural crest derivatives (HAND)-subclass of basic helix-loop-helix transcription factors [J]. Gene, 2003, 312: 27.
[19] Zhang Y D, Chen Z, Song Y Q, et al. Making a tooth: growth factors, transcription factors, and stem cells [J]. Cell Res, 2005, 15: 301.
[20] Balic A. Biology explaining tooth repair and regeneration: a mini-review [J]. Gerontology, 2018, 64: 382.
[21] Balic A. Concise review: cellular and molecular mechanisms regulation of tooth initiation: cellular and molecular mechanisms regulation of tooth initiation [J]. Stem Cells, 2019, 37: 26.
引用本文格式:
中 文: 张柏权, 李中瀚, 殷旖珂. 基于PiggyBac转座系统的低溢漏诱导型Tet-On过表达体系的建立及应用[J]. 四川大学学报: 自然科学版, 2023, 60: 036004.
英 文: Zhang B Q, Li Z H, Yin Y K. Establishment and application of a low-leakage Tet-On inducible overexpression system based on the PiggyBac transposition system [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 036004.
