远隔缺血预处理联合控制性低中心静脉压在肝切除术中的应用
2023-04-29高苑淞杨柳吴悠张娜田春
高苑淞 杨柳 吴悠 张娜 田春
摘要:目的 评价远隔缺血预处理(RIPC) 联合控制性低中心静脉压(CLCVP)在肝切除术中的应用效果。方法 选取2021年5月—2022年4月择期在重庆医科大学附属永川医院行部分肝切除术患者80例,采用随机数表法分成对照组(C组)、CLCVP组(L组)、RIPC组(R组)、RIPC联合CLCVP组(RL组),每组 20 例。L组接受CLCVP干预,R组接受RIPC干预,RL组同时接受CLCVP和RIPC干预。比较患者术前第1 天 (D0)、术后第 1 天 (D1)、术后第 3 天 (D3)、术后第 5 天 (D5)、术后第 7 天(D7) TNFα、ALT、AST、TBil和患者围术期一般情况。正态分布的计量资料组间比较采用单因素方差分析或重复测量方差分析,偏态分布的计量资料组间比较采用Kruskal-Wallis H检验;计数资料组间比较采用χ2检验。结果 RL组患者手术持续时间(H=14.278, P=0.015)、总输液量(H=24.175, P=0.001)、出血估计量(H=45.625, P<0.001)均低于R组。分组和时间因素对四组患者TNFα、ALT、AST均具有顯著交互作用 (P值分别为<0.001、0.010、0.012)。RL组患者D1的TNFα均低于L组(P值均<0.001)。RL组患者D1(P=0.008)、D7(P<0.001)ALT水平均低于L组。结论 RIPC联合CLCVP技术能够有效减少肝切除术患者术中出血量,提供清晰手术视野和缩短手术时间;同时还能通过降低患者TNFα,抑制机体炎症反应,但不能有效减轻CLCVP技术下肝切除术后的肝缺血-再灌注损伤。
关键词:缺血预处理; 中心静脉压; 再灌注损伤; 肝切除术
基金项目:重庆市科卫联合医学科研项目(2020FYYX033); 重庆市永川区自然科学基金(Ycstc, 2020nb0229)
Application of remote ischemic preconditioning combined with controlled low central venous pressure in hepatectomy
GAO Yuansong, YANG Liu, WU You, ZHANG Na, TIAN Chun. (Department of Anesthesiology, Yongchuan Hospital Affiliated to Chongqing Medical University, Chongqing 402160, China)
Corresponding author:
TIAN Chun, Tianchun314@163.com (ORCID:0000-0001-9107-167X)
Abstract:
Objective To investigate the application effect of remote ischemic preconditioning (RIPC) combined with controlled low central venous pressure (CLCVP) in hepatectomy. Methods A total of 80 patients who underwent elective partial hepatectomy in Yougchuan Hospital Affiliated to Chongqing Medical University from May 2021 to April 2022 were enrolled and divided into control group (group C), CLCVP group (group L), RIPC group (group R), and RIPC+CLCVP group (group RL) using a random number table, with 20 patients in each group. The patients in group L received CLCVP, those in group R received RIPC, and those in group RL received both CLCVP and RIPC. The patients were compared in terms of perioperative general status and the levels of tumor necrosis factor-α (TNFα), alanine aminotransferase (ALT), aspartate aminotransferase (AST), and total bilirubin on preoperative day 1(D0), postoperative day 1(D1), postoperative day 3(D3), postoperative day 5(D5), and postoperative day 7(D7). A one-way analysis of variance or a repeated measures analysis of variance was used for comparison of normally distributed continuous data between groups, and the Kruskal-Wallis H test was used for comparison of continuous data with skewed distribution between groups; the chi-square test was used for comparison of categorical data. Results Compared with group R, group RL had a significantly shorter time of operation (H=14.278, P=0.015), a significantly lower total infusion volume (H=24.175, P=0.001), and a significantly lower estimated blood loss (H=45.625, P<0.001). Group and time factors had significant interaction effects on TNFα, ALT, and AST in the four groups (P<0.001; P=0.010; P=0.012). Group RL had a significantly lower level of TNFα than group L on D1(P<0.001) and D3(P<0.001). Group RL had a significantly lower level of ALT than group L on D1(P=0.008) and D7(P<0.001). Conclusion For patients undergoing hepatectomy, RIPC combined with CLCVP can effectively reduce intraoperative blood loss, provide a clear surgical field, and shorten the time of operation; meanwhile, it can also inhibit inflammatory response by reducing TNFα, but it cannot effectively alleviate hepatic ischemia-reperfusion injury after hepatectomy under the context of CLCVP.
Key words:
Ischemic Preconditioning; Central Venous Pressure; Reperfusion Injury; Hepatectomy
Research funding:
Chongqing Municipal Science and Health Joint Medical Research Project of China (2020FYYX033); The Science Foundation of Yongchuan, Chongqing (Ycstc, 2020nb0229)
2020年全球癌症监测数据[1]显示,肝癌发病率居全球恶性肿瘤第5位(发病率为9.5/10万),死亡率居所有恶性肿瘤第3位(死亡率为8.7/10万)[1]。目前,肝切除术仍是治疗原发性和继发性肝癌最基础有效的治疗方法,对于早、中期局限性肝癌患者,可以将肿瘤完全切除而显著改善其预后[2-3]。尤其是精准肝切除术理念[4]的提出,使得高龄患者同样可以获益[5-6]。在肝切除术中借助控制性低中心静脉压(control low central venous pressure, CLCVP)技术可以有效减少肝切除期间的出血量,提供清晰手术视野,在国内外的研究报道中均已得到证实[7-8]。但值得关注的是,患者也往往因CLCVP、术中肝损伤、术中输血等因素,易发生肝缺血-再灌注损伤(hepatic ischemia-reperfusion injury, HIRI)[9-10]。HIRI是肝切除术的主要并发症,也是导致患者预后不良甚至死亡的主要原因之一[11]。有临床研究[12-13]显示远隔缺血预处理(remote ischemic preconditioning,RIPC) 对心脏手术患者心肌缺血-再灌注损伤(ischemia-reperfusion injury, IRI)具有保护作用,但将RIPC作为保护性治疗策略应用于CLCVP下肝脏手术的临床研究暂未见报道。因此,本研究旨在探讨RIPC 联合CLCVP技术用于肝切除术中的有效性和安全性,为减少肝切除术患者术后并发症,促进术后肝功能恢复,改善患者预后和生活质量提供新的思路。本研究已在中国临床试验注册中心注册(注册号:ChiCTR2100043322)。
1 资料与方法
1.1 研究对象 选取2021年5月—2022年4月择期在本院行部分肝切除术患者80例,采用随机数表法将患者分为对照组(C组)、CLCVP组(L组)、RIPC组(R组)、RIPC联合CLCVP组(RL组),每组20例。纳入标准:ASA Ⅱ~Ⅲ级;年龄 45~75 岁;心功能NYHA Ⅱ~Ⅲ级。排除标准:肢体有残缺者或患有影响上肢功能的外周血管疾病者;严重心律失常或严重心肺功能不全者;严重肝肾功能异常者;既往有心脑血管意外者;既往有神经免疫系统疾病者;患者或其家属拒绝参加本项目者。剔除标准:各种原因导致需二次手术或术中改变术式切除其他器官组织的病例。
1.2 麻醉方法 所有患者均未接受术前用药,入室后常规监测心电图、外周血氧饱和度、无创血压、脑电双频指数(bispectral index, BIS)等。局麻后超声引导下桡动脉穿刺置管,实时监测平均动脉压(mean arterial pressure, MAP)。麻醉誘导采用咪达唑仑(宜昌人福医药,国药准字 H20067040, 2 mL ∶2 mg)0.05 mg/kg,依托咪酯(江苏恩华药业,国药准字 H20028511, 10 mL ∶20 mg) 0.15~0.3 mg/kg,舒芬太尼(宜昌人福药业,国药准字H20054171,1 mL ∶50 μg)0.3~0.4 μg/kg,罗库溴铵(浙江仙琚制药,国药准字 H20093186, 5 mL ∶50 mg)0.6 mg/kg依次静注。可视喉镜下气管插管,连接麻醉机(Drager Fabius plus, 国械注准20163541068)机械通气,维持PetCO2在35~45 mmHg。超声引导下右侧颈内静脉穿刺置管监测中心静脉压(central venous pressure, CVP),鼻咽温探头监测体温。静脉泵注丙泊酚(西安力邦制药,国药准字 H19990282, 20 mL ∶200 mg) 4~8 mg· kg-1· h-1、舒芬太尼0.3~0.4 μg· kg-1· h-1、七氟醚(江苏恒瑞医药,国药准字 H20070172, 120 mL)1%~2%吸入维持,术中间断静注罗库溴铵(40~50 min,0.15 mg/kg)维持肌松,维持 BIS值在 40~50。根据出血量、尿量、MAP综合液体管理,监测血气分析,必要时输注成分血液制品(血红蛋白水平低于70 g/L开始输血),维持内环境稳定。术中肝实质离断时采用 Pringle 方法(无创夹闭第一肝门门静脉和肝动脉,每阻断15 min后需开放5 min)阻断肝脏血供[8,14]。C组采用传统麻醉管理方法,CVP 维持正常水平(6~12 cmH2O)。L组和RL组在肝实质完全离断前严格限制性液体输入,控制在1~2 mL· kg-1· h-1,采取反Trendelenburg 体位(15°头高脚低左倾位),联合硝酸甘油(白云山明兴制药,国药准字H44020569,1 mL ∶5 mg) 0.1~0.3 μg· kg-1· h-1将CVP维持在0~5 cmH2O,肝实质完全离断且创面止血彻底后迅速按晶体胶体1∶1补液(复方氯化钠: 太极西南药业,国药准字H50021611; 聚明胶肽:华龙生物制药,国药准字H42020002,500 mL ∶3.2 g)使CVP恢复并维持在6~12 cmH2O。R组和RL组在手术开始前进行RIPC处理,将麻醉监护仪(Mindray T8,国械准字2012第3211101号)袖带系于患者右上肢肘上 2~3 cm处,充气加压至200 mmHg,以远端桡动脉搏动不能被触及或脉搏氧饱和度不能测量为准,持续5 min,然后袖带排气恢复上肢血流,持续 5 min,共进行 3个循环,总用时约 30 min。C组和L组在手术开始前同样将袖带系于患者右上肢肘上 2~3 cm处30 min,但不进行充气排气操作。所有患者的麻醉手术均由同一组麻醉医师和外科医师完成。若术中需要,使用去甲肾上腺素(远大医药,H42021301,1 mL ∶2 mg)、麻黄碱(太极西南药业,国药准字H50021774,1 mL ∶30 mg)、多巴胺(未来药物开发有限公司,国药准字H20041357,20 mg)、呋塞米(五洲通药业,国药准字H20051478,20 mg)等药物维持患者MAP > 60 mmHg 且尿量>1 mL· kg-1· h-1。
1.3 观察指标 于术前第1 天 (D0)、术后第 1天(D1)、术后第3天(D3)、术后第5天(D5)、术后第7天(D7) 经外周静脉用EDTA- K2管采血1管,低温下离心20 min(4 ℃,3 000 r/min),收集上清液-80 ℃保存,直至最后运用ELISA法测定TNFα(Rndsystems, Human TNF-alpha DuoSet ELISA, DY210-05)。同时于上述时间点用无添加剂的干燥真空管采血1管,使用日立7600-210全自动生化分析仪测定血清 AST、 ALT、TBil。记录患者围术期一般资料,包括基线特征资料、手术时间、肝脏血供阻断时间、肝脏切除范围、术中出血和输血量、住院天数、术后并发症等情况。
1.4 统计学方法 采用双人双录形式,将研究结果资料建立成excel数据库后,应用SPSS 20.0统计软件分析。正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析或重复测量方差分析,组内采取 LSD-t检验;偏态分布的计量资料以M(P25~P75)表示,组间比较采用Kruskal-Wallis H检验。计数资料组间比较采用χ2检验。重复多个比较进行Bonferroni校正后分析。P<0.05 为差异有统计学意义。
2 结果
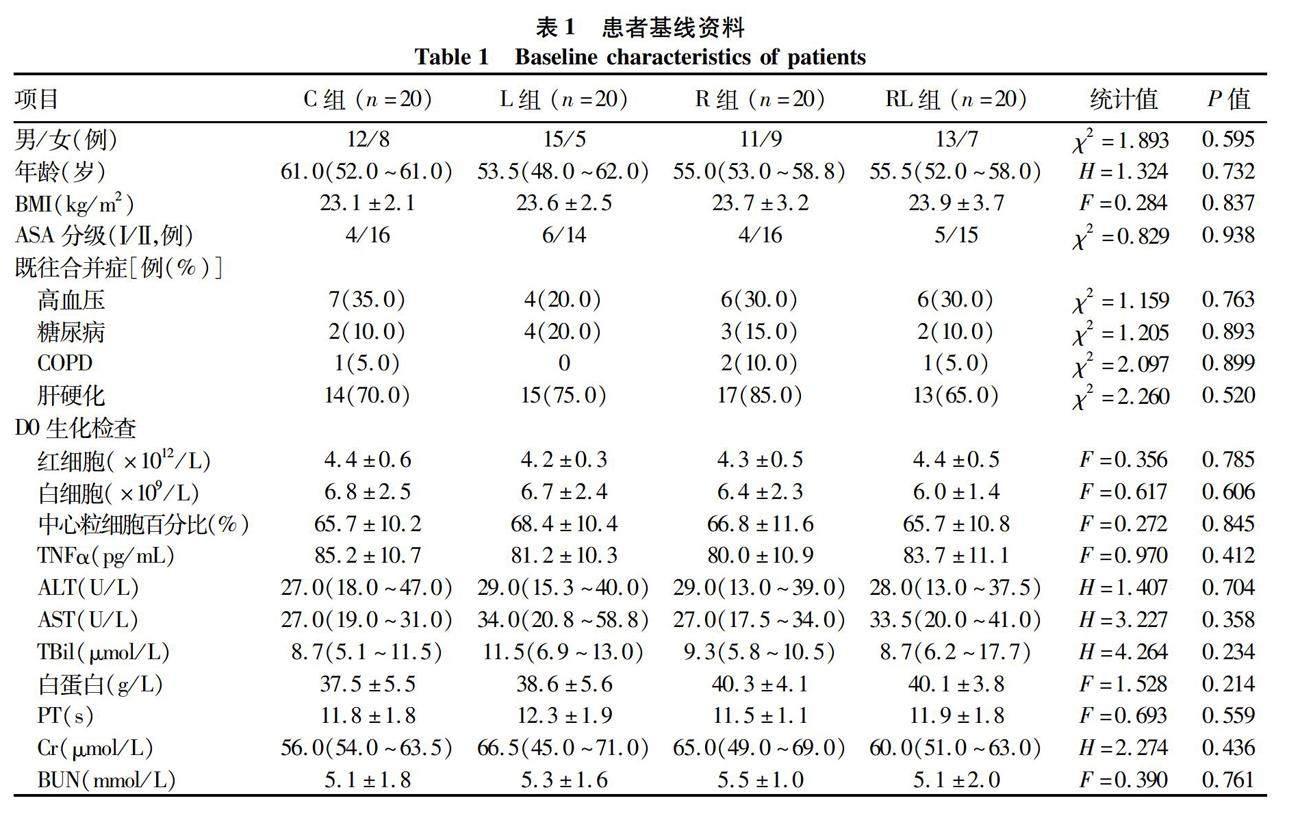
2.1 一般资料 纳入80例患者中男 51 例,女 29 例。四组患者性别比、年龄、BMI、ASA分级、既往合并症、D0的生化检查等基线资料差异均无统计学意义(P值均> 0.05)(表1)。
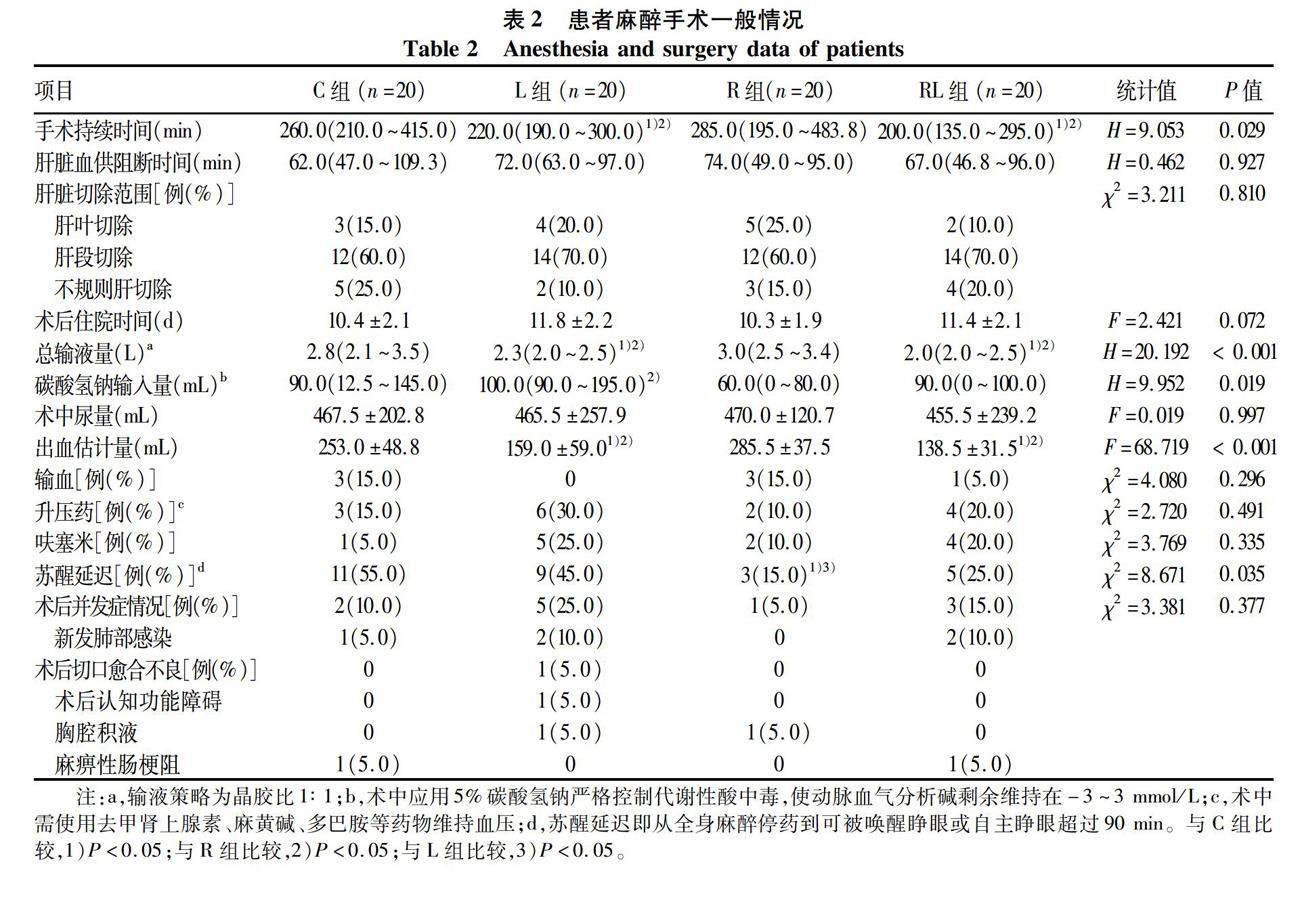
2.2 四组患者麻醉手术一般情况比较 所有患者均成功完成麻醉手术,且复苏后安返病房。四组患者术中肝脏血供阻断时间、肝脏切除范围、术中尿量、输血患者例数、使用升压药患者例数、使用呋塞米患者例数、术后住院时间、术后并发症情况组间比较差异均无统计学意义(P值均>0.05)。与C组比较,L、RL组患者的手术持续时间、总输液量、出血估计量均明显降低(P值均<0.05);与R组比较,L、RL组患者的手术持续时间、总输液量、出血估计量均明显降低(P值均<0.05)。R组患者碳酸氢钠输入量低于L组,苏醒延迟例数低于C、L组(P值均<0.05)(表2)。
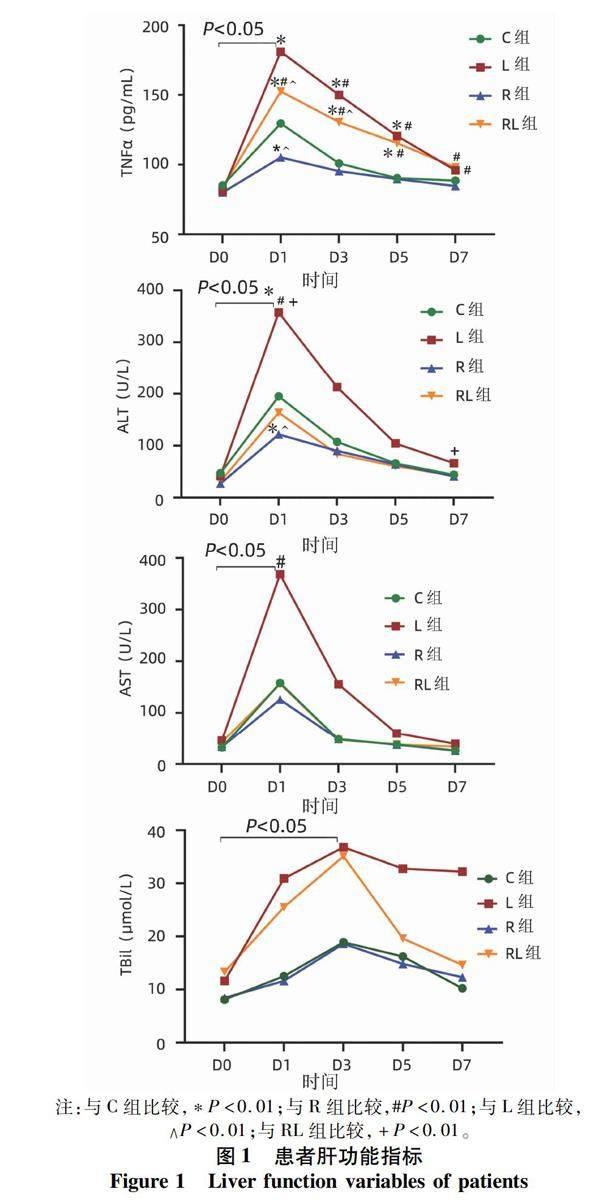
2.3 四组患者肝功能指标比较 重复测量方差分析结果显示,分组和时间因素对四组患者TNFα、ALT、AST均具有显著交互作用(P值分别为<0.001、0.010、0.012);对TBil无明显交互作用(P=0.051),但时间因素效应显著(P<0.001)。对多个比较进行Bonferroni校正(定义P<0.01为差异有统计学意义)后分析显示,四组患者手术前后TNFα、ALT、AST、
TBil均有明显变化,其中TNFα、ALT、AST峰值出现在D1,组间比较具有统计学意义(P值分别为<0.001、0.006、0.008);TBil峰值出现在D3,组间比较进行Bonferroni校正后无统计学意义(P=0.045)(图1)。
四组患者D0的TNFα、ALT 、AST、TBil水平比较均无明显差异(P值均>0.05),具有可比性。RL组患者D1(P<0.001)、D3(P<0.001)的TNFα低于L组。RL组患者D1(P=0.008)、D7(P<0.001)的ALT低于L组;RL组与L组患者D3、D5的ALT,D1、D3、D5、D7的AST组间差异均无统计学意义(P值均>0.05)。四组患者各时间点TBil组间差异均无统计学意义(P值均>0.01)(图1)。本研究共有15例患者在术中使用了升压药治疗(包括C组3例、L组6例、R組2例、RL组4例),排除上述患者后再进行分析比较,得到的结果与原始分析结果类似。
3 讨论
人体肝脏血供丰富,血管复杂、肝血窦数量庞大,同时肝实质脆性大,因此肝切除术中如何有效避免损伤血管,控制术中出血量是外科医师面临的一大主要问题。CVP即胸腔内上、下腔静脉靠近右心房处的压力,正常范围为6~12 cmH2O,可用于反映右心室的前负荷。在肝切除术中阻断第一肝门后,肝实质离断面的出血主要来自肝血窦和肝静脉,CVP可间接反映其压力,有效控制CVP水平能够减少术中出血,在此理论基础上,CLCVP技术这一概念得以提出[15]。CLCVP是指通过某种方法和/或麻醉相关药物使CVP维持在0~5 cmH2O水平,同时MAP>60 mmHg,从而减少术中出血而不影响机体重要器官血流灌注的技术。大量临床研究[8,16-17]表明,CLCVP技术在肝切除手术中可以显著减少术中出血量,为肝切除手术提供清晰的手术视野。但具体如何实施CLCVP技术,目前尚无统一标准[7,18]。本研究中主要通过反Trendelenburg体位联合外科医师Pringle手法,加上麻醉医师限制性输液、调节麻醉相关药物(丙泊酚、七氟烷、硝酸甘油等)降低CVP从而实现CLCVP。本研究结果显示CLCVP组和RIPC联合CLCVP组患者手术持续时间、出血估计量、总输液量均明显低于对照组和RIPC组,证实单纯应用CLCVP技术或RIPC联合CLCVP技术均能够有效减少肝切除术患者术中出血量,提供清晰手术视野和缩短手术时间。此外,多巴酚丁胺可通过增强心肌收缩力,进而增加心输出量。有学者[19]发现硝酸甘油联合多巴酚丁胺实现CLCVP具有独特优势,在快速有效地降低CVP的同时,更有利于维持血流动力学稳定。RIPC对硝酸甘油联合多巴酚丁胺方案的CLCVP是否能临床获益,值得进一步探究。
虽然CLCVP可有效减少术中出血,但此时患者有效循环血容量却相对或绝对不足,加上肝门血管阻断,较易发生HIRI,甚至影响患者预后[16]。在本研究中,CLCVP组患者术后第1、3、5、7天的TNFα、ALT、AST、TBil均高于其他组,间接证实了这一观点。HIRI是一个复杂的病理生理过程,肝缺血时间和残余肝实质质量是其关键决定因素,其主要通过激活肝Kupffer细胞、肝窦内皮细胞、肝星状细胞等释放大量炎症介质引发一系列炎症级联反应,轻则可引起术后肝功能障碍和部分残余肝细胞死亡,重则可能导致围术期病死率增加[20-21]。因此,采取适当的保护性预防策略降低HIRI可以促进肝切除患者术后肝功能恢复,改善患者的预后和生活质量。缺血预处理(ischemic preconditioning, IPC)是指靶器官在多次可逆的缺血再灌注后对后续IRI产生更强抵抗力的现象,是一种适应性的病理生理机制,其核心理念是在可逆缺血条件下干预靶器官,以降低IRI的影响。1986年,Murry等[22]首先对这一现象进行了描述,他们通过阻断动物模型犬的冠状动脉回旋支5 min,然后再开放 5 min,共4次循环后发现,此干预措施可以增强心肌对后续长时间缺血的耐受性,减轻心肌IRI。RIPC最早由Przyklenk等[23]在犬模型实验中提出,是指通过在远离靶器官的远端部位或器官实施多次短暂缺血/再灌注周期,以预防或减轻靶器官IRI。临床上,实施RIPC干预一般操作是通过血压袖带对四肢进行循环充气和放气,使袖带充气压比收缩压大 20 mmHg左右(或设置为200 mmHg),造成上肢或下肢缺血 5~10 min,接着将袖带放气灌注 5~10 min,连续重复3~4个周期[18,24]。
有研究[24-26]证实,肝脏IPC对HIRI具有明确的保护作用,但由于其为侵入性干预操作,限制了其临床应用。RIPC则是通过对远离肝脏的器官(如四肢等)进行干预,获得和IPC类似的临床益处,具备操作简单、安全等特点,被视为肝切除术中降低HIRI的潜在标准干预策略[24]。其肝脏保护机制可能是通过抑制高迁移率族蛋白B1诱导的TLR4/MyD88/NF-κB信号通路[27-29]。NF-κB是炎症反应和细胞分化的原型转录因子,TNFα具有强大的炎症和细胞毒性作用,被NF-κB激活的TNFα可导致肝脏缺血-再灌注的炎症损伤。本研究发现,对肝切除术患者上肢行RIPC干预策略,患者术后第1天的TNFα明显低于对照组、CLCVP组、RIPC联合CLCVP组,术后第3、5、7天的TNFα明显低于CLCVP组和RIPC联合CLCVP组,证实RIPC可以减轻肝切除患者术后炎症损伤。RIPC联合CLCVP组术后第1、3天的TNFα高于对照组、RIPC组,但明显低于CLCVP组,表明RIPC联合CLCVP技术能够减轻CLCVP导致的肝脏炎症损伤。
转氨酶是评估肝功能的主要指标之一,其异常升高表明肝细胞受损严重,因此肝切除术后ALT、AST可作为评价残余肝肝功能情况的重要指标之一[21],甚至可以用来预测术后肝病病死率[30-31]。在本研究中,RIPC联合CLCVP组术后第1、7天的ALT低于CLCVP组,但RIPC联合CLCVP组与CLCVP组术后第1、3、5、7天的AST组间差异均无统计学意义,表明RIPC联合CLCVP技术对CLCVP导致的HIRI作用十分有限。同时TBil也被认为是肝切除术后残余肝代谢功能受损的一个敏感指标[32-33],而本研究中RIPC联合CLCVP组与CLCVP组在术后1、3、5、7天的TBil均无统计学意义。因此,笔者认为RIPC联合CLCVP技术不能有效减轻肝切除术后HIRI引起的肝损伤。此外,本研究结果还发现,RIPC组患者术中碳酸氢钠输入量明显低于CLCVP组,同时苏醒延迟例数也低于对照组、CLCVP组,但RIPC联合CLCVP组患者却并没有体现出此益处,推测这可能和此次研究的样本量较小有关。
综上所述,RIPC 联合CLCVP技术操作简单,可安全应用于肝切除术,术中可以减少手术出血,提供清晰手术视野和缩短手术时间。RIPC能够通过降低患者TNFα,抑制机体炎症反应,但不能有效减轻CLCVP技术下肝切除术后的HIRI。故笔者认为在未来可能需要设计更加完善的大样本、多中心临床研究,探究RIPC 联合CLCVP技术是否能够有效保护肝切除术患者的残余肝肝功能及其保护作用机制。
伦理学声明:本研究方案于2020年7月6日经由重庆医科大学附属永川医院伦理委员会审批,批号:2020.89。患者及其家属均知情同意并签字。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:高苑淞负责收集数据,资料分析,撰写论文;吴悠参与收集数据;杨柳、张娜负责数据统计和资料分析;田春负责课题设计,拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[2]General Office of National Health Commission.Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J].J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969 /j.issn.1001-5256.2022.02.009.
国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022 年版)[J]. 临床肝胆病杂志, 2022, 38(2): 288-303. DOI: 10.3969 /j.issn.1001-5256.2022.02.009.
[3]SUN Z, SHAO WW, SONG JH. Progress in diagnosis and treatment of hepatocellular carcinoma with microvascular invasion[J/OL]. Chin J Hepat Surg(Electronic Edition), 2021, 10(3): 235-241. DOI: 10.3877/cma.j.issn.2095-3232.2021.03.002.
孫振, 邵巍伟, 宋京海. 肝细胞癌合并微血管侵犯的诊疗进展[J/OL]. 中华肝脏外科手术学电子杂志, 2021, 10(3): 235-241. DOI: 10.3877/cma.j.issn.2095-3232.2021.03.002.
[4]WANG KJ, HUANG ZH, SHI QL, et al. Research progress of precise hepatectomy for hepatocellular carcinoma[J]. China Med Herald, 2021, 18(23): 43-46.
王克净, 黄祖鸿, 石清兰, 等. 肝细胞癌精准肝切除的研究进展[J]. 中国医药导报, 2021, 18(23): 43-46.
[5]RIPAMONTI L, DE CARLIS R, LAUTERIO A, et al. Major hepatectomy for perihilar cholangiocarcinoma in elderly patients: is it reasonable?[J]. Updates Surg, 2022, 74(1): 203-211. DOI: 10.1007/s13304-021-01111-6.
[6]HOJO A, NAKAYAMA H, OKAMURA Y, et al. Evaluation of safety-related outcomes of one-segment and more-than-one-segment high-level hepatectomy in hepatocellular carcinoma based on the japanese board certification system[J]. World J Surg, 2022, 46(5): 1141-1150. DOI: 10.1007/s00268-022-06467-3.
[7]JUNRUNGSEE S, SUWANNIKOM K, TIYAPRASERTKUL W, et al. Efficacy and safety of infrahepatic inferior vena cava clamping under controlled central venous pressure for reducing blood loss during hepatectomy: A randomized controlled trial[J]. J Hepatobiliary Pancreat Sci, 2021, 28(7): 604-616. DOI: 10.1002/jhbp.969.
[8]SHI HZ, XIONG QR, XIA J, et al. Application of controlled low central venous pressure in laparoscopic hepatectomy for patients with primary liver cancer and posthepatitis cirrhosis[J]. Chin J Gen Surg, 2020, 29(1): 27-34. DOI: 10.7659/j.issn.1005-6947.2020.01.004.
史惠中, 熊奇如, 夏俊, 等. 控制性低中心静脉压在原发性肝癌伴肝炎后肝硬化患者腹腔镜肝切除中的应用 [J]. 中国普通外科杂志, 2020, 29(1): 27-34. DOI: 10. 7659 /j. issn. 1005-6947. 2020. 01. 004.
[9]WU G, CHEN M, WANG X, et al. Effect of remote ischemic preconditioning on hepatic ischemia-reperfusion injury in patients undergoing liver resection: a randomized controlled trial[J]. Minerva Anestesiol, 2020, 86(3): 252-260. DOI: 10.23736/S0375-9393.19.13838-2.
[10]TEO JY, HO A, BULLUCK H, et al. Effect of remote ischemic preConditioning on liver injury in patients undergoing liver resection: the ERIC-LIVER trial[J]. HPB(Oxford), 2020, 22(9): 1250-1257. DOI: 10.1016/j.hpb.2019.12.002.
[11]HIRAO H, NAKAMURA K, KUPIEC-WEGLINSKI JW. Liver ischaemia-reperfusion injury: a new understanding of the role of innate immunity[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(4): 239-256. DOI: 10.1038/s41575-021-00549-8.
[12]LIU JD, ZHANG LQ, SHI MZ, et al. Protective effects of modified limb remote ischemic preconditioning on myocardial injury in patients undergoing mitral valve replacement surgery[J]. Chin Circulation J, 2019, 34(3): 272-275. DOI: 10.3969/j.issn.1000-3614.2019. 03.012.
刘金东, 张连芹, 石夢竹, 等. 改良肢体远端缺血预处理对二尖瓣置换术患者心肌损伤的保护作用[J]. 中国循环杂志, 2019, 34(3): 272-275. DOI: 10.3969/j.issn.1000-3614.2019. 03.012.
[13]GORJIPOUR F, SAEEDZADEH T, TOLOUEITABAR Y, et al. Remote ischemic preconditioning effects on inflammatory markers and myocardial protection in coronary artery bypass graft surgery[J]. Perfusion, 2022, 37(1): 56-61. DOI: 10.1177/0267659120979293.
[14]XIA J, JIA R, QIAN YB, et al. Safety and efficacy of the controlled first hepaticportal blood flow occlusion in hepatectony [J]. Chin J Hepatobiliary Sury, 2021, 27(12): 889-893. DOI: 10.3760/cma.j.cn113884-20210429-00150.
夏俊, 賈冉, 钱叶本, 等. 控制性第一肝门阻断法在肝切除手术中的安全性和有效性 [J]. 中华肝胆外科杂志, 2021, 27(12): 889-893. DOI: 10.3760/cma.j.cn113884-20210429-00150.
[15]LIU XZ, LI MY, REN CN, et al. Specific measures to achieve controlled low central venous pressure during partial hepatectomy[J]. Chin J Hepatobiliary Surg, 2020, 26(6): 469-471. DOI: 10.3760/cma.j.cn113884-20200302-00106.
刘秀珍, 李明颖, 任超楠, 等. 大部肝切除术中实现控制性低中心静脉压的具体措施[J]. 中华肝胆外科杂志, 2020, 26(6): 469-471. DOI: 10.3760/cma.j.cn113884-20200302-00106.
[16]LIU TS, SHEN QH, ZHOU XY, et al. Application of controlled low central venous pressure during hepatectomy: A systematic review and meta-analysis[J]. J Clin Anesth, 2021, 75: 110467. DOI: 10.1016/j.jclinane.2021.110467.
[17]PAN YX, WANG JC, LU XY, et al. Intention to control low central venous pressure reduced blood loss during laparoscopic hepatectomy: A double-blind randomized clinical trial[J]. Surgery, 2020, 167(6): 933-941. DOI: 10.1016/j.surg.2020.02.004.
[18]SHI XD, LI BB. Application of controlled low central venous pressure in hepatectomy[J]. J Clin Anesthesiol, 2021, 37(8): 871-874. DOI: 10.12089 /jca. 2021. 08. 019.
石雪朵, 李冰冰. 控制性低中心静脉压在肝脏切除术中的应用[J]. 临床麻醉学杂志, 2021, 37(8): 871-874. DOI: 10.12089 /jca. 2021. 08. 019.
[19]LU JC. Application of dobutamine combined with nitroglycerin in ppartial hepatic resection under low central venous pressure[D]. Guangzhou: Guangzhou Medical University, 2020.
卢基成. 多巴酚丁胺联合硝酸甘油在控制性低中心静脉压下肝部分切除手术的应用[D]. 广州: 广州医科大学, 2020.
[20]ZHANG H, ZHANG T, ZHONG F, et al. Effects of remote ischemic preconditioning on liver injury following hepatectomy: a systematic review and meta-analysis of randomized control trials[J]. Surg Today, 2021, 51(8): 1251-1260. DOI: 10.1007/s00595-020-02205-1.
[21]WU J, YU C, ZENG X, et al. The hepatoprotective effect from ischemia-reperfusion injury of remote ischemic preconditioning in the liver related surgery: a meta-analysis[J]. ANZ J Surg, 2022, 92(6): 1332-1337. DOI: 10.1111/ans.17236.
[22]MURRY CE, JENNINGS RB, REIMER KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J]. Circulation, 1986, 74(5): 1124-1136. DOI: 10.1161/01.cir.74.5.1124.
[23]PRZYKLENK K, BAUER B, OVIZE M, et al. Regional ischemic ‘preconditioning protects remote virgin myocardium from subsequent sustained coronary occlusion[J]. Circulation, 1993, 87(3): 893-899. DOI: 10.1161/01.cir.87.3.893.
[24]STANKIEWICZ R, GRT M. Direct, remote and combined ischemic conditioning in liver surgery[J]. World J Hepatol, 2021, 13(5): 533-542. DOI: 10.4254/wjh.v13.i5.533.
[25]LIU A, FANG H. Ischemic preconditioning on liver ischemia reperfusion injury: How far is the bedside from the bench?[J]. J Invest Surg, 2020, 33(9): 884-885. DOI: 10.1080/08941939.2019.1578443.
[26]JAKUBAUSKIENE L, JAKUBAUSKAS M, STIEGLER P, et al. Ischemic preconditioning for liver transplantation: A systematic review and meta-analysis of randomized controlled trials[J]. Visc Med, 2021, 37(5): 329-337. DOI: 10.1159/000516608.
[27]KOH WU, KIM J, LEE J, et al. Remote ischemic preconditioning and diazoxide protect from hepatic ischemic reperfusion injury by inhibiting HMGB1-induced TLR4/MyD88/NF-κB signaling[J]. Int J Mol Sci, 2019,
20(23): 5899. DOI: 10.3390/ijms20235899.
[28]JULIA S, PETER S, KARL-HEINZ W, et al. Possible role of the HMGB1 and RAGE inflammatory pathway in primary sclerosing cholangitis[J]. Clin Res Hepatol Gastroenterol, 2022, 46(2): 101791. DOI: 10.1016/j.clinre.2021.101791.
[29]LIU JH, JIANG W, SHI G, et al. Effect of ischemic preconditioning on liver and kidney function in surgery for large vessels [J]. Chin J Gen Prac, 2019, 17(2): 190-192, 208. DOI: 10.16766/j.cnki.issn.1674-4152.000636.
劉建华, 蒋伟, 石光, 等. 大血管手术中应用缺血预处理对肝肾功能的影响 [J]. 中华全科医学, 2019, 17(2): 190-192, 208. DOI: 10.16766/j.cnki.issn.1674-4152.000636.
[30]SONG IA, JANG ES, OH TK. Validation of dynamic aspartate-to-alanine aminotransferase ratio for predicting liver disease mortality[J]. Hepatol Commun, 2022, 6(4): 740-749. DOI: 10.1002/hep4.1844.
[31]KOBAYASHI D, YAMAMOTO K, KIMURA T, et al. Aspartate aminotransferase/alanine aminotransferase ratio and subsequent cancer development[J]. Cancer Med, 2022, 11(3): 798-814. DOI: 10.1002/cam4.4473.
[32]LIU X, CAO L, ZHANG T, et al. Effect of remote ischemic preconditioning in patients undergoing hepatectomy with portal triad clamping: A randomized controlled trial[J]. Anesth Analg, 2019, 129(6): 1742-1748. DOI: 10.1213/ANE.0000000000004434.
[33]OUYANG S, OUYANG L, LI Y, et al. Bone marrow-derived stem cells for patients with liver cirrhosis: A systematic review and meta-analysis[J]. Turk J Gastroenterol, 2021, 32(10): 896-906. DOI: 10.5152/tjg.2021.19694.
收稿日期:
2022-08-26;录用日期:2022-09-26
本文编辑:王亚南
