麝香草酚对藤黄微球菌的抑菌活性及其作用机制
2023-04-29齐琦田露杨思琪龚国利
齐琦 田露 杨思琪 龚国利
摘 要:藤黄微球菌是一种条件致病菌,不仅会感染养殖水产品,还会导致人体感染.麝香草酚作为一种绿色、天然、高效的植物源抗菌剂,具有良好的抑菌活性.本研究在细胞水平上探究了麝香草酚对藤黄微球菌的生长、细胞膜通透性以及细胞形态等多方面的影响.结果表明,麝香草酚对藤黄微球菌的最小抑菌浓度为0.31 mg/mL,在该浓度下藤黄微球菌的细胞膜电位、胞内ATP、DNA完整性、胞内pH分别降低了4.79、49.90、0.40、0.56倍,胞内活性氧增加了0.36倍,并通过CLSM和SEM进一步观察到细胞膜皱缩、破损.揭示了麝香草酚对藤黄微球菌的抑菌活性及可能的抑菌机制,为麝香草酚作为天然抗菌剂提供理论支撑.
关键词:麝香草酚;藤黄微球菌;抑菌活性
中图分类号:TS201.3
文献标志码: A
文章编号:2096-398X(2023)04-0064-06
Abstract:Micrococcus garciniae is a conditionally pathogenic bacterium that not only infects farmed aquatic products,but also causes infections in humans.Thymol,as a green,natural and highly effective plant-derived antimicrobial agent,has good antibacterial activity.In this study,the effects of muscimol on the growth,cell membrane permeability and cell morphology of M.garciniae were investigated at the cellular level.The results showed that the minimum inhibitory concentration of thymol on M.garciniae was 0.31 mg/mL,at which the cell membrane potential,intracellular ATP,DNA integrity and intracellular pH of M.garciniae decreased by 4.79,49.90,0.40 and 0.56-fold,respectively,and the intracellular reactive oxygen species increased by 0.36-fold,and further cell membrane wrinkling and breakage was observed by CLSM and SEM.The antibacterial activity of thymol against M.garciniae and the possible mechanism of inhibition were revealed,providing theoretical support for thymol as a natural antibacterial agent.
Key words:thymol; Micrococcus garciniae; antibacterial activity
0 引言
藤黃微球菌属于微球菌属,在自然界中广泛存在,在人和其他哺乳动物的皮肤上可分离得到.当机体抵抗力下降时,藤黄微球菌可能会引发如脑脊液感染、脑膜炎、脊髓感染、藤黄微球菌关节炎等疾病[1-3].研究表明,黄褐斑患者的面部藤黄微球菌数量高于正常人[4].藤黄微球菌还会导致黄鳝出血病,造成经济损失[5].在过去的二十年中,由于不规范地使用抗生素,以及遗传耐药性成分的不断演变和传播,导致多种多重耐药(MDR)甚至极端耐药(XDR)细菌病原体出现,增加了患者的发病率、死亡率和医疗成本[6].而天然产物所具备的低毒、无公害和无抗药性等优势,使其被开发为新型抗菌剂并对解决当前抗生素危机提供了新思路[7].
麝香草酚又称百里酚,是伞花烃的天然酚单萜衍生物和香芹酚的异构体,具有抗菌、抗氧化、抗癌、抗炎和解痉活性,以及作为生长促进剂和免疫调节剂的潜力[8].据报道,麝香草酚可抑制食源性病原体生长,例如产气荚膜梭菌、大肠杆菌和李斯特菌[9,10].主要机制是通过降低细胞质膜上的pH使其去极化.pH梯度的降低也会对质子动力产生不利影响,导致细胞内ATP的消耗,从而导致细胞死亡[11,12].Khan等[13]发现,麝香草酚会诱导变形链球菌的自溶和应激,诱导提升自溶素基因(atlE)和超氧化物歧化酶基因(sodA)的表达水平.此外,Ranjbar等[14]发现麝香草酚还具有抗真菌活性,表现为通过降低细胞壁降解酶的活性,抑制石榴果实腐烂真菌的生长.然而目前还缺乏有关麝香草酚对藤黄微球菌的抑菌活性和其作用机制的研究.
本文通过测定麝香草酚对藤黄微球菌的最小抑菌浓度、生长曲线、膜电位、胞内ATP水平、胞内活性氧含量、DNA完整性和胞内pH,同时通过激光共聚焦扫描显微镜(CLSM)和场发射扫描电镜(SEM)观察细胞膜完整性和细胞形态,探究麝香草酚对藤黄微球菌的抑制作用和可能的机制,为麝香草酚作为新型抗菌剂提供可靠的理论依据.
1 材料与方法
1.1 材料及仪器
1.1.1 菌株和培养物
藤黄微球菌(BNCC 103930),购自北京细菌培养保藏中心(China BNCC),储存于-80 ℃.
1.1.2 主要试剂
麝香草酚(纯度>98%)、2′,7′-二氯荧光素(上海生工生物工程股份有限公司),磷酸缓冲盐(北京索莱宝科技有限公司),LB肉汤培养基(北京奥博星生物技术有限责任公司),DiBAC4(3)(美国sigma公司),SYTO 9/PI试剂盒(赛默飞世尔科技公司),ATP检测试剂盒(上海碧云天生物技术有限公司).
1.1.3 主要仪器
BS210S电子天平(上海天平仪器厂),DZF-6050真空干燥箱、THZ-98A恒温振荡器(上海一恒科学仪器有限公司),TGL20M台式高速离心机(长沙英泰仪器有限公司),Synergy H1多功能酶标仪(BT2),LSM800激光共聚焦扫描显微镜(德国卡尔蔡司),MLA场发射扫描电子显微镜(美国FEI).
1.2 实验方法
1.2.1 菌悬液的制备
将保藏在-80 ℃冰箱中的菌株用平板划线法接种在LB固体平板上,置于37 ℃恒温培养箱中培养12 h.挑取单菌落于LB肉汤培养基中活化,即可获得藤黄微球菌的菌悬液.
1.2.2 麝香草酚对藤黄微球菌最小抑菌浓度(Minimum inhibition concentration,MIC)测定
根据1.2.1节的方法制备OD600为0.5(约108 CFU/mL)的菌悬液.本实验在96孔板中采用微量稀释法测定,先将麝香草酚溶解于无水乙醇中,制成100 mg/mL的母液,在96孔板中加入菌悬液和母液,使麝香草酚的终浓度为5.00 mg/mL、2.50 mg/mL、1.25 mg/mL、0.63 mg/mL、0.31 mg/mL、0.16 mg/mL和0.08 mg/mL,以不含麝香草酚的实验组为阴性对照组,以终浓度为10 mg/mL的氨苄青霉素钠的实验组为阳性对照组.混合均匀后,将孔板进行恒温培养,用酶标仪测定600 nm处的吸光值,并结合肉眼观察.
1.2.3 麝香草酚对藤黄微球菌的生长曲线的影响
根据1.2.1节中的方法制备菌悬液.经1.2.2节测定得到MIC值后,在96孔板中加入菌悬液和母液,使麝香草酚的终浓度为2 MIC、MIC 、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC,同时以不含麝香草酚的实验组作为对照组.每隔1 h用酶标仪测定600 nm处的吸光值,共检测24 h,并绘制生长曲线.
1.2.4 麝香草酚对藤黄微球菌膜电位的影响
根据1.2.1节中的方法制备菌悬液.离心收集菌体沉淀,用PBS洗涤菌体并重悬,加入母液后使麝香草酚的终浓度为0、MIC和2 MIC,培养2 h后离心收集菌体沉淀,洗涤并重悬后加入3 mM DiBAC4(3)膜电位荧光探针,避光孵育30 min,分别吸取200 μL加入到黑色96孔板中.多功能酶标仪测定荧光强度(激发波长=492 nm,发射波长=515 nm).
1.2.5 麝香草酚对藤黄微球菌胞内ATP的影响
方法同1.2.4节,得到麝香草酚处理并用PBS洗涤的菌体沉淀后,使用ATP检测试剂盒测定细菌胞内ATP含量.
1.2.6 麝香草酚对藤黄微球菌胞内活性氧(Reactive-oxygen species,ROS)的影响
方法同1.2.4节,得到麝香草酚处理并用PBS洗涤的菌体沉淀后,加入100 μL的10 mM的2′,7′-二氯荧光素,避光孵育1 h,离心并用PBS洗涤菌体沉淀后重悬.各吸取200 μL加入到黑色96孔板中,测定荧光强度(激发波长=498 nm,发射波长=520 nm).
1.2.7 麝香草酚對藤黄微球菌DNA完整性的影响
方法同1.2.4节,向PBS重悬的菌悬液中加入1.5 μL的SYTO 9荧光探针,避光孵育15 min,分别吸取200 μL加入到黑色96孔板中,测定荧光强度(激发波长=485 nm,发射波长=525 nm).
1.2.8 麝香草酚对藤黄微球菌pHin的影响
根据1.2.1节中的方法制备OD600为0.5(约108 CFU/mL)的菌悬液,离心后用磷酸钾溶液洗涤菌体并重悬,加入3 mM cFDA-SE荧光探针后孵育20 min,洗涤菌体并离心.用10 mM葡萄糖溶液重悬菌体30 min以去除未结合的cFSE荧光探针.PBS洗涤后重悬,加入母液使麝香草酚的终浓度为0、MIC和2 MIC.培养2 h后分别吸取200 μL加入到黑色96孔板中,测定荧光强度(激发波长=490/440 nm,发射波长=515 nm).
测定不同pH溶液负载荧光探针后的荧光强度,将激发波长在490 nm和440 nm下的荧光比值与藤黄微球菌的pHin构建校准曲线.用NaOH/HCl调节缓冲溶液的pH值至3、4、5、6、7、8、9和10.用缬氨霉素(10 μM)平衡细胞的pH值使pHin等于pHout.最后测定荧光强度,并根据标准曲线计算细菌样品的pH值.
1.2.9 麝香草酚对藤黄微球菌细胞膜完整性的影响
方法同1.2.4节,得到麝香草酚处理的菌体沉淀,用PBS洗涤并重悬,向菌悬液中按1∶1(v/v)加入3 μL的SYTO 9和PI荧光探针,避光孵育15 min,用PBS洗涤并重悬.吸取2-3 μL菌悬液滴加在载玻片上,通过CLSM观察其荧光颜色的变化,拍照保存.
1.2.10 麝香草酚对藤黄微球菌细胞形态的影响
方法同1.2.4节,得到麝香草酚处理并用PBS洗涤后的菌体沉淀.用2.5%(v/v)戊二醛在冰箱(4 ℃)固定过夜,PBS洗涤菌体,将无水乙醇稀释为30%、50%、60%、70%、80%、90%和100%的梯度浓度,逐步脱水(每个梯度处理10 min).用乙酸异戊酯重悬菌体30 min后离心.烘箱干燥后通过导电胶将菌体粘附在样品台上,溅射喷金,通过SEM观察细胞形态的变化,拍照保存.
2 结果与讨论
2.1 麝香草酚对藤黄微球菌的最小抑菌浓度
最小抑菌浓度是指培养细菌18 h后能抑制病原菌生长的最低药物浓度.由图1可见,当麝香草酚的浓度<0.31 mg/mL时,18 h后600 nm处的吸光度值均已超过0.5,且培养液出现浑浊,说明细菌进行了生长繁殖;当麝香草酚的浓度≥0.31 mg/mL时,吸光度值均低于0.5,与阳性对照组的数值相当,且培养液相对清澈,说明细菌的生长受到了抑制.结果表明,麝香草酚对藤黄微球菌具有抑制作用,其MIC约为0.31 mg/mL.
2.2 麝香草酚对藤黄微球菌生长曲线的影响
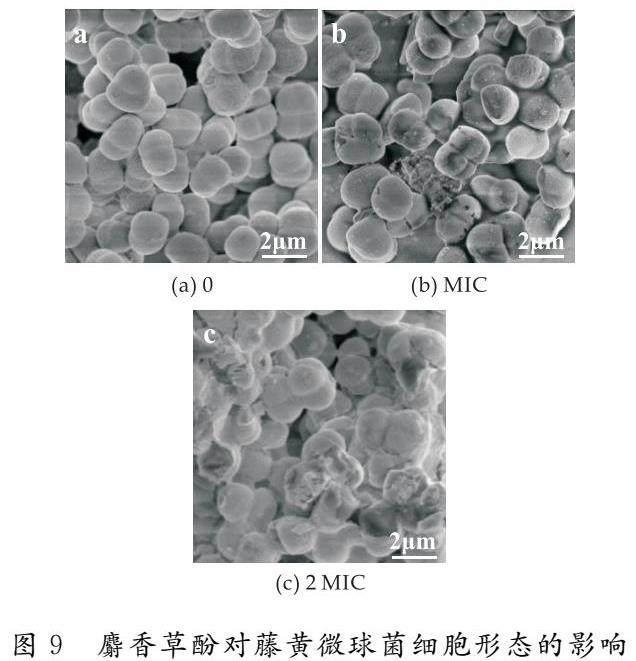
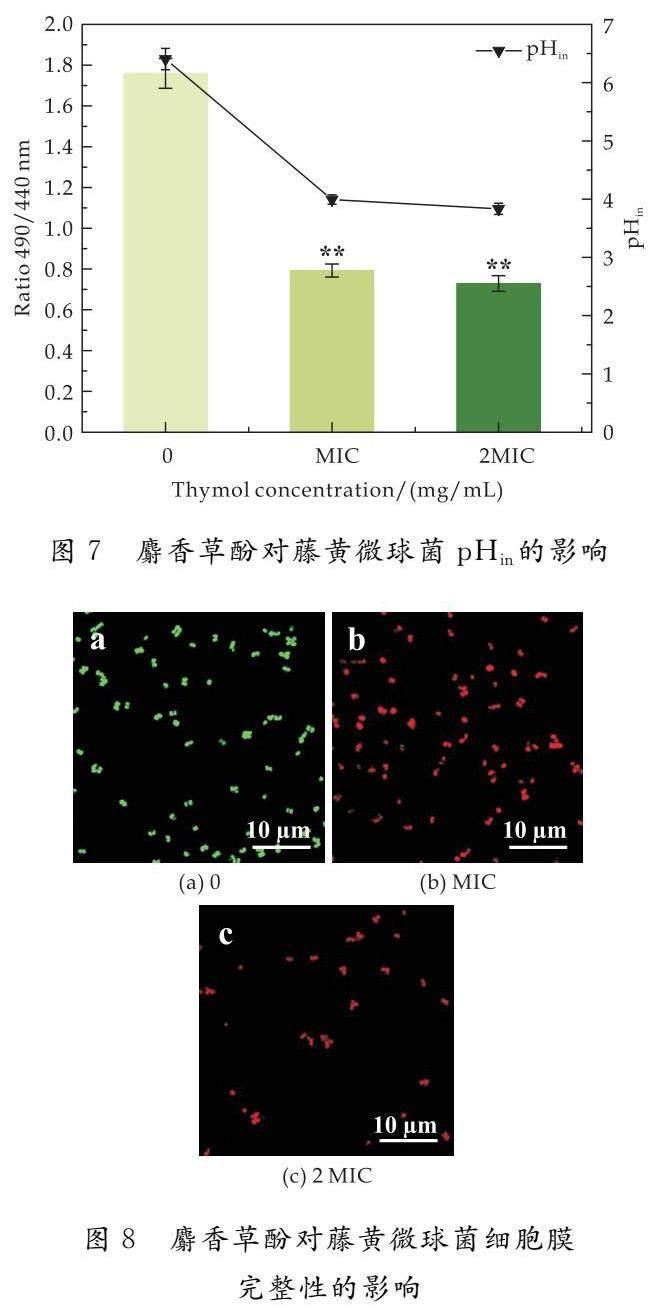
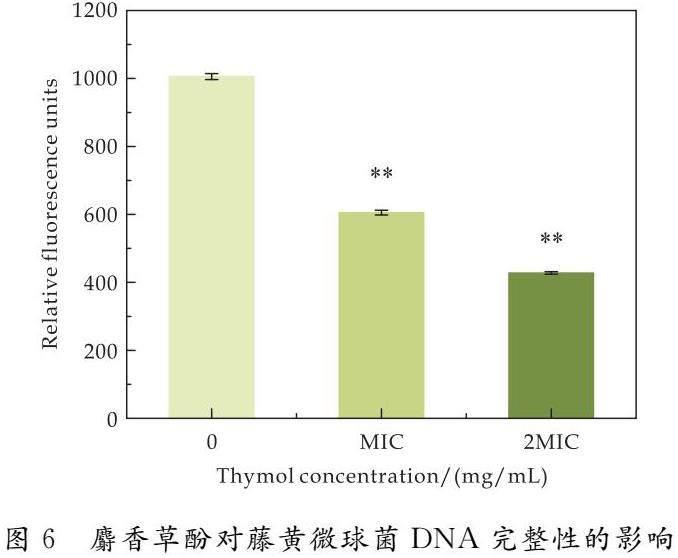
生长曲线是指培养细菌时,以OD600为纵坐标,以时间为横坐标作图得到的曲线.由图2可知,在0~3 h为藤黄微球菌的生长迟缓期,此时期各浓度下的吸光度未出现明显差异.在3~10 h内,浓度 2.3 麝香草酚对藤黄微球菌膜电位的影响 膜电位是指生物细胞膜内外的电位差,由图3可见,与对照组相比,经过麝香草酚处理2 h后,藤黄微球菌的细胞膜电位显著降低.对照组的藤黄微球菌膜电位为2775,MIC组为-10 509,2 MIC组为-13 614,分别降低了4.79和5.91倍,表明麝香草酚引起了藤黄微球菌细胞膜的超极化,这可能会改变钾离子通道的活性并导致其泄露,从而干扰菌体的正常生命活动. 2.4 麝香草酚对藤黄微球菌胞内ATP的影响 胞内ATP是细胞内最重要的能量分子,参与细胞的各种生命活动.由图4可见,对照组的ATP含量为728,经MIC和2 MIC处理后的细菌胞内ATP分别为14.3和7.0,分别下降了49.90倍和103倍.说明经麝香草酚处理后,藤黄微球菌的胞内ATP浓度显著降低.胞内ATP的显著降低,可能是麝香草酚增加了藤黄微球菌的细胞膜的通透性,引起ATP的大量泄露;也可能是其影响了细菌胞内ATP的正常合成和代谢,导致胞内ATP的快速消耗或抑制了ATP的合成,最终紊乱菌体的正常生命活动,甚至导致菌体的死亡. 2.5 麝香草酚对藤黄微球菌胞内ROS的影响 ROS是氧正常代谢的天然副产物,在恶劣条件下,ROS水平会急剧增加.2′,7′-二氯荧光素二乙酸酯是一种可渗透细胞的荧光探针,可定量ROS变化,用于评估毒理学中的整体氧化应激. 如图5所示,对照组的ROS含量为979,经MIC和2 MIC浓度处理2 h后,藤黄微球菌的ROS含量分别为1 540和1 824,分别增加了0.36倍和0.46倍.表明麝香草酚会诱导细菌发生氧化应激,导致胞内ROS过量积累进而氧化损伤. 2.6 麝香草酚对藤黄微球菌DNA完整性的影响 如图6所示,对照组荧光强度为1 006,而经MIC和2 MIC浓度处理2 h后,藤黄微球菌的荧光强度分别为605和428,分别降低了0.40倍和0.57倍.SYTO 9是一种可以和DNA小沟结合的荧光染料,荧光强度越高,则DNA的完整度越高.表明随麝香草酚处理浓度增加,可与SYTO 9结合的DNA被降解或结构被破坏,荧光强度逐渐降低.DNA损伤会抑制细菌的正常增殖和代谢,甚至导致菌体死亡. 2.7 麝香草酚对藤黄微球菌pHin的影响 荧光探针cFDA-SE易被细胞质中的脂酶水解,水解产物会发出绿色荧光,且在490 nm和440 nm处的荧光强度比值与pH呈现良好的线性关系,通过计算荧光强度比值,并与pH标准曲线进行构建,可以获得荧光强度比值与pHin的校准曲线:y=1.380 5x-2.001 3,R2=0.987 7. 如图7所示,未经处理的藤黄微球菌pHin为1.8,而经过MIC和2 MIC浓度处理2 h后,其pHin值为0.8和0.7,分别降低了0.56倍和0.61倍.pH降低说明处理后的细胞内氢离子大量积累,导致离子通道的干扰和关闭,从而影响细胞膜的通透性和正常的生长代谢. 2.8 麝香草酚对藤黄微球菌细胞膜完整性的影响 图 8(a)表示对照组的藤黄微球菌,细胞膜完整从而发出绿色荧光;图8(b)和图8(c)表示经过MIC和2 MIC浓度处理后,细胞膜已不再完整,被PI染色后发出红色荧光.结果表明,经麝香草酚处理后,细菌的细胞膜被破坏,导致细菌死亡.本实验采用SYTO 9和PI双荧光染料染色法,SYTO 9透过活细胞膜,与完整的DNA结合,发出绿色荧光;PI只能通过破损的细胞膜,标记死细胞并发出红色荧光.用两个荧光探针同时浸染细菌,并在CLSM下观察荧光,可区分细胞膜完整和破损的细菌. 2.9 麝香草酚对藤黄微球菌细胞形态的影响 通过SEM进一步研究了麝香草酚对细胞形态的影响.如图9(a)所示,对照组中细胞结构完整,细胞膜表面圆滑规整;图9(b)为MIC处理后的细菌,细胞膜表面出现裂纹,细胞膜被损伤出现创口;图9(c)为2 MIC处理后的细菌,可见大部分细菌的细胞膜和细胞形态都被严重破坏,细胞出现塌陷和皱缩. SEM结果與前文细胞膜渗透性和完整性的研究结果一致,验证了麝香草酚会导致藤黄微球菌细胞膜的结构和功能发生改变,影响细菌的正常生长代谢,进而抑制或杀死细菌. 3 结论 本研究在细胞水平上探究了麝香草酚对藤黄微球菌的抑菌活性和可能的抑菌机制.实验结果表明麝香草酚对藤黄微球菌有良好的抑菌作用,其MIC值约为0.31 mg/mL,麝香草酚会使藤黄微球菌的细胞膜发生超极化,诱导细胞发生氧化应激,导致细胞过氧化损伤,破坏细胞膜的通透性和形态,使胞内ATP浓度降低、核酸分子被破坏,细胞出现塌陷和皱缩、细胞膜破 损.本研究结果可为麝香草酚的开发和利用提供理论依据. 参考文献 [1] 陈 玲,姚齐龙.从血液及痰液中均同检出藤黄微球菌1例报道[J].四川省卫生管理干部学院学报,2000,19(2):100. [2] 姜梅杰,魏绪廷.颅脑外伤患者脑脊液中检出藤黄微球菌一例[J].中华神经外科杂志,2005,21(12):735. [3] 刘 英,邹桂玲,孟小玉,等.骨髓培养检出藤黄微球菌1例[J].中华医院感染学杂志,2007,17(8):1 017. [4] 林 敏.黄褐斑患者皮损表面微球菌定植情况研究[D].遵义:遵义医科大学,2020. [5] 彭 彬,杨光友,陈晓利,等.黄鳝藤黄微球菌的分离鉴定及药敏试验[J].上海海洋大学学报,2011,20(3):405-411. [6] Banin E,Hughes D,Kuipers O P.Editorial:Bacterial pathogens,antibiotics and antibiotic resistance[J].FEMS Microbiology Reviews,2017,41(3):450-452. [7] Dai J,Han R,Xu Y,et al.Recent progress of antibacterial natural products:Future antibiotics candidates[J].Bioorganic Chemistry,2020,101:1-25. [8] Salehi B,Mishra A P,Shukla I,et al.Thymol,thyme,and other plant sources:Health and potential uses[J].Phytotherapy Research,2018,32(9):1 688-1 706. [9] Du E,Gan L,Li Z,et al.In vitro antibacterial activity of thymol and carvacrol and their effects on broiler chickens challenged with Clostridium perfringens[J].Journal of Animal Science and Biotechnology,2015,6:58-70. [10] Guarda A,Rubilar J F,Miltz J,et al.The antimicrobial activity of microencapsulated thymol and carvacrol[J].International Journal of Food Microbiology,2011,146(2):144-150. [11] Ultee A,Bennik M H,Moezelaar R.The phenolic hydroxyl group of carvacrol is essential for action against the food-borne pathogen Bacillus cereus[J].Applied and Environmental Microbiology,2002,68(4):1 561-1 569. [12] Xu J,Zhou F,Ji B P,et al.The antibacterial mechanism of carvacrol and thymol against Escherichia coli[J].Letters in Applied Microbiology,2008,47(3):174-179. [13] Khan S T,Khan M,Ahmad J,et al.Thymol and carvacrol induce autolysis,stress,growth inhibition and reduce the biofilm formation by Streptococcus mutans[J].AMB Express,2017,7(1):49-60. [14] Ranjbar A,Ramezanian A,Shekarforoush S,et al.Antifungal activity of thymol against the main fungi causing pomegranate fruit rot by suppressing the activity of cell wall degrading enzymes[J].LWT-Food Science and Technology,2022,161:1-15. 【责任编辑:蒋亚儒】 基金项目:陕西省教育厅专项科研计划项目(21JK0541);陕西省咸阳市秦创原科技创新专项项目(2021ZDZX-NY-0007) 作者简介:齐 琦(1997—),女,陕西咸阳人,在读硕士研究生,研究方向:天然食品防腐剂 通讯作者:田 露(1989—),女,陜西榆林人,副教授,博士,研究方向:微生物代谢产物分离及鉴定 tianlu@sust.edu.cn
