一种小鼠背根神经节原代神经元细胞分离与培养的优化方法
2023-04-29张皞晟王培民
张皞晟 王培民

【摘要】 目的 探索一种可以大量快速培养活力好且卫星胶质细胞污染少的原代神经元细胞的方法。方法 混合酶溶液消化体式显微镜下提取的背根神经节(DRG),随后接种于纤维连接蛋白提前包被的培养皿中,8 h后更换含5-氟尿嘧啶的维持培养基,抑制非神经元细胞增殖。结果 分离培养的感觉神经元细胞在培养过程中可维持15 d左右,部分细胞可维持更长时间。原代细胞于第3天即可观察到交错的轴突网络,接种细胞密度大,卫星胶质细胞污染情况少,细胞在7 d之内可投入使用,操作者经短时间训练后即可快速掌握方法。结论 新方法在传统方法的基础上进行了改良,可获取较多数量细胞活性好、纯度高的原代神经元细胞,相较传统方法具有可操作性高,重复率高的优势。
【关键词】 背根神经节;神经元细胞;细胞培养;TRPA1
【中图分类号】 Q813.1+1;R651 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0189-06
Abstract:Objective To explore a method that can rapidly cultivate a large number of primary neurons with good vitality and less pollution of satellite glial cells. Methods Dorsal root ganglion(DRG) extracted under microscope was digested with mixed enzyme solution, and then inoculated into fibronectin coated culture dish. After 8 hours, the maintenance medium containing 5-fluorouracil was changed to inhibit the proliferation of non-neuronal cells. Results The isolated and cultured sensory neuron cells could last for about 15 days, and some of them could last longer. On the third day, the primary cells could observe the crisscross axon network. The density of the inoculated cells was high, and the pollution of satellite glial cells was less. The cells could be put into use within 7 days. The operator could quickly master the method after a short period of training. Conclusions The new method is improved on the basis of the traditional method, which can obtain a large number of primary neurons with good cell activity and high purity. Compared with the traditional method, the new method has the advantages of high operability and high repetition rate.
Key words: dorsal root ganglion; neuron cell; cell culture; TRPA1
基金项目:国家自然科学基金资助项目(82074460);江苏省自然科学基金(BK20201501)
作者单位:210022 南京,南京大学现代生物研究院(张皞晟);南京中医药大学附属医院骨伤科(王培民)
通信作者:王培民
原代背根神经节(dorsal root ganglion,DRG)感觉神经元被广泛运用于瘙痒[1]、疼痛[2]、神经损伤[3]、神经再生、细胞间相互作用[4]以及轴突运输等方面的研究中。因此原代DRG感觉神经元细胞的提取及培养,为识别新的药物分子靶标、基因功能、代谢差异等提供了材料[5-6],然而如何有效且快速地提取培养原代DRG神经元细胞仍是难题。小鼠DRG原代培养方法多种多样,早期使用小鼠胚胎作为提取DRG感觉神经元的材料,操作难度大、耗时较长,长时间的手术操作增加了污染风险,体式显微镜下DRG提取难度极大,难以批量提取,所用试剂材料较多,耗费较大,耗时也较长[7]。近两年的研究中提出,使用马血清替代胎牛血清,从而抑制非神经元细胞增殖,但神经元的功能与神经元轴突分叉与再生长关联较小,无血清也可满足神经细胞再生需求[8];但成纤维细胞与卫星胶质细胞的存在对神经元生长影响较大。因此,在不影响神经元活性,尽可能减少卫星胶质细胞或成纤维细胞污染[9]的前提下,快速、大量地提取原代DRG感觉神经元细胞,减少实验所需的花销,保证足够密度和数量的神经元细胞,是后续实验成功的前提。在过去的基础上,本研究比较并改良了原代DRG神经元的提取方法,依据此方法,在多脊柱水平培养了DRG内的感觉神经元细胞,并降低了实验的操作难度及时间。培养的原代神经元细胞,可以作为功能和遗传学研究的工具来验证在动物模型中的分子靶点。通过膜片钳记录、钙离子成像、免疫组化、基因敲除和病毒基因转染等实验方法,可以更准确地描述感觉神经元的基本生理特性[10]。这些方法可以帮助研究新的靶受体或通道、细胞内信号转导、细胞间信号传递等[11]。通过微阵列测序、RNA和全基因组测序等先进方法,利用全神经节或原代神经元帮助识别小鼠慢性疼痛和瘙痒的生物标志物已获得一定的成效[12]。此外,原代培養的DRG神经元细胞具有新的治疗干预包括基因治疗和细胞活动的光遗传学和化学遗传学操作的潜力,可应用于疼痛性疾病[13]、神经退行性疾病[14]的病理生理及治疗研究,为特异性药物的研究及运用提供研究目标。
1 资料与方法
1.1 材料 12只C57BL/6小鼠,雌雄不限,8周左右,体质量约20~30 g,由南京中医药大学实验动物中心提供。使用随机数字表法进行动物分组,分为旧方法组与新方法组。
1.2 试剂与仪器
1.2.1 试剂药品 MEM-ALPHA培养基(BI,01-042-1ACS);青霉素-链霉素溶液(HyCLone,SV30031);35 mm细胞培养皿(Nest,706001);Collagenase Type I powder(Thermo,17100-017);人血浆纤维连蛋白(fibronectin human plasma,Sigma,F0895-1MG);脱氧尿嘧啶核苷(5-Fluoro-2′-deoxyuridine,Sigma, F0503-100MG);分散酶(源葉生物,S25046-1g);胎牛血清(FBS)(Gibco);βⅢ-tubulin抗体(Sigma);GFAP抗体(Sigma);荧光二抗(anti-rabbit);荧光二抗(anti-mouse);曲拉通X-100(Triton X-100);DAPI;多聚甲醛;PBS;ddH2O;QuickBlock免疫染色一抗稀释液;QuickBlock免疫染色封闭液;免疫荧光染色二抗稀释液;抗荧光淬灭封片液;TRPA1抗体(Affinity Biosciences);TRPV4抗体(Affinity Biosciences);TRPM8抗体(Affinity Biosciences);tau抗体(Affinity Biosciences),synapsin抗体(Affinity Biosciences)。
1.2.2 实验所用主要仪器 CO2恒温细胞培养箱;体视显微镜;200目细胞筛;倒置式显微镜;荧光显微镜;眼科显微镊子(尖端有齿);普通不锈钢剪刀;显微角膜剪直剪或弯剪(11.5 cm);普通剪刀;镊子;培养皿;流式细胞仪;HCA(Operetta, Perkinelmer,PE)。
1.2.3 用于提取与培养的试剂配置 (1)提取培养基:MEM-ALPHA培养基+2%血清,分装为1 mL溶液并储存在2 mL离心管中,全程置于冰上;(2)混合消化酶:I型胶原酶+分散酶(消化酶与分散酶各取100 mg溶于1 mL PBS或培养基内制成母液,母液浓度为100 mg/mL,使用时稀释成工作液,浓度为5 mg/mL),1 mL工作液装在2 mL离心管置于冰上,分装工作液在-20 ℃保存时间不多于3个月;(3)完全培养基:MEM-ALPHA培养基+10%FBS+1%双抗;(4)Fibronectin:母液浓度为1 mg/mL,工作液:取20 uL溶于1 mL ddH2O;(5)5-Fluoro 1.5 mg/mL,取1 mL溶于100 mL ddH2O;(6)换液培养基:MEM-ALPHA培养基+5%FBS+1%双抗+1% 5-Fluoro。
1.3 方法 小鼠DRG原代神经元的提取与培养,拟使用两种方法提取原代DRG神经元细胞。方法一参考任旺等的研究[7],改良方法如下。
1.3.1 实验前准备 在培养皿中滴加1 mL Fibronectin溶液提前包被培养皿,于37 ℃恒温培养箱中浸泡1 h,浸泡开始20 min后可以进行DRG原代提取实验。浸泡开始后即刻准备75%乙醇溶液用于小鼠消毒,提取培养基以临时储存DRG,混合消化酶溶液用于后续操作,准备妥当后可进行下一步实验。
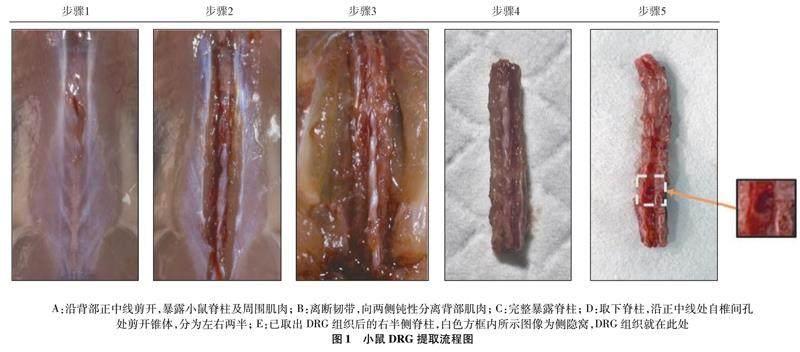
1.3.2 小鼠DRG的分离 小鼠备皮,脱颈处死,待完全死亡后置入提前预冷的75%乙醇溶液浸泡消毒3~5 min,待消毒完毕,沿背部正中线剪开小鼠皮肤,向两侧钝性分离小鼠背部筋膜,此时可见小鼠背部白色韧带组织,手术刀片沿韧带棘突交界处迅速离断韧带,随后使用刀柄向两侧钝性分离小鼠背部肌肉群,露出肌肉下附着于横突的韧带,刀片分离后,迅速清理周围肌肉组织,刀片离断脊柱,取出脊柱后,含双抗PBS冲洗,清除多余血液及影响视野的肌肉。
以下操作均在体视显微镜下操作,清洗脊柱后沿正中线自椎间孔处剪开锥体,分为左右两半;必要时剪去棘突以方便分离锥体,清理椎间孔内的脊髓组织与神经纤维,注意动作轻柔缓慢,以防误将DRG连同脊髓组织与神经纤维一同清理;使用吸入PBS注射器冲洗椎间孔,清理多余血液,即可见侧隐窝;DRG处于侧隐窝内,为淡黄色结节状组织,两端均有神经纤维组织,使用带齿眼科显微镊摄取DRG组织,轻轻提起后使用显微角膜剪(直剪或弯剪)剪断两端神经纤维;修理多余神经纤维后,将DRG置于提取培养基内;以相同方法摄取剩余DRG组织,提取过程中提取培养基全程置于冰上。见图1。每只小鼠至少提取20个的DRG。
提取后,缓慢吸弃1.5 mL离心管中的提取培养基,加入混合消化酶工作液1 mL,水浴消化60~70 min,每10 min颠倒摇匀一次,注意动作轻柔。消化完成后,吸弃混合消化酶,加入完全培养基1 mL,枪头吹打18下,此时经消化的DRG组织分散,试管内组织肉眼难见,含DRG细胞溶液过200目细胞筛清除杂质,随后使用1 mL完全培养基冲洗筛子一次, 1 000 rpm离心8.5 min。离心过程中取出事先准备好的Fibronectin溶液包被的培养皿,吸取Fibronectin溶液(可重复使用2~3次),2 mL ddH2O清洗培养皿3次,最后一次清洗后ddH2O留在培养皿内,防止培养皿过于干燥,待种板时吸弃。离心结束后,1 mL枪头吸弃离心管液体,注意不要吸入底部沉淀,加入1 mL完全培养基重悬溶液,洗弃培养皿内ddH2O,计数后种入35 mm培养皿内;随后另补1 mL完全培养基,37 ℃ 5%CO2恒温培养箱培养8~12 h。8~12 h后,使用“换液培养基”维持细胞生长,换液培养基内含有5-氟尿嘧啶用于抑制卫星胶质细胞增殖,同时对非增殖性细胞(神经元细胞)影响较小,随后2~3 d更换培养基的1/2,最多取用存活15 d的DRG神经元,培养时宜用35 mm培养皿以保持神经元细胞的密度,维持神经元细胞之间的突触的高效连接。部分培养至第6天的DRG原代神经元细胞使用LPS(5 μg/mL)干预8 h,用于后续高内涵细胞成像拍摄免疫荧光图片。
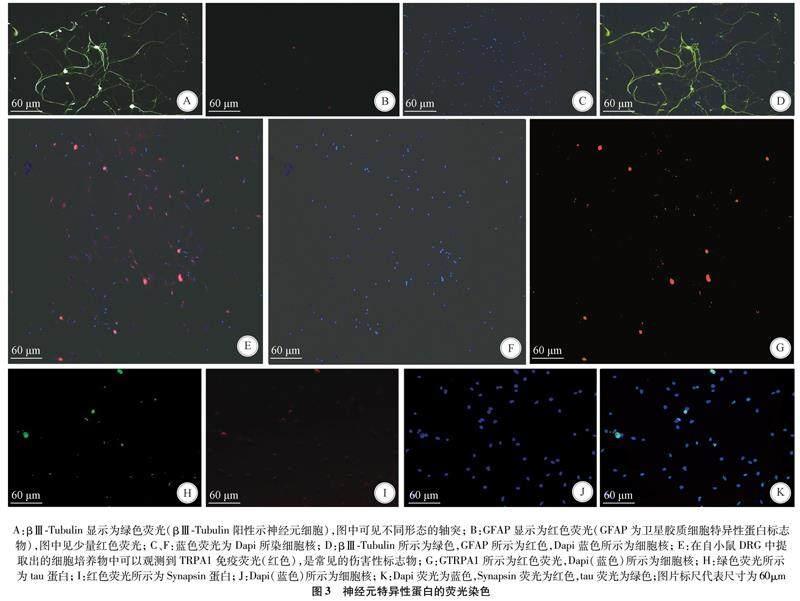
1.3.3 免疫荧光染色 按上述方法提取培养DRG原代神经元细胞,分别在种板后的第3天、第5天及第7天进行神经元特异性的免疫荧光染色。一抗选取βⅢ-tubulin抗体与GFAP抗体。完全吸弃培养基,取1 mL的PBS溶液清洗培养皿(3次),Triton X-100孵育细胞,取1 mL的PBS溶液清洗培养皿(3次),2 mL 4%多聚甲醛固定细胞,取1 mL的PBS溶液清洗培养皿(3次)。配置βⅢ-tubulin与GFAP一抗(QuickBlock免疫染色一抗稀释液配置),4 ℃冷库孵育过夜,次日取1 mL的PBS溶液清洗培养皿(3次),取适量QuickBlock免疫染色封闭液,37 ℃封闭1 h,取1 mL的PBS溶液清洗培养皿(3次),37 ℃荧光二抗孵育1 h(免疫荧光染色二抗稀释液配置),取1 mL的PBS溶液清洗培养皿(3次),自此时起,后续操作全程避光。DAPI染液孵育染色,孵育仅需1 min,取1 mL的PBS溶液清洗培养皿(3次),滴加适量抗荧光淬灭封片液。將培养皿置于免疫荧光显微镜下观察、拍照。每次添加试剂时均需PBS清洗3次。这些图像由HCA(Operetta、Perkinelmer、PE)拍摄。图像分析由Columbus和Image J完成。
1.3.4 流式细胞术 含EDTA胰蛋白酶于37 ℃消化神经元细胞3 min,显微镜下可见神经元细胞之间的突触连接,轻吹至分散;200目筛网过滤,收集细胞悬液,1 000 rpm/min离心5 min;加入2 mL 0.25%triton-X重悬细胞,室温孵育10 min;离心后PBS洗涤两次;加入βⅢ-tubulin(1∶200)500 μL,4 ℃孵育过夜;第2天4 ℃离心洗涤两次,每管加入500 μL二抗室温避光孵育1 h;4 ℃离心洗涤2次,1 mL PBS重悬细胞,准备上机;阴性对照一抗二抗均用PBS代替,其余步骤同实验组。
1.3.5 图像和统计学分析 使用Image J进行图像处理,包括免疫荧光图像merge及比例尺添加。所有计量数据资料统计使用GraphPad Prism(version 8.0.1),采用均数±标准差(x-±s) ,两组之间比较采用t检验(Student's t-test),以P<0.05认为差异有统计学意义。
2 结 果
2.1 感觉神经元形态学观察 培养时间为3 d时的神经元细胞(图2A),部分神经元细胞被卫星胶质细胞所覆盖(图2B右侧箭头),但仍可见未被完全覆盖的神经元细胞膜,未较多被卫星胶质细胞包裹的神经元细胞;随着培养时间的增加,附着在神经元细胞表面的卫星胶质细胞会脱离神经元(图2C 右侧箭头),转移并黏附在培养皿表面(左侧箭头示完全裸露的神经元细胞);第5~6 d时,神经元细胞的胞质大量暴露,此时可见神经元细胞全部的胞体及周围的突触,卫星胶质细胞几乎全部脱离神经元细胞,此时的神经元细胞可用于膜片钳实验或钙成像实验。
2.2 免疫荧光染色鉴定 免疫荧光显微镜按标准步骤,拍摄了培养天数为6 d时的神经元细胞(图3)。
2.3 细胞纯度测定 比较种板前细胞技术的结果显示,改良法相较原方法能够得到更多的细胞,细胞纯度的鉴定方法参照前文提及文献[5]中的方法,细胞纯度可达90%。流式细胞术所示细胞纯度结果见图4。
2.4 炎症相关神经元TRPA1免疫荧光染色 为了进一步明确所提取DRG原代神经元细胞是否可用于炎症相关研究,实验使用高内涵细胞成像技术摄取的LPS干预后的神经元细胞免疫荧光染色图像,图5为相邻四个孔内摄取的细胞图像,图5(a)为原代DRG神经元TRPA1蛋白免疫荧光,图(b)为DRG神经元特异性标志物βⅢ-tubulin蛋白免疫荧光;图(c)为DRG神经元细胞核Dapi免疫荧光染色;(d)Image J软件合并TRPA1、βⅢ-tubulin、Dapi免疫荧光染色图像。结果表明,神经元胞体及突触均有大量TRPA1表达。
3 讨 论
本研究运用原代细胞培养,免疫荧光,流式细胞术等方法,比较了传统的小鼠DRG提取培养方法和优化后的提取培养方法。研究结果显示,通过βⅢ-tubulin、GFAP免疫荧光染色,流式细胞术等方法证明了改良后的提取培养方法具有一定的优点,如细胞纯度较高,提取培养步骤简便,可重复性高等;TRPA1、Tau、Synapsin等蛋白的表达,提示这些原代神经元细胞可以被用作研究疼痛、神经损伤等方面的研究。
鉴于小鼠动物品系稳定、易于繁殖且子代数量较多等优点,小鼠神经元常被选用于原代培养,这些神经元被广泛应用于瘙痒、疼痛、神经损伤与再生和轴突运输等临床前研究[7]。近期研究中神经元细胞的提取培养方法描述并不详细,参照文中方法提取的原代神经元细胞较少且存活率不高,步骤及所需试剂较多[7]。故在此基础上提出一个用于提取培养小鼠脊髓背角DRG原代神经元细胞的详细方法。经过大量尝试,改良后的方法可以保证原代神经元细胞的数量与存活率,原代的神经元细胞在第8~12 h时即可贴壁。此时换液可以弃去未贴壁细胞及脱落的卫星胶质细胞,在换液后的12~24 h后即可观察到细胞呈现梭形,大部分细胞可观察到神经元标志性的突起,神经元的轴突数目逐步增加、延伸范围逐渐扩大;在3~4 d后即可观察到清晰的神经纤维网络,神经元周围光晕明显,贴壁紧密;在5~7 d时可见神经元之间的轴突呈大量增加,神经元之间形成了仍在逐步扩大的轴突网络,这些神经元均可以投入后续实验使用,同时这些细胞的最佳试用期在6~15 d内。本研究参考并试验了国内外文献中提供的实验方法,具有以下的特点及优势:(1)选择小鼠为实验对象,其基因组与人类相似度较大鼠更高;(2)避免使用胎鼠,既往研究大量使用胎鼠作为研究对象,胎鼠胎龄掌握困难,剖腹取出的胎鼠易死亡,耗时极长、耗费较大,此外胎鼠体积较小,操作难度高,组织极易损伤,影响术野,耗时长的前提下,分离出的细胞较少,细胞活性较差问题难以解决;(3)既往研究中大量使用DMEM/F12或Neurobasal培养基,价格高昂,用途局限,本研究使用MEM-ALPHA培养基,价格较低,且培养效果较好;(4)分离后的背根神经节组织使用Ⅰ型胶原酶及分散酶混合消化,较单纯使用胰蛋白酶消化可帮助卫星胶质细胞从神经元细胞上脱落,也可帮助神经元细胞分离,获得更多的细胞,神经元细胞存活率高;(5)提取培养基与换液培养基的成分不同,在神经元细胞贴壁后,选用含1%的5-氟尿嘧啶的换液培养基,既往研究多使用阿糖胞苷抑制非神经元细胞增殖,使用条件较为苛刻,同时抑制了神经元的细胞活性,针对神经元细胞无法增殖的特点,添加含1%的5-氟尿嘧啶和5%浓度FBS的换液培养基继续培养,可以有效抑制非神经元细胞,如小胶质细胞的增殖,同时可以促进神经元细胞生长,对神经元细胞损伤较小;(6)选取免疫荧光鉴定神经元细胞,优先使用βⅢ-tubulin作为神经元标志蛋白,GFAP作为卫星胶质细胞标志蛋白,分别选取不同种属、不同颜色的荧光二抗以方便同时染色,βⅢ-tubulin作为神经元细胞骨架,参与神经发生和轴突的引导和维持[15],表达量较高,方便染色,因此在染色时可帮助观察到整个神经元细胞。GFAP作为卫星胶质细胞的特异性标志物,卫星胶质细胞最初包裹着分离出的DRG神经元少数神经干细胞表达GFAP,因此GFAP可用作区分卫星胶质细胞和神经元细胞;(7)本研究培养皿包被时首选纤维连接蛋白,相较使用多聚赖氨酸,神经元细胞贴壁所需时间大大减少,8~12 h即可使用换液培养基换液,提前抑制非神经元细胞的增殖,所得细胞活性更好、纯度更佳;(8)在提取神经元细胞时需要操作者大量的操作练习,熟悉流程,同时在练习的帮助下加强实验的稳定性,尽可能缩短提取DRG所花费的时间,以使神经元原代细胞活性保持在最佳状态。因流式细胞术所用非流式专用抗体,使用的为βⅢ-tubulin一抗间接标记了神经元细胞;此外,胰蛋白酶消化及离心操作均会导致细胞损伤,甚至破碎、丢失,故神经元细胞所占比例较低;使用传统计数方法第6天时镜下观察计数,原代神经元细胞纯度可达90%,与传统方法一致。此外为了验证此方法培养的原代神经元细胞是否可用于疼痛、神经损伤与再生等实验的研究,本研究使用荧光标记了TRPA1、Tau、Synapsin等蛋白,发现这些蛋白均有表达,可用于后续实验。
綜上所述,这些神经元细胞常用于瘙痒、疼痛、神经损伤与再生等的研究。改良后的方法具有操作简便、提取培养的细胞纯度高、用途广泛,同时价格便宜等优点,为研究者提供了一种新的用于小鼠DRG神经元细胞原代培养的方法。
[参 考 文 献]
[1]王德,刘雪婷,曾丽萍,等.神经肽Y在DNFB诱发的ACD慢性瘙痒模型小鼠背根神经节中的表达[J].中国皮肤性病学杂志,2021,35(3):255-260.
[2]Wang KK,Wang SS,Chen Y,et al.Single-cell transcriptomic analysis of somatosensory neurons uncovers temporal development of neuropathic pain[J].Cell Res,2021,31(8):939-940.
[3]Geron M,Tassou A,Scherrer G.Sympathetic yet painful:autonomic innervation drives cluster firing of somatosensory neurons[J].Neuron,2022,110(2):175-177.
[4]Kivitz AJ,Gimbel JS,Bramson C,et al.Efficacy and safety of tanezumab versus naproxen in the treatment of chronic low back pain[J].Pain,2013,154(7):1009-1021.
[5]董甜甜,李世刚,唐和斌,等.小鼠背根神经节神经细胞的原代培养新方法[J].西安交通大学学报(医学版),2019,40(2):302-304.
[6]隋峰,杜新亮,张畅斌,等.一种原代培养大鼠DRG神经元的新方法[J].中国药理学通报,2009,25(7):971-973.
[7]任旺,胡朔丹,刘琳,等.施万细胞样细胞对大鼠背根神经节细胞突起生长的影响[J].神经解剖学杂志,2020,36(6):605-611.
[8]Valtcheva MV,Copits BA,Davidson S,et al.Surgical extraction of human dorsal root ganglia from organ donors and preparation of primary sensory neuron cultures[J].Nat Protoc,2016,11(10):1877-1888.
[9]Sadler KE,Mogil JS,Stucky CL.Innovations and advances in modelling and measuring pain in animals[J].Nat Rev Neurosci,2022,23(2):70-85.
[10]Miller RE,Tran PB,Ishihara S,et al.Microarray analyses of the dorsal root ganglia support a role for innate neuro-immune pathways in persistent pain in experimental osteoarthritis[J].Osteoarthritis Cartilage,2020,28(5):581-592.
[11]Taneja A,Di Iorio VL,Danhof M,et al.Translation of drug effects from experimental models of neuropathic pain and analgesia to humans[J].Drug Discov Today,2012,17(15-16):837-849.
[12]Chambraud B,Daguinot C,Guillemeau K,et al.Decrease of neuronal FKBP4/FKBP52 modulates perinuclear lysosomal positioning and MAPT/Tau behavior during MAPT/Tau-induced proteotoxic stress[J].Autophagy,2021,17(11):3491-3510.
[13]Deng CL,Hu CB,Ling ST,et al.Photoreceptor protection by mesenchymal stem cell transplantation identifies exosomal miR-21 as a therapeutic for retinal degeneration[J].Cell Death Differ,2021,28(3):1041-1061.
[14]Singh R,Cottle L,Loudovaris T,et al.Enhanced structure and function of human pluripotent stem cell-derived beta-cells cultured on extracellular matrix[J].Stem Cells Transl Med,2021,10(3):492-505.
[15]Saillour Y,Broix L,Bruel-Jungerman E,et al.Beta tubulin isoforms are not interchangeable for rescuing impaired radial migration due to Tubb3 knockdown[J].Hum Mol Genet,2014,23(6):1516-1526.
(收稿2022-03-07 修回2022-05-03)
